Соединения 2, 4-пиримидиндиамина, обладающие воздействием при аутоиммунных расстройствах
Иллюстрации
Показать всеНастоящее изобретение относится к новым соединениям 2,4-пиримидиндиамина формулы (I), которые могут быть использованы для лечения или профилактики аутоиммунных болезней, например, таких как ревматоидный артрит и/или связанные с ним симптомы, системная эритематозная волчанка и/или связанные с ней симптомы, а также рассеянный склероз и/или связанные с ним симптомы. В структурной формуле (I)
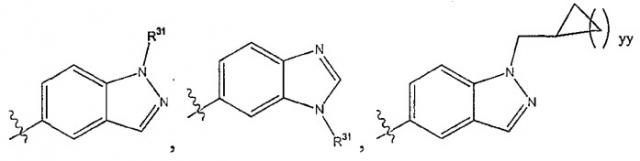
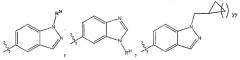
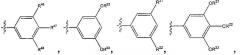
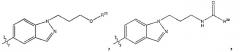
L1 является прямой связью; L2 является прямой связью; R2 является фенильной группой, трижды замещенной тремя группами R8; R4 является
Х представляет собой N; Y выбирается из группы, состоящей из О, NH, S, SO и SO2; Z выбирается из группы, состоящей из О, NH; при условии если Y выбран из группы, состоящей из NH, S, SO и SO2, то Z не такой же, как Y; R5 выбирается из группы, состоящей из R6, галогена; каждый R6 независимо выбирается из группы, состоящей из водорода, галогена; R8 выбирается из группы, состоящей из Ra, Rb, Ra, замещенного одной или несколькими одинаковыми или различными группами Ra или Rb, -ORa, -О-CHRaRb; каждый R35 независимо от других выбирается из группы, состоящей из водорода и R8, или в альтернативном случае две группы R35, присоединенные к одному и тому же атому углерода, берутся вместе с образованием оксогруппы (=O), и остальные две группы R35 каждая независимо одна от другой выбираются из группы, состоящей из водорода и R8; каждый Ra независимо выбирается из группы, состоящей из водорода, (C1-С6) алкила, (С3-C8) циклоалкила; каждый Rb является подходящей группой, которая независимо выбирается из группы, состоящей из -ORd, галогена, -CF3, -C(O)NRcRc и -ОС(O)ORd; каждый Rс независимо является защитной группой или Ra; каждый Rd независимо является защитной группой или
Ra; каждый индекс m независимо является целым числом от 1 до 3. 17 н. и 24 з. п. ф-лы, 3 ил.
Реферат
1. ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
Согласно § 119(e) части 35 Свода Законов США (United States Code - U.S.C.) по настоящей заявке испрашивается приоритет на основании следующих заявок: регистрационный номер 60/491641, дата подачи 30 июля 2003 года (номер дела патентного поверенного 28575/US/US/2); регистрационный номер 60/531598, дата подачи 19 декабря 2003 года (номер дела патентного поверенного 28575/US/8) и регистрационный номер 60/572256, дата подачи 15 мая 2004 года (номер дела патентного поверенного 28575/US/9).
2. ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение в целом относится к соединениям 2,4-пиримидиндиаминов, фармацевтическим составам, содержащим указанные соединения, промежуточным соединениям и синтетическим методам производства указанных соединений и методам использования этих соединений и составов в различных областях, например при лечении или профилактике аутоиммунных заболеваний и (или) симптомов, связанных с этими заболеваниями.
3. ПРЕДПОСЫЛКИ К СОЗДАНИЮ ИЗОБРЕТЕНИЯ
Сшивание Fc-рецепторов, таких как, например, рецептор с высоким сродством к IgE (FcεRI) и/или рецептор с высоким сродством к IgG (FcγRI), активирует сигнальный каскад в мастоцитах, базофилах и других иммунных клетках, в результате чего происходит выделение химических медиаторов, ответственных за ряд неблагоприятных явлений. Например, такое сшивание приводит к выделению преформированных медиаторов реакций анафилактической гиперчувствительности I типа (немедленная реакция), таких как гистамин, из зон накопления в гранулах посредством дегрануляции. Оно также приводит к синтезу и выделению других медиаторов, включая лейкотриены, простагландины и факторы активации тромбоцитов (PAF), которые играют важную роль в протекании воспалительных реакций. Дополнительные медиаторы, которые синтезируются и выделяются в результате сшивания Fc-рецепторов, включают цитокины и оксид азота.
Сигнальный каскад или каскады, активированные в результате сшивания Fc-рецепторов, как, например, FcεRI и/или FcγRI, состоят из набора клеточных протеинов. Одними из наиболее важных распространителей межклеточных сигналов являются тирозинкиназы. Важной тирозинкиназой, участвующей в установлении сигнальных путей трансдукции, связанных со сшиванием рецепторов FcεRI и/или FcγRI, а также других сигнальных трансдукционных каскадов, является Syk-киназа (в целях обзора см. Valent et al., 2002, Intl. J. Hematol. 75(4):257-362).
Поскольку медиаторы, выделенные в результате сшивания рецепторов FcεRI и FcγRI, являются ответственными или играют важную роль в проявлении многочисленных неблагоприятных явлений, крайне желательно иметь в наличии соединения, способные ингибировать сигнальный каскад или каскады, ответственные за их выделение. Более того, ввиду критической роли Syk-киназы в сигнальном каскаде (каскадах) этих и других рецепторов, наличие соединений, способных ингибировать Syk-киназу, также очень желательно.
4. КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Одним из аспектов настоящего изобретения является предложение новых соединений 2,4-пиримидиндиаминов, которые, как будет подробно описано ниже, проявляют биологическую активность в ряде направлений. Эти соединения в целом состоят из 2,4-пиримидиндиаминового «ядра», которое имеет следующую структуру и систему нумерации:
Указанные соединения согласно настоящему изобретению замещаются в месте присоединения азота (N2) к атому C2 с образованием вторичного амина и могут быть далее замещены в одной или нескольких позициях: в месте присоединения азота (N4) к атому C4, C5 и/или C6. При замещении в узле N4 заместитель образует вторичный амин. Заместитель в узле N2, а также возможные заместители в других позициях, могут сильно отличаться по природе и физико-химическим свойствам. Например, заместитель (заместители) может представлять собой разветвленный, неразветвленный или циклический алкил, разветвленный, неразветвленный или циклический гетероалкил, моно- или полициклический гетероарил или комбинацию этих групп. Эти группы замещения могут в дальнейшем быть замещены, как подробно описано ниже.
Заместители N2 и/или N4 могут присоединяться непосредственно к соответствующим атомам азота или быть отделенными от соответствующих атомов азота посредством линкеров, которые могут быть одинаковыми или различными. Природа линкеров может широко варьироваться и может включать практически любую комбинацию атомов или групп, подходящую для разделения одной части молекулы от другой. Например, линкером может быть мостик из ациклического углеводорода (например, насыщенный или ненасыщенный алкилен-, такой как метан-, этан-, этен-, пропан-, 1-пропен-, бутан-, 1-бутен-, 2-бутен, 1,3-бутадиен- и им подобные), мостик из моноциклического или полициклического углеводорода (например, 1,2-бензол-, 2,3-нафталин- и им подобные), простой ациклический гетероатомный мостик или гетероалкилдиильный мостик (например, -О-, -S-, S-O-, -NH-, -PH-, -C(O)-, -C(O)NH-, -S(O)-, -S(O)2-, -S(O)NH-, -S(O)2NH-, -O-CH2-, -CH2-O-CH2-, -O-CH=CH-CH2- и им подобные), моноциклический или полициклический гетероарильный мостик (например, [3,4]-фуран-, пиридин-, тиофен-, пиперидин-, пиперазин-, пиразидин-, пирролидин- и им подобные) или комбинации перечисленных мостиков.
Заместители в положениях N2, N4, C5 и/или C6, а также потенциальные линкеры могут в дальнейшем быть замещены одной или несколькими одинаковыми или различными группами замещения. Природа этих групп замещения может меняться в широких пределах. Неограниченный ряд примеров подходящих групп замещения включает разветвленные, неразветвленные и циклические алкилы, моно- и полициклические арилы, разветвленные, неразветвленные и циклические гетероалкилы, моно- и полициклические гетероарилы, галоиды, разветвленные, неразветвленные или циклические галогеналкилы, гидроксилы, оксо-группы, триоксо-группы, разветвленные, неразветвленные и циклические алкокси-группы, разветвленные, неразветвленные и циклические галогеналкокси-группы, трифторметокси-группы, моно- и полициклические арилокси-группы, моно- и полициклические гетероарилокси-группы, эфиры, спирты, сульфиды, тиоэфиры, сульфанилы (тиолы), имины, азогруппы, азиды, амины (первичные, вторичные и третичные), нитрилы (любые изомеры), цианаты (любые изомеры), тиоцианаты (любые изомеры), нитрозогруппы, нитрогруппы, диазогруппы, сульфоксиды, сульфонилы, сульфоновые кислоты, сульфамиды, сульфонамиды, эфиры сульфаминовой кислоты, альдегиды, кетоны, карбоновые кислоты, сложные эфиры, амиды, амидины, формадины, аминокислоты, ацетилены, карбаматы, лактоны, лактамы, глюкозиды, глюконуриды, сульфоны, кетали, ацетали, тиокетали, оксимы, оксаминовые кислоты, эфиры оксаминовых кислот и т.д., а также комбинации указанных групп. Группы замещения, имеющие функциональную способность к реакции, могут быть защищенными или незащищенными, что хорошо известно из предыдущих работ.
В одном из иллюстративных примеров соединения 2,4-пиримидиндиаминов согласно настоящему изобретению представляют собой соединения структурной формулы (I):
включая их соли, гидраты, сольваты и N-оксиды, в которой:
структурные звенья L1 и L2 каждое в отдельности независимо друг от друга выбираются из групп, содержащих прямую связь и линкер;
R2 и R4 описаны ниже;
R5 выбирается из группы, содержащей R6, (C1-C6) алкил, необязательно замещенный одной или несколькими одинаковыми или различными группами R8; (C1-C4) алканил, необязательно замещенный одной или несколькими одинаковыми или различными группами R8; (C2-C4) алкенил, необязательно замещенный одной или несколькими одинаковыми или различными группами R8, и (C2-C4) алкинил, необязательно замещенный одной или несколькими одинаковыми или различными группами R8;
Каждая из групп R6 выбирается независимо из группы, состоящей из водорода, электроотрицательной группы, -ORd, -SRd, (C1-C3) галогеналкилокси-группы, (C1-C3) пергалогеналкилокси-группы, -NRcRc, галогена, (C1-C3) галогеналкила, (C1-C3) пергалогеналкила, -CF3, -CH2CF3, -CF2CF3, -CN, -NC, -OCN, -SCN, -NO, -NO2, -N3,
-S(O)Rd, -S(O)2Rd, -S(O)2ORd, -S(O)NRcRc; -S(O)2NRcRc, -OS(O)Rd, -OS(O)2Rd, -OS(O)2ORd, -OS(O)NRcRc, -OS(O)2NRcRc, -C(O)Rd, -C(O)ORd, -C(O)NRcRc, -C(NH)NRcRc, -OC(O)Rd, -SC(O)Rd, -OC(O)ORd, -SC(O)ORd, -OC(O)NRcRc, -SC(O)NRcRc, -OC(NH)NRcRc, -SC(NH)NRcRc, -[NHC(O)]nRd, -[NHC(O)]nORd, -[NHC(O)]nNRcRc и -[NHC(NH)]nNRcRc, (C5-C10) арила, необязательно замещенного одной или несколькими одинаковыми или различными группами R8, фенила, необязательно замещенного одной или несколькими одинаковыми или различными группами R8, (C6-C16) арилалкила, необязательно замещенного одной или несколькими одинаковыми или различными группами R8, 5-10-членного гетероарила, необязательно замещенного одной или несколькими одинаковыми или различными группами R8, и 6-16-членного гетероарилалкила, необязательно замещенного одной или несколькими одинаковыми или различными группами R8;
R8 выбирается из группы, состоящей из Ra, Rb, Ra, необязательно замещенного одной или несколькими одинаковыми или различными группами Ra или Rb, -ORa, необязательно замещенного одной или несколькими одинаковыми или различными группами Ra или Rb, -B(ORa)2, -B(NRcRc)2, -(CH2)m-Rb, -(CHRa)m-Rb, -O-(CH2)m-Rb,
-S-(CH2)m-Rb, -O-CHRaRb, -O-CRa(Rb)2, -O-(CHRa)m-Rb,
-O-(CH2)m-CH[(CH2)mRb]Rb, -S-(CHRa)m-Rb, -C(O)NH-(CH2)m-Rb,
-C(O)NH-(CHRa)m-Rb, -O-(CH2)m-C(O)NH-(CH2)m-Rb,
-S-(CH2)m-C(O)NH-(CH2)m-Rb, -O-(CHRa)m-C(O)NH-(CHRa)m-Rb,
-S-(CHRa)m-C(O)NH-(CHRa)m-Rb, -NH-(CH2)m-Rb, -NH-(CHRa)m-Rb,
-NH[(CH2)mRb], -N[(CH2)mRb]2, -NH-C(O)-NH-(CH2)m-Rb,
-NH-C(O)-(CH2)m-CHRbRb и -NH-(CH2)m-C(O)-NH-(CH2)m-Rb;
каждая из групп Ra независимо выбирается из группы, состоящей из водорода, (C1-C6) алкила, (C3-C8) циклоалкила, циклогексила, (C4-C11) циклоалкилалкила, (C5-C10) арила, фенила, (C6-C16) арилалкила, бензила, 2-6-членного гетероалкила, 3-8-членного циклогетероалкила, морфолинила, пиперазинила, гомопиперазинила, пиперидинила, 4-11-членного циклогетероалкилалкила, 5-10-членного гетероарила и 6-16-членного гетероарилалкила;
каждая из групп Rb представляет собой подходящую группу, которая независимо выбирается из группы, состоящей из =O, -ORd, (C1-C3) галогеналкилокси-группы,
-OCF3, =S, -SRd, =NRd, =NORd, -NRcRc, галогена, -CF3, -CN, -NC, -OCN, -SCN, -NO, -NO2, =N2, -N3, -S(O)Rd, -S(O)2Rd, -S(O)2ORd, -S(O)NRcRc, -S(O)2NRcRc, -OS(O)Rd, -OS(O)2Rd, -OS(O)2ORd, -OS(O)2NRcRc, -C(O)Rd, -C(O)ORd, -C(O)NRcRc, -C(NH)NRcRc, -C(NRa)NRcRc, -C(NOH)Ra, -C(NOH)NRcRc, -OC(O)Rd, -OC(O)ORd, -OC(O)NRcRc, -OC(NH)NRcRc, -OC(NRa)NRcRc, -[NHC(O)]nRd, -[NRaC(O)]nRd, -[NHC(O)]nORd, -[NRaC(O)]nORd, -[NHC(O)]nNRcRc, -[NRaC(O)]nNRcRc, -[NHC(NH)]nNRcRc и -[NRaC(NRa)]nNRcRc;
каждая из групп Rc независимо представляет защитную группу или Ra, или альтернативно, каждая из групп Rc берется вместе с атомом азота, к которому она присоединена, с образованием 5-8-членного циклогетероалкила или гетероарила, которые могут необязательно включать один или несколько одинаковых или различных дополнительных гетероатомов и которые могут необязательно замещаться одной или несколькими одинаковыми или различными группами Ra или подходящими группами Rb;
каждая Rd группа независимо представляет собой защитную группу или Ra;
каждый индекс m независимо представляет собой целое число от 1 до 3; и
каждый индекс n независимо представляет собой целое число от 0 до 3.
В одном из способов применения R5 является F и R6 является водородом.
Другой аспект настоящего изобретения включает пролекарства соединений 2,4-пиримидиндиаминов. Подобные пролекарства могут быть активными в их пролекарственной форме или же неактивными до момента превращения в активную лекарственную форму при определенных физиологических или иных условиях применения. В пролекарствах согласно настоящему изобретению одна или несколько функциональных групп соединений 2,4-пиримидиндиаминов включены в прокомпоненты (promoieties), которые отщепляются от молекулы при условиях применения, обычно путем гидролиза, ферментативного расщепления или другого механизма расщепления с образованием функциональных групп. Например, первичные или вторичные аминогруппы могут быть включены в амидный прокомпонент, который расщепляется при условиях применения с образованием первичной или вторичной аминогруппы. Таким образом, пролекарства согласно настоящему изобретению включают особые виды защитных групп, которые называются «прогруппы» (“progroups”) и маскируют одну или несколько функциональных групп соединений 2,4-пиримидиндиаминов, которые расщепляются при условиях применения с образованием активных лекарственных соединений 2,4-пиримидиндиаминов. Функциональные группы, входящие в состав соединений 2,4-пиримидиндиаминов, которые могут быть замаскированы с помощью прогрупп с целью включения в прокомпонент, включают, но не ограничиваются следующими: амины (первичные и вторичные), гидроксилы, сульфанилы (тиолы), карбоксилы, карбонилы, фенолы, катехолы, диолы, алкины, фосфаты и пр. В настоящее время известно огромное количество прогрупп, подходящих для маскировки указанных функциональных групп с целью образования прокомпонентов, способных расщепляться при условиях применения. Все эти прогруппы, сами по себе или в комбинациях, могут быть включены в пролекарства согласно настоящему изобретению. Конкретные примеры прокомпонентов, образующих первичные или вторичные аминогруппы, которые могут быть включены в пролекарства согласно настоящему изобретению, включают, но не ограничиваются следующими группами: амиды, карбаматы, имины, мочевины, фосфенилы, фосфорилы и сульфенилы. Конкретные примеры прокомпонентов, образующих сульфанильные группы, которые могут быть включены в пролекарства согласно настоящему изобретению, включают, но не ограничиваются следующими группами: тиоэфиры, например S-метил производные (монотио-, дитио-, окситио-, аминотиоацетали), силиловые тиоэфиры, сложные тиоэфиры, тиокарбонаты, тиокарбаматы, асимметричные дисульфиды и т.д. Конкретные примеры прокомпонентов, образующих в результате расщепления гидроксильные группы, которые могут быть включены в пролекарства согласно настоящему изобретению, включают, но не ограничиваются следующими группами: сульфонаты, сложные эфиры и карбонаты. Конкретные примеры прокомпонентов, образующих карбоксильные группы, которые могут быть включены в пролекарства согласно настоящему изобретению, включают, но не ограничиваются следующими группами: сложные эфиры (включая сложные силиловые эфиры, эфиры оксаминовой кислоты и тиоэфиры), амиды и гидразиды.
В одном из иллюстративных примеров пролекарства согласно настоящему изобретению представляют собой соединения структурной формулы (I), в которой защитная группа Rc и Rd является прогруппой.
В другом иллюстративном примере пролекарства согласно настоящему изобретению представляют собой соединения структурной формулы (II):
включая их соли, гидраты, сольваты и N-оксиды, в которых:
R2, R4, R5, R6, L1 и L2 представляют группы, указанные ранее при описании формулы (I);
R2b является прогруппой;
R4b является прогруппой или алкильной группой, например метилом, как описано далее в разделе примеров.
Следующий аспект настоящего изобретения включает составы, содержащие одно или несколько соединений и/или пролекарств согласно настоящему изобретению, а также соответствующий носитель, наполнитель или разбавитель. Точная природа носителя, наполнителя или разбавителя будет зависеть от желаемого использования данного состава, от веществ, применяемых в ветеринарной практике, до веществ, применяемых для лечения людей.
Еще один аспект настоящего изобретения включает промежуточные соединения, используемые при синтезе соединений 2,4-пиримидиндиамина и пролекарств согласно настоящему изобретению. В одном из примеров промежуточные соединения представлены 4-пиримидинаминами структурной формулы (III):
включая их соли, гидраты, сольваты и N-оксиды, в которых R4, R5, R6 и L2 представляют собой группы, упомянутые ранее при описании структурной формулы (I); LG представляет собой замещаемую группу, например -S(O)2Me, -SMe или галогеновые группы (например, F, Cl, Br, I); и R4c представляет собой водород, прогруппу, алкильную группу или другую группу, описанную в данном тексте.
В другом примере промежуточные соединения представлены 2-пиримидинаминами согласно структурной формуле (IV):
включая их соли, гидраты, сольваты и N-оксиды, в которых R2, R5, R6 и L1 представляют собой группы, упомянутые ранее при описании структурной формулы (I); LG представляет собой замещаемую группу, например -S(O)2Me, -SMe или галогеновые группы (например, F, Cl, Br, I).
В еще одном примере промежуточные соединения представлены 4-амино- или 4-гидрокси-2-пиримидинаминами в соответствии со структурной формулой (V):
включая их соли, гидраты, сольваты и N-оксиды, в которых R2, R5, R6 и L1 представляют собой группы, упомянутые ранее при описании структурной формулы (I); R7 представляет собой амино- или гидроксильную группу, и R2c представляет собой водород или прогруппу.
В еще одном примере промежуточные соединения представлены N4-замещенными цитозинами в соответствии со структурной формулой (VI):
включая их соли, гидраты, сольваты и N-оксиды, в которых R4, R5, R6 и L2 представляют собой группы, упомянутые ранее при описании структурной формулы (I), и R4c представляет собой группу, аналогичную упомянутой при описании формулы (III).
Еще один аспект настоящего изобретения включает методы синтеза соединений 2,4-пиридиндиаминов и пролекарств согласно настоящему изобретению. В одном из примеров указанный метод предполагает реакцию 4-пиримидинамина структурной формулы (III) с амином формулы HR2cN-L1-R2, где L1, R2 и R2c представляют собой группы, указанные ранее при описании структурной формулы (IV), с образованием 2,4-пиримидиндиамина структурной формулы (I), или пролекарства в соответствии со структурной формулой (II).
В другом примере указанный метод предполагает реакцию 2-пиримидинамина структурной формулы (IV) с амином формулы R4-L2-NHR4c, в которой L4, R4 и R4c представляют собой группы, указанные ранее при описании структурной формулы (III), с образованием 2,4-пиримидиндиамина структурной формулы (I), или пролекарства в соответствии со структурной формулой (II).
В еще одном примере указанный метод предполагает реакцию 4-амино-2-пиримидинамина структурной формулы (V) (в которой R7 является аминогруппой) с амином формулы R4-L2-NHR4c, в которой L4, R4 и R4c представляют собой группы, указанные ранее при описании структурной формулы (III), с образованием 2,4-пиримидиндиамина структурной формулы (I), или пролекарства в соответствии со структурной формулой (II). В альтернативном варианте 4-амино-2-пиримидинамин может реагировать с соединением формулы R4-L2-LG, в которой R4 и L2 представляют собой группы, указанные ранее при описании структурной формулы (I), и LG является замещаемой группой.
В еще одном примере указанный метод предполагает реакцию галогенирования 4-гидрокси-2-пиримидинамина структурной формулы (V) (R7 является гидроксильной группой) с образованием 2-пиримидинамина структурной формулы (IV) с последующей реакцией указанного пиримидинамина с соответствующим амином, как указано выше.
В еще одном примере указанный метод предполагает реакцию галогенирования N4-замещенного цитозина структурной формулы (VI) с образованием 4-пиримидинамина структурной формулы (III) с последующей реакцией указанного пиримидинамина с соответствующим амином, как указано выше.
Соединения 2,4-пиримидиндиаминов согласно настоящему изобретению являются мощными ингибиторами дегрануляции иммунных клеток, таких как мастоциты, базофилы, нейтрофилы и/или эозинофилы. Таким образом, еще один аспект настоящего изобретения включает методы регулирования и, в частности, ингибирования дегрануляции таких клеток. Предлагаемый метод в целом заключается в приведении дегранулируемой клетки в контакт с соединением 2,4-пиримидиндиамина или пролекарства согласно настоящему изобретению либо приемлемой соли, гидрата, сольвата, N-оксида указанных соединений и/или их комбинации в количестве, достаточном для эффективного регулирования или ингибирования дегрануляции клетки. Указанный метод может применяться in vitro или in vivo как тактика лечения или профилактики болезней, характеризуемых, обусловленных или связанных с клеточной дегрануляцией.
Не претендуя на связь с какой-либо теорией, объясняющей принцип действия, имеющиеся в наличии биохимические данные подтверждают, что соединения 2,4-пиримидинаминов оказывают ингибирующий эффект на дегрануляцию, по крайней мере частично, за счет блокирования или ингибирования сигнального трансдукционного каскада (каскадов), инициированного в результате сшивания Fc-рецепторов с высокой степенью сродства к IgE (“FcεRI”) рецепторам и/или IgG (“FcγRI”) рецепторам. На самом деле, соединения 2,4-пиримидиндиамина являются мощными ингибиторами дегрануляции, опосредованной и FcεRI, и FcγRI рецепторами. Как следствие этого, соединения 2,4-пиримидина могут использоваться для ингибирования сигнальных каскадов указанных Fc-рецепторов в клетках любых типов, экспрессирующих такие FcεRI и/или FcγRI рецепторы, включая, но не ограничиваясь следующими клетками: макрофаги, мастоциты, базофилы, нейтрофилы и/или эозинофилы.
Указанные методы также позволяют регулировать и, в частности, ингибировать процессы, протекающие в прямом направлении, которые являются результатом активации таких сигнальных каскадов Fc-рецепторов. Такие прямые процессы включают, но не ограничиваются следующими: FcεRI- и/или FcγRI-опосредованная дегрануляция, производство цитокина и/или производство и/или выделение медиаторов липидов, таких как лейкотриены и простагландины. Указанный метод в целом заключается в приведении клетки из категории описанных выше, экспрессирующей Fc-рецептор, в контакт с соединением 2,4-пиримидиндиамина или пролекарства согласно настоящему изобретению либо соответствующей соли, гидрата, сольвата, N-оксида указанных соединений и/или их комбинации в количестве, достаточном для эффективного регулирования или ингибирования сигнального каскада Fc-рецепторов и/или прямого процесса, затронутого активацией этого сигнального каскада. Указанный метод может применяться in vitro или in vivo в качестве тактики лечения или профилактики болезней, характеризуемых, обусловленных или связанных с сигнальным каскадом Fc-рецепторов, как, например, болезней, обусловленных выделением химических медиаторов гранул в процессе дегрануляции, выделением и/или синтезом цитокинов и/или выделением и/или синтезом медиаторов липидов, таких как, например, лейкотриенов и простагландинов.
Еще один аспект настоящего изобретения включает методы лечения и/или профилактики болезней, характеризуемых, обусловленных или связанных с выделением химических медиаторов в результате активирования сигнальных каскадов Fc-рецепторов, таких как, например, сигнальные каскады FcεRI и/или FcγRI рецепторов. Эти методы могут применяться как на животных, так и на людях. Указанные методы в целом заключаются во введении животным или человеку соединения 2,4-пиримидиндиамина или пролекарства согласно настоящему изобретению либо соответствующей соли, гидрата, сольвата, N-оксида указанных соединений и/или их комбинации в количестве, достаточном для эффективного лечения или предотвращения заболевания. Как обсуждалось выше, активация сигнального каскада FcεRI или FcγRI-рецепторов в определенных иммунных клетках приводит к выделению и/или синтезу различных химических веществ, которые являются фармакологическими медиаторами широкого диапазона болезней. Любые из этих болезней могут лечиться или быть предотвращены в соответствии с методами согласно настоящему изобретению.
Например, в мастоцитах и базофилах активация сигнального каскада FcεRI или FcγRI рецепторов приводит к немедленному (т.e. в течение 1-3 мин с момента активации рецепторов) выделению преформированных медиаторов атопических реакций и/или реакций гиперчувствительности I типа (например, гистамина, протеаз, как, например, триптазы и т.д.) посредством процесса дегрануляции. Такие атопические реакции и/или реакции гиперчувствительности I типа включают, но не ограничиваются следующими: анафилактические реакции на окружающую среду и другие аллергены (например, пыльца, яд насекомых и/или животных, пища, лекарства, контрастная краска и т.д.), анафилактоидные реакции, сенная лихорадка, аллергический конъюнктивит, аллергический ринит, аллергическая астма, атопический дерматит, экзема, крапивница, нарушение функции слизистой оболочки, тканей, а также ряд желудочно-кишечных расстройств.
Вслед за немедленным выделением преформированных медиаторов посредством дегрануляции происходит выделение и/или синтез ряда других химических медиаторов, включающих, среди прочих, фактор активации тромбоцитов (PAF), простагландины и лейкотриены (например, LTC4), а также de novo синтез и выделение цитокинов, как, например, TNFα, IL-4, IL-5, IL-6, IL-13 и т.д. Первый их этих двух процессов происходит примерно через 3-30 мин после активации рецепторов; последующий - примерно через 30 мин-7 ч после активации рецепторов. Эти медиаторы “поздней стадии” считаются частично ответственными за хронические симптомы вышеперечисленных атопической реакции и реакции гиперчувствительности I типа и вдобавок являются химическими медиаторами воспалений и воспалительных заболеваний (т.е. остеоартрита, воспалительной болезни кишечника, язвенного колита, болезни Крона, идиопатической воспалительной болезни кишечника, синдрома повышенной раздражимости желудка, спастического колита и т.д.), слабого рубцевания (т.е. склеродермы, выраженного фиброза, образования келоидов, послеоперационных рубцов, фиброза легких, спазмов сосудов, мигрени, реперфузионной травмы и пост-инфаркта миокарда) и синдрома Шегрена. Все эти заболевания могут лечиться или быть предотвращены в соответствии с методами согласно настоящему изобретению.
Дополнительные болезни, которые можно лечить или предотвратить с помощью методов согласно настоящему изобретению, включают болезни, связанные с патологией базофильных и/или мастоцитных клеток. Примеры таких заболеваний включают, но не ограничиваются следующими: болезни кожи, как, например, склеродерма, болезни сердца, как, например, инфаркт миокарда, болезни легких, как, например, изменения или преобразования мышц легких или хроническое обструктивное заболевание легких (COPD), и болезни кишечника, как, например, синдром воспаления кишечника (спастический колит).
Соединения 2,4-пиримидиндиаминов согласно настоящему изобретению также являются мощными ингибиторами тирозинкиназы и, в частности, Syk-киназы. Таким образом, еще один аспект настоящего изобретения включает методы регулирования и, в частности, ингибирования активности Syk-киназы. Метод в целом заключается в приведении Syk-киназы или клетки, содержащей Syk-киназу, в контакт с соединением 2,4-пиримидиндиаминов или пролекарства согласно настоящему изобретению либо соответствующей соли, гидрата, сольвата, N-оксида указанных соединений и/или их композиции в количестве, достаточном для эффективного регулирования или ингибирования активности Syk-киназы. В одном из примеров Syk-киназа представлена в качестве выделенной или рекомбинантной Syk-киназы. В другом примере Syk-киназа представлена в качестве эндогенной или рекомбинантной Syk-киназы, экспрессированной клеткой, как, например, в случае мастоцита или базофила. Метод может применяться in vitro или in vivo в качестве тактики лечения или профилактики болезней, характеризуемых, обусловленных или связанных с активностью Syk-киназы.
Не пытаясь ограничиться какой-либо одной теорией, объясняющей механизм воздействия, считается, что соединения 2,4-пиримидиндиаминов согласно настоящему изобретению оказывают ингибирующий эффект на дегрануляцию клеток и/или выделение других химических медиаторов преимущественно за счет ингибирования Syk-киназы, которая активируется посредством гомодимера гамма-цепи рецептора FcεRI (см., например, фиг.2). Этот гомодимер гамма-цепи является общим для других Fc-рецепторов, включая FcγRI, FcγRIII и FcαRI. Для всех этих рецепторов процесс внутриклеточной сигнальной трансдукции опосредован общим гомодимером гамма-цепи. Связывание и агрегация этих рецепторов приводит к рекрутингу и активации тирозинкиназ, как, например, Syk-киназы. В результате этих общих сигнальных действий, указанные соединения 2,4-пиримидиндиаминов, могут использоваться для регулирования и, в частности, ингибирования сигнальных каскадов Fc-рецепторов с гомодимерами гамма-цепи, как, например, FcεRI, FcγRI, FcγRIII и FcαRI, а также реакций клеток, полученных посредством этих рецепторов.
Известно, что Syk-киназа играет критическую роль в других сигнальных каскадах. Например, Syk-киназа является эффектором сигналов рецепторов В-клеток (BCR) (Turner et al., 2000, Immunology Today 21:148-154) и является существенным компонентом сигнального пути бета(1), бета(2) и бета(3) интегрина в нейтрофилах (Mocsai et al., 2002, Immunity 16:547-558). Поскольку указанные соединения 2,4-пиримидиндиаминов являются мощными ингибиторами Syk-киназы, их можно использовать для регулирования и, в частности, ингибирования любых сигнальных каскадов, в которых Syk-киназа играет роль, например, в сигнальных каскадах Fc-рецепторов, BCR и интегрина, а также реакций клеток, полученных посредством этих рецепторов. Регулирование или ингибирование конкретной реакции клетки частично зависит от конкретного типа клетки и сигнального каскада рецепторов, как хорошо известно в литературе. Некоторые из примеров реакций клеток, которые можно регулировать или ингибировать посредством соединений 2,4-пиримидиндиаминов включают респираторный всплеск, клеточную адгезию, дегрануляцию клеток, распространение клеток, миграцию клеток, фагоцитоз (например, в макрофагах), поток ионов кальция (например, в мастоцитах, базофилах, нейтрофилах, эозинофилах и B-клетках), агрегацию тромбоцитов и созревание клеток (например, в B-клетках).
Таким образом, еще один аспект настоящего изобретения включает методы регулирования и, в частности, ингибирования каскадов сигнальной трансдукции, в которых участвует Syk-киназа. Метод в целом заключается в приведении Syk-зависимого рецептора или клетки, экспрессирующей Syk-зависимый рецептор, в контакт с соединением 2,4-пиримидиндиаминов или пролекарства согласно настоящему изобретению, либо соответствующей соли, гидрата, сольвата, N-оксида указанных соединений и/или их комбинации в количестве, достаточном для эффективного регулирования или ингибирования сигнального трансдукционного каскада. Указанные методы могут также использоваться для регулирования и, в частности, ингибирования прямых процессов или реакций клеток, полученных в результате активации конкретного Syk-зависимого каскада сигнальной трансдукции. Методы можно использовать для регулирования любых каскадов сигнальной трансдукции, в которых роль Syk-киназы неизвестна или же установлена позже. Методы могут использоваться in vitro или in vivo в качестве тактики лечения или профилактики болезней, характеризуемых, обусловленных или связанных с активацией Syk-зависимого каскада сигнальной трансдукции. Некоторые примеры таких заболеваний включают болезни, описанные ранее.
Данные, полученные в результате клеточного анализа, в совокупности с данными, полученными на животных, также подтверждают, что соединения 2,4-пиримидиндиаминов в соответствии с настоящим изобретением могут быть использованы для лечения или профилактики аутоиммунных заболеваний и/или симптомов этих заболеваний. Соответствующие методы в целом включают введение пациенту, страдающему аутоиммунным заболеванием или находящемуся под угрозой развития аутоиммунного заболевания, 2,4-пиримидиндиамина или пролекарства согласно настоящему изобретению, или же приемлемой соли, N-оксида, гидрата, сольвата или их комбинации в количестве, эффективном для лечения или профилактики аутоиммунного заболевания и/или связанных с ним симптомов. Аутоиммунные заболевания, поддающиеся лечению или профилактике с помощью соединений 2,4-пиримидиндиаминов, включают заболевания, зачастую ассоциируемые с реакциями не-анафилактической гиперчувствительности (II, III и/или IV типа), и/или заболевания, опосредованные, по крайней мере частично, активацией сигнального каскада FcγR в моноцитах. Такого рода аутоиммунные заболевания включают, но не ограничиваются болезнями, часто характеризуемыми как аутоиммунные расстройства отдельного органа или единого типа клеток, а также болезни, часто характеризуемые как включающие системные аутоиммунные расстройства. Некоторые примеры болезней, часто характеризуемых как аутоиммунные расстройства отдельного органа или единого типа клеток, включают: тиреоидит Хасимото, аутоиммунную гемолитическую анемию, аутоиммунный атрофический гастрит пернициозной анемии, аутоиммунный энцефаломиелит, аутоиммунный орхит, синдром Гудпасчера, аутоиммунную тромбоцитопению, симпатическую офтальмию, астенический бульбарный паралич, базедову болезнь, билиарный первичный цирроз печени, хронический агрессивный гепатит, язвенный колит и мембранозную гломерулопатию. Некоторые примеры болезней, часто характеризуемых как включающие системные аутоиммунные расстройства, включают системную эритематозную волчанку, ревматоидный артрит, синдром Шегрена, синдром Рейтера, полимиозит-дерматомиозит, системный склероз, нодозный полиартериит, рассеянный склероз и буллезный пемфигоид.
5. КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
Фиг.1 наглядно иллюстрирует производство IgE под воздействием аллергенов и последующее выделение преформированных и прочих химических медиаторов мастоцитов;
Фиг.2 наглядно иллюстрирует сигнальный трансдукционный каскад рецепторов FcεR1, ведущий к дегрануляции мастоцитов и/или базофилов; и
Фиг.3 наглядно иллюстрирует предполагаемые участки действия соединений, которые выборочно ингибируют опосредованную FcεRI-рецепторами дегрануляцию в обратном направлении, а также соединений, которые ингибируют дегрануляцию, опосредованную FcεRI-рецепторами, и дегрануляцию, вызванную иономицинами.
6. ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
6.1 Определения
Применительно к настоящему тексту приведенные ниже термины имеют следующие значения.
“Алкил” самостоятельно или как часть другого соединения относится к насыщенному или ненасыщенному моновалентному углеводородному радикалу с разветвленной, неразветвленной или циклической структурой и установленным числом атомов углерода (