Способ получения магниточувствительных липосом
Иллюстрации
Показать всеИзобретение относится к области медицины - онкологии (а также генной инженерии, биохимии) и касается способов получения магниточувствительных липосомальных систем доставки лекарственных веществ с контролируемым высвобождением. Способ получения магниточувствительных липосом, содержащих лекарственное средство, включает растворение фосфолипидов в хлороформе, добавление носителя магнитных свойств и воздействие ультразвуком, при этом в качестве источника фосфолипидов используют барсучий жир, в качестве носителя магнитных свойств используют ферромагнитный нанопорошок металла, полученный газофазным способом, с размером частиц 2-5 нм, заключенный в углеродную оболочку, и стерилизуют липосомальную систему в камере бетатрона. 4 ил.
Реферат
Изобретение относится к области медицины - онкологии (а также генной инженерии, биохимии) и касается способов получения нацеленных магниточувствительных липосомальных систем доставки лекарственных веществ с контролируемым высвобождением.
Использование липосом для транспорта и целенаправленной доставки противоопухолевых препаратов (цитостатиков) является одним из перспективных направлений в онкологии и позволяет разрешить проблему побочных действий химиотерапевтических препаратов, проявляющихся в виде аллергических реакций, токсических явлений, дисбактериоза, суперинфекции [Черномордик А.В. Применение антибиотиков и других химиотерапевтических препаратов. Справочник. 1988. 320 с.]. Специфическая структура кровеносных сосудов в опухоли и небольшой размер липосом способствуют устойчивому накоплению липосомального лекарственного вещества в опухоли, обеспечивая этим пассивную направленную доставку и повышение терапевтической активности препаратов [Пономарева О.В., Кидзельский Л.П., Кулик Г.И., Губарева А.А. Возможности лечения больных с неходжкинскими лимфомами с использованием липосомальной формы доксорубицина. // Онкология. 1999. №4. С.274-277].
Эффективность воздействия липосом обусловлена возможностью их глубокого проникновения в ткани. Обычно при получении липосомальных везикул исходный фосфолипид растворяют в органическом растворителе, таком как хлороформ, дихлорметан или спирт (метанол или этанол). Затем раствор высушивают, после чего на стенке испарительной колбы образуется пленка липида. Добавление к сухой пленке воды или водного раствора, такого как буфер, приводит к формированию многослойных липосом. Образованием именно такого продукта завершается первая стадия получения везикул с использованием различных методик.
При последующей обработке липидной суспензии ультразвуком получают однослойные липосомы [(A.D.Bangham et al., J. Mol. Biol. 13, 238 (1965)]. Ранее предложенные способы включают также детергентную обработку [Пат. США №5019394, Кл. А61К 9/127], выпаривание с обращением фаз [В.И.Ефременко. Липосомы (получение, свойства, аспекты применения в биологии и медицине). Ставрополь. 1999], предполагают введение эфира [D.Diamer et al., Biochim. Biophys. Acta, (1976) 433, 629], а также лиофилизацию [Kirby and Grigoriadis, Biotechnology (1984), 2, 979-984] и использование методов замораживания-оттаивания [D.D.Lasic "Liposomes: From Physics to Application", Elsevier, 1993, p.98].
Размер липосом важен с точки зрения их применения. В одних случаях нужны крупные липосомы, как например, для получения вакцин, когда инкапсулируют бактерии, как описано авторами [Пат. RU 2145212 С1, Кл. А61К 9/127]. В других случаях более предпочтительными являются мелкие липосомы.
Мелкие липосомы могут быть получены при использовании гомогенизаторов под высоким давлением [Пат. RU 2223764 С1, Кл. А61К 31/496]. При использовании другого подхода [Glesoriadis et. al., Int. J. Pharm. 65 (1990) 235-242] в псевдоожиженном слое многослойных дегидратированных-регидратированных везикул в присутствии неинкапсулированного лекарственного средства получают везикулы размером менее 200 нм, сохраняющие количество первоначально включенных растворенных веществ.
Показан стабилизирующий эффект на везикулы, возникающий при добавлении сахаров после получения липосом [Пат. RU 2216315 С2, Кл. А61К 9/127], в том случае, например, когда липосомы, содержащие лекарственное средство, лиофильно высушивают для хранения, а затем подвергают повторной гидратации.
Известен способ получения липосомальных препаратов путем смешивания биологически активного вещества, фосфолипидов, органического растворителя, способного растворять фосфолипиды, и порошкообразного наполнителя в одной емкости с последующим удалением растворителя в условиях пониженного давления при сохраняющемся постоянном перемешивании [Пат. RU 2130771 С1, Кл. А61К 9/127]. В результате получают сухой порошкообразный препарат биологически активного вещества, при растворении которого в воде или в биологических жидкостях организма образуется липосомальный препарат. В качестве сухих порошкообразных наполнителей также могут быть использованы сахара и/или полисахариды (глюкоза, лактоза, декстраны и т.п.), полиолы (сорбит, ксилит и другие), соли (поваренная соль и другие). В качестве фосфолипидов при этом используют яичный лецитин, холестерин, додецилфосфат, суммарные фосфолипиды из мозга крупного рогатого скота, суммарные фосфолипиды из микроорганизмов E.coli штамм М-17.
Известен способ получения липосомальной композиции [патент РФ 2014071 С1, Кл. А61К 9/127], включающий растворение липидов в органическом растворителе, диспергирование полученного раствора в водном растворе, содержащем низкомолекулярные соединения, упаривание растворителя в вакууме и удаление невключенных компонентов методом диализа, причем водный раствор одновременно с включенным низкомолекулярным соединением содержит 5-10% криопротектора, а полученную водную суспензию подвергают лиофилизации и регидратируют до исходного объема. Недостаток этого способа заключается в том, что он характеризуется значительной сложностью исполнения и не пригоден для получения липосом, имеющих маленькие размеры.
Известен способ получения липосомальной формы альфа-токоферрола путем растворения фосфолипидов в органическом растворителе, упаривания, высушивания в токе инертного газа, гидратации, гомогенизации при высоком давлении и последующей стерилизующей фильтрации липосомальной суспензии [Пат. RU 2085192 С1, Кл. А61Л 31/355].
Известен способ образования инкапсулированной в липосомы формы кристаллического бета-каротина в присутствии сухого порошкообразного наполнителя (сорбит, ксилит, манит, поваренная соль, декстраны, полиэтиленгликоли, поливинилпирролидо), фосфолипидов (смеси фосфолипидов, полученных из растительного, животного или микробиологического сырья) и летучего органического растворителя (хлороформ, гексан, эфир, бензол) с последующим удалением растворителя в условиях вакуума при постоянном перемешивании до получения сухого мелкодисперсного порошка [Пат. RU 2102073 С1, Кл. А61К 31/66].
Описано инкапсулирование доксорубицина (DOX) в липосомы выпариванием с обращением фаз. Для формирования липосом использовали смесь фосфатидилхолина из соевых бобов и фосфатидилэтанола, а DOX - в виде его раствора с лактозой или NaCl [Жукова М.В. и др. Инкапсулирование доксорубицина в липосомы, содержащие фосфатидилэтанол. // Химико-фармацевтический журнал, Т.40, №1, С.31-33, 2006].
Известен способ получения липосомальной формы рифампицина из его раствора вместе с фосфолипидами в органическом растворителе. Затем растворитель удаляют до получения тонкой пленки, которую диспергируют в водной среде до получения суспензии мультиламелярных везикул с заключенным в них рифампицином. Полученную суспензию гомогенизируют при высоком давлении или продавливают через фильтр также под давлением. В качестве фосфолипидов берут смесь, содержащую фосфатидилхолин, смесь липидов яичного желтка, и/или сои, и/или крупного рогатого скота [Пат. RU 2223764 С1, Кл. А61Л 31/496, А61К 9/127].
Известен способ получения липосомальной формы рифампицина путем формирования сухой липидной пленки из смеси липосомообразующих компонентов и рифампицина с последующим ее диспергированием в натрий-фосфатном буфере до получения липосом с включенным рифампицином, отличающийся тем, что в смесь липосомообразующих компонентов вводят в качестве заряд-формирующего компонента стеариновую кислоту [Пат. BY 5614 С1, Кл. А61К 9/127].
Липосомальные препараты, содержащие различные лекарственные средства, могут быть оптимизированы, с точки зрения содержания лекарственного ингредиента, стабильности, картины биологического распределения и уровня поступления в клетку путем изменения физико-химических параметров липосом, таких как температура фазового перехода, размер липосом, характер распределения препарата по размеру, величина поверхностного заряда, гидратация поверхности соединениями, несущими гидрофильные группы, характер распределения по размеру частиц, а также придания липосомам магниточувствительных свойств за счет введения ферромагнетиков. Магниточувствительные липосомальные суспензии востребованы при ЯМР-диагностике, гипертермии, а также при скорректированной адресной доставке инкапсулированных лекарственных субстанций.
В заявленных ранее способах в качестве носителей магнитных свойств применяют наноразмерные порошки, полученные химическим способом. Известен способ получения магнетитовых наночастиц, включающий смешение соли железа [Fe(ООССН3)2, Fe(асас)3, Fe(acac)2, FeC2O4 или Fe2(С2O4)3, где асас - СН3СОСНСОСН3] со спиртом в органическом растворителе и нагрев полученной смеси до 200-360°С. Размеры частиц (2-20 нм) могут регулироваться путем изменения соотношения соли железа с кислотой. Способ может быть распространен на наноматериалы из MFe2O4, где М=Со, Ni, Си, Zn, Cr, Ti, Ba, Mg [Пат. USA, 6962685, МПК7, C01G 49/08]. Также предложен способ синтеза монодисперсных нанокристаллов магнетита при комнатной температуре в отсутствии растворителей [Ye X.R., Daraio С. et al. Room temperature solvent-free synthesis of monodisperse magnetite nanocrystals. J. Nanosci. and Nanotechnol. 2006. 6, №3, p.852-856].
Коллоидный гамма-оксид железа (и соответствующие большие униламеларные магнетолипосомы) можно получить соосаждением щелочных растворов солей железа [М.Babincova, P, Cicmanek, P.Babinec, V.Altanerova, С.Altaner. Magnetoliposomes mediated local electromagnetic hyperthermia. Radio Eng. 2000. 9. p.12-13].
Вместе с тем, необходимо отметить, что самые последние публикации свидетельствуют о токсичности наноразмерных металлов, их оксидов относительно тканей, органов и компонентов биологических жидкостей живых организмов [C.Medina, M.J.Santos-Martinez, A.Radomski, O.I.Corrigan, M.W.Radomski. Nanoparticles: pharmacological and toxicological significance. // British Journal of Farmacology, (2007) 150, 552-558. doi:10.1038/sj.bjp.0707130; published online 22 January 2007].
Известен способ получения «магнетосом», когда монокристаллы магнетита размером не менее 45 нм получают из магнитной бактерии Magnetospirillum, покрывают фосфолипидной мембраной и затем «упаковывают» в липосомы [Пат. USA 20020012698. Кл. А61Л 048/00]. Причем, во внешнюю мембрану или вовнутрь ее может быть заключен еще один терапевтический препарат, в зависимости от гидрофильности или липофильности инкапсулируемого агента. Недостатком метода является двухслойная структура липосомальной системы и сложность ее приготовления.
Основным условием проявления максимальной функциональной и терапевтической активности липосомальных препаратов является сродство состава их мембран к клеточной структуре органов-мишеней, что обеспечивается сбалансированным биохимическим составом всех типов присутствующих в них компонентов.
По известным способам в качестве источника фосфолипидов используют экстракт головного мозга крупного рогатого скота [Пат. RU 2192265 С2; Кл. А61Л 35/30]; медицинскую пиявку [Пат. RU 2131736. Кл. А61К 35/32]; жидкие глицериды из подкожного тюленьего жира [Пат. RU 2099087 С1; Кл. А61К 47/00]; отходы головоногих моллюсков [Авт.св. СССР 1080825, А61К 37/22, оп. 23.03.84, Бюлл.11], комплекс липидов из вилочковой железы [пат. RU 1836092 кл. А61К 31/685]. Высокоочищенный лецитин, который получают из яичного желтка или сои, также используют для получения липосомальных везикул с инкапсулированными формами антибиотиков и цитостатиков [М.В.Жукова и др. Инкапсулирование доксорубицина в липосомы, содержащие фосфатидилэтанол. Химико-фармацевтический журнал. Т.40, №1, С.31-33. 2006]. При этом вынужденным является применение целого комплекса приемов, которые обеспечивают степень необходимой чистоты лецитина и его сохранность.
Известен также способ получения «холостых» магниточувствительных липосом [Г.К.Исмаилова, В.И.Ефременко, А.Г.Курегян. Биотехнология получения магнитоуправляемых липосом. Химико-фармацевтический журнал. Т. №39. №7, 2005. С.47-49], который касается включения в липосомы только водной суспензии магнетита без лекарственного вещества. Источником липидного сырья служит головной мозг крупного рогатого скота; для придания липосомальной композиции магниточувствительных свойств, в ее состав вводят магнетит, который получают химическим способом путем осаждения из растворов сульфата и хлорида железа раствором гидроксида аммония. Недостатком указанного способа является длительность процедуры выделения фосфолипидного концентрата (12-15 часов) путем гомогенизации исходного сырья (головной мозг крупного рогатого скота) ацетоном, фильтрации, многократной экстракции осадка хлороформом и этанолом, отделение липидной части и выделение из нее фосфолипидов добавлением ацетона [Пат. RU 2192265 С2; Кл. A61K 35/30], а также необходимость модификации химического состава липидного концентрата добавлением фосфатидилхолина, холестерина, продолжительность процедуры получения магнетита на фоне его сравнительно высокой концентрации и возможное проявление токсичности.
Известен способ получения магнитоуправляемых липосом с инкапсулированным преднизолоном [Исмаилова Г.К. и др. Эффективность наружного применения новой магнитоуправляемой липосомальной формы преднизолона при экспериментальном аллергическом дерматите. // Химико-фармацевтический журнал, 2006. Т.40. №4, С.3-7]. Липосомы получали методом «выпаривания и обращения фаз», используя смесь фосфолипидов и холестерина, из головного мозга крупного рогатого скота. В качестве магнитного носителя использовали мелкодисперсный магнетит, полученный химическим способом.
В качестве прототипа можно рассматривать метод получения больших униламелярных магнитолипосом с инкапсулированным доксорубицином (DOX) [Babincova М., Cicmanec P., Altanerova V., Altaner С., Babinec P. AC-magnetic field controlled drug release from magnetoliposomes: design of a method for site-specific chemotherapy. Bioelectrochemistry. 2002; V.55; Issue 1-2; p.17-19]. По этому методу коллоидный гамма-оксид железа получают химическим способом действием щелочи на соли железа, который затем отмывают дистиллированной водой, метанолом, хлороформом. Затем к полученному коллоидному осадку добавляют раствор в хлороформе дипальмитоил-фосфатидилхолина и удаляют органический растворитель в атмосфере азота до получения липидной пленки, которую, в свою очередь, растворяют затем в смеси изопропилового эфира и хлороформа, добавляют лимонную кислоту и диспергируют в ультразвуковом поле. После отгонки растворителей получают большие униламелярные липосомы, в которые вводят DOX, используя метод градиента рН. При изменении рН от 4,0 до 7,8 за счет прибавления 1 М NaOH и нагревания до 60°С образуется липосомальная эмульсия, которая смешивается с подогретым DOX. Здесь же предложен способ высвобождения указанного противоонкологического препарата из липосомальной эмульсии путем ее нагревания в магнитном поле с частотой 3,5 МГц и напряженностью 1,5 мТл до 42°С в течение нескольких минут, когда фосфолипидная мембрана разрывается с полным высвобождением инкапсулированного DOX. Указанный способ не отличается простотой и имеет ряд недостатков. Основной недостаток состоит в ограничении его применения к синтезу липосомальных препаратов с инкапсулированным цитостатиком класса производных платины. Например, препарат цис-платин (аптечная форма) представляет собой раствор активного вещества концентрацией 1-10% в физрастворе (0,9% раствор NaCl в воде). Если выполнять синтез липосом, нагруженных цис-платином, по способу, описанному выше, то неизбежен непосредственный контакт цис-платина с магнитным гамма-Fe2О3, а также температурное и кислотно-щелочное воздействие на смесь реагентов. В этих условиях нельзя исключить возможность перехода фармакологически активной цис-формы цитостатика в неактивный транс-изомер. В то же время полученные нами предварительные экспериментальные данные свидетельствуют о том, что контакт гамма-Fe2О3 с физраствором сопровождается постепенным его переходом в альфа-Fe2О3, который не активен относительно магнитного поля, что неизбежно приведет к снижению и потере его магнитных свойств. Кроме того, не исключается проявление токсичности оксидом железа.
Задачей данного изобретения является разработка простого и экспрессного, технологичного способа получения нетоксичных магниточувствительных липосом, инкапсулированных цитостатиком.
Технический результат достигается за счет использования при синтезе магниточувствительных липосом в качестве исходного сырья - барсучьего жира, а в качестве носителя магнитных свойств - нанопорошков металлов с размером частиц 2-5 нм, заключенных в углеродную оболочку, полученных газофазным способом. Липосомальную систему стерилизуют в камере бетатрона.
Заявляемый способ имеет следующие отличительные признаки:
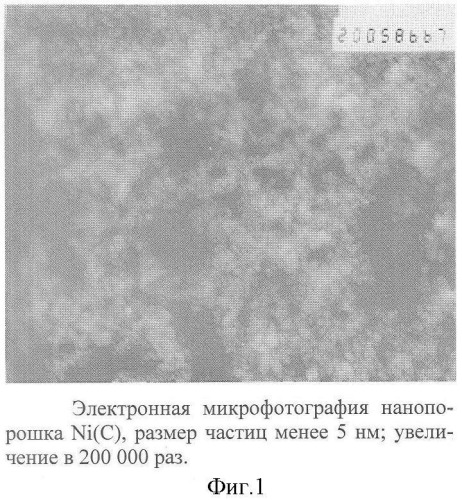
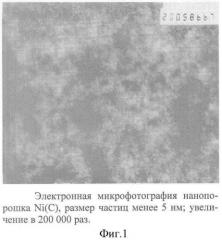
- газофазные нанопорошки металлов (Fe, Ni, Со) имеют средний размер 2 нм, они покрыты оболочкой аморфного углерода, причем пограничный с металлом слой имеет алмазоподобную структуру (фиг. 1, 2), которая обеспечивает прочное сцепление углеродной оболочки с металлическим ядром, за счет чего достигается нивелирование химической активности собственно нанопорошка относительно компонентов биологических жидкостей при сохранении ими ферромагнитных свойств, исключается вероятность эмболии за счет его агломерации, обеспечивается свободное удаление нанопорошков из организма через органы выделения;
- в качестве источника фосфолипидов выбран барсучий жир, который традиционно применяется в медицине, особенно при заболевании туберкулезом. Набор присутствующих в нем биологически активных веществ (липиды, витамины, микроэлементы и органические кислоты) на 100% усваивается в крови, вызывая усиление белкового обмена, повышение иммунитета организма и осуществляя корректирование кроветворной системы; по предлагаемому способу барсучий жир используется как природная матрица, предохраняющая в целостности все составляющие ее компоненты, и, прежде всего, фосфолипиды, которые высвобождаются на стадии инкапсулирования активных ингредиентов с образованием замкнутых органотропных биологических мембран.
Предложенный способ позволяет исключить проявление токсичности со стороны носителя магнитных свойств за счет капсулирования наночастиц в углеродную оболочку.
Примеры конкретного выполнения.
Пример 1.
1. Навеску барсучьего жира (100 мг, аптечный препарат) растворяют в 25 мл хлороформа, к нему прибавляют ферромагнитный нанопорошок с размером частиц 2-5 нм, заключенных в оболочку аморфного углерода. Фосфолипидные компоненты барсучьего жира имеют высокое сродство к поверхности нанопорошков и после ультразвукового воздействия (УЗ, 12 кГц) в течение 3 секунд образуют опалесцирующий коллоидный раствор коричневой окраски.
2. Затем к полученной коллоидной системе добавляют раствор цитостатика (2 мл, 10%-ный в физрастворе) и подвергают У3-обработке еще 5 секунд.
3. Верхний слой отделяют в делительной воронке и помещают в круглодонную колбу, которую, в свою очередь, подсоединяют к роторному испарителю и выдерживают в инертной среде в течение двух часов при температуре 50±5°С для удаления растворителя.
4. После этого добавляют фосфатный буфер и интенсивно механически перемешивают содержимое колбы.
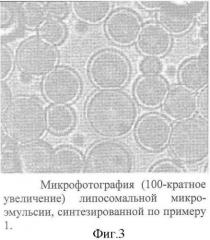
5. Образовавшуюся микроэмульсию подвергают стерилизации в камере бетатрона и хранят в холодильнике при температуре не выше +5°С. Размер полученных липосом 1-7 мкм, их структура бислойная (фиг.3).
Пример 2.
1. Навеску барсучьего жира (100 мг, аптечный препарат) растворяют в 25 мл хлороформа.
2. К раствору цитостатика (2 мл, 10%-ный в физрастворе, препарат для инъекций) прибавляют ферромагнитный нанопорошок с размером частиц 2-5 нм, заключенных в оболочку аморфного углерода (1 мг), ПАВ (поверхностно-активное вещество) и подвергают У3-обработке в течение 3 секунд.
3. К нанодисперсии нанопорошка в цитостатике добавляют раствор барсучьего жира в хлороформе (как в примере 1) и дополнительно выдерживают в У3-поле еще 5 секунд.
4. Верхний слой отделяют и помещают в 1-литровую круглодонную колбу, которую, в свою очередь, подсоединяют к роторному испарителю и выдерживают в инертной среде в течение двух часов при температуре 50±5°С для удаления остатка растворителя.
5. После этого в условиях, обеспечивающих инертную атмосферу, добавляют фосфатный буфер.
6. Полученную смесь в инертной атмосфере обрабатывают УЗ.
7. Образовавшуюся эмульсию субмикронных размеров подвергают стерилизации в камере бетатрона и хранят в холодильнике при температуре не выше +5°С.
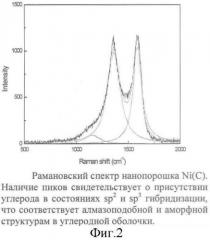
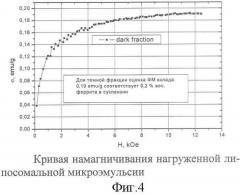
Магнитная чувствительность синтезированной липосомальной системы, как следует из фиг.4, составляет не менее 0,18 emu/g, что является достаточным для контроля за ее подвижностью посредством наложения внешнего магнитного поля. Это, в свою очередь, делает возможным адресное удерживание липосомального композита в процессе хирургического вмешательства у онкологических больных. Стерилизация в камере бетатрона позволяет полностью освободиться от микроорганизмов, бактерий и вирусов, негативно влияющих на активность липосомальной системы.
Таким образом, предлагается простой и универсальный способ приготовления нетоксичной магниточувствительной липосомальной композиции, инкапсулированной цитостатиком, с использованием в качестве носителя магнитных свойств наночастиц металлов с поверхностью, защищенной углеродной оболочкой, которая стабильна при хранении и характеризуется биодоступностью лекарственной формы за счет органотропных фосфолипидов барсучьего жира.
Способ получения магниточувствительных липосом, содержащих лекарственное средство, путем растворения фосфолипидов в хлороформе, добавления носителя магнитных свойств и воздействия ультразвуком, отличающийся тем, что в качестве источника фосфолипидов используют барсучий жир, в качестве носителя магнитных свойств используют ферромагнитный нанопорошок металла, полученный газофазным способом, с размером частиц 2-5 нм, заключенных в углеродную оболочку, и стерилизуют липосомальную систему в камере бетатрона.