Кристаллы человеческого гормона роста и способы их получения
Иллюстрации
Показать всеИзобретение относится к стабильным кристаллам человеческого гормона роста или производного человеческого гормона роста, обладающим длительным действием, а также к композициям или препаратам, содержащим эти кристаллы. Кроме того, изобретение относится к способам получения указанных кристаллов и композиций, содержащих эти кристаллы. Изобретение также относится к способам лечения индивидуумов, страдающих расстройствами, ассоциированными с дефицитом человеческого гормона роста, или расстройствами, симптомы которых могут быть ослаблены путем лечения человеческим гормоном роста с использованием указанных кристаллов, а также композиций или препаратов, содержащих эти кристаллы. Изобретение позволяет введение лекарственной формы один раз в неделю, возможность ее использования в кристаллической суспензионной форме, обеспечивает безопасность, эффективность, чистоту и стабильность, а также обеспечивает получение улучшенных свойств кристаллов чГР и композиций, содержащих эти кристаллы. 10 н. и 60 з.п. ф-лы, 26 табл., 27 ил.
Реферат
Область, к которой относится изобретение
Настоящее изобретение относится к кристаллам человеческого гормона роста или производного человеческого гормона роста, а также к композициям или препаратам, содержащим эти кристаллы. Кроме того, настоящее изобретение относится к способам получения кристаллов человеческого гормона роста или производного человеческого гормона роста. Кристаллы согласно настоящему изобретению являются особенно подходящими для использования в способах лечения млекопитающего, страдающего расстройствами, связанными с дефицитом человеческого гормона роста, или расстройством, симптомы которого могут быть ослаблены путем лечения человеческим гормоном роста.
Предшествующий уровень техники
Соматотропин, или гормон роста (ГР), представляет собой белок млекопитающего, принадлежащий к классу трофических гормонов, синтезируемых и секретируемых в головном мозге главной железой эндокринной системы, аденогипофизом. Секреция ГР и других трофических гормонов аденогипофизом регулирует активность клеток в других эндокринных железах и во всех тканях организма. Более конкретно, ГР секретируется соматотрофными клетками передней доли гипофиза и стимулирует синтез и секрецию IGF-1, белка, который регулирует деление клеток в печени и других тканях, а также регулирует метаболические процессы, и который присутствует в свободном состоянии или связывается с одним из шести других белков, обозначаемых как IGFBP-1-IGFBP-6. Сам процесс секреции модулируется противоположными по своему характеру функциями соматолиберина (стимулирующего высвобождение ГР) и саматостатина (ингибирующего высвобождение ГР).
Человеческий гормон роста (“чГР”) представляет особый интерес, поскольку он служит в качестве гормона, играющего важную роль в регуляции роста клеток и органов, а также в физиологической функции на различных этапах старения. Так, например, сверхпродуцирование чГР приводит к гигантизму у детей и к акромегалии у взрослых тогда, как его недостаточное продуцирование приводит к карликовости у детей [Mauras et al., J. Clin. Endocrinology and Metabolism, 85(10), 3653-3660 (2000); Frindik et al., Hormone Research, 51(1), 15-19 (1999); Leger et al., J. Clin. Endocrinology and Metabolism, 83(10), 3512-3516 (1998)], к синдрому Тернера (только у женщин) [Bramswig, Endocrine, 15(1), 5-13 (2001); Pasquino et al., Hormone Research, 46(6), 269-272 (1996)] и к хронической почечной недостаточности [Carroll et al., Trends in Endocrinology and Metabolism, 11(6), 231-238 (2000); Ueland et al., J. Clin. Endocrinology and Metabolism, 87(6), 2760-2763 (2002); Simpson et al., Growth Hormone & IGF Research, 12, 1-33 (2002)]. У взрослых дефицит чГР может негативно влиять на метаболизм белков, углеводов, липидов и микроэлементов и на соединительную ткань и может приводить к атрофии мышц, костей или кожи [Mehls & Haas, Growth Hormone & IPG Research, Supplement B, S31-S37 (2000); Fine et al., J. Pediatrics, 136(3), 376-382 (2000); Motoyama et al., Clin. Exp. Nephrology, 2(2), 162-165 (1998)]. Другими расстройствами, связанными с дефицитом чГР и характеризующимися недостаточным ростом, являются синдром истощения при СПИД'е [Hirschfeld, Hormone Research, 46, 215-221 (1996); Tritos et al., Am. J. Medicine, 105(1), 44-57 (1998); Mulligan et al., J. Parenteral and Enteral Nutrition, 23(6), S202-S209 (1999); Torres and Cadman, BioDrugs, 14(2), 83-91 (2000)] и синдром Прадера-Вилли [Ritzen, Hormone Research, 56(6), 208 (2002); Eiholzer et al., Eur. J. Pediatrics, 157(5), 368-377 (1998)]. До настоящего времени схемы лечения дефицита чГР у человека предусматривали, главным образом, подкожную инъекцию очищенного чГР, полученного с использованием техники рекомбинантных ДНК. Препарат для такого терапевтического лечения представляет собой или раствор, упакованный в патрон, или лиофилизованный порошок, который необходимо разводить перед использованием. Частота инъекций варьирует в зависимости от заболевания, подвергаемого лечению, и от типа используемого коммерчески доступного продукта. Так, например, карликовость подвергают лечению путем ежедневной подкожной инъекции рекомбинантного чГР.
Необходимость подкожного введения, обеспечивающего быструю доставку чГР, продиктована природной нестабильностью белка в растворе. Такая нестабильность является результатом расщепления важных внутримолекулярных перекрестных связей в конкретных положениях аминокислотной последовательности белка, что, в свою очередь, приводит к разрушению основной трехмерной структуры, распознаваемой рецепторами клеточной поверхности и ассоциированной с этими клеточными поверхностями у пациента. Механизм расщепления или деградации чГР регулируется, главным образом, окислением метиониновых остатков или дезамидированием остатков аспарагиновой кислоты после растворения, что делает данный белок неактивным. Поэтому, принимая во внимание такую нестабильность белка, необходимо разработать чГР-содержащие композиции или препараты, которые обладали бы стабильностью и продолжительным действием и которые можно было бы вводить не только подкожно, но и другими стандартными способами введения лекарственных средств, такими как пероральное, дермальное и внутривенное введение.
Попытки решения этой проблемы привели к получению различных продуктов чГР, которые в настоящее время являются коммерчески доступными. Таким продуктом, например, является Nutropin Depot®, который представляет собой инъецируемую суспензию рекомбинантного человеческого гормона роста (рчГР), заключенную в микросферы из сополимера полилактида-гликолида (ПЛГ) (см., http://www.gene.com). Помимо рчГР и ПЛГ, указанные микросферы также содержат такие компоненты, как ацетат цинка и карбонат цинка. Перед введением твердый материал должен быть разведен водным раствором, содержащим натриевую соль карбоксиметилцеллюлозы, полисорбат, хлорид натрия и воду. Эту суспензию, которая, в основном, состоит из полимера, вводят один или два раза в месяц, и для ее инъекции требуется игла калибра 21. Из-за размера микросфер и вязкой консистенции продукта в месте инъекции могут наблюдаться побочные реакции, приводящие к возникновению узлов, эритемы, болей, гематомы, зуда, липоатрофии и отечности (см. http://www.genentech.com/gene/products/ information/opportunistic/nutropin-depot/index.jsp).
Другим продуктом чГР, получение которого было начато, но затем приостановлено, является AlbutropinTM, препарат пролонгированного действия, а именно генетически продуцированный гибридный белок, состоящий из человеческого альбумина и человеческого гормона роста (см. http://www.hgsi.com/products/albutropin.html). Считается, что этот продукт имеет более длительное время полужизни в кровотоке, т.е. по грубой оценке, его время полужизни на 50% превышает время полужизни растворимого нативного чГР. AlbutropinTM обычно вводят путем инъекции один раз в неделю, и считается, что он стимулирует увеличение уровней IGF-1, которые поддерживаются в течение длительного периода времени, после его выведения из организма. Биологический эффект этого продукта аналогичен эффекту, достигаемому при применении современной терапии гормонами роста.
Другим полученным продуктом является Infitropin CRTM, препарат чГР, состоящий из молекул чГР, конъюгированных с полиэтиленгликолем. Этот конъюгированный чГР необходимо вводить один раз в неделю, при этом считается, что он высвобождается непрерывно, без каких-либо явно наблюдаемых “выбросов” [Ross et al., J. Biol. Chem., 271(36), 21696-21977 (1996)]. Однако производство этого продукта было прекращено.
В патентах США №№ 5981485 и 6448225 описаны водные препараты чГР, которые, как считается, не требуют разведения, и эти препараты вводят путем ежедневных инъекций. Такие препараты обычно содержат чГР, буфер, неионогенное поверхностно-активное вещество, и необязательно, нейтральную соль, маннит или консервант.
Для обеспечения пролонгированного высвобождения лекарственного средства, содержащего чГР, были предприняты попытки разработать другие методы доставки лекарственных средств, такие как методы с использованием гидрогелей [Katakam et al., J. Controlled Release, 49(1), 21-26 (1997)], липосом, масляных эмульсий и микросфер на основе биологически разлагаемого полимера. Однако полученные препараты дают очень резкое высвобождение лекарственного средства, то есть по типу “выброса”, и требуют соблюдения жестких условий, а некоторые из них трудно получить промышленным способом. Это, в частности, относится к технологии изготовления препаратов чГР, основанной на использовании микросфер, состоящих из сополимера DL-молочной и гликолевой кислоты (ПЛГА), поскольку технология, используемая для получения микросфер, требует выполнения определенных условий, таких как повышенная температура, присутствие поверхностно-активного вещества, органических растворителей и границы раздела водного/органического растворителя, каждое из которых приводит к разложению белка [Herberger et al., Proc. Intl. Symp. Controlled Release of Bioactive Materials, 23, 835-836 (1996); Kim et al., Intl. J. Pharmaceutics, 229(1-2), 107-116 (2001)].
Для некоторых из вышеописанных препаратов необходимо поддержание чГР в лиофилизованном состоянии, что может потребовать много времени и проведения дорогостоящих процедур. В патентах США №№ 5780599 и 6117984 описаны кристаллы чГР, содержащие двухвалентный катион, и методы получения таких содержащих двухвалентный катион кристаллов чГР, которые не требуют проведения стадии лиофилизации.
Несмотря на то, что попытки устранения недостатков, присущих стандартным продуктам чГР, включая их нестабильность при хранении, а также после введения инъекции, непродолжительное время полужизни in vivo, импульсный характер высвобождения, недостаточную биологическую доступность, трудность и частоту введения, предпринимались и ранее, однако, необходимость получения препаратов чГР с улучшенными свойствами до сих пор остается актуальной. Для решения этой проблемы было разработано настоящее изобретение, целью которого является преимущественно получение кристаллов человеческого гормона роста, обеспечивающих стабильное и длительное время действия чГР.
Описание сущности изобретения
Настоящее изобретение относится к стабильным кристаллам человеческого гормона роста или производного человеческого гормона роста, которые обладают длительным действием, а также являются пригодными и удобными для введения пациенту. Настоящее изобретение также относится к композициям кристаллов человеческого гормона роста или производного человеческого гормона роста, включая фармацевтически приемлемые композиции, содержащие эти кристаллы. Настоящее изобретение также относится к способам получения таких кристаллов, а также к композициям, содержащим эти кристаллы. Кристаллы и композиции согласно изобретению предпочтительно используются в способах лечения индивидуума, страдающего расстройством, ассоциированным с дефицитом человеческого гормона роста, или расстройством, симптомы которого могут быть ослаблены путем лечения человеческим гормоном роста.
Кристаллы человеческого гормона роста или производного человеческого гормона роста, или композиции или препараты, содержащие эти кристаллы, имеют несколько преимуществ, включая возможность их введения один раз в неделю, возможность их использования в кристаллической суспендированной форме, безопасность, эффективность, чистоту, стабильность, ресуспендируемость и возможность введения через шприц в течение короткого периода времени. Другие цели настоящего изобретения, включая улучшение свойств кристаллов чГР и композиций или препаратов, содержащих эти кристаллы, по сравнению со стандартными чГР-препаратами, будут более понятны специалистам из нижеследующего описания изобретения.
Краткое описание графического материала
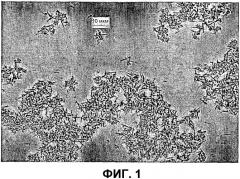
На фиг.1 представлено полученное с помощью оптической микроскопии изображение кристаллов чГР, выращенных в присутствии 860 мМ фосфата аммония (рН 8,9). См. пример 1.
На фиг.2 представлено полученное с помощью оптической микроскопии изображение кристаллов чГР, выращенных в присутствии 390 мМ цитрата натрия. См. пример 2.
На фиг.3 представлено полученное с помощью оптической микроскопии изображение кристаллов чГР, выращенных в присутствии 600 мМ двухосновного фосфата натрия и 100 мМ Трис-HCl (рН 8,6). См. пример 3.
На фиг.4 представлено полученное с помощью оптической микроскопии изображение кристаллов чГР, выращенных в присутствии 85 мМ ацетата кальция и 100 мМ Трис-HCl (рН 8,6) и полученных посредством совместной кристаллизации с сульфатом протамина (1 мг/мл). См. пример 4.
На фиг.5 проиллюстрированы растворимость кристаллов чГР, выращенных в присутствии фосфата аммония, цитрата натрия, двухосновного фосфата натрия, и осадителей, ацетата кальция/протамина, в зависимости от времени, и мониторинг при 280 нм. См. пример 5.
На фиг.6 представлено полученное с помощью оптической микроскопии изображение кристаллов чГР, выращенных в присутствии 10% (об./об.) изопропанола, 85 мМ ацетата кальция и 100 мМ Трис-HCl (рН 8,6). См. пример 6.
На фиг.7 представлено полученное с помощью оптической микроскопии изображение кристаллов чГР, выращенных в присутствии 5% (об/об) изопропанола, 85 мМ хлорида кальция и 100 мМ Трис-HCl (рН 8,6). См. пример 7.
На фиг.8 представлено полученное с помощью оптической микроскопии изображение кристаллов чГР, выращенных в присутствии этанола, 10% (об./об.) ПЭГ-6000 и 100 мМ Трис-HCl (рН 8,6). См. пример 8.
На фиг.9 проиллюстрированы растворимость кристаллов чГР, выращенных как описано в примерах 6-8, в зависимости от времени, и мониторинг при 280 нм. См. пример 9.
На фиг.10 представлено полученное с помощью оптической микроскопии изображение кристаллов чГР, выращенных в присутствии 85 мМ ацетата кальция, 2% (об./об.) ПЭГ-6000 и 100 мМ Трис-HCl (рН 8,6). См. пример 10.
На фиг.11 представлено полученное с помощью оптической микроскопии изображение кристаллов чГР, выращенных в присутствии 500 мМ ацетата натрия, 6% (об./об.) ПЭГ-6000 и 100 мМ Трис-HCl (рН 8,6). См. пример 11.
На фиг.12 представлено полученное с помощью оптической микроскопии изображение кристаллов чГР, выращенных в присутствии 85 мМ хлорида кальция, 6% (об./об.) ПЭГ-6000 и 100 мМ Трис-HCl (рН 8,6). См. пример 12.
На фиг.13 представлено полученное с помощью оптической микроскопии изображение кристаллов чГР, выращенных в присутствии 85 мМ ацетата кальция, 6% (об./об.) ПЭГ-6000 и 100 мМ Трис-HCl (рН 8,6) и полученных посредством совместной кристаллизации с сульфатом протамина (1 мг/мл). См. пример 13.
На фиг.14 представлено полученное с помощью оптической микроскопии изображение кристаллов чГР, выращенных в присутствии 125 мМ ацетата кальция, 6% (об./об.) ПЭГ-ММЕ-6000 и 100 мМ Трис-HCl (рН 8,6). См. пример 14.
На фиг.15 проиллюстрированы растворимость кристаллов чГР, выращенных как описано в примерах 10-14, в зависимости от времени, и мониторинг при 280 нм. См. пример 15.
На фиг.16 показаны сывороточные уровни (нг/мл) коммерчески доступного чГР (растворимого чГР) и чГР, полученного как описано в примере 10 (кристаллического чГР) в пробах крови, взятых у самок крыс Sprague-Dawley через 24 часа после одного подкожного введения дозы 2,5 мг/кг растворимого или кристаллического чГР на крысу. Уровни чГР в сыворотке измеряли на t=0 и через 0,5, 1, 2, 4, 6, 8, 12 и 24 часа после введения. См. пример 16.
На фиг.17 проиллюстрирована способность к растворению кристаллов чГР (образованных в присутствии 85 мМ ацетата кальция, 2% (об./об.) ПЭГ-6000 и 100 мМ Трис-HCl (рН 8,6)) после добавления различных количеств сульфата протамина. Различные композиции этих кристаллов чГР добавляли в буфер для растворения и оставляли на 1 час, после чего определяли концентрацию растворимого чГР в супернатанте с помощью ОФ-ВЭЖХ (площадь). См. пример 17.
На фиг.18А представлено полученное с помощью ПЭМ (просвечивающей оптической микроскопии) продольное изображение кристаллов чГР, выращенных в присутствии 500 мМ ацетата натрия, 6% (об./об.) ПЭГ-6000 и 100 мМ Трис-HCl (рН 8,6). См. пример 18.
На фиг.18В представлено полученное с помощью ПЭМ (просвечивающей оптической микроскопии) изображение кристаллов чГР в поперечном сечении, выращенных в присутствии 500 мМ ацетата натрия, 6% (об./об.) ПЭГ-6000 и 100 мМ Трис-HCl (рН 8,6). См. пример 18.
На фиг.19А показаны уровни (нг/мл) чГР в пробах сыворотки, взятых у самок крыс Sprague-Dawley групп 3-5 и 9 через 168 часов (приводятся данные проб крови, взятых через 0-72 часа), либо после ежедневного подкожного введения в течение 7 дней, либо после одного подкожного введения за 7 дней дозы 6,7 мг/кг чГР на крысу. См. пример 22 и таблицы 7-12.
На фиг.19В показано увеличение массы (г) самок крыс Sprague-Dawley (групп 2, 4 и 9), которым были инъецированы выбранные композиции, через 8 дней либо после ежедневного подкожного введения в течение 7 дней (группа 2), либо на день 1 после единственного за 7 дней подкожного введения (группы 4 и 9) дозы 6,7 мг/кг чГР на крысу. См. пример 22 и таблицу 13.
На фиг.20А представлены концентрации чГР в сыворотке крови в зависимости от времени для молодых самок собакоподобных обезьян после подкожного введения стандартного (для ежедневного введения) растворимого чГР (группа 1), натрийсодержащих кристаллов чГР, образующих комплекс с полиаргинином (группа 2), и натрийсодержащих кристаллов чГР, образующих комплекс с протамином (группа 3), как показано в таблице 16. См. пример 23.
На фиг.20В представлены концентрации IGF-1 в сыворотке крови в зависимости от времени для молодых самок собакоподобных обезьян после подкожного введения стандартного (для ежедневного введения) растворимого чГР (группа 1), натрийсодержащих кристаллов чГР, образующих комплекс с полиаргинином (группа 2), и натрийсодержащих кристаллов чГР, образующих комплекс с протамином (группа 3), как показано в таблице 16. См. пример 23.
На фиг.21А представлены концентрации чГР в сыворотке крови в зависимости от времени для молодых самок собакоподобных обезьян после подкожного введения стандартного (для ежедневного введения) растворимого чГР (группа 1), натрийсодержащих кристаллов чГР, образующих комплекс с протамином (отношение чГР:протамин = 3:1) (группа 2), и натрийсодержащих кристаллов чГР, образующих комплекс с протамином (отношение чГР:протамин = 2:1) (группа 3), как показано в таблице 20. См. пример 24.
На фиг.21В представлены концентрации IGF-1 в сыворотке крови в зависимости от времени для молодых самок собакоподобных обезьян после подкожного введения стандартного (для ежедневного введения) растворимого чГР (группа 1), натрийсодержащих кристаллов чГР, образующих комплекс с протамином (отношение чГР:протамин = 3:1) (группа 2), и натрийсодержащих кристаллов чГР, образующих комплекс с протамином (отношение чГР:протамин = 2:1) (группа 3), как показано в таблице 22. См. пример 24.
На фиг.22 проиллюстрирован семидневный рост самцов крыс Wistar, которым подкожно вводили контроль (группа 1, один раз в день в течение семи дней) растворимый чГР (группы 4 и 5, один раз в день в течение семи дней) и кристаллический чГР (группы 6, 7, 9 и 10, один раз за семь дней) как показано в таблице 25. См. пример 25.
На фиг.23 проиллюстрирован ежедневный прирост массы (в граммах) в течение семидневного периода времени для самцов крыс Wistar, которым подкожно вводили контроль (группа 1, один раз в день в течение семи дней) растворимый чГР (группы 4 и 5, один раз в день в течение семи дней) и кристаллический чГР (группы 6, 7, 9 и 10, один раз за семь дней), как показано в таблице 26. См. пример 25.
Подробное описание изобретения
Определения
Если не указано иное, то все научные и технические термины, используемые в настоящем изобретении, имеют общепринятые значения, известные специалистам в данной области. Кроме того, если это не требуется в данном контексте, то употребление терминов в единственном числе может подразумевать формы множественного числа, а употребление терминов во множественном числе может подразумевать формы единственного числа. Обычно используемая здесь номенклатура и описанные здесь методы колоночной хроматографии, оптической микроскопии и спектроскопии в УФ- и визуальной области спектра (UV-VIS-спектроскопии), а также методы проведения фармакокинетических анализов, методы рекомбинантных ДНК, методы химического синтеза пептидов и белков, методы химического синтеза нуклеиновых кислот и методы, применяемые в молекулярной биологии, являются хорошо известными и широко используются специалистами.
Описанные ниже термины, если не указано иное, имеют следующие значения.
Термин “гормон роста (ГР)”, в общих чертах, означает гормоны роста, секретируемые гипофизом млекопитающих. Примерами таких млекопитающих являются, но не ограничиваются ими, человек, человекообразные обезьяны, мартышки, крысы, свиньи, собаки, кролики, кошки, коровы, лошади, мыши и козы. В соответствии с предпочтительным вариантом настоящего изобретения указанным млекопитающим является человек.
Термин “человеческий гормон роста (чГР)” означает белок, имеющий аминокислотную последовательность, структуру и функции, присущие нативному человеческому гормону роста. Используемый здесь термин “человеческий гормон роста (чГР)” также означает любую изоформу нативного человеческого гормона роста, включая, но не ограничиваясь ими, изоформы с молекулярными массами 5, 17, 20, 22, 24, 36 и 45 кДа [Haro et al., J. Chromatography B, 720, 39-47 (1998)]. Так, например, термин “чГР” включает последовательность нативного чГР из 191 аминокислоты, соматотропина; последовательность из 192 аминокислот, содержащую N-концевой метионин (Met-чГР), и соматрем [патенты США №№ 4342832 и 5633352]. чГР может быть получен путем выделения и очистки из биологического источника или методами рекомбинантных ДНК. Если чГР был получен методами рекомбинантных ДНК, то такой чГР называется рекомбинантным человеческим гормоном роста (рчГР). Met-чГР обычно получают с использованием техники рекомбинантных ДНК.
Термин “производное человеческого гормона роста” означает белок, имеющий аминокислотную последовательность, сравнимую с аминокислотной последовательностью природного человеческого гормона роста. Термин “сравнимый” относится к аминокислотной последовательности, которая имеет 2-100%-ную гомологию с последовательностью чГР, состоящей из 191 аминокислоты, или с последовательностью Met-чГР, состоящей из 192 аминокислот. В различных вариантах настоящего изобретения производные человеческого гормона роста включают органические катионы чГР или Met-чГР, варианты биологически синтезированных белков чГР или Met-чГР, полученные в результате замены, делеции и инсерции; посттрансляционно модифицированные белки чГР и Met-чГР, включая белки, полученные посредством реакций дезамидирования, фосфорилирования, гликозилирования, ацетилирования, агрегации и ферментативного расщепления [Haro et al., J. Chromatography B, 720, 39-47 (1998)]; химически модифицированные белки чГР или Met-чГР, полученные из биологических источников; полипептидные аналоги и химически синтезированные пептиды, содержащие аминокислотные последовательности, аналогичные аминокислотным последовательностям чГР или Met-чГР.
Методы, используемые для получения чГР или Met-чГР, включают выделение из биологического источника, осуществление техники рекомбинантных ДНК, химический синтез или их комбинацию. До настоящего времени считалось, что генами, которые кодируют различные ДНК-последовательности чГР, являются гены hGH-N и hGH-V [Haro et al., J. Chromatography B, 720, 39-47 (1998); Bennani-Baiti et al., Genomics, 29, 647-652 (1995)].
Термин “валентность” определяется как способность элемента связываться с другими элементами, и такая способность определяется числом электронов внешней оболочки атома и выражается числом атомов водорода (или любого другого стандартного одновалентного элемента), которые могут присоединять (или замещать) атомы данного элемента [Webster's New World Dictionary of Science, Lindley D. and Moore T.H., Eds., Macmillan, New York, New York, 1998]. Термины “одновалентный катион” и “двухвалентный катион” означают ионы, несущие положительный заряд, который имеет валентность 1 или 2 соответственно. Катионы, имеющие различные валентности, по своей природе могут быть органическими или неорганическими. Примерами одновалентных неорганических катионов являются аммоний (NH4 +) и элементы группы I Периодической таблицы элементов (Н+, Li+, Na+, K+, Rb+, Cs+ и Fr+), а примерами двухвалентных неорганических катионов являются элементы группы II (Ве2+, Mg2+, Ca2+, Sr2+, Ba2+, Mn2+, Co2+, Ni2+, Cu2+, Zn2+, Cd2+, Mo2+ и Ra2+).
Термин “кальцийсодержащий кристалл человеческого гормона роста или производного человеческого гормона роста” означает человеческий гормон роста или его производное, которые были кристаллизованы в присутствии двухвалентного иона кальция. Двухвалентный ион кальция вводят в раствор для кристаллизации в виде кальциевой соли. В предпочтительном варианте осуществления изобретения кальцийсодержащий кристалл человеческого гормона роста или производного человеческого гормона роста содержит от примерно 1 до примерно 500 молекул кальция на мономер или мономерное звено человеческого гормона роста или производного человеческого гормона роста. В более предпочтительном варианте изобретения кальцийсодержащий кристалл человеческого гормона роста или производного человеческого гормона роста содержит примерно от 1 до 140 молекул кальция на мономер или мономерное звено человеческого гормона роста или производного человеческого гормона роста.
Термин “соль кальция” включает неорганические и органические противоионы или молекулы, образующие ионную связь с ионом (ионами) кальция. Примерами различных солей кальция являются гидрат ацетата кальция, моногидрат ацетата кальция, гидрат ацетилацетоната кальция, дигидрат L-аскорбата кальция, бис(6,6,7,7,8,8,8-гептафтор-2,2-диметил-3,5-октандионат) кальция, бис(2,2,6,6-тетраметил-3,5-гептандионат) кальция, бромид кальция, карбонат кальция, хлорид кальция, дигидрат хлорида кальция, гексагидрат хлорида кальция, гидрат хлорида кальция, тетрагидрат цитрата кальция, дигидрофосфат кальция, 2-этилгексаноат кальция, фторид кальция, глюконат кальция, гидроксид кальция, гипохлорит кальция, иодат кальция, иодид кальция, гидрат иодида кальция, кальцийсодержащий ионофор 1, молибдат кальция, нитрат кальция, оксалат кальция, гидрат оксалата кальция, оксид кальция, пантотенат кальция, пропионат кальция, пирофосфат кальция и сульфат кальция. В предпочтительном варианте настоящего изобретения соль кальция выбрана из группы, состоящей из ацетата кальция, хлорида кальция, сульфата кальция и глюконата кальция. В более предпочтительном варианте изобретения солью кальция является ацетат кальция.
Термин “кристалл человеческого гормона роста или производного человеческого гормона роста, содержащий органический катион”, означает человеческий гормон роста, который был кристаллизован в присутствии органического катиона. Термин “органический катион” означает положительно заряженный атом или группу атомов, содержащих углерод. Примерами органических катионов являются четвертичные катионы аммония, тетраэтиламмоний (ТЕА), трибутилметиламмоний (TBuMA), этобромид прокаинамида (РАЕВ), метоиодид азидопрокаинамида (АРМ), d-тубокурарин, метокурин-векуроний, рокуроний, 1-метил-4-фенилпиридиний, холин и N-(4,4-аксо-н-пентил)-21-дезоксиаймалиний (APDA).
чГР является коммерчески доступным продуктом, поставляемым в лиофилизованной форме, и обычно его получают методами рекомбинантных ДНК. В соответствии с настоящим изобретением кристаллизацию чГР обычно осуществляют путем приготовления буферного раствора чГР, очистки и/или обессоливания, диализа и концентрирования такого раствора и добавления к этому раствору одновалентного или двухвалентного катиона или соли. В последней стадии образуется органический или неорганический катион, связанный с чГР.
В одном из своих предпочтительных вариантов настоящее изобретение относится к кристаллам чГР или производного чГР, содержащим одновалентный катион. В более предпочтительном варианте изобретения одновалентный катион выбран из группы, состоящей из лития, натрия, калия и аммония. В более предпочтительном варианте изобретения одновалентным катионом является натрий. В наиболее предпочтительном варианте изобретения человеческий гормон роста или производное человеческого гормона роста содержит от примерно 1 до примерно 500 молекул одновалентного катиона на мономер или мономерное звено человеческого гормона роста или производного человеческого гормона роста.
Термин “соль одновалентного катиона” включает как неорганические, так и органические противоионы или молекулы, образующие ионную связь с одновалентным ионом. В предпочтительном варианте изобретения солью одновалентного катиона является соль натрия. В более предпочтительном варианте изобретения соль натрия выбрана из группы, состоящей из цитрата натрия, фосфата натрия и ацетата натрия. В наиболее предпочтительном варианте изобретения солью натрия является ацетат натрия.
В другом своем предпочтительном варианте настоящее изобретение относится к протаминсодержащему кристаллу чГР или производного чГР. Аналогичным образом, в еще одном своем предпочтительном варианте настоящее изобретение относится к полиаргининсодержащему кристаллу чГР или производного чГР.
В другом своем предпочтительном варианте настоящее изобретение относится к кристаллам чГР или производного чГР, содержащим одновалентный или двухвалентный катион и образующим комплекс или совместно кристаллизующимся с протамином или полиаргинином. Более предпочтительно указанными кристаллами являются натрийсодержащие кристаллы, образующие комплекс или совместно кристаллизующиеся с протамином или полиаргинином.
Растворимая форма чГР может быть охарактеризована различными методами, включая обращенно-фазовую высокоэффективную жидкостную хроматографию (ОФ-ВЭЖХ), эксклюзионную высокоэффективную жидкостную хроматографию (Э-ВЭЖХ) и гидрофобную хроматографию (ГФХ) [Wu et al., J. Chromatography, 500, 595-606 (1990); “Hormone Drugs”, FDA publication, (1982)]. С другой стороны, кристаллическая форма чГР может быть охарактеризована с помощью оптической микроскопии и рентгенографии. В общих чертах, условия кристаллизации определяются формой кристаллов белка, то есть формой, выбранной из группы, состоящей из сфер, игл, стержней, пластин (гексагональных и квадратных), ромбов, кубов, бипирамид и призм.
Кристаллы чГР или производного чГР согласно настоящему изобретению образуют стержневидные или иглообразные морфологические структуры, наблюдаемые при оптической микроскопии. В одном из вариантов осуществления изобретения чГР или производное чГР образуют кристаллы в виде стержней или игл, имеющие длину от примерно 0,1 до примерно 200 мкм. В предпочтительном варианте осуществления изобретения кристаллы чГР или производного чГР имеют форму стержней или игл длиной примерно 3-100 мкм. В более предпочтительном варианте осуществления изобретения кристаллы чГР или производного чГР имеют форму стержней или игл длиной примерно 10-25 мкм.
В другом своем варианте настоящее изобретение относится к композициям, содержащим кристаллы чГР или производного чГР, полученные путем кристаллизации в присутствии кальция, одновалентного катиона, протамина или полиаргинина, и фармацевтически приемлемый наполнитель. В еще одном предпочтительном варианте изобретения кристаллы чГР или производного чГР и наполнитель присутствуют в указанных композициях в молярном отношении чГР:наполнитель, составляющем от примерно 1:250 до примерно 1:20. В альтернативном предпочтительном варианте изобретения кристаллы чГР или производного чГР и наполнитель присутствуют в молярном отношении чГР:наполнитель, составляющем от примерно 3:1 до примерно 1:10. В еще одном предпочтительном варианте изобретения кристаллы чГР или производного чГР и наполнитель присутствуют в молярном отношении чГР:наполнитель, составляющем от примерно 1:10 до примерно 1:0,125. В предпочтительном варианте изобретения кристаллы чГР или производного чГР выращивают в присутствии ацетата натрия, и эти кристаллы могут быть кристаллизованы вместе с полиагринином или протамином или покрыты полиагринином или протамином.
Кристаллы человеческого гормона роста или производного человеческого гормона роста могут быть объединены с любым фармацевтически приемлемым эксципиентом. В соответствии с настоящим изобретением термин “фармацевтически приемлемый эксципиент” означает эксципиент, который действует как наполнитель или как комбинация наполнителей, обычно используемых в фармацевтических композициях. Предпочтительными эксципиентами, которые могут быть включены в эту категорию, являются: 1) аминокислоты, такие как глицин, аргинин, аспарагиновая кислота, глутаминовая кислота, лизин, аспарагин, глутамин, пролин; 2) углеводы, например моносахариды, такие как глюкоза, фруктоза, галактоза, манноза, арабиноза, ксилоза, рибоза; 3) дисахариды, такие как лактоза, трегалоза, мальтоза, сахароза; 4) полисахариды, такие как мальтодекстрины, декстраны, крахмал, гликоген; 5) альдиты, такие как маннит, ксилит, лактит, сорбит; 6) глюкуроновая кислота, галактуроновая кислота; 7) циклодекстрины, такие как метилциклодекстрин, гидроксипропил-β-циклодекстрин и т.п.; 8) неорганические молекулы, такие как хлорид натрия, хлорид калия, хлорид магния, фосфаты натрия и калия, борная кислота, карбонат аммония и фосфат аммония; 9) органические молекулы, такие как ацетат, цитрат, аскорбат, лактат; 10) эмульгирующие или солюбилизирующие/стабилизирующие агенты, такие как аравийская камедь, диэтаноламин, глицерилмоностеарат, лецитин, моноэтаноламин, олеиновая кислота, олеиловый спирт, полоксамер, полисорбаты, лаурилсульфат натрия, стеариновая кислота, монолаурат сорбитана, моностеарат сорбитана и другие производные сорбитана, полиоксиловые производные, воск, производные полиоксиэтилена, производные сорбитана; и 11) реагенты, повышающие вязкость, такие как агар, альгиновая кислота и ее соли, гуаровая камедь, пектин, поливиниловый спирт, полиэтиленоксид, целлюлоза и ее производные, пропиленкарбонат, полиэтиленгликоль, гексиленгликоль, тилоксапол. Могут быть также использованы соли указанных соединений. Другой предпочтительной группой эксципиентов являются сахароза, трегалоза, лактоза, сорбит, лактит, маннит, инозит, соли натрия и калия, такие как ацетат, фосфаты, цитраты и борат, глицин, аргинин, полиэтиленоксид, поливиниловый спирт, полиэтиленгликоль, гексиленгликоль, метоксиполиэтиленгликоль, желатин, гидроксипропил-β-циклодекстрин, полилизин и полиаргинин.
В одном из вариантов осуществления изобретения указанный эксципиент выбирают из группы, состоящей из аминокислот, солей, спиртов, углеводов, белков, липидов, поверхностно-активных веществ, полимеров, полиаминокислот и их смесей. В предпочтительном варианте осуществления изобретения указанный эксципиент выбран из группы, состоящей из протамина; поливинилового спирта; циклодекстринов; декстранов; глюконата кальция; полиаминокислот, таких как полиаргинин, полилизин и полиглутамат; полиэтиленгликоля; дендримеров; полиорнитина; полиэтиленимина; хитозана и их смесей. В более предпочтительном варианте изобретения указанный эксципиент выбран из группы, состоящей из протамина, полиаргинина, полиэтиленгликоля и их смесей.
Кристаллы человеческого гормона роста или производного человеческого гормона роста согласно изобретению могут быть также объединены с носителем или эксципиентом, т.е. веществом, которое при его введении в терапевтический препарат ускоряет или улучшает его действие [The On-Line Medical Dictionary, http://cancerweb.ncl.ac.uk/omd/index.html]. Примерами носителей или эксципиентов являются, например, буферные вещества, такие как фосфаты, глицин, сорбиновая кислота, сорбат калия, смеси неполных глицеридов насыщенных растительных жирных кислот, вода, соли или электролиты, такие как сульфат протамина, динатрийбифосфат, хлорид натрия, соли цинка, коллоидальная двуокись кремния, магний, трисиликат, вещества на основе целлюлозы и полиэтиленгликоль. Носителями или эксципиентами для гелевых основ могут быть, например, натрийсодержащая карбоксиметилцеллюлоза, полиакрилаты, блоксополимеры полиоксиэтилена-полиоксипропилена, полиэтиленгликоль и спирты из древесного воска.
В еще более предпочтительном варианте изобретения указанным эксципиентом является протамин. Кроме того, кристаллы чГР или производного чГР и протамин присутствуют в отношении чГР:протамин, равном от примерно 5:1 до примерно 1:10 (мас./мас.). Это отношение может также варьировать в пределах примерно 10:1-20:1 (мас./мас.). Наиболее предпочтительно, это отношение составляет в пределах примерно 12:1-15:1 (мас./мас.). В соответствии с альтернативным вариантом осуществления изобретения это отношение составляет примерно 3:1-1:10 (мас./мас.). В другом варианте осуществления