Способ изготовления стерилизованного и тарированного медицинского устройства на основе биосенсора (варианты)
Иллюстрации
Показать всеИзобретение относится к области изготовления медицинских устройств. Способ изготовления стерилизованного и тарированного медицинского устройства на основе биосенсора (например, медицинского устройства с объединенными в одно целое биосенсором и ланцетом), содержащее реагент биосенсора (например, реагент биосенсора из специфического фермента для анализируемого вещества и медиатора). Стерилизацию осуществляют, например, гамма-излучением. Затем тарируют реагент биосенсора стерилизованного медицинского устройства на основе биосенсора. Другой способ изготовления стерилизованного и тарированного медицинского устройства на основе биосенсора включает в себя вначале сборку и упаковывание множества медицинских устройств с реагентом биосенсора, затем стерилизацию облучением для создания множества стерилизованных, упакованных медицинских устройств на основе биосенсора. После этого тарируют стерилизованные и упакованные медицинские устройства на основе биосенсора. Тарирование можно выполнять, используя, например, статистически выбранный образец из множества стерилизованных, упакованных медицинских устройств на основе биосенсора. Изобретение позволяет исключить операцию сборки в чистом помещении и предотвратить смещение при сборке устройства. 2 н. и 17 з.п. ф-лы, 4 табл., 4 ил.
Реферат
Предпосылки к созданию изобретения
1. Область изобретения
Это изобретение, в общем, относится к способам изготовления медицинских устройств, в частности к способам изготовления стерилизованных и тарированных медицинских устройств.
2. Описание уровня техники
Стерилизация облучением медицинских устройств определенных типов общепринята и широко распространена в настоящее время вследствие как благоприятной экономичности, так и надежности. В зависимости от типа стерилизуемого медицинского устройства стерилизацию облучением можно осуществлять, используя либо электромагнитное излучение, либо излучение частиц. Ионизирующее излучение в электромагнитном спектре (например, гамма [γ]-излучение, рентгеновское излучение и излучение электронов) может оказывать бактерицидные воздействия посредством превращения энергии фотонов в характерные ионизации в биологической мишени или вблизи нее (например, вредных микроорганизмах). Кроме пар положительных и отрицательных ионов, которые образуются посредством таких характерных ионизаций, в медицинских устройствах, подвергающихся стерилизации облучением, могут также образовываться свободные радикалы и активированные молекулы.
Гамма-излучение обычно используют для стерилизации небиоактивных медицинских устройств, включая обычные больничные средства, например пластмассовые шприцы для подкожных инъекций и шовные материалы. Гамма-излучение может успешно уничтожать вредные микроорганизмы, при этом не повышая температуру медицинского устройства, подвергающегося стерилизации облучением. Поэтому стерилизацию облучением, при которой используют гамма-излучение, часто называют "холодной стерилизацией". При стерилизации медицинского устройства обычно используют минимальную стандартную дозу облучения в 25 кГр. Эта доза может обеспечить коэффициент безопасности, эквивалентный 10-6 инактивации наиболее стойких микроорганизмов.
Подвергая действию энергии, вызванной облучением, можно изменять химические вещества, включая воду, в виде их ионизации, разложения и образования свободных радикалов. В присутствии кислорода такие свободные радикалы могут образовывать перекись водорода и/или гидропероксильные радикалы, которые действуют как окислители или восстановители. Эти вещества затем могут разлагать или иначе изменять различные химические и биохимические вещества (например, ферменты).
Стерилизация гамма-излучением могла считаться подходящей для полного разрушения микробной флоры в медицинском устройстве на основе биосенсора (например, в сенсорах глюкозы одноразового использования, в которых части для прокалывания ланцетом, передачи пробы и измерения концентрации глюкозы объединены в одно цельное медицинское устройство). Однако стерилизация медицинских устройств на основе биосенсора, содержащих специфические реагенты для анализируемого вещества (т.е. реагент биосенсора, например, специфические ферменты для анализируемого вещества и соответствующие медиаторы), до этого была неудачной вследствие того, что облучение могло оказать вредное воздействие на реагенты биосенсоров. Это вредное воздействие может изменить химическую природу биосенсора, что приводит к неточной ответной реакции во время использования биосенсора.
В идеальном случае медицинские устройства на основе биосенсора следует стерилизовать в виде собранного и упакованного изделия. В противном случае потребовался менее экономичный способ стерилизации отдельных частей медицинского устройства на основе биосенсора с последующей сборкой и упаковкой устройства в стерильных условиях.
Следовательно, в этой области все еще требуется простой и недорогой способ изготовления медицинского устройства на основе биосенсора, позволяющий получать медицинское устройство на основе биосенсора, которое является как стерильным, так и точно тарированным. Кроме того, этот способ должен быть годным для стерилизации собранного и упакованного медицинского устройства на основе биосенсора.
Сущность изобретения
В вариантах осуществления настоящего изобретения предлагаются способы изготовления медицинского устройства на основе биосенсора, позволяющие получать медицинское устройство на основе биосенсора, которое является как стерильным, так и точно тарированным. Кроме того, этот способ дает возможность стерилизовать собранное и упакованное медицинское устройство на основе биосенсора.
Способ изготовления стерилизованного и тарированного медицинского устройства на основе биосенсора (например, медицинского устройства из объединенных в одно целое биосенсора и ланцета) согласно одному примерному варианту осуществления настоящего изобретения включает в себя стерилизацию, по меньшей мере, одного медицинского устройства на основе биосенсора, которое содержит реагент биосенсора. Реагент биосенсора может содержать, например, специфический фермент для анализируемого вещества и медиатор. Стерилизацию можно осуществлять, используя, например, способ на основе гамма-излучения. После этого тарируют реагент биосенсора в стерилизованном медицинском устройстве (устройствах) на основе биосенсора.
Способ изготовления стерилизованного и тарированного медицинского устройства на основе биосенсора согласно другому примерному варианту осуществления настоящего изобретения включает в себя сначала сборку и упаковывание множества медицинских устройств на основе биосенсора, которые содержат реагент биосенсора. Затем упакованные медицинские устройства на основе биосенсора стерилизуют, используя способ стерилизации облучением, для создания множества стерилизованных, упакованных медицинских устройств на основе биосенсора. После этого тарируют стерилизованные и упакованные медицинские устройства на основе биосенсора. Тарирование можно осуществлять, используя, например, статистически выбранный образец из стерилизованных, упакованных медицинских устройств на основе биосенсора.
Способы согласно примерным вариантам осуществления настоящего изобретения обеспечивают изготовление недорогим образом стерильного медицинского устройства на основе биосенсора благодаря устранению расходов, связанных со сборкой в чистой и стерильной окружающей среде ранее стерилизованных частей медицинского устройства на основе биосенсора. Кроме того, в результате выполнения стадии стерилизации до стадии тарирования получают высокоточные медицинские устройства на основе биосенсора.
Краткое описание чертежей
Лучшее понимание отличительных признаков и преимуществ настоящего изобретения будет получено из нижеследующего подробного описания иллюстративных вариантов воплощения настоящего изобретения и из сопроводительных чертежей, на которых:
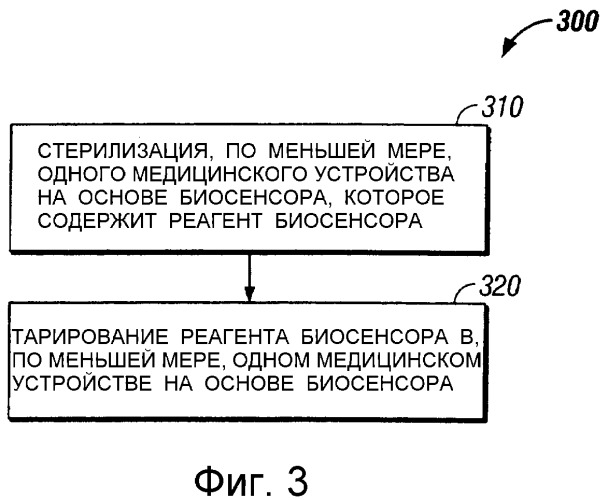
фиг.1 - перспективный вид медицинского устройства на основе биосенсора (т.е. электрохимического медицинского устройства на основе биосенсора), которое может быть использовано в определенных вариантах осуществления настоящего изобретения,
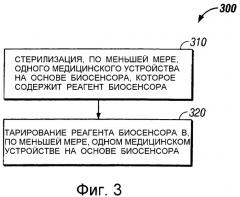
фиг.2 - перспективный вид другого медицинского устройства на основе биосенсора (т.е. колориметрически-фотометрического медицинского устройства на основе биосенсора), которое может быть использовано в определенных вариантах осуществления настоящего изобретения,
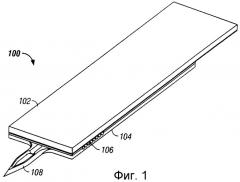
фиг.3 - технологическая схема, иллюстрирующая последовательность стадий при способе согласно одному примерному варианту осуществления настоящего изобретения,
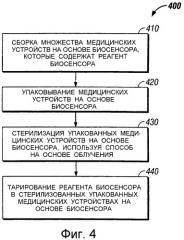
фиг.4 - технологическая схема, иллюстрирующая последовательность стадий при способе согласно другому примерному варианту осуществления настоящего изобретения.
Подробное описание изобретения
Способы согласно примерным вариантам осуществления настоящего изобретения могут быть применены для изготовления различных стерилизованных и точно тарированных медицинских устройств на основе биосенсора, включая, но не ограничиваясь ими, медицинские устройства из объединенных в одно целое биосенсора и ланцета, описанные в патентной заявке США №10/143399, которая приведена здесь для ссылки.
На фиг.1 и 2 соответственно показаны электрохимическое и медицинское устройство на основе биосенсора и колориметрически-фотометрическое медицинское устройство на основе биосенсора, которые могут быть изготовлены, например, способами согласно примерным вариантам осуществления настоящего изобретения.
На фиг.1 электрохимическое медицинское устройство 100 на основе биосенсора содержит верхний электрод 102 и нижний электрод 104. Верхний электрод 102 и нижний электрод 104 удерживаются вместе слоем клея (не показан). Слой клея выполнен с образованием реакционной зоны 106. Электрохимическое медицинское устройство 100 на основе биосенсора, кроме того, содержит пристроенную микроиглу 108 (также называемую ланцетом или пристроенным ланцетом).
Кроме того, электрохимическое медицинское устройство 100 на основе биосенсора содержит реагент биосенсора (например, окислительно-восстановительный реагент, не показан), присутствующий в реакционной зоне 106. Реагент биосенсора выбирают для взаимодействия с анализируемым компонентом (компонентами) (например, глюкозой) в пробе жидкости (например, в пробе цельной крови) во время анализа пробы жидкости. В электрохимическом медицинском устройстве 100 на основе биосенсора реагент биосенсора расположен на верхнем электроде 102 и находится в реакционной зоне 106.
В варианте выполнения на фиг.1 нижний электрод 104 выполнен с возможностью служить в качестве противоэлектрода сравнения, в то время как верхний электрод 102 выполнен с возможностью служить в качестве рабочего электрода электрохимической ячейки. Однако в других вариантах выполнения электрохимического медицинского устройства на основе биосенсора и в зависимости от порядка приложения напряжения к электрохимической ячейке роль верхнего и нижнего электродов может быть обратной, так что нижний электрод 104 будет служить в качестве рабочего электрода, в то время как верхний электрод 102 будет служить в качестве противоэлектрода сравнения.
В число подходящих реагентов биосенсора в электрохимическом медицинском устройстве 100 на основе биосенсора входят, например, фермент и окислительно-восстановительный активный компонент (например, медиатор). Дальнейшие подробности, касающиеся электрохимического медицинского устройства 100 на основе биосенсора, обсуждаются в патентной заявке США №10/143399.
На фиг.2 показано колориметрически-фотометрическое медицинское устройство 200 на основе биосенсора, которое содержит подложку 202, изготовленную из инертного материала, матрицу 204 для приема пробы, реагент биосенсора (не показан) внутри матрицы 204, которая обычно содержит один или большее число элементов системы для образования сигнала об окислении анализируемого вещества, и верхний слой 206 (например, прозрачный верхний слой), который покрывает, по меньшей мере, матрицу 204. В других вариантах выполнения колориметрически-фотометрического медицинского устройства на основе биосенсора верхним слоем 206 может быть, например, мембрана, пропитанная реагентом биосенсора, при этом взаимно исключаются матрица 204 и верхний слой 206. Колориметрически-фотометрическое медицинское устройство 200 на основе биосенсора, кроме того, содержит пристроенную микроиглу 208 (также называемую как ланцет или пристроенный ланцет).
На фиг.3 показана технологическая схема, иллюстрирующая последовательность стадий при способе 300 согласно настоящему изобретению для изготовления стерилизованного и тарированного медицинского устройства на основе биосенсора. Способ 300 включает в себя стадию стерилизации, по меньшей мере, одного медицинского устройства на основе биосенсора (например, медицинских устройств на фиг.1 и 2, которые содержат объединенные в одно целое ланцеты и биосенсоры, т.е. электрохимические и колориметрически-фотометрические биосенсоры) для создания, по меньшей мере, одного стерилизованного медицинского устройства на основе биосенсора, как это показано на стадии 310. Медицинское устройство (устройства) на основе биосенсора, стерилизованное на стадии 310, содержит реагент биосенсора.
Ознакомившись с данным описанием, специалист в этой области признает, что настоящее изобретение может быть применено во время изготовления различных медицинских устройств на основе биосенсора, включая, но не ограничиваясь ими, устройства с объединенными в одно целое биосенсором и ланцетом, описанные в патентной заявке США №10/143399, которая приведена здесь для ссылки.
Стерилизация гамма-излучением может считаться подходящей для полного разрушения вредной микробиологической флоры в устройствах с объединенными в одно целое биосенсором и ланцетом, в которых составные части для прокалывания ланцетом, передачи пробы и измерения концентрации глюкозы (биосенсор) объединены в одно устройство одноразового использования. В таких устройствах микроигла выполнена с возможностью проникновения в подкожный слой для доступа к пробе крови и передачи крови, например, к местоположению электрохимической ячейки устройства для определения концентрации глюкозы. Следовательно, микроигла должна использоваться в стерильном состоянии.
Способ 300 особенно полезен для изготовления медицинского устройства на основе биосенсора, которое содержит реагент биосенсора (например, реагент, который содержит специфический фермент для анализируемого вещества и соответствующий медиатор), чья аналитическая способность изменяется под воздействием облучения. Например, аналитическая способность реагента биосенсора, который содержит глюкозодегидрогеназу на основе ПХХ (специфический фермент для глюкозы) и феррицианид (медиатор), как определено, изменяется под воздействием гамма-излучения.
На стадии 310 стерилизации можно использовать любой подходящий способ стерилизации. Однако, как будет подробнее описано ниже, способы согласно примерным вариантам осуществления настоящего изобретения оказываются особенно полезными, когда применяется способ, основанный на облучении (например, способ с использованием гамма-излучения). На стадии 310 стерилизации может быть использовано, например, гамма-излучение от источника Co60 и доза облучения в 10-30 кГр.
Далее на стадии 320 тарируют реагент биосенсора, по меньшей мере, одного стерилизованного медицинского устройства на основе биосенсора. Для того чтобы избежать неточностей при анализе, являющихся результатом изменений в аналитической способности реагента биосенсора вследствие стадии 310 стерилизации (например, изменений в коэффициентах тарирования вследствие воздействия гамма-излучения на реагент биосенсора), стадию 320 тарирования выполняют после стадии 310 стерилизации.
Благодаря проведению стадии 320 тарирования после стадии 310 стерилизации компенсируются влияния стадии стерилизации на аналитическую способность медицинского устройства на основе биосенсора. Например, гамма-излучение, применяемое при способе стерилизации облучением, может иметь вызывающее изменение влияние на аналитическую способность реагентов биосенсоров, которые содержат специфический фермент для анализируемого вещества и медиатор. Однако благодаря проведению стадии тарирования после стерилизации такие влияния компенсируются во время тарирования с получением, таким образом, точно тарированного медицинского устройства на основе биосенсора. Этот тип компенсации особенно полезен для объединенных медицинских устройств на основе биосенсора, где биосенсор (например, биосенсор с электрохимической ячейкой или колориметрически-фотометрический биосенсор) и ланцет изготовлены как единое объединенное медицинское устройство на основе биосенсора.
На фиг.4 показана технологическая схема, иллюстрирующая последовательность стадий при способе 400 согласно настоящему изобретению для изготовления стерилизованного и тарированного медицинского устройства на основе биосенсора. Способ 400 включает в себя стадию сборки множества медицинских устройств на основе биосенсора, как это показано на стадии 410. Медицинскими устройствами на основе биосенсора, собираемыми на стадии 410, могут быть любые подходящие медицинские устройства на основе биосенсора, известные специалистам в данной области. Однако способ 400 особенно полезен для изготовления медицинских устройств на основе биосенсора с реагентом биосенсора и пристроенным ланцетом, включая и те, которые показаны на фиг.1 и 2.
Сборку медицинского устройства на основе биосенсора можно выполнять, используя любой подходящий способ сборки, известный специалистам в данной области, включая, но не ограничиваясь ими, и те, которые описаны в патентной заявке США №10/143399.
Затем на стадии 420 медицинские устройства на основе биосенсора, собранные на стадии 410, упаковывают для получения упакованных медицинских устройств на основе биосенсора. При таком упаковывании, например, используют упаковки в виде картриджей или отдельно обернутые устройства упаковывают в упаковку размером с карточку.
Упакованные медицинские устройства на основе биосенсора затем стерилизуют, используя способ стерилизации облучением, для получения множества стерилизованных, упакованных медицинских устройств на основе биосенсора, как это показано на стадии 430. В случае, если медицинские устройства на основе биосенсора содержат пристроенный ланцет, стадию 430 стерилизации выполняют для получения стерильного ланцета.
Затем тарируют реагент биосенсора стерилизованных, упакованных медицинских устройств на основе биосенсора, как это показано на стадии 440. На стадии тарирования используют только часть массы реагента биосенсора, использованной при сборке множества медицинских устройств на основе биосенсора. Например, эталонным методом можно тарировать образец (например, статистически выбранный образец) стерилизованных, упакованных медицинских устройств на основе биосенсора. Следовательно, можно экономичным образом получить информацию о тарировании (например, о коэффициентах тарирования) для остальных устройств, которые не были частью образца. Кроме того, на стадии 440 тарирования не обязательно требуется помещение с чистыми стерильными условиями, в результате чего не увеличиваются чрезмерно производственные расходы.
При способе 400 получают недорогим образом стерильное медицинское устройство на основе биосенсора благодаря устранению расходов, связанных со сборкой ранее стерилизованных составных частей медицинского устройства на основе биосенсора (например, ранее стерилизованных ланцета и электрохимической опытной ячейки или фотометрической опытной полоски) в чистом и стерильном помещении. Кроме того, благодаря выполнению стерилизации до тарирования получают высокоточное медицинское устройство на основе биосенсора.
Как при способе 300, так и при способе 400 стадия стерилизации предшествует стадии тарирования. Эта особая последовательность стадий (т.е. стадии стерилизации до стадии тарирования) дает возможность изготавливать стерилизованное и тарированное медицинское устройство на основе биосенсора, имеющее высокую точность и широкий диапазон применения, как это демонстрируют нижеизложенные примеры 1 и 2.
Пример 1: влияние гамма-излучения на ферментативную активность реагента биосенсора.
Полиэфирные пластины с напыленным палладием (Pd) (имеются на рынке от CP Films, Canoga Park, штат Калифорния, США) покрывали реагентом биосенсора, чувствительным к глюкозе и содержащим пирролохинолинхинон-глюкозодегидрогеназу (ПХХ-ГДГ), пирролохинолинхинон (ПХХ), феррицианид калия, буфер и другие компоненты, указанные в нижеприведенной Таблице 1. Состав реагента биосенсора, кроме того, описан в патентной заявке США №10/242951, которая приведена здесь для ссылки.
| Таблица 1 | ||
| Состав реагента биосенсора | ||
| Компонент | Вес (г) в 100 мл | % сухого вещества |
| Буфер (цитраконат 66,7 мМ): Цитраконовая кислота | 0,0273 | 0,0869 |
| Буфер (буфер рН 6,8): Двукалиевый цитраконат | 1,334 | 4,247 |
| Смачивающее вещество (0,066%): Плюроник Р103 | 0,067 | 0,213 |
| Моющее вещество (0,0332%):Плюроник F87 | 0,033 | 0,105 |
| Стабилизатор фермента (1,7 мМ): CaCl2 | 0,019 | 0,0605 |
| Стабилизатор (75 мМ): Сахароза | 2,5673 | 8,174 |
| Кофактор фермента (484 мкМ): ПХХ | 0,016 | 0,051 |
| Фермент (240 мкМ): ПХХ-ГДГ | 2,647 | 8,428 |
| Медиатор (750 мМ): Феррицианид калия | 24,697 | 78,635 |
| Всего сухого вещества: | 31,407 | 100,000 |
Высушенные пластины с палладиевым покрытием (размером 6 дюймов на 1,5 дюйма), покрытые реагентом биосенсора с составом согласно Таблице 1, упаковывали в мешочки KAPAK (Миннеаполис, штат Миннесота, США) (по 1 пластине в мешочек) вместе с силикагелевым осушителем и запечатывали под аргоном (Ar). Помещенные в мешочки образцы отправляли к месту стерилизации вместе с помещенным в мешочек контрольным образцом (т.е. с пластиной, упакованной в KAPAK, но не предназначавшейся для облучения). Для облучения (т.е. стерилизации с использованием способа на основе облучения) образцов использовали "Гаммаселл 220" (порядковый №254). Для этой цели в качестве источника гамма-излучения приняли Co60. Стерилизацию проводили в Johnson & Johnson Sterilization Sciences & Technology (г.Нью-Брансуик, штат Нью-Джерси, США).
После стерилизации с дозами гамма-излучения в 10, 20 и 30 кГр (без открывания мешочков) образцы возвращали и подвергали проверке на активность ПХХ-ГДГ, используя спектрофотометрический метод на основе ДХИФ и ФЭС (ДХИФ - 2,6-Дихлорофенолиндофенолнатриевая соль и ФЭС - феназинэтосульфат), описанный в патентной заявке США №10/242951.
Дозы в 10, 20 и 30 кГр были выбраны на основании мнения о том, что в промышленности по производству медицинских устройств обычно используют дозу гамма-излучения в 25 кГр. Поэтому предполагалось, что доза в 25 кГр была бы достаточной для получения подходящего стерильного медицинского устройства на основе биосенсора, однако, после стерилизации облучением не проводился никакой анализ концентрации микроорганизмов. После ознакомления с данным описанием специалист в этой области может без чрезмерного экспериментирования определить подходящие дозы облучения для использования при способах согласно настоящему изобретению.
Приготавливали образец из пластины с напыленным палладием, свежепокрытый реагентом биосенсора с составом согласно Таблице 1. В нижеприведенной Таблице 2 для каждого из вышеописанных образцов показано влияние дозы гамма-излучения на активность фермента ПХХ-ГДГ.
| Таблица 2 | ||||
| Влияние гамма-излучения на активность покрытых ферментом ПХХ-ГДГ образцов из пластин с напыленным палладием | ||||
| Тип образца | Время облучения, (мин) | Полученная ферментативная активность, (ед./мл) | Коэффициент изменения, % (n=6) | % изменения по сравнению с необлученным образцом |
| Свежий образец | - | 23,6 | 3,4 | - |
| Контрольный образец (необлученный, но отправленный к месту облучения и полученный из него) | - | 24,1 | 1,5 | - |
| 10 кГр | 48,9 | 21,0 | 1,7 | -12,9 |
| 20 кГр | 97,8 | 21,9 | 1,1 | -9,1 |
| 30 кГр | 146,7 | 20,6 | 2,0 | -14,5 |
Данные Таблицы 2 показывают уменьшение ферментативной активности реагента биосенсора после воздействия гамма-излучения по сравнению с образцами, которые не подвергались гамма-излучению. При желании такое уменьшение активности (потерю активности) можно компенсировать недорогим способом, нанося реагент с ферментативной активностью, которая соответственно больше на ожидаемую потерю активности вследствие стерилизации гамма-излучением. Например, в случае дозы гамма-излучения в 30 кГр для компенсации ожидаемой потери ферментативной активности в 14,5% можно было использовать реагент с ферментативной активностью, большей на 15%.
Пример 2: влияние тарирования медицинских устройств на основе биосенсора до и после стадии стерилизации.
Получали полностью собранные и готовые к использованию медицинские устройства на основе биосенсора для определения глюкозы, которые содержали реагент с составом согласно Таблице 1 и золотой и палладиевый электроды, расположенные напротив друг друга. До стерилизации гамма-излучением эти устройства тарировали посредством анализа проб крови, содержащих эквивалентные концентрации глюкозы в плазме 30, 270 и 620 мг/дл, измеренные методом эталонного прибора с использованием стандартного прибора YSI (имеется на рынке от Yellow Springs, штат Огайо, США). При испытаниях по тарированию использовали пробы крови с низким, нормальным и высоким уровнями гематокрита (т.е. с уровнями гематокрита соответственно 20%, 42% и 70%).
Стадия тарирования реагента биосенсора основывается на сборе данных о реакции многочисленных устройств на пробы крови с известной концентрацией глюкозы в плазме в пределах желаемого динамического диапазона (например, 20-600 мг/дл) и на корреляции этой реакции с эталонным способом посредством сведения к минимуму различий между двумя показаниями концентрации глюкозы. В идеальном случае смещение между значениями концентрации глюкозы в крови, определенными медицинским устройством на основе биосенсора и эталонным методом измерения концентрации глюкозы, должно быть равно нулю для всех проб крови. Однако в зависимости от концентрации глюкозы и гематокрита крови смещение может быть не равным нулю (например, вплоть до ±15%). Обычно после того, как тарирована партия медицинских устройств на основе биосенсора, получают следующее уравнение:
ГлюкозаYSI = (Глюкозасенсор)а+b,
где ГлюкозаYSI - концентрация глюкозы, определенная эталонным прибором,
Глюкозасенсор - концентрация глюкозы, определенная медицинским устройством на основе биосенсора,
а - коэффициент, который соотносит реакцию сенсора с концентрацией глюкозы, определенной эталонным методом,
b - коэффициент сдвига (отделения) (наблюдаемый, например, при анализе пробы крови, свободной от глюкозы); коэффициент b является либо положительным, либо отрицательным числом.
Вышеописанная стадия тарирования, когда она проводилась до стадии стерилизации, давала следующие значения коэффициентов: а=0,6921 и b=0,5854. Тарированные медицинские устройства на основе биосенсора упаковывали в мешочки KAPAK, содержащие силикагелевый осушитель, запечатывали и разделяли на четыре группы: 1) устройства, хранившиеся в упаковке в окружающей среде с контролируемыми температурой и влажностью (т.е. при 20-25°С и относительной влажности<10%), 2) отправлявшиеся контрольные образцы, 3) устройства, стерилизуемые при дозе облучения в 20 кГр, и 4) устройства, стерилизуемые при дозе облучения в 25 кГр.
Последние три групы медицинских устройств на основе биосенсора (т.е. группы 2-4) отправляли к тому же самому месту стерилизации, что и в Примере 1. После облучения проводили анализ крови на содержание глюкозы в соответствии с той же самой процедурой, как и на стадии тарирования, используя коэффициенты а и b, которые были получены на стадии тарирования, проводившейся до стадии стерилизации сенсоров. В Таблице 3 показана усредненная реакция медицинских устройств на основе биосенсора, испытывавшихся с кровью с гематокритом 20, 42 и 70% при трех концентрациях глюкозы (величины YSI), и смещение усредненной реакции в мг/дл для низкой концентрации глюкозы или в % для двух других концентраций глюкозы.
| Таблица 3 | |||
| Реакция сенсоров глюкозы, стерилизованных при гамма-излучении в 20 и 25 кГр, при использовании коэффициентов тарирования, полученных проведением тарирования до стерилизации (а=0,6921, b=0,5854); n=18 | |||
| Наименование | Концентрация глюкозы по YSI, (мг/дл) | Усредненные концентрации глюкозы, определенные сенсором, (мг/дл) | Смещение относительно значений по YSI, (мг/дл или %) |
| 20 кГр | 32,7 | 44,5 | 11,8 |
| 266,3 | 270,5 | 1,57 | |
| 606,0 | 565,8 | -6,64 | |
| 25 кГр | 32,7 | 45,1 | 12,4 |
| 266,3 | 268,3 | 0,73 | |
| 606,0 | 564,2 | -6,90 | |
| Отправлявшиеся контрольные образцы | 32,7 | 28,1 | -4,56 |
| 266,3 | 259,5 | -2,56 | |
| 606,0 | 571,0 | -5,77 | |
| Образцы, хранившиеся при контролируемой окружающей среде | 32,7 | 27,5 | -5,18 |
| 266,3 | 264,6 | -0,65 | |
| 606,0 | 571,1 | -5,76 |
Данные Таблицы 3 показывают, что в результате стерилизации с использованием гамма-излучения наблюдается значительное положительное смещение реакции при низкой концентрации глюкозы, делающее медицинское устройство на основе биосенсора сравнительно неточным при этом содержании глюкозы в тех случаях, когда определение гипогликемии является крайне необходимым для лечения больного. В среднем смещение по YSI для устройств, облученных при 20 и 25 кГр, составляло около 12 мг/дл при низкой концентрации глюкозы (30 мг/дл), в то время как смещение для отправлявшегося контрольного образца и образца, хранившегося в контролируемой окружающей среде, составляло лишь около -5 мг/дл.
Хотя и не проводился никакой дополнительный анализ, за исключением измерения фоновой реакции устройства, предположение, основанное на изменении ферментативной активности, сообщенном в Таблице 1, заключается в том, что главным источником увеличения в смещении реакции является образование ферроцианида калия из окисленной формы медиатора.
Далее, процедуру тарирования проводили после процесса облучения гамма-лучами, чтобы показать, что получается медицинское устройство на основе биосенсора, имеющее улучшенную точность. Такая последовательность стадий объясняет изменения аналитической способности, проистекающие из взаимодействия гамма-лучей с реагентом биосенсора, что, таким образом, предоставляет реагент биосенсора с точной реакцией на всем динамическом диапазоне системы. В нижеприведенной Таблице 4 содержатся данные о реакции медицинских устройств на основе биосенсора, которые были тарированы после стадии облучения гамма-лучами.
| Таблица 4 | |||
| Реакция сенсоров глюкозы, облученных при 20 и 25 кГр, при использовании коэффициентов тарирования, полученных после стерилизации облучением а=0,7885, b=1,088 для дозы в 20 кГр; а=0,7974, b=1,1242 для дозы в 25 кГр; n=18 | |||
| Наименование | Концентрация глюкозы по YSI (мг/дл) | Усредненные концентрации глюкозы, определенные сенсором, (мг/дл) | Смещение относительно значений по YSI, (мг/дл или %) |
| 20 кГр | 32,7 | 32,9 | 0,18 |
| 266,3 | 275,8 | 3,56 | |
| 606,0 | 601,0 | -0,82 | |
| 25 кГр | 32,7 | 32,9 | 0,27 |
| 266,3 | 274,4 | 3,02 | |
| 606,0 | 603,4 | -0,43 |
Результаты в Таблице 4 показали значительное улучшение в смещении относительно значений по YSI по сравнению с данными в Таблице 3, особенно для самой низкой концентрации глюкозы. Таким образом, если стадия тарирования реагента проводится после стерилизации облучением, смещение в реакции относительно значений, определенных по эталонному методу, сводится к минимуму, потому что параметры тарирования, определенные во время тарирования, отражают (компенсируют) любые изменения в химической природе реагента биосенсора.
Согласно необязывающему предположению гамма-лучи вызывают образование ферроцианида [Fe(CN)6]-4 из медиатора [Fe(CN)6]-3 в составе реагента биосенсора. Когда пробу крови анализируют на медицинском устройстве на основе биосенсора, увеличение в концентрации восстановленного медиатора интерпретируется устройством как дополнительная глюкоза. Другими словами, облучение гамма-лучами медицинского устройства на основе биосенсора, как предполагается, влияет на активность фермента и/или целостность медиатора с образованием в большом количестве продукта, который ошибочно обнаруживается устройством как анализируемое вещество, что, таким образом, искажает точность устройства. Однако, если медицинские устройства на основе биосенсора во время их изготовления облучают вначале и тарируют после стадии стерилизации, то влияние облучения компенсируют для получения высокоточного медицинского устройства на основе биосенсора.
Так как основное смещение реакции наблюдается в прерываемой части тарирования после облучения гамма-лучами, то реагент биосенсора можно тарировать на последней стадии изготовления, тем самым исключая дорогостоящие операции сборки в чистом помещении. Короче говоря, когда стадию стерилизации осуществляют до стадии тарирования, то отсутствует смещение, наблюдаемое при способе с обратной последовательностью.
Необходимо учесть, что при практическом применении изобретения могут быть внесены различные изменения в описанные здесь варианты осуществления изобретения. Как предполагается, нижеследующая формула изобретения определяет пределы изобретения, которые охватывают способы и их эквиваленты.
1. Способ изготовления стерилизованного и тарированного медицинского устройства на основе биосенсора, заключающийся в том, что стерилизуют, по меньшей мере, одно медицинское устройство на основе биосенсора, которое содержит реагент биосенсора для создания, по меньшей мере, одного стерилизованного медицинского устройства на основе биосенсора, и после этого тарируют реагент биосенсора, по меньшей мере, одного стерилизованного медицинского устройства на основе биосенсора.
2. Способ по п.1, в котором на стадии стерилизации используют способ стерилизации облучением.
3. Способ по п.2, в котором на стадии стерилизации используют способ стерилизации гамма-излучением.
4. Способ по п.3, в котором на стадии стерилизации используют дозу гамма-излучения в пределах от 10 до 30 кГр.
5. Способ по п.1, в котором стадия стерилизации включает в себя стерилизацию медицинского устройства на основе биосенсора с реагентом биосенсора, который содержит специфический фермент для анализируемого вещества и медиатор.
6. Способ по п.5, в котором специфический фермент для анализируемого вещества содержит пирролохинолинхинон (ПХХ), а медиатор содержит феррицианид.
7. Способ по п.1, в котором стадия стерилизации включает в себя стерилизацию медицинского устройства на основе биосенсора, содержащегореагент биосенсора, который включает в себяспецифический фермент для анализируемого вещества и медиатор, ипристроенный ланцет.
8. Способ по п.7, в котором специфический фермент для анализируемого вещества содержит ПХХ, а медиатор содержит феррицианид.
9. Способ по п.1, дополнительно содержащий до стадии стерилизации стадию упаковывания, по меньшей мере, одного медицинского устройства на основе биосенсора.
10. Способ по п.1, в котором медицинское устройство на основе биосенсора содержит реагент, чья аналитическая способность значительно изменяется под воздействием облучения.
11. Способ по п.1, в котором на стадии стерилизации стерилизуют множество медицинских устройств на основе биосенсора для создания множества стерилизованных медицинских устройств на основе биосенсора и используют образец из множества стерилизованных медицинских устройств на основе биосенсора.
12. Способ изготовления стерилизованного и тарированного медицинского устройства на основе биосенсора, заключающийся в том, что выполняют сборку множества медицинских устройств на основе биосенсора, которые содержат реагент биосенсора, упаковывают медицинские устройства на основе биосенсора, тем самым создавая упакованные медицинские устройства на основе биосенсора, стерилизуют упакованные медицинские устройства на основе биосенсора с использованием способа стерилизации облучением, тем самым создавая множество стерилизованных, упакованных медицинских устройств на основе биосенсора, и после этого тарируют реагент биосенсора стерилизованных, упакованных медицинских устройств на основе биосенсора.
13. Способ по п.12, в котором на стадии стерилизации используют дозу гамма-излучения в пределах от 10 до 30 кГр.
14. Способ по п.12, в котором стадия стерилизации включает в себя стерилизацию медицинского устройства на основе б