Терапевтическое средство при повреждении спинного мозга, включающее антагонист интерлейкина-6
Иллюстрации
Показать всеИзобретение относится к медицине и касается терапевтического средства, применяемого при повреждении спинного мозга, включающего антагонист интерлейкина-6. Терапевтическое средство при повреждении спинного мозга включает в качестве активного ингредиента антитело к рецептору IL-6. Преимущество изобретения заключается в создании композиции, пригодной для лечения повреждений спинного мозга. 3 н. и 24 з.п. ф-лы, 5 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение имеет отношение к терапевтическому средству, применяемому при повреждении спинного мозга, включающему в качестве активного ингредиента антагонист интерлейкина-6 (IL-6).
Уровень техники
В современном обществе человек может страдать повреждением спинного мозга, возникающим в результате автомобильных аварий, падений, спортивных травм и т.п. В Японии ежегодное число пострадавших составляет около 5000, а общее число пострадавших к настоящему времени составляет около 100000. Симптомы повреждения спинного мозга очень тяжелые и включают постоянную тетраплегию (паралич четырех конечностей), двигательный и сенсорный паралич, поражения мочевого пузыря и прямой кишки, нарушения дыхания и т.д. Повседневное решение этих проблем включает реабилитацию, контроль за дыханием, предупреждение появлений пролежней, помощь и уход при дефекации и мочеиспускании и т.п.
В настоящее время эффективные методы лечения повреждений спинного мозга отсутствуют, и существуют лишь симптоматические способы, включающие местную стабилизацию, например хирургию. Чтобы предотвратить обострение патологических состояний, пациентам вводили в больших количествах стероиды, но результатов, указывающих на выздоровление от паралича, получено не было. Многие повреждения спинного мозга начинаются с повреждения (первичное повреждение), вызванного внешним механическим воздействием, и затем прогрессируют, приводя к разрушению тканей (вторичное повреждение) через метаболические пути живого организма. Единственным лекарственным средством, применяемым для замедления прогрессирования вторичных повреждений, является метилпреднизолон, который вводили в больших количествах, таких как 10000 мг. Было показано, однако, что этот способ сопровождается побочными эффектами, такими как обострение сахарного диабета и пневмонии.
В конце XIX в. нейроанатом Рамон-и-Кахаль (Ramon у Cajal) в своей книге утверждал: «центральная нервная система (головной и спинной мозг) млекопитающих не способна к регенерации после того, как была повреждена», и с тех пор это утверждение не подвергалось сомнению. В 1980-х годах, однако, было сообщено об имплантации периферических нервов в поврежденный спинной мозг (A.Aquayo et al., J. Exp. Biol. 95:231-240, 1981) и об имплантации эмбрионального спинного мозга (Bregman B.S., Dev. Brain Res., 34:265-279, 1987), что указывало на то, что даже после повреждения спинного мозга можно наблюдать регенерацию поврежденных аксонов, если в поврежденном месте создать соответствующую среду. Также было представлено множество данных об аксональной регенерации, например о стимулировании регенерации поврежденных аксонов нейротрофическими факторами (Cat D. et al., Neuron, 22:89-101, 1999), об идентификации факторов, ингибирующих рост аксонов (Chen D. et al., Nature 403:434-439, 2000), и похожие сведения, предполагающие, что регенерация поврежденного спинного мозга может стать реальностью. Однако клиническое применение имплантации эмбрионального спинного мозга затруднительно из-за недостатка доноров и из-за этических проблем.
Кроме того, нервные стволовые клетки являются недифференцированными (плюрипотентными) клетками нервной системы, которые могут размножаются и многократно пассируются (способность к самовоспроизведению) и одновременно приводят к образованию трех типов клеток (нейроны, астроциты, олигодендроциты), которые составляют центральную нервную систему и, так как они также обнаруживаются в спинном мозге взрослых людей, предполагают, что они способны к репарации поврежденных тканей. Однако в действительности, после повреждения они не дифференцируются в нейроны и целиком превращаются в глиальные клетки, формируя, таким образом, рубцы.
Встречаются отдельные сообщения о том, что в индукцию дифференцировки нервных стволовых клеток вовлечены цитокины. Weiss et al., сообщили о том, что дифференцировка нервных стволовых клеток, происходящих из стриатума (полосатое тело, «центр удовольствия» головного мозга) эмбрионов мыши, в нейроны ускоряется нейротрофическим фактором мозга (BDNF, brain-derived neurotrophic factor) (Ahmed, S. et al., J. Neurosci. 150:5765-5778, 1995). Grosh et al., сообщили также, что дифференцировка нервных стволовых клеток, происходящих из мозговой оболочки эмбрионов крысы, в нейроны активируется нейротрофином-3 (NT-3) (Grosh, A. et al., Neuron 15:89-103, 1995). McKay et al., сообщили, что дифференцировка нервных стволовых клеток, происходящих из гиппокампа эмбрионов крысы, в нейроны «инструктивно» индуцируется нейротрофическим фактором тромбоцитов (PDNF), в астроциты - цилиарным (глиальным) нейротрофическим фактором (CNTF), а в олигодендроциты - тиреоидным гормоном (Т3) (Jone, К. et al., Gene & Dev. 10:3129-3140).
Кроме того, недавно Taga et al., сообщили, что дифференцировка нервных стволовых клеток, происходящих из нервных эпителиальных клеток эмбрионов мыши, в астроциты стимулируется фактором, ингибирующим лейкемию (LIF, leukaemia inhibitory factor), и морфогенным протеином-2 из костной ткани (BMP-2) (Nakashima et al., Science 284:479-482, 1999). Общим для этих сообщений является так называемое суперсемейство IL-6, например, CNTF и LIF. Таким образом, полагают, что сигнал через gp130, который является субъединицей цитокинового рецептора, индуцирует дифференцировку нервных стволовых клеток в астроциты.
Однако литературные данные, демонстрирующие, что повреждение спинного мозга может быть восстановлено с помощью индукции цитокинами дифференцировки нервных стволовых клеток, отсутствуют.
Интерлейкин-6 (IL-6) представляет собой цитокин, который также называют фактором 2, стимулирующим В-клетки (BSF2) или интерфероном β2. IL-6 был открыт как фактор дифференцировки, вовлеченный в активацию В-лимфатических клеток (Hirano, Т. et al., Nature 324:73-76, 1986). Впоследствии было обнаружено, что он является полифункциональным цитокином, который влияет на многие функции клеток (Akira, S. et al., Adv. in Immunology 54:1-78, 1993). Было показано, что IL-6 индуцирует созревание Т-лимфатических клеток (Lotz, M. et al., J. Exp.Med. 167:1253-1258, 1988).
IL-6 сообщает клетке свою биологическую активность через два типа белков. Один из них является рецептором IL-6, белком, связывающем лиганды, с молекулярной массой около 80 кДа, к которому присоединяется IL-6 (Taga, Т. et al., J. Exp.Med. 166:967-981, 1987; Yamasaki, К. et al., Science 241:825-828, 1987). Рецептор IL-6 обнаружен не только в мембрано-связанной форме, которая проникает и экспрессируется в клеточной мембране, но также и в форме растворимого IL-6 рецептора, обнаруживаемого в большинстве экстраклеточных областей.
Другой белок представляет собой мембрано-связанный белок gp130, имеющий молекулярную массу около 130 кДа, который вовлечен в передачу сигнала без связывания лигандов. IL-6 и рецептор IL-6 образуют комплекс IL-6/рецептор IL-6, который после связывания с gp130 передает клетке биологически активный сигнал от IL-6 (Taga, Т. et al., Cell 58:573-581,1989).
Антагонист IL-6 представляет собой вещество, которое ингибирует передачу биологически активного сигнала IL-6. В настоящее время известны антитела к IL-6 (анти-IL-6 антитело), антитела к рецептору IL-6 (aHTH-IL-6-рецепторное антитело), антитела к gp130 (анти-gp130 антитело), модифицированный IL-6, неполные пептиды IL-6 или рецептора IL-6 и т.п.
Антитела к рецептору IL-6 описаны в нескольких работах (Novick, D. et al., Hybridoma 10:137-146, 1991; Huang, Y.W. et al., Hybridoma 12:621-630, 1993; International Patent Publication WO 95-09873, French Patent Application FR 2694767, United States Patent US 521628). Гуманизированное (химерное антитело, в котором большую часть составляет белок человека, «очеловеченное») РМ-1 антитело было получено путем пересадки участка, определяющего комплементарность (CDR, complementarity determining region), одного из антител, типа мышиного РМ-1 антитела (Hirata, Y. et al., Immunology 143:2900-2906, 1989), в антитело человека (International Patent Publication WO 92-19759).
Patent document 1: WO 95-09873
Patent document 2: FR 2694767
Patent document 3: USP 0521628
Non-patent document 1: A. Aguayo et al., J. Exp. Biol. 95:231-240, 1981
Non-patent document 2: Bregman B.S., Dev. Brain Res. 34:265-279, 1987
Non-patent document 3: Cai D. et al., Neuron 22:89-101, 1999
Non-patent document 4: Chen D. et al., Nature 403:434-439, 2000
Non-patent document 5: Ahmed S. et al., J. Neurosci. 150:5765-5778, 1995
Non-patent document 6: Grosh A. et al., Neuron 15:89-103, 1995
Non-patent document 7: Jone K. et al., Gene & Dev. 10:3129-3140, 1996
Non-patent document 8: Nakashima K. et al., Science 284:479-482, 1999
Non-patent document 9: Hirano T. et al., Nature 324:73-76, 1986
Non-patent document 10: Akira S. et al., Adv. Immunology 54:1-78, 1993
Non-patent document 11: Lotz M. et al., J. Exp.Med. 167:1253-1258, 1988
Non-patent document 12: Taga T. et al., Cell 58:573-581, 1989
Non-patent document 13: Yamasaki K. et al., Science 241:825-828, 1987
Non-patent document 14: Novick D. et al., Hybridoma 10:137-146, 1991
Non-patent document 15: Huang Y.W. et al., Hybridoma 12:621-630, 1993
Non-patent document 16: Hirata Y. et al., J. Immunol. 143:2900-2906, 1989
Раскрытие изобретения
Таким образом, существует необходимость в терапевтическом средстве, которое не только предупреждает обострение симптомов повреждения спинного мозга, но также помогает выздоровлению, и настоящее изобретение предоставляет фармацевтическую композицию, пригодную для этих целей.
После тщательного и исчерпывающего изучения, направленного на решение проблемы, указанной выше, авторы настоящего изобретения обнаружили, что антагонист IL-6, например антитела к рецептору IL-6, способствуют восстановлению при повреждении спинного мозга. Таким образом, настоящее изобретение обеспечивает терапевтическое средство для лечения повреждений спинного мозга, включающее в качестве активного ингредиента антагонист интерлейкина-6 (IL-6).
Настоящее изобретение также предоставляет модулятор дифференцировки нервных стволовых клеток, включающий в качестве активного ингредиента антагонист интерлейкина-6 (IL-6).
Настоящее изобретение также предоставляет ингибитор дифференцировки в глиальные клетки, включающий в качестве активного ингредиента антагонист интерлейкина-6 (IL-6).
Указанный антагонист IL-6 предпочтительно является антителом к рецептору IL-6, и, наиболее предпочтительно, моноклональным антителом. В качестве такого моноклонального антитела можно отметить, например, моноклональное антитело к человеческому рецептору IL-6 и моноклональное антитело к мышиному рецептору IL-6. В качестве отдельного примера указанного выше моноклонального антитела к человеческому рецептору IL-6 можно упомянуть, например, антитело РМ-1, а в качестве отдельного примера указанного выше моноклонального антитела к мышиному рецептору IL-6, можно упомянуть например, антитело MR16-1. Кроме того, в качестве примера антител к рецептору IL-6 можно упомянуть рекомбинантное антитело, например химерное антитело, гуманизированное антитело и другие, которые можно получить с помощью искусственно сконструированного гена, клонированного из гибридомы, продуцирующей антитело.
Краткое описание чертежей
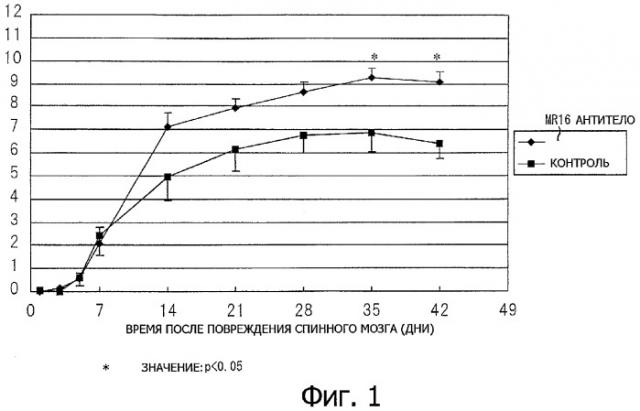
Фиг.1. График, демонстрирующий оценку восстановления двигательной функции нижних конечностей после повреждения спинного мозга у мышей с поврежденным спинным мозгом, которые получали антитела к рецептору IL-6 (MR16-1), по сравнению с мышами с поврежденным спинным мозгом (контроль), которые не получали указанных антител.
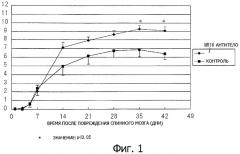
Фиг.2. График, показывающий тестирование на вращающемся стержне ротарод восстановление двигательной координации после повреждения спинного мозга у мышей с поврежденным спинным мозгом, которые получали антитела к рецептору
IL-6 (MR 16-1), по сравнению с мышами с поврежденным спинным мозгом (контроль), которые указанные антитела не получали.
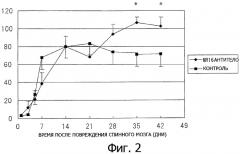
Фиг.3. График, показывающий, что формирование глии в поврежденной области спинного мозга, ингибировалось у мышей с поврежденным спинным мозгом, которые получали антитела к рецептору IL-6 (MR16-1), по сравнению с мышами с поврежденным спинным мозгом (контроль), которые указанные антитела не получали.
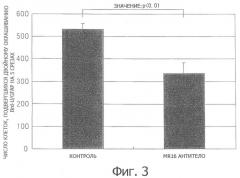
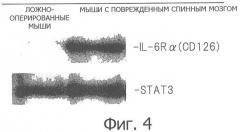
Фиг.4. Рисунок (вестерн-блот), показывающий, что рецептор IL-6 экспрессировался в поврежденной области спинного мозга у мышей с поврежденным спинным мозгом по сравнению с ложнооперированными мышами (SHAM), у которых повреждение спинного мозга отсутствовало.
Фиг.5. Вестерн-блот фосфорилированного STAT3, показывающий, что введение антител к рецептору IL-6 (MR16-1) действительно ингибирует сигнальный каскад IL-6 в поврежденной области спинного мозга.
Осуществление изобретения
Антагонисты IL-6, применяемые в настоящем изобретении, могут быть любого происхождения, любого вида и любой формы до тех пор, пока они демонстрируют терапевтический эффект на повреждение спинного мозга.
Антагонисты IL-6 блокируют передачу сигнала от IL-6 и ингибируют биологическую активность IL-6. Антагонисты IL-6 предпочтительно являются веществами, обладающими активностью, ингибирующей связывание друг с другом любого компонента сигнальной цепи - IL-6, рецептора IL-6 или gp130. В качестве антагонистов IL-6 могут быть упомянуты, например, антитела к IL-6, антитела к рецептору IL-6, антитела к gp130, измененный IL-6, измененный растворимый рецептор IL-6, неполные пептиды IL-6 или рецептора IL-6 и вещество с низкой молекулярной массой, обладающее такой же активностью, как и они.
Антитела к IL-6 для применения в настоящем изобретении можно получить в виде поликлональных или моноклональных антител с помощью известного метода. В качестве антител к IL-6 в настоящем изобретении предпочтительно применяются моноклональные антитела, в особенности, антитела млекопитающих. Моноклональные антитела млекопитающих включают антитела, продуцируемые гибридомой, и рекомбинатные антитела, продуцируемые «хозяином», который был трансформирован с помощью экспрессионного вектора, содержащего генетически сконструированные гены антител. Эти антитела, связываясь с IL-6, блокируют связывание IL-6 с рецептором IL-6 и, таким образом, блокируют передачу биологически активного сигнала от IL-6 в клетку.
Примеры таких антител включают антитело МН166 (Matsuda Т. et al., Eur. J. Immunol. 18:951-956, 1988) и антитело SK2 [Sato, К. et al., The 21st Nihon Menekigakkai Soukai (General Meeting of the Japan Immunology Society), Academic Record 21:166, 1991] и т.п.
Гибридому, продуцирующую антитела к IL-6, можно сконструировать, используя известную процедуру, описанную ниже. Таким образом, в качестве сенсибилизирующего антигена можно применять IL-6 и им иммунизируют с помощью традиционного метода иммунизации. Полученные таким образом иммунные клетки сливают с известными родительскими клетками в обычном процессе клеточного слияния, и затем, для получения желаемой гибридомы, клетки, продуцирующие моноклональные антитела, отбирают с помощью традиционных методов скрининга.
В частности, антитела к IL-6 можно получить следующим способом. Например, человеческий IL-6, применяемый в качестве сенсибилизирующего антигена для получения антител, можно получить, используя ген/аминокислотную последовательность IL-6, подробно описанную в Eur. J. Biochem. 168:543-550, 1987, J. Immunol. 140:1534-1541, 1988 или Agr. Biol. 54:2685-2688, 1990.
После этого подходящую клетку-хозяина трансформируют с помощью вставки генной последовательности IL-6 в известную систему экспрессионного вектора, интересующий белок IL-6 очищают из хозяйских клеток или их культурального супернатанта, и очищенный белок IL-6 может быть использован в качестве сенсибилизирующего антигена. Альтернативно, в качестве сенсибилизирующего антигена можно использовать слитый белок, образованный комбинацией белка IL-6 и другого белка.
Антитела к рецептору IL-6 для применения в настоящем изобретении могут быть получены в виде поликлональных или моноклональных антител с использованием известного метода. В качестве антител к рецептору IL-6 для применения в настоящем изобретении предпочтение имеют моноклональные антитела, в особенности антитела млекопитающих. Моноклональные антитела млекопитающих включают антитела, продуцируемые гибридомой, и антитела, продуцируемые хозяином, который был трансформирован с помощью экспрессионного вектора, включающего генетически сконструированные гены антитела. Эти антитела, связываясь с рецептором IL-6, блокируют связывание IL-6 с рецептором IL-6 и, таким образом, блокируют передачу биологически активного сигнала от IL-6 в клетку.
Примеры таких антител включают антитело MR16-1 (Tamura, Т. et al., Proc. Natl. Acad. Sci. USA 90:11924-11928, 1993), антитело PM-1 (Hirata, Y. et al., J. Immunol. 143:2900-2906, 1989), или антитело AUK12-20, антитело AUK64-7 или антитело AUK146-15 (International Patent Publication WO 92-19759) и т.п. Среди них наиболее предпочтительным является антитело PM-1.
В этой связи клеточная линия PM-1 гибридомы, которая продуцирует PM-1 антитело, была депонирована для международного признания 12 июля 1989 г. по условиям Будапештского договора как FERM ВР-2998 Депозитарием для патентуемых микроорганизмов Национального института индустриальной науки и технологии (Patent Microorganism Depository of National Institute of Industrial Science and Technology, of Chuo 6, 1-1, Higashi 1-chome, Tsukuba city, Ibaraki pref., Japan). Клеточная линия крысино-мышиной гибридомы MR16-1, которая продуцирует антитела MR16-1, была депонирована для международного признания 13 марта 1997 г. по условиям Будапештского договора как PERM BP-5875 Депозитарием для патентуемых микроорганизмов Национального института индустриальной науки и технологии (Patent Microorganism Depository of National Institute of Industrial Science and Technology, of Chuo 6, 1-1, Higashi 1-chome, Tsukuba city, Ibaraki pref., Japan).
Гибридомы, продуцирующие моноклональные антитела к рецептору IL-6, могут быть получены в основном с помощью известной процедуры, описанной ниже. Таким образом, в качестве сенсибилизирующего антигена применяется рецептор IL-6, и им иммунизируют с помощью обычного метода иммунизации. Полученные таким образом иммунные клетки сливают с известными родительскими клетками в обычном процессе клеточного слияния, и затем, для получения желаемой гибридомы, клетки, продуцирующие моноклональные антитела, отбирают с помощью традиционного метода скрининга.
В частности, антитела к рецептору IL-6 можно получить следующим способом. Например, человеческий рецептор IL-6, применяемый в качестве сенсибилизирующего антигена для получения антител, можно получить, используя ген/аминокислотную последовательность рецептора IL-6, подробно описанную в European Patent Application EP 325474, и мышиный рецептор IL-6 можно получить, используя последовательность гена и аминокислотную последовательность рецептора IL-6, подробно описанную в Japanese Unexamined Patent Publication (Kokai) 3-155795.
Существуют два типа белков рецептора IL-6: рецептор IL-6, экспрессированный на клеточной мембране и рецептор IL-6, отделенный от клеточной мембраны (растворимый рецептор IL-6) (Yasukawa К. et al., J. Biochem. 108:673-676, 1990). Растворимый рецептор IL-6 формируется в значительной степени из экстраклеточного участка рецептора IL-6, связанного с клеточной мембраной, и, таким образом, отличается от мембрано-связанной формы рецептора IL-6 тем, что растворимый рецептор не содержит трансмембранный участок или трансмембранный участок вместе с внутриклеточным участком. В качестве белка рецептора IL-6 можно использовать любой рецептор IL-6 до тех пор, пока его можно применять в качестве сенсибилизирующего антигена для использования в настоящем изобретении.
После того, как последовательность гена рецептора IL-6 включают в известную экспрессионную векторную систему для трансформации клетки подходящего хозяина, желаемый белок рецептора IL-6 может быть очищен из хозяйских клеток или из культурального супернатанта с помощью известного метода, и очищенный белок рецептора IL-6 может быть использован в качестве сенсибилизирующего антигена. Альтернативно, в качестве сенсибилизирующего антигена можно использовать клетки, экспрессирующие рецептор IL-6, или слитый белок, образованный комбинацией белка рецептора IL-6 и другого белка.
Escherichia coli (E.coli) HB101-pIBIBSF2R, которая содержит плазмиду pIBIBSF2R, включающую кДНК, которая кодирует рецептор IL-6 человека, была депонирована для международного признания 9 января 1989 г. по условиям Будапештского договора как FERM ВР-2232 Депозитарием для патентуемых микроорганизмов Национального института индустриальной науки и технологии (Patent Microorganism Depository of National Institute of Industrial Science and Technology, of Chuo 6, 1-1, Higashi 1-chome, Tsukuba city, Ibaraki pref., Japan).
Антитела к gp130, применяемые в настоящем изобретении, могут быть получены в виде поликлональных или моноклональных антител с использованием известного метода. В качестве антител к gp130 для применения в настоящем изобретении предпочтительно используются моноклональные антитела, в особенности антитела млекопитающих. Моноклональные антитела млекопитающих включают антитела, продуцируемые гибридомой, и антитела, продуцируемые хозяином, который был трансформирован с помощью экспрессионного вектора, включающего генетически сконструированные гены антитела. Эти антитела, связываясь с gp130, блокируют связывание комплекса IL-6/рецептор IL-б с gp130, и, таким образом, блокируют передачу биологически активного сигнала от IL-6 в клетку.
Примеры таких антител включают антитело АМ64 (Japanese Unexamined Patent Publication (Kokai) 3-219894), антитело 4В11 и антитело 2Н4 (US 5571513), антитело
B-S12 и антитело В-Р8 (Japanese Unexamined Patent Publication (Kokai) 8-291199) и т.п.
Гибридома, продуцирующая моноклональные антитела к gp130, может быть получена в основном с помощью известной процедуры, описанной ниже. Таким образом, gp130 применяется в качестве сенсибилизирующего антигена и им иммунизируют с помощью обычного метода иммунизации. Полученные таким образом иммунные клетки сливают с известными родительскими клетками в обычном процессе клеточного слияния, и затем, для получения желаемой гибридомы, клетки, продуцирующие моноклональные антитела, отбирают с помощью традиционного метода скрининга.
В частности, моноклональные антитела можно получить следующим способом. Например, gp130, применяемый в качестве сенсибилизирующего антигена для получения антител, можно получить, используя ген/аминокислотную последовательность gp130, подробно описанную в European Patent Application EP 411946.
После того, как клетку подходящего хозяина трансформируют путем включения последовательности гена gp130 в известную экспрессионную векторную систему, интересующий белок gp130 очищают из хозяйских клеток или из культурального супернатанта с помощью известного метода. Очищенный белок gp130 может быть использован в качестве сенсибилизирующего антигена. Альтернативно в качестве сенсибилизирующего антигена можно использовать клетки, экспрессирующие gp130, или слитый белок, образованный комбинацией gp130 и другого белка.
Хотя выбор млекопитающих, применяемых для иммунизации, специально не ограничен, их предпочтительно выбирают из соображений их совместимости с родительскими клетками, используемыми для клеточного слияния. Обычно они включают грызунов, таких как мыши, крысы, хомяки и т.п.
Иммунизацию животных сенсибилизирующим антигеном проводят, используя известный способ. Основной способ, например, включает внутрибрюшинную или подкожную инъекцию млекопитающим сенсибилизирующего антигена. В частности, сенсибилизирующий антиген, который был разведен и суспендирован в подходящем количестве фосфатно-солевого буфера (PBS) или физиологического раствора и т.д., смешивают, по желанию, с подходящим количеством обычного адъюванта, например полного адъюванта Фрейнда. После эмульгирования он вводится млекопитающему предпочтительно в несколько приемов каждые 4-21 дня. Альтернативно, во время иммунизации сенсибилизирующим антигеном может быть использован подходящий носитель.
Клетки миеломы млекопитающих как другой тип родительских клеток, которые сливают с упомянутыми выше иммунными клетками, предпочтительно включают различные известные клеточные линии, такие как P3X63Ag8.653 (Keamey J. F. et al., J. Immunol. 123:1548-1550, 1979), P3X63Ag8U.1 (Current Topics in Microbiology and Immunology 81:1-7, 1978), NS-1 (Kohler G. and Milstein C., Eur. J. Immunol. 6:511-519, 1976), MPC-11 (Margulies D.H. et al., Cell 8:405-415, 1976), SP2/0 (Shulman, M. et al., Nature 276:269-270, 1978), FO (de St. Groth S. F. et al., J. Immunol. Methods 35:1-21, 1980), S194 (Trowbridge I.S., J. Exp. Med. 148:313-323, 1978), R210 (Galfre G. et al., Nature 277:131-133, 1979) и т.п.
Слияние клеток между указанными выше иммунными клетками и клетками миеломы по существу может быть проведено в соответствии с известным способом, таким как способ, описанный в работе Milstein et al. (Kohler G. and Milstein C., Methods Enzymol. 73:3-46, 1981) и т.п.
Более конкретно указанное слияние клеток проводят в подходящем питательном бульоне в присутствии, например, катализатора клеточного слияния. В качестве катализатора клеточного слияния, например, можно использовать полиэтиленгликоль (PEG), вирус Сендай (HVJ) и нечто подобное, и, кроме того, чтобы усилить эффективность слияния, по желанию, можно добавлять адъювант, такой как диметилсульфоксид и т.д.
Предпочтительное соотношение используемых иммунных клеток и клеток миеломы составляет, например, от 1- до 10-кратного избытка иммунных клеток по сравнению с клетками миеломы. Примеры культуральных сред, применяемых для клеточного слияния, включают среду RPMI1640 и культуральную среду MEM, подходящую для роста клеточных линий миеломы, а также обычную культуральную среду, используемую для такого типа клеточной культуры, и, помимо этого, можно вводить сывороточные добавки, такие как фетальная сыворотка теленка (FCS).
При слиянии клеток в указанных выше культуральных жидкостях, к которым добавляют предварительно прогретый до 37°С раствор PEG, например раствор PEG с молекулярной массой от 1000 до 6000 в концентрации от 30 до 60% (вес/объем), тщательно смешивают предварительно определенное количество иммунных клеток и клеток миеломы и перемешивают для образования желаемых слитых клеток (гибридома). Затем с помощью процедуры повторного последовательного добавления подходящей культуральной среды и центрифугирования можно удалить супернатант, агенты клеточного слияния и т.д., присутствие которых нежелательно для роста гибридомы.
Гибридома может быть отобрана с помощью культивирования в обычной селекционной среде, например в культуральной среде HAT (культуральная жидкость, содержащая гипоксантин, аминоптерин и тимидин). Культивирование в указанной культуральной среде HAT продолжают обычно в течение времени, достаточного для гибели неслившихся клеток, отличающихся от желаемой гибридомы, и которое обычно длится от нескольких дней до нескольких недель. Затем, чтобы осуществить скрининг и клонирование гибридом, продуцирующих желаемое антитело, используют обычный метод предельных (конечных) разведений.
Кроме получения указанной выше гибридомы с помощью иммунизации антигеном животного, но не человека, для получения желаемых человеческих антител, обладающих активностью связывания с желаемым антигеном или клетками, экспрессирующими желаемый антиген (см. Japanese Post-examined Patent Publication (Kokoku) No 1-59878), также лимфоциты человека можно сенсибилизировать in vitro желаемым белком-антигеном или клетками, экспрессирующими желаемый антиген; и полученные сенсибилизированные В-лимфоциты сливают с клетками миеломы человека, например с клетками U266. Кроме этого, чтобы получить желаемое человеческое антитело с помощью способа, описанного выше (см. International Patent Publication WO 93/12227, WO 92/03918, WO 94/02602, WO 94/25585, WO 96/34096, WO 96/33735), антигеном или клетками, экспрессирующими антиген, можно иммунизировать трансгенное животное, имеющее набор всех генов антител человека.
Сконструированную таким образом гибридому, продуцирующую моноклональные антитела, можно культивировать как инокулят в обычной культуральной жидкости или можно хранить длительное время в замороженном состоянии при температуре жидкого азота.
Чтобы получить моноклональные антитела из указанной гибридомы, можно использовать способ, в котором гибридому культивируют обычным образом и получают антитела в виде супернатанта, или с помощью способа, в котором гибридому вводят и выращивают в животных, совместимых с указанной гибридомой, а антитела получают в виде асцита. Первый способ подходит для получения высокоочищенных антител, тогда как последний способ подходит для производства больших количеств антител.
Например, гибридому, продуцирующую антитела к рецептору IL-6, можно сконструировать, используя способ, раскрытый в Japanese Unexamined Patent Publication (Kokai) 3-139293. Ее можно сконструировать с помощью способа, в котором гибридому, продуцирующую антитело РМ-1, которая была депонирована для международного признания 12 июля 1989 г. по условиям Будапештского договора как FERM ВР-2998 Депозитарием для патентуемых микроорганизмов Национального института индустриальной науки и технологии (Patent Microorganism Depository of National Institute of Industrial Science and Technology, of Chuo 6, 1-1, Higashi 1-chome, Tsukuba city, Ibaraki pref., Japan), вводят внутрибрюшинно мышам BALB/c для получения асцитов, из которых очищают антитела РМ-1; или с помощью способа, в котором указанную гибридому культивируют в подходящей культуральной среде, такой как среда RPMI1640, содержащая 10%-ную фетальную сыворотку теленка и 5%-ный MB-Condimed HI (производство фирмы Boehringer Mannheim), или гибридомная среда SFM (производство фирмы GIBCO-BRL), или среда PFHM-II (производство фирмы GIBCO-BRL) и т.п. Затем антитела РМ-1 можно очистить из супернатанта.
Рекомбинантное антитело, продуцированное с помощью технологии рекомбинантных генов, в которой ген антитела был клонирован из гибридомы и интегрирован в подходящий вектор, который затем был введен в организм хозяина, может быть использовано в настоящем изобретении как моноклональное антитело (см., например, Borrebaeck C.A.K. and Larrick J.W. THERAPEUTIC MONOCLONAL ANTIBODIES, published in the United Kingdom by MACMILLAN PUBLISHERS LTD. 1990).
В частности, мРНК, кодирующую вариабельную (V) область желаемого антитела, выделяют из клеток, продуцирующих антитело, таких как гибридома. Выделение мРНК проводят, получая суммарный препарат РНК с использованием, например, известного способа, такого как метод ультрацентрифугирования в присутствии гуанидина (Chirgwin J.M. et al., Biochemistry 18:5294-5299, 1979), метода AGPC (Chomczynski P. et al., Anal., Biochem. 162:156-159, 1987), и затем мРНК получают из суммарного препарата РНК, используя набор фирмы Pharmacia «mRNA Purification Kit» и подобные наборы. Альтернативно, мРНК можно выделить непосредственно, используя набор фирмы Pharmacia «QuickPrep mRNA Purification Kit».
кДНК V-области антитела можно синтезировать из полученной таким способом мРНК, используя обратную транскриптазу. кДНК можно синтезировать, используя набор «AMV Reverse Transcriptase First-strand cDNA Synthesis Kit» и сходные наборы. Альтернативно, для синтеза и амплификации кДНК можно использовать набор фирмы Clontech «5'-Ampli FINDER RACE Kit» и метод 5'-RACE (Frohman M.A. et al., Proc. Natl. Acad. Sci. USA 85:8998-9002, 1988; Belyavsky A. et al., Nucleic Acids Res. 17:2919-2932, 1989), в котором используется полимеразная цепная реакция (ПЦР). Желаемый фрагмент ДНК очищают из продукта ПНР, и его можно лигировать в ДНК вектора. Кроме того, из него конструируют рекомбинантный вектор и вводят его в Е. coli и т.д., отбирая колонии, продуцирующие желаемый рекомбинантный вектор. Последовательность оснований желаемой ДНК может быть подтверждена с помощью известного способа, такого как дидезокси-метод секвенирования.
После получения ДНК, кодирующей V-область желаемого антитела, ее можно лигировать в молекулу ДНК, кодирующую константную область (С-область) желаемого антитела, которую затем интегрируют в экспрессионный вектор. Альтернативно, ДНК, кодирующую V-область антитела, можно интегрировать в экспрессионный вектор, содержащий ДНК, кодирующую С-область антитела.
Чтобы продуцировать антитела для применения в настоящем изобретении, ген антитела интегрируют, как описано ниже, в экспрессионный вектор для того, чтобы он экспрессировался под контролем регуляторного участка, например энхансера и/или промотора. Затем экспрессионный вектор может быть трансформирован в клетку-хозяина, и в ней затем могут экспрессироваться антитела.
В соответствии с настоящим изобретением в целях снижения гетерологичной антигенности у человека, можно применять искусственно измененные рекомбинантные антитела, такие как химерное антитело, гуманизированное антитело и человеческое антитело.
Химерное антитело можно получить с помощью лигирования полученной таким образом ДНК, кодирующей V-область антитела, в ДНК, кодирующую С-область человеческого антитела, которую затем интегрируют в экспрессионный вектор и вводят в хозяина для продуцирования в нем антител (см. European Patent Application EP 125023 и International Patent Publication WO 92-19759). С использованием этого известного способа можно получить химерное антитело, полезное в настоящем изобретении.
Например, плазмида, которая содержит ДНК, кодирующую L-цепь V-области или Н-цепь V-области химерного антитела РМ-1, была обозначена как pPM-k3 или pPM-h1, соответственно, и Е. coli, обладающие этими плазмидами, были депонированы для международного признания 12 февраля 1991 г. по условиям Будапештского договора как NCIMB 40366 и NCIMB 40362, соответственно, Компанией Национальные коллекции промышленных и морских бактерий.
Гуманизированное антитело, которое также называют «измененным человеческим антителом», может быть получено с помощью трансплантации участка, детерминирующего комплементарность антитела (CDR) млекопитающих, но не человека, например мышиного антитела, в участок, детерминирующий комплементарность человеческого антитела. Общепринятая технология рекомбинантных ДНК для получения таких антител также известна (см. European Patent Application EP 125023 и International Patent Publication WO 92-19759).
В частности, последовательность ДНК, которая была сконструирована для лигирования CDR мышиного антитела без нарушения рамки считывания (FR, framework region) в человеческое антитело, синтезируется с помощью метода ПЦР, используя олигонуклеотиды, имеющие на концах перекрывающиеся области. Полученную таким образом ДНК лигируют в ДНК, кодирующую С-область человеческого антитела, и затем объединяют в экспрессионный вектор, который вводят в хозяина для продукции антител (см. European Patent Application EP 239400 и International Patent Publication WO 92-19759).
Чтобы получить FR человеческого антитела, дотированного по CDR-участку, выбирали такие, в которых присутствовал участок, определяющий комплементарность, формирующий подходящий участок связывания антигена. При желании можно было заменить аминокислоты без нарушения рамки считывания в вариабельном участке антитела так, чтобы участок, определяющий комплементарность человеческого антитела с измененной формой, мог образовать соответствующее место связывания антигена.
Например, для химерного антитела или гуманизированного антитела используют С-область человеческого антитела. В качестве С-области человеческого антитела могут быть использованы Сγ и Сγ1, Сγ2, Сγ3 и Сγ4, которые следует упомянуть в качестве примеров. С-область человеческого антитела можно модифицировать для улучшения стабильности антитела или его продукции.
Химерное антитело включает вариабельную область антитела, происходящего из млекопитающих, отличных от человека, и С-область, происходящую из человеческого антитела, тогда как гуманизированное антитело включает участок, определяющий комплементарность антитела, происходящего из млекопитающих, отличных от человека, а также рамку считывания и С-область, происходящие из человеческого антитела. В соответствии с этим их антигенность в организме человека снижена таким образом, что они полезны в качестве антител для применения в настоящем изобретении.
В качестве предпочтительного воплощения гуманизированного антитела для применения в настоящем изобретении можно упомянуть гуманизированное антитело РМ-1 (см. International Patent Publication WO 92-19759).
Кроме того, в дополнение к способам, описанным выше, для получения человеческих антител известна технология, использующая «просмотр» библиотеки человеческих антител. Например, используя метод фагового отображения (phage display), можно отобрать фаг, который связывается с нужным антигеном, так как вариабельная область человеческого антитела экспрессируется на поверхности фага в виде отдельной цепи антитела (scFv). С помощью генного анализа отобранного фага можно определить последовательность ДНК, кодирующую вариабельную область человеческого антитела, которая связывается с антигеном. После того, как последовательность ДНК цепи scFv, которая связывает антиген, выяснена, можно сконструировать подходящий экспрессионный вектор, который содержит указанную последовательность, и использовать его в дальнейшем для получения человеческого антитела. Эти способы известны и их можно найти в WO 92/01047, WO 92/20791, WO 93/06213, WO 93/11236, WO 93/19172, WO 95/01438 и WO 95/15388.
Гены антител, сконструированных как описано выше, можно экспрессировать и получить с помощью известного метода. В случае клеток млекопитающих экспрессию можно выполнить, используя вектор, включающий обычно используемый промотор, с которого идет экспрессия гена антитела, ДНК, к 3'-концу которой эффективно присоединена поли-А сигнальная последовательность, или вектор, включающий указанную ДНК. Примеры промотора/энхансера включают промотор/энхансер ранней экспрессии цитомегаловируса человека.
Кроме того, в качестве промотора/энхансера, которые могут быть использованы для экспрессии антител для применения в настоящем изобретении, можно использовать вирусные промоторы/энхансеры, такие как промоторы/энхансеры ретровируса, вируса полиомы, аденовируса и вируса обезьян 40 (SV40), а также промоторы/энхансеры, име