Способ коррекции постэвакуаторного синдрома у больных с напряженным злокачественным асцитом
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к онкологии, хирургии и интенсивной терапии, и может быть использовано в качестве коррекции постэвакуаторного синдрома у больных с напряженным асцитом вследствие карциноматоза брюшины. Для этого пациенту производят удаление асцитической жидкости. Затем полученную асцитическую жидкость концентрируют и фильтруют с помощью гемодиализного фильтра, а затем концентрат фильтруют с помощью плазмофильтра. К полученному фильтрату добавляют гипохлорит натрия для окисления, цефазолин 2,0 г/л и преднизолон 90 мг/л с последующей реинфузией жидкости пациенту. Способ позволяет осуществлять эффективную коррекцию гиповолемических и гипопротеинемических расстройств у больных с данной патологией за счет введения аутоасцитической жидкости с максимально повышеной концентрацией белка с неизменным соотношением его фракций, сниженной концентрацией молекул средней массы и максимально удаленными атипичными клетками. 3 табл.
Реферат
Изобретение относится к области медицины, в частности к абдоминальной хирургии и онкологии, и может быть использовано как адьювантный метод лечения больных с запущенными формами онкологических заболеваний органов брюшной полости, осложненных карциноматозом брюшины и напряженным малигнизированным асцитом.
Известен способ лечения этих заболеваний путем выполнения лечебного лапароцентеза с эвакуацией асцитической жидкости [Gotlieb W.H., Feldman В., Feldman-Moran О., et al. Intraperitoneal pressures and clinical parameters of total paracentesis for palliation of symptomatic ascites in ovarian cancer // Gynecol. Oncol. - 1998. - Vol.71. - P.381-5; Appelqvist P., Silvo J., Salmela L. et al. On the treatment and prognosis of malignant ascites: is the survival time determined when the abdominal paracentesis is needed? // J.Surg. Oncol. - 1982. - Vol.20. - P.238-42; Fischer D.S. Abdominal paracentesis of malignant ascites // Arch. Intern. Med. - 1979. - Vol.139. - №2. - P.235; Stephenson J., Gilbert J. The development of clinical guidelines on paracentesis for ascites related to malignancy // Palliat. Med. - 2002. - Vol.16. - P.213-8; McNamara P.Paracentesis - an effective method of symptom control in the palliative care setting? // Palliat. Med. - 2000. - Vol.14. - P.62-4].
Недостатками указанного способа являются отсутствие лечебной коррекции неизбежно развивающейся гиповолемии и гипопротеинемии, что ведет к значительному снижению качества жизни данной категории больных.
Известен способ лечения постэвакуаторного синдрома, в котором в качестве плазмозамещающего раствора используется раствор альбумина [Gines P., Cardenas А., Arroyo V. Management of cirrhosis and ascites // N.Eng.l J. Med. - 2004. - Vol.350. - P.1646-54].
Недостатком этого способа является высокая цена лекарственного средства.
Цель изобретения - повысить эффективность лечения и качество жизни больных с карциноматозом брюшины и напряженным малигнизированным асцитом.
Цель достигается путем экстракорпоральной концентрации, фильтрации и реинфузии асцитической жидкости, причем используют два вида специальных фильтров (гемодиализный и плазмофильтр) и в состав фильтрата добавляют гипохлорит натрия, цефазолин 2,0 г/л и преднизолон, в дозе 90 мг/л.
Способ коррекции постэвакуаторного синдрома у больных с напряженным злокачественным асцитом состоит из четырех этапов и реализуется следующим образом.
1 этап. Этап забора асцитической жидкости.
В асептических условиях под местной анестезией больному с напряженным асцитом выполняется лапароцентез общепринятым способом. Асцитическая жидкость эвакуируется в стерильную емкость. Помимо этого эвакуированная жидкость направляется на цитологическое, клиническое, бактериологическое и биохимическое исследования.
2 этап. Этап фильтрации с концентрированием асцитической жидкости заключается в концентрации забранной асцитической жидкости посредством гемодиализного фильтра. Асцитическая жидкость при помощи роликового насоса по системе магистралей поступает в гемодиализный фильтр, где происходит ее фильтрация и концентрирование. При этом концентрат поступает обратно в стерильную емкость, а безбелковый водный фильтрат в отдельный контейнер. Таким образом, к завершению этапа фильтрации происходит концентрирование асцитической жидкости в заданное количество раз.
Однако полученный раствор остается с сохраненным клеточным составом, в котором присутствуют клетки крови, а также атипичные клетки. Поэтому нами предложено использование плазмофильтра, способного задерживать все клетки крови.
3 этап. Этап клеточной фильтрации асцитической жидкости заключается в фильтрации асцитической жидкости от клеток крови и атипичных клеток с помощью плазмофильтра. Полученный концентрат после второго этапа при помощи роликового насоса по системе магистралей поступает в плазмофильтр, где происходит его фильтрация. Клетки оседают в фильтре, а отфильтрованная жидкость поступает во вторую стерильную емкость.
4 этап. Этап качественной коррекции асцитической жидкости заключается в добавлении в полученный фильтрат окислителя (гипохлорит натрия), антибиотика (цефазолин) и глюкокортикоида (преднизолон). Добавление гипохлорита натрия позволяет снизить содержание в фильтрате молекул средней массы, провоспалительных цитокинов и других продуктов раковой интоксикации. Применение антибиотика снижает вероятность бактериального инфицирования, а введение глюкокортикоида предотвращает развитие возможных пирогенных реакций. Авторами установлено, после первого этапа фильтрации с заданными параметрами концентрация общего белка повышалась в заданное количество раз. Количество белка в удаляемой жидкости было низким и составляло примерно 5 г/л, что доказывает эффективность работы гемодиализного фильтра. Изменений в соотношениях фракций белков после всех этапов фильтрации выявлено не было. Изменения содержания в асцитической жидкости уровней креатинина, билирубина и мочевины были незначительны. При цитологическом исследовании асцитической жидкости до фильтрации, а также после второго этапа - фильтрации асцитической жидкости наблюдалось одинаковое большое количество эозинофилов, лимфоидных элементов, лейкоцитов, клеток мезотелия с реактивными изменениями, а также атипичные клетки. После третьего этапа, клеточной фильтрации, их количество в асцитической жидкости значительно уменьшалось до единичных клеток, что говорит об эффективности использования плазмофильтра. При бактериологическом исследовании как до фильтрации, так и после обоих этапов фильтрации роста микрофлоры выявлено не было. После четвертого этапа добавления в асцитическую жидкость окислителя, антибиотика и глюкокортикоида отмечалось снижение в асцитической жидкости концентрации молекул средней массы. Аллергических, пирогенных реакций и инфекционных осложнений у больных не наблюдалось.
Таким образом, разработанный способ позволяет в стерильных условиях концентрировать асцитическую жидкость, повышая белковый состав в заданное количество раз с неизмененным соотношением фракций белка. Отфильтровывание атипичных клеток делает эту методику безопасной в отношении гематогенной генерализации опухоли, а удаление из концентрированной асцитической жидкости клеток крови, снижение концентрации молекул средней массы и добавление глюкокортикоида предотвращает возможные пирогенные реакции.
Клиническая апробация и оценка эффективности реинфузии асцитической жидкости.
Характеристика больных.
Характеристика больных контрольной и основной групп в зависимости от локализации первичной опухоли, пола и возраста пациентов представлена в таблице 1.
После выполнения лапароцентеза и эвакуации асцитической жидкости с целью коррекции развивавшегося постэвакуаторного синдрома больным основной группы проводили корректирующую инфузионную терапию, включавшую парентеральное введение плазмозамещающих растворов, назначали анальгетики. В качестве плазмозаменителей использовались кристаллоиды (0,9% раствор натрия хлорида) и коллоидные растворы (концентрированная асцитическая жидкость больного с добавлением гипохлорита натрия для окисления, цефазолина 2.0 г/л и преднизолона 90 мг/л) в объеме 400 и 500 мл в сутки соответственно. Длительность курса проводимой терапии составила 3 суток. Больным контрольной группы проводилась симптоматическая терапия (анальгетики).
| Таблица 1. | ||||||
| Характеристика больных в зависимости от локализации первичной опухоли, пола и возраста | ||||||
| Локализация первичной опухоли | Мужчины | Женщины | Средний возраст | |||
| Контрольная группа | Основная группа | Контрольная группа | Основная группа | Контрольная группа | Основная группа | |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Желудок | 1 | 1 | 4 | 51±8 | 60±7 | |
| Яичники | 11 | 1 | 54±8 | 65±12 | ||
| Матка | 2 | 2 | 59±4 | 61±8 | ||
| Молочная железа | 2 | 8 | 56±7 | 55±8 | ||
| Толстая кишка | 1 | 1 | 71±3 | |||
| Неизвестной локализации | 1 | 1 | 1 | 58±2 | 61±5 | |
| Всего | 3 | 13 | 7 | 14 | 58±9 | 60±5 |
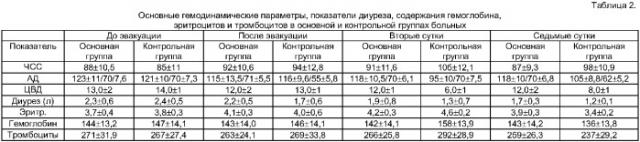
Основные гемодинамические параметры, показатели диуреза, содержания гемоглобина, эритроцитов и тромбоцитов в основной и контрольной группах больных представлены в таблице 2.
Как видно из таблицы 1, до и непосредственно после эвакуации асцитической жидкости показатели гемодинамики, общего анализа крови и диуреза в основной и контрольной группах были практически одинаковыми. Во вторые сутки в контрольной группе у больных отмечались выраженные расстройства гемодинамики, вплоть до гиповолемического шока, гемоконцентрация, снижение диуреза. К седьмым суткам выраженность возникших нарушений несколько снизилась. Однако по-прежнему в сравнении с основной группой сохранялись гипотония и некоторое снижение диуреза. В основной группе на фоне проводимой инфузионной терапии в объеме 500 мл концентрата асцитической жидкости и 800 мл физиологического раствора в течение первых трех суток подобных изменений измеряемых показателей не отмечалось или они были менее выражены.
Характеристика биохимических показателей крови основной и контрольной групп представлена в таблице 3.
Как видно из таблицы 3, в контрольной группе больных в биохимическом анализе крови отмечалось постепенное снижение содержания общего белка с достижением минимального значения к седьмым суткам. В основной группе на фоне проводимой реинфузии концентрированной асцитической жидкости значимой гипопротеинемии не отмечалось. В то же время выявлялось некоторое увеличение общего билирубина и трансаминаз, вероятно обусловленное их повышенным содержанием в реинфузируемой жидкости.
Аллергических, гиперпиретических реакций и инфекционных осложнений при проведении метода не было.
Таким образом, проведение в постэвакуаторный период инфузионной терапии с использованием в качестве коллоидного плазмозамещающего раствора концентрированной асцитической жидкости позволяет предотвратить неизбежно возникающие после эвакуации асцита клинические проявления гиповолемии и развитие гипопротеинемии, максимально нарастающей к концу первой недели после выполнения лапароцентеза.
Способ коррекции гиповолемических и гипопротеинемических расстройств, развивающихся после эвакуации напряженного асцита у больных с карциноматозом брюшины, включающий удаление асцитической жидкости, ее концентрирование, фильтрацию и последующую реинфузию, отличающийся тем, что вначале полученную асцитическую жидкость концентрируют и фильтруют с помощью гемодиализного фильтра, а затем концентрат фильтруют с помощью плазмофильтра, к полученному фильтрату добавляют гипохлорит натрия для окисления, цефазолин 2,0 г/л и преднизолон 90 мг/л.