Пегилированный липосомальный доксорубицин в комбинации с эктеинасцидином 743 (ecteinescidin 743)
Иллюстрации
Показать всеИзобретение относится к медицине, в частности к онкологии, и касается лечения рака пегилированным липосомальным доксорубицином (ПЛФД) в комбинации с эктеинасцидином 743 (ЕТ-743). Для этого предложены варианты способа лечения, варианты композиций, а также медицинские наборы. Изобретение обеспечивает эффективное подавление раковой ткани за счет комбинированного воздействия ПЛФД и Е-743 при снижении токсических эффектов. 11 н. и 30 з.п. ф-лы, 1 ил., 9 табл.
Реферат
Изобретение относится к лечению раковых заболеваний и, в частности, эффективному лечению раковых опухолей у людей с использованием эктеинасцидина 743 (ET-743) в комбинации с другим лекарственным средством.
Эктеинасцидин 743 (ET-743) представляет собой противораковое средство, полученное из морского источника.
Предпосылки к созданию изобретения
Эктеинасцидин 743 (ET-743) представляет собой алкалоид тетрагидроизохинолина, выделенный из морского оболочечника Ecteinascidia turbinate, имеющий следующую структуру:
ET-743, его химический состав, механизм действия и доклинические и клинические разработки можно найти в Kesteren, Ch. Van et al., 2003, Anti-Cancer Drugs, 14 (7), стр. 487-502: «Yondelis (trabectedin, ET-743): the development of an anticancer agent of marine origin», и приведенных там ссылках.
ET-743 обладает мощной антинеопластической активностью в отношении различных опухолевых ксенотрансплантатов человека, выращенных у бестимусных мышей, включая меланому и карциному яичников и груди.
В фазе I клинических испытаний ET-743 были получены обнадеживающие результаты у пациентов, страдающих саркомой и карциномой груди и яичников. Таким образом, это новое лекарственное средство в настоящее время интенсивно изучается в некоторых клинических испытаниях фазы II у онкологических пациентов, страдающих рядом неопластических заболеваний.
ET-743 оказывает миелотоксический и гепатотоксический побочные эффекты. Пациенты, получающие ET-743 пролонгированной инфузией свыше 24-72 часов, испытывали миелосуппрессию и, зачастую, острый, хотя обратимый, подъем трансаминаз и субклинический холангит, характеризующийся увеличениями щелочной фосфатазы (ALP) и/или билирубина, см., например, Ryan D.P. et al., 2001 Clin Cancer Res 7, 231: «Phase I and pharmacokinetic study of ecteinascidin 743 administered as a 72-hour continuous intravenous infusion in patients with solid malignancies»; Puchalski T.A. et al., 2002, Cancer Chemother Pharmacol 50: 309: «Pharmacokinetics of ecteinascidin 743 administered as a 24-h continuous intravenous infusion to adult patients with soft tissue sarcomas: associations with clinical characteristics, pathophysiological variables and toxicity».
Доклинические исследования острой токсичности, проводимые на мышах, крысах, собаках и обезьянах, согласовано продемонстрировали печеночную токсичность как важный побочный эффект ET-743, доказанный увеличением в плазме уровней специфичных печеночных ферментов и патологическими проявлениями холангита. В последнее время природа и степень гепатобилиарных изменений, вызванных ET-743 у самок крыс, видов, которые наиболее подвержены гепатотоксичному действию ET-743, были охарактеризованы с помощью гистопатологического, электронно-микроскопического, иммуногистохимического анализа, биохимического анализа плазмы и ДНК микрочипов, см. Donald S. et al., 2002, Cancer Research, 62: 4256 «Hepatobiliary damage and changes in hepatic gene expression caused by the antitumor drug ecteinascidin 743 (ET-743) in the female rat».
Кроме того, было показано, что премедикация высокой дозой дексаметазона устраняет ET-743-опосредованную гепатотоксичность в этой животной модели, не препятствуя его противоопухолевой активности, см. Donald S. et al, 2003, Cancer Research, 63: 5903-5908: «Complete protection by high-dose dexamethasone against the hepatotoxicity of the novel antitumor drug ecteinascidin-743 (ET-743) in the rat» и WO 0236135.
Защита с помощью премедикации дексаметазоном сопровождалась резким снижением уровней ET-743 в печени, предположительно означая повышенный печеночный клиренс ET-743, возможно, посредством индуцированных метаболических ферментов как механизма, посредством которого проявляется благоприятное действие дексаметазона, т.е. путем повышения скорости метаболической детоксикации ET-743.
Доксорубицин представляет собой цитотоксический антрациклиновый антибиотик, выделенный из Streptomyces peucetius var. caesius. Известно, что при введении в чистом виде доксорубицин прежде всего вызывает миелотоксичность.
Композиции и применения ЕТ-743 с другими лекарственными средствами для лечения раковых заболеваний описаны в WO 0236135, опубликованной 10 мая 2002 и включенной в описание в качестве особой ссылки. In vitro исследования указывали на сверхсуммарные эффекты для комбинаций ET-743 с некоторыми другими лекарственными средствами. В частности, синергетические эффекты были показаны in vitro в отношении сарком человека. Были исследованы композиции и применения ET-743 с антрациклином доксорубицин. В этом исследовании токсичность комбинаций подробно не рассматривалась.
Дальнейшее руководство по дозировкам, схемам лечения и введению ET-743 отдельно или в комбинации дано в WO 0069441, WO 0236135, WO 03039571 и PCT/GB2004/002319, которые включены в описание в качестве ссылок в полном объеме.
По-прежнему существует необходимость в обеспечении дополнительными лекарственными средствами, которые дают возможность проводить эффективное лечение млекопитающих, в частности людей, с использованием ET-743, уменьшая или устраняя его побочные токсические эффекты и сводя к минимуму дальнейшие отрицательные эффекты.
Краткое описание чертежей
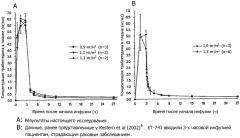
На чертеже показана средняя концентрация ET-743 в плазме (также называемого в примерах трабектедин) как функция времени после начала инфузии, где А относится к результатам, полученным в настоящем исследовании, а В относится к результатам, представленным Van Kestern et al. («Clinical Pharmacology of the novel marine-derived anticancer agent Ecteinascidin 743 administered as a 1- and 3-hour infusion in a phase I study; Anticancer Drugs; 13(4); 381-393; 2002»).
Краткое изложение сущности изобретения
Изобретение относится к комбинированным продуктам, комбинированному медикаментозному лечению и способам лечения пациентов, имеющих раковые заболевания, с меньшим количеством или с менее тяжелыми нежелательными токсическими эффектами.
В соответствии с одним аспектом изобретение относится к способу лечения организма человека от ракового заболевания, включающему в себя введение эффективного терапевтического количества пегилированной липосомальной формы антрациклина доксорубицина («PLD»), в комбинации с эффективным терапевтическим количеством ET-743. Предпочтительно, млекопитающим является человек.
Варианты осуществления изобретения
Неожиданно было обнаружено, что комбинация ET-743 и PLD может приводить к более высокой противоопухолевой эффективности, в то же время обладая сниженной миелотоксичностью и сниженной кардиотоксичностью. Кроме того, комбинация ET-743 с PLD является синергичной.
PLD может представлять собой доксорубицина гидрохлорид (HCl) в пегилированной липосомальной форме. Инкапсулирование в липосомы делает его стабильным для внутривенного введения. Липосомы представляют собой микроскопические везикулы, состоящие из фосфолипидного бислоя, который способен инкапсулировать активные лекарственные средства. «Пегилирование» - это процесс, при котором липосомы образуются поверхностно связанным метоксиполиэтиленгликолем (MPEG). Липосомальное инкапсулирование может существенно влиять на функциональные свойства лекарственного средства, по сравнению с таковыми неинкапсулированного лекарственного средства. Кроме того, различные липосомальные лекарственные продукты могут отличаться друг от друга по химическому составу и физической форме липосом. Такие различия могут существенно влиять на функциональные свойства липосомальных лекарственных продуктов. Doxil™ является примером коммерчески доступной формы пегилированного липосомального доксорубицина.
Комбинация PLD и ET-743 со сниженной миелотоксичностью и сниженной кардиотоксичностью является эффективной по сравнению с токсичностями, наблюдаемыми при использовании комбинации доксорубицина и ET-743.
Более высокая противоопухолевая эффективность наблюдается по сравнению с лечением, в котором используется только ET-743. Было обнаружено, что комбинация PLD и ET-743 переносима в той степени, при которой оба лекарственных средства можно вводить в полных, или близких к полным, терапевтических дозах в течение длительных периодов времени.
В одном аспекте настоящее изобретение относится к композиции для лечения человека от раковой опухоли, содержащей ET-743 и PLD, которая эффективна при сниженной токсичности по сравнению с токсичностью, наблюдаемой при использовании комбинации доксорубицина и ET-743. В частности, комбинация ET-743 и PLD демонстрирует сниженную миелотоксичность и сниженную кардиотоксичность.
В другом аспекте настоящее изобретение относится к медицинскому набору для введения ET-743 в комбинации с PLD, включающему введение ET-743 в лекарственных формах по меньшей мере на один цикл, где лекарственная форма содержит соответствующее количество ET-743 для установленного лечения и фармацевтически приемлемый носитель, и печатные инструкции по приему ET-743 в соответствии со схемой дозирования.
В другом аспекте изобретение относится к применению ET-743 для получения лекарственного средства для эффективного лечения организма человека от ракового заболевания с помощью комбинированной терапии с использованием ET-743 с PLD.
Термин «комбинация», используемый по всему тексту описания, охватывает введение терапевтических агентов в одном или отдельных фармацевтических составах, и в одно и то же или в разное время.
В дополнительном аспекте изобретение относится к применению PLD для получения лекарственного средства для эффективного лечения организма человека от ракового заболевания путем комбинированной терапии с использованием PLD с ET-743. Это лечение является эффективным со сниженной миелотоксичностью и кардиотоксичностью, а также отличается отсутствием при этом как воспаления слизистой оболочки, так и алопеции.
В дополнительном аспекте настоящее изобретение относится к способу повышения противоопухолевой эффективности ET-743 при лечении организма человека от ракового заболевания, включающему введение эффективного терапевтического количества ET-743 в комбинации с эффективным терапевтическим количеством PLD.
Изобретение также относится к способу лечения организма человека от ракового заболевания, включающему введение эффективного терапевтического количества PLD в комбинации с эффективным терапевтическим количеством ET-743. Предпочтительно млекопитающим является человек.
Термин «ET-743» охватывает любую фармацевтически приемлемую соль, сложный эфир, сольват, гидрат или любое другое соединение, которое при введении реципиенту может давать (прямо или опосредовано) описанное соединение. Однако, будет понятно, что фармацевтически неприемлемые соли также подпадают под объем изобретения, поскольку они могут быть использованы для получения фармацевтически приемлемых солей. Получение солей и пролекарств и производных можно осуществить способами, известными в данной области.
ET-743 поставляют и хранят в виде стерильного лиофилизированного продукта, состоящего из ET-743 и эксципиента в составе, пригодном для терапевтического применения, в частности в составе, содержащем маннит и фосфатную соль, забуференную до соответствующего pH.
Введение композиций по этому способу осуществляют путем внутривенной инъекции. Введение можно проводить непрерывно или периодически в пределах максимально переносимой дозы (MTD). По всему тексту описания MTD относится к наивысшей дозе, при которой менее одной трети пациентов в дозозависимой группе испытывали токсичность, ограничивающую дозу (DLT).
ET-743 и PLD можно вводить как отдельные лекарственные средства для введения в одно и то же время или в разное время. Предпочтительно, ET-743 и PLD вводят как отдельные лекарственные средства для введения в разное время. При раздельном введении и в разное время первым можно вводить либо ET-743, либо PLD; однако предпочтительно вводить PLD с последующим введением ET-743.
Обычное время инфузии составляет до 72 часов, более предпочтительно 1-24 часа, с наибольшим предпочтением 1-6 часов. В тех случаях, когда PLD и ET-743 применяют в виде отдельных лекарственных средств для введения в разное время, время инфузии для каждого может различаться.
Время инфузии для PLD в основном составляет до 6 часов, более предпочтительно 1-3 часа, с наибольшим предпочтением 1-2 часа. Время инфузии для ET-743 в основном составляет до 24 часов, более предпочтительно около 1, около 3 или около 24 часов. Особенно желательно короткое время инфузии, которое позволяет проводить лечение без ночного пребывания в стационаре.
Будет понятно, что точная дозировка композиций по этому аспекту изобретения будет зависеть от конкретного состава, способа применения и конкретного situs, организма и опухоли, подвергаемых лечению. Следует принимать во внимание другие факторы, такие как возраст, масса тела, пол, рацион питания, время введения, скорость экскреции, состояние организма, комбинации лекарственных средств, чувствительность реакции и тяжесть заболевания. Все дозы выражают в миллиграммах (мг) на квадратный метр (м2) площади поверхности тела. Поскольку в способе по изобретению PLD и ET-743 используют в комбинации, дозу каждого устанавливают так, чтобы обеспечить оптимальный клинический ответ.
В способе по настоящему изобретению используют дозы PLD до 50 мг/м2, более предпочтительно 25-45 мг/м2, наиболее предпочтительно 30-40 мг/м2 и еще более предпочтительно около 30 мг/м2. Дозы ET-743 применяют до 1,3 мг/м2, более предпочтительно 0,4-1,2 мг/м2, наиболее предпочтительно около 1,1 мг/м2.
В соответствии с предпочтительным вариантом осуществления этого аспекта изобретения 25-45 мг/м2 PLD вводят внутривенно с последующим введением до 1,3 мг ET-743, также вводимого внутривенно. Более предпочтительно, вводят около 30 мг/м2 PLD с последующим введением около 1,1 мг/м2 ET-743. PLD предпочтительно вводят за время инфузии до 6 часов, более предпочтительно 1-2 часов, наиболее предпочтительно 1 час. ET-743 предпочтительно вводят за время инфузии около 1, около 3 или около 24 часов.
В применяемом способе по изобретению введение комбинации проводят циклами. Внутривенные инфузии PLD и ET-743 проводят пациентам обычно каждые 3 недели, с учетом фазы покоя в каждом цикле, в котором пациенты восстанавливаются. Предпочтительная продолжительность каждого цикла обычно от 3 до 4 недель; по мере необходимости могут быть проведены множественные циклы. При необходимости проводят задержки дозы и/или снижения дозы и корректировки схем введения, в зависимости от индивидуальной переносимости лечения каждым пациентом.
В соответствии с особенно предпочтительным вариантом осуществления каждые 3 недели пациенту вводят около 30 мг/м2 PLD за время инфузии около 1 часа с последующим введением около 1,1 мг/м2 ET-743 за время инфузии около 3 часов.
Используя режим дозирования, соответствующий режиму дозирования, используемому в этих предпочтительных вариантах осуществления, было обнаружено, что эта комбинация хорошо переносится, когда оба лекарственных средства вводят в полных, или близких к полным, терапевтических дозах в течение длительных периодов времени.
Известно, что полная доза ET-743 составляет 1,3 мг/м2 при введении одного средства за 3 часа. Полная доза PLD, используемая в настоящее время в клинической практике, составляет 10 мг/м2 в неделю при введении в виде отдельного средства.
Следующие фигуры указывают на то, что применение PLD в комбинации с ET-743 позволяет переносить повышенную дозу ET-743, по сравнению с использованием доксорубицина. фаза I изучения повышения дозы доксорубицина (60 мг/м2) в комбинации с ET-743, вводимой за 3 часа, могла только подтвердить дозу ET-743 0,7 мг/м2. В фазе I изучения повышения дозы 30 мг/м2 PLD в комбинации с ET-743, вводимой за 3 часа, ET-743 можно было повысить до 1,1 мг/м2.
Таким образом, в другом аспекте настоящее изобретение относится к способу максимального увеличения переносимой дозы ET-743 при лечении организма человека от ракового заболевания, включающему в себя введение эффективного терапевтического количества ET-743 в комбинации с пегилированной липосомальной формой доксорубицина.
Таким образом, комбинация ET-743 и PLD дает возможность проводить эффективную противораковую терапию у людей со сниженной миелотоксичностью и кардиотоксичностью. В фазе I испытаний с использованием ET-743 вместе с PLD измеряемые реакции представили подтверждение клинической эффективности для пациентов с саркомой мягких тканей и раком яичников и раком тканей головы и шеи.
Заметно сниженная кардиотоксичность демонстрировала способы, с помощью которых можно долговременно вводить комбинации для использования в этом аспекте изобретения. Кроме того, эти комбинации отличаются отсутствием при их применении как воспаления слизистой оболочки, так и алопеции.
В Примере 1 показаны результаты исследования оценки MTD ET-743 в комбинации с 30 мг/м2 PLD вместе с результатами испытаний фазы I. В ходе лечения была установлена MTD ET-743 в комбинации с 30 мг/м2 PLD в значении 1,1 мг/м2.
Таким образом, это изобретение, следовательно, относится к способам лечения, применению соединений для получения композиции для лечения ракового заболевания и связанным с ними вариантам осуществления. Настоящее изобретение также распространяется на композиции по изобретению для применения в способе лечения.
Настоящее изобретение также относится к фармацевтическим препаратам, включающим фармацевтически приемлемый носитель, которые включают в качестве активного ингредиента соединение или соединения по изобретению, а также к способам их получения.
Следующий пример дополнительно иллюстрирует изобретение. Этот пример не следует интерпретировать как ограничение объема изобретения.
Для предоставления более краткого описания некоторые количественные выражения, приведенные здесь, не сопровождаются понятием «примерно». Понятно, что, используется ли понятие «примерно» явным образом или нет, подразумевается, что каждое приведенное количественное значение относится к фактически существующей заданной величине, а также подразумевается, что относится к приближению к этой заданной величине, которая была бы соответствующим образом получена на основании обычных знаний в этой области, включая эквиваленты и приближения вследствие экспериментальных условий и/или условий измерения для такой заданной величины.
Примеры
По всему тексту Примера Ecteinascidin 743 (ET-743) также называется трабектедин.
Пример 1
Проводили фазу I испытания, комбинируя PLD и трабектедин. Целью исследования было определение максимально переносимой дозы (MTD) трабектедина в комбинации с 30 мг/м2 PLD, вводимой каждые 21 день. Дополнительными целями было оценить профиль безопасности этой комбинации лекарственных средств и оценить фармакокинетические параметры трабектедина и PDL, представленных в комбинации. Максимально переносимая доза (MTD) относится к наивысшей дозе, при которой менее одной трети пациентов в группе по уровню дозы испытывали токсичность, ограничивающую дозу (DLT).
Авторы изобретения планировали испытание для поиска дозы с фиксированной дозой PLD 30 мг/м2, вводимой внутривенно за один час, за которой сразу следует одна из шести доз трабектедина (0,4, 0,6, 0,75, 0,9, 1,1 и 1,3 мг/м2), вводимая внутривенно за 3 часа. Это лечение повторяли каждые 21 день.
Критерии включения в исследование включали печеночные пробы без патологии, ранее ограниченное воздействие доксорубицина (доза менее 250 мг/м2), нормальную сердечную функцию и общее состояние больного (PS) по шкале Eastern Cooperative Oncology Group (ECOG) в баллах 0 или 1.
Лечение проводили у тридцати пациентов, 14 с саркомами, 2 с раком яичников, 2 с раком поджелудочной железы, 2 с карциномой головы и шеи, 1 с раком мочевого пузыря, 1 с раком груди, 1 с раком желудка, 1 с немелкоклеточной карциномой легких (NSCLC), 1 с мелкоклеточной карциномой легких (SCLC) и еще 5 с другими типами злокачественных заболеваний (Таблица 1).
| Таблица 1Исходные характеристики заболевания | |
| Время до 1 дозы с момента постановки диагноза, мес. | |
| N | 30 |
| Среднее (SD) | 37,4(43,8) |
| Медиана | 25,5 |
| Разброс | 1,2-216,0 |
| Время до 1 дозы с момента последней химиотерапии, мес. | |
| N | 22 |
| Среднее (SD) | 3,54(3,0) |
| Медиана | 2,6 |
| Разброс | 0,9-12,8 |
| Гистология | |
| N | 30 |
| Мочевой пузырь | 1 |
| Грудь | 1 |
| Голова и шея | 2 |
| NSCLC | 1 |
| Яичник | 2 |
| Поджелудочная железа | 2 |
| Саркома | 14 |
| Желудок | 1 |
| SCLC | 1 |
| Другие | 5 |
Девять пациентов из 30 имели общее состояние (PS) 0 (полностью активные, способные выполнять всю деятельность, осуществляемую до заболевания, без ограничения). В Таблице 2 представлены демографические данные пациентов, проходивших лечение.
| Таблица 2Демографические данные | |
| Всего | |
| Пол, n (%) | |
| N | 30 |
| Женщины | 17 (57) |
| Мужчины | 13 (43) |
| Раса, n (%) | |
| N | 30 |
| Черная | 1 (3) |
| Белая | 29 (97) |
| Возраст в годах | |
| N | 30 |
| Категория, n (%) | |
| 18-60 | 25 (83) |
| >60 | 5 (17) |
| Среднее (SD) | 51,5 (13,8) |
| Медиана | 53,0 |
| Разброс | 20-78 |
| Исходный балл по шкале ECOG, n (%) | |
| N | 30 |
| 0 | 9 (30) |
| 1 | 21 (70) |
Пациентов предварительно интенсивно лечили: 23/30 ранее получали 1-5 циклов химиотерапии (в среднем 3), 15/30 ранее получали лучевую терапию и 27/30 была сделана хирургическая операция (Таблица 3).
| Таблица 3Предшествующее лечение | |
| N=30 | |
| Предшествующее системное лечение, n (%) | |
| Не было | 7 (23) |
| Было | 23 (77) |
| Предшествующее хирургическое лечение, n (%) | |
| Не было | 3 (10) |
| Было | 27 (90) |
| Предшествующая лучевая терапия, n (%) | |
| Не было | 15 (50) |
| Было | 15 (50) |
В Таблицах 4a и 4b показаны число (N) пациентов, подвергавшихся воздействию каждой дозы ET-743, длительность лечения и интенсивность дозы.
| Таблица 4aЛечебное воздействие: длительность лечения и интенсивность дозы | |||
| ЕТ-7430,4 мг/м2 (N=3) | ЕТ-7430,6 мг/м2 (N=3) | ЕТ-7430,75 мг/м2 (N=3) | |
| Общая продолжительность лечения, недели | |||
| Среднее (SD) | 39,4 (37,4) | 31,5 (37,1) | 24,2 (31,7) |
| Медиана | 24,0 | 14,4 | 6,0 |
| Разброс | 12,1-82,0 | 6,0-74,0 | 5,9-60,9 |
| Общее количество циклов | |||
| Среднее (SD) | 13,0 (12,3) | 10,0 (12,2) | 7,7 (9,8) |
| Медиана | 8,0 | 4,0 | 2,0 |
| Разброс | 4-27 | 2-24 | 2-19 |
| Суммарная относительная интенсивность дозы ЕТ-743 | |||
| Среднее (SD) | 1,1 (0,2) | 0,9 (0,1) | 1,0 (0,0) |
| Медиана | 1,0 | 1,0 | 1,0 |
| Разброс | 1,0-1,3 | 0,8-1,0 | 0,9-1,0 |
| Суммарная относительная интенсивность дозы PLD | |||
| Среднее (SD) | 0,9 (0,1) | 0,9 (0,1) | 0,9 (0,2) |
| Медиана | 1,0 | 1,0 | 1,0 |
| Разброс | 0,8-1,0 | 0,8-1,0 | 0,7-1,0 |
| Таблица 4bЛечебное воздействие: длительность лечения и интенсивность дозы | ||||
| ЕТ-743 0,9 мг/м2 (N=3) | ЕТ-743 1,1 мг/м2 (N=12) | ЕТ-743 1,3 мг/м2 (N=6) | Всего (N=30) | |
| Общая продолжительность лечения, недели | ||||
| Среднее (SD) | 6,0 (0,0) | 14,6 (11,1) | 25,7 (11,3) | 21,1 (20,5) |
| Медиана | 6,0 | 11,1 | 25,5 | 13,0 |
| Разброс | 6,0-6,0 | 3,0-42,0 | 7,1-39,9 | 3,0-82,0 |
| Общее количество циклов | ||||
| Среднее (SD) | 2,0 (0,0) | 4,8 (3,8) | 8,2 (3,8) | 6,8 (6,7) |
| Медиана | 2,0 | 3,5 | 8,0 | 4,0 |
| Разброс | 2-2 | 1-14 | 2-13 | 1-27 |
| Суммарная относительная интенсивность дозы ЕТ-743 | ||||
| Среднее (SD) | 1,1 (0,0) | 0,9 (0,1) | 0,8 (0,1) | 0,9 (0,1) |
| Медиана | 1,0 | 0,9 | 0,7 | 1,0 |
| Разброс | 0,9-1,0 | 0,8-1,0 | 0,7-1,0 | 0,7-1,3 |
| Суммарная относительная интенсивность дозы PLD | ||||
| Среднее (SD) | 1,0 (0,0) | 0,9 (0,1) | 0,8 (0,1) | 0,9 (0,1) |
| Медиана | 1,0 | 0,9 | 0,7 | 0,9 |
| Разброс | 0,9-1,0 | 0,7-1,0 | 0,7-0,9 | 0,7-1,0 |
При лечении самые тяжелые проявления токсичности лекарственного средства 3 и 4 степени были минимальными, ограниченными нейтропенией и повышением уровня трансаминаз. В Табл.5а и 5б показана частота возникновения неблагоприятных реакций 3 и 4 степеней, связанных с приемом лекарственного средства, минимально у 5% пациентов. Включены неблагоприятные реакции, о которых сообщалось в любое время от первой терапевтической дозы до 30 дней после последней терапевтической дозы. Для определения степени токсичности используют общепринятые критерии NCI (Национального института рака).
| Таблица 5aНеблагоприятные реакции, связанные с приемом лекарственного средства | |||
| ЕТ-743 0,4 мг/м2 (N=3) | ЕТ-743 0,6 мг/м2 (N=3) | ЕТ-743 0,75 мг/м2 (N=3) | |
| Общее число пациентов с неблагоприятными реакциями, связанными с приемом лекарственного средства, 3/4 степени | 0 | 1 | 0 |
| Печень и билиарная система | 0 | 0 | 0 |
| Повышена аланин аминотрансфераза | 0 | 0 | 0 |
| Повышена сывороточная глутамат-оксалацетат трансаминаза | 0 | 0 | 0 |
| Другие | 0 | 1 | 0 |
| Ладонно-подошвенная эритродизестезия | 0 | 0 | |
| Аллергическая реакция | 0 | 0 | 0 |
| Тошнота | 0 | 1 | 0 |
| Таблица 5bНеблагоприятные реакции, связанные с приемом лекарственного средства | ||||
| ЕТ-743 0,9 мг/м2 (N=3) | ЕТ-743 1,1 мг/м2 (N=12) | ЕТ-743 1,3 мг/м2 (N=6) | Всего (N=30) | |
| Общее число пациентов с неблагоприятными реакциями, связанными с приемом лекарственного средства, 3/4 степени | 0 | 10 | 6 | 17 |
| Печень и билиарная система | 0 | 6 | 3 | 9 |
| Повышена аланин аминотрансфераза | 0 | 6 | 3* | 9 |
| Повышена сывороточная глутамат-оксалацетат трансаминаза | 0 | 1 | 2* | 3 |
| Другие | 0 | 4 | 2 | 7 |
| Ладонно-подошвенная эритродизестезия | 0 | 2 | 2 | 4 |
| Аллергическая реакция | 0 | 2 | 0 | 2 |
| Тошнота | 0 | 1 | 0 | 2 |
| * DLT (токсичность, ограничивающая дозу): 2 пациента испытывали 4 степень подъема аланин аминотрансферазы во время цикла 1. |
Кроме того, в Таблицах 6a и 6b представлены тяжелые неблагоприятные реакции, связанные с приемом лекарственного средства.
| Таблица 6aТяжелые неблагоприятные реакции, связанные с приемом лекарственного средства | |||
| ЕТ-7430,4 мг/м2 (N=3) | ЕТ-7430,6 мг/м2 (N=3) | ЕТ-7430,75 мг/м2 (N=3) | |
| Общее число пациентов с тяжелыми неблагоприятными реакциями | 0 | 0 | 0 |
| Тошнота/Рвота | 0 | 0 | 0 |
| Таблица 6bТяжелые неблагоприятные реакции, связанные с приемом лекарственного средства | ||||
| ЕТ-743 0,9 мг/м2 (N=3) | ЕТ-743 1,1 мг/м2 (N=12) | ЕТ-743 1,3 мг/м2 (N=6) | Всего (N=30) | |
| Общее число пациентов с тяжелыми неблагоприятными реакциями | 0 | 1 | 0 | 1 |
| Тошнота/Рвота | 0 | 1 | 0 | 1 |
Из 18 пациентов, которым отменили лечение, только один пациент закончил лечение вследствие неблагоприятной реакции, связанной с приемом лекарственного средства (Таблицы 7a и 7b).
| Таблица 7aОтмена лечения пациенту/Причины прекращения лечения | |||
| ЕТ-743 0,4 мг/м2 (N=3) | ЕТ-743 0,6 мг/м2 (N=3) | ЕТ-743 0,75 мг/м2 (N=3) | |
| 1(27+) | 1(24+) | 1(19+) | |
| Ongoing (Cycles) | |||
| 2 | 2 | 2 | |
| Закончено | |||
| Летальный исход | 0 | 0 | 0 |
| Неблагоприятные реакции, связанные с приемом лекарственного средства (ладонно-подошвенный синдром) | 0 | 0 | 0 |
| Прогрессированиезаболевания | 2 | 1 | 2 |
| Выбор пациента | 0 | 1 | 0 |
| Таблица 7bОтмена лечения пациенту/Причины прекращения лечения | ||||
| ЕТ-743 0,9 мг/м2 (N=3) | ЕТ-743 1,1 мг/м2 (N=12) | ЕТ-743 1,3 мг/м2 (N=6) | Всего (N=30) | |
| 0 | 6(8+) | 3(13+) | 12 | |
| Ongoing (Cycles) | ||||
| 3 | 6 | 3 | 18 | |
| Закончено | ||||
| Летальный исход | 0 | 0 | 1 | 1 |
| Неблагоприятные реакции, связанные с приемом лекарственного средства (ладонно-подошвенный синдром | 0 | 1 | 0 | 1 |
| Прогрессирование заболевания | 3 | 5 | 2 | 15 |
| Выбор пациента | 0 | 0 | 0 | 1 |
У пяти пациентов, трех с саркомой мягких тканей и по одному с раком яичников и раком тканей головы и шеи, был частичный ответ. Четырнадцать (14) дополнительных пациентов (пять с саркомой и по одному с карциноидной опухолью, раком поджелудочной железы, мочевого пузыря, тканей головы и шеи, щитовидной железы, груди, желудка, мелкоклеточным раком легких и раком яичников) имели стабильное заболевание в течение >3 месяцев (Таблица 8a и 8b).
| Таблица 8aНаилучший суммарный ответ | |||
| Наилучший ответ | ЕТ-743 0,4 мг/м2 (N=3) | ЕТ-743 0,6 мг/м2 (N=3) | ЕТ-743 0,75 мг/м2 (N=3) |
| Частичный ответ | 1 Саркома | 0 | 0 |
| Стабильное заболевание | 1 Поджелудочной железы | 1 Саркома | 1 Щитовидной железы |
| 1 Пузырь | |||
| 1 Ткани головы и шеи | |||
| 1 Карциноидная опухоль |
| Таблица 8bНаилучший суммарный ответ | |||
| Наилучший ответ | ЕТ-743 0,9 мг/м2 (N=3) | ЕТ-743 1,1 мг/м2 (N=12) | ЕТ-743 1,3 мг/м2 (N=6) |
| Частичный ответ | 0 | 1 Саркома (Незрелая нейроэктодермальная опухоль) | 1 Папиллярно-серозная аденокарцинома |
| 1 Саркома | |||
| 1 Ткани головы и шеи | |||
| Стабильное заболевание | 0 | 3 Саркома | 1 Яичников |
| 1 Груди | |||
| 1 Желудка | |||
| 1 Мелкоклеточный рак легких | 1 Саркома |
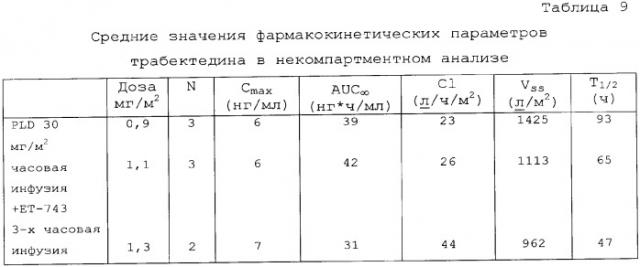
Сопутствующее введение PLD не оказывало влияния на фармакокинетические параметры (PK) трабектедина. Исходя из предварительного фармакокинетического анализа величины CL трабектедина (системный клиренс после внутривенной дозы), t 1/2 (период полувыведения) и Vss (выраженный объем распределения в равновесном состоянии) находятся в пределах диапазона, наблюдаемого при введении одного трабектедина (данные гистологического контроля) (см. чертеж Таблица 9).
Из этого исследования авторы изобретения делают вывод о том, что MTD трабектедина составляет 1,1 мг/м2 при введении в комбинации с 30 мг/м2 PLD. Было показано, что эта комбинация хорошо переносится, когда оба лекарственных средства вводят в полных (или близких к полным) терапевтических дозах в течение длительных периодов времени. Рекомендуемая доза в этом комбинированном лечении составляет 1,1 мг/м2 трабектедина плюс 30 мг/м2 PDL.
Кроме того, было показано, что сопутствующее введение PDL явным образом не влияло на фармакокинетические параметры трабектедина.
1. Способ лечения организма человека от ракового заболевания, включающий введение терапевтически эффективного количества пегилированной липосомальной формы антрациклина доксорубицина (ПЛФД), в комбинации с терапевтически эффективным количеством ЕТ-743.
2. Способ по п.1, где указанные терапевтически эффективные количества ЕТ-743 и ПЛФД вводят как часть одного и того же лекарственного средства.
3. Способ по п.1, где указанные терапевтически эффективные количества ЕТ-743 и ПЛФД предоставляют в виде отдельных лекарственных средств для введения в разное время.
4. Способ по п.3, где указанное терапевтически эффективное количество ПЛФД вводят перед введением указанного эффективного терапевтического количества ЕТ-743.
5. Способ по п.2, где указанные терапевтически эффективные количества ПЛФД и Е-743 вводят путем внутривенной инъекции.
6. Способ по п.3, где указанные терапевтически эффективные количества ПЛФД и Е-743 вводят путем внутривенной инъекции.
7. Способ по п.4, где указанные терапевтически эффективные количества ПЛФД и Е-743 вводят путем внутривенной инъекции.
8. Способ по п.7, где время инфузии для внутривенной инъекции составляет вплоть до 6 ч для указанного терапевтически эффективного количества ПЛФД и вплоть до 24 ч для указанного терапевтически эффективного количества ЕТ-743.
9. Способ по п.8, где время инфузии для внутривенной инъекции составляет 1-2 ч для указанного терапевтически эффективного количества ПЛФД и около 3 ч для указанного терапевтически эффективного количества ЕТ-743.
10. Способ по п.7, где инфузии проводят с интервалом от 3 до 4 недель.
11. Способ по п.8, где инфузии проводят с интервалом от 3 до 4 недель.
12. Способ по п.9, где инфузии проводят с интервалом от 3 до 4 недель.
13. Способ по любому из пп.1-12, где терапевтически эффективное количество ПЛФД вводят в дозе до 50 мг/м2 с последующим введением терапевтически эффективного количества ЕТ-743 в дозе до 1,3 мг/м2.
14. Способ по п.13, где указанное терапевтически эффективное количество ПЛФД вводят в дозе 30-40 мг/м2 за время инфузии 1-2 ч с последующим введением терапевтически эффективного количества ЕТ-743 в дозе примерно 1,1 мг/м2 за время инфузии около 3 ч.
15. Способ по п.14, где указанное терапевтически эффективное количество ПЛФД вводят в дозе примерно 30 мг/м2 за время инфузии около 1 ч с последующим введением указанного терапевтически эффективного количества ЕТ-743 в дозе примерно 1,1 мг/м2 за время инфузии около 3 ч.
16. Способ по п.13, где пациент страдает раковым заболеванием, выбранным из саркомы мягких тканей и рака головы и шеи.
17. Способ по п.13, где пациент имеет рак яичников.
18. Способ по п.14, где пациент страдает раковым заболеванием, выбранным из саркомы мягких тканей и рака головы и шеи.
19. Способ по п.14, где пациент имеет рак яичников.
20. Способ по п.15, где пациент страдает раковым заболеванием, выбранным из саркомы мягких тканей и рака головы и шеи.
21. Способ по п.15, где пациент имеет рак яичников.
22. Применение ЕТ-743 для изготовления лекарственного средства для эффективного лечения организма человека от ракового заболевания с помощью комбинированной терапии с использованием ЕТ-743 с пегилированной липосомальной формой антрациклина доксорубицина (ПЛФД).
23. Применение ПЛФД для изготовления лекарственного средства для эффективного лечения организма человека от ракового заболевания с помощью комбинированной терапии с использованием ПЛФД с ЕТ-743.
24. Применение по п.22, где комбинация ЕТ-743 с ПЛФД является синергетической.
25. Применение по п.23, где комбинация ЕТ-743 с ПЛФД является синергетической.
26. Применение по любому из пп.22-25, где ЕТ-743 образует часть того же лекарственного средства или предоставлено в виде отдельного лекарственного средства для введения в одно и то же время или в разное время с ПЛФД.
27. Применение по п.26, где пациент страдает раковым заболеванием, выбранным из саркомы мягких тканей, рака яичников и рака тканей головы и шеи.
28. Композиция для лечения организма человека от ракового заболевания, содержащая ЕТ-743 и ПЛФД, которая является эффективной при сниженной токсичности по сравнению с токсичностью, наблюдаемой при использовании комбинации ЕТ-743 и доксорубицина.
29. Медицинский набор для введения ЕТ-743 в комбинации с ПЛФД, включающий ЕТ-743 в лекарственных формах по меньшей мере для одного цикла, где лекарственная форма содержит соответствующее количество ЕТ-743 для установленного лечения и фармацевтически приемлемый носитель, и печатные инструкции по приему ЕТ-743 в соответствии с режимом дозирования.
30. Способ повышения противоопухолевой эффективности ЕТ-743 при лечении организма человека от ракового заболевания, включающий введение эффективного терапевтического количества ЕТ-743 в комбинации с эффективным терапевтическим количеством ПЛФД.
31. Способ максимального увеличения переносимой дозы ЕТ-743 при лечении организма человека от ракового заболевания, включающий введен