Производные бензотрополона, фармацевтическая композиция, способ ингибирования репликации вирусов
Иллюстрации
Показать всеНастоящее изобретение относится к новым производным бензотрополона общей структурной формулы (А), а также к их фармацевтически приемлемым солям, обладающим ингибирующей активностью в отношении репликации вируса ВИЧ-1, к фармацевтической композиции на их основе и к способу ингибирования репликации вируса ВИЧ-1.
где R1 представляет собой водород; R2 представляет собой OC1-6алкил; R3, R4, R5 каждый независимо представляет собой водород; G выбирают из группы, состоящей из структур I, II; R6 представляет собой водород;
R7 представляет собой группу (CH2)bCOOR9, где b принимает целые значения от 1 до 5; R8 выбирают C1-6алкила, замещенного одним или более атомами галогена; W выбирают из O; R9 выбирают из водорода, C1-6алкила. Структуры I, II представлены в формуле изобретения. 3 н. и 1 з.п. ф-лы, 6 ил.
Реферат
Настоящее изобретение описывает новые химические соединения, фармацевтические композиции и способы для лечения или предотвращения вирусной инфекции. В частности, изобретение описывает соединения бензотрополона, их фармацевтически приемлемые соли, которые являются полезными для предотвращения или лечения болезненных состояний млекопитающих, вызываемых репликацией вирусов, экспрессирующих металлосодержащие ферменты.
Вирусы являются этиологическими агентами, вызывающими огромное количество заболеваний у млекопитающих и других групп животных. Не являясь живым существом в полном смысле этого слова, вирус способен к расширенному самовоспроизведению (репликации) только в том случае, если он проникает в чувствительную к нему клетку. Такая репликация вируса, наносящая вред клеткам млекопитающего или другого организма, где данная репликация происходит, является причиной возникновения вирусной инфекции, способной причинить значительный вред здоровью млекопитающего или вызвать его преждевременную смерть. Профилактика или лечение вирусной инфекции, таким образом, должна быть направлена на предотвращение или замедление репликации вируса.
Такое предотвращение или замедление может быть достигнуто путем ингибирования ферментативных систем, задействованных в процессе репликации вируса. Эти ферментативные системы могут быть разделены на вирус-специфичные ферментативные системы и ферментативные системы клетки-хозяина. Ингибирование ферментативных систем клетки-хозяина может вызвать целый ряд побочных эффектов, так как эти системы могут быть задействованы в поддержании жизненно-важных для живой клетки функций. В то же время ингибирование вирус-специфичных ферментов, т.е. тех, которые появляются в клетке только после проникновения в нее вирусной частицы, представляется наиболее избирательным методом ингибирования репликации вируса.
Независимо от типа вируса механизм репликации обязательно задействует один или более вирус-специфичный фермент, производящий синтез полинуклеотидных последовательностей или манипуляцию с ними. Так, например, РНК-содержащие вирусы, такие как вирус гриппа (A, B, C), вирус гепатита C, калицивирусы, коронавирусы и др., используют РНК-зависимую РНК полимеразу для синтеза последовательности РНК на матрице вирусной РНК. Ретровирусы используют РНК-зависимую ДНК полимеразу (обратную транскриптазу, ревертазу) для синтеза вирусной ДНК на матрице вирусной РНК. Кроме того, в цикле репликации ретровирусов задействована интеграза, производящая встраивание вирусной ДНК в последовательность ДНК клетки-хозяина.
Вирус-специфичные ферменты, производящие синтез полинуклеотидных последовательностей и манипуляции с ними, имеют активный центр, содержащий от одного и более ионов двухвалентного металла, как правило - магния. Такие ионные активные центры осуществляют разрыв или образование фосфорно-эфирных связей в молекулах нуклеиновых кислот. Блокирование ионных центров ведет к ингибированию активности фермента и, как следствие, ингибированию репликации вируса.
В настоящее время существует множество доступных противовирусных препаратов, способных противодействовать инфекции. Так, для противодействия ретровирусной инфекции, вызываемой ВИЧ используются конкурентные ингибиторы аспартильной протеазы (например, саквинавир, индинавир, ритонавир, нелфинавир и ампренавир), нуклеотидные ингибиторы обратной транскриптазы (зидовудин, диданозин, ставудин, ламивудин и абакавир), ненуклеотидные ингибиторы обратной транскриптазы (невирапин, делавирдин, эфавиренц). Для противодействия вирусам гриппа A используются ингибиторы нейраминидазы (озельтамивир, занамивир), ингибиторы ионных каналов (римантадин, амантадин). Для противодействия инфекции, вызываемой герпесвирусами и цитомегаловирусом, используют ацикловир и ганцикловир. Однако эффект от препаратов является временным, поскольку вирус легко вырабатывает устойчивость ко всем известным агентам. Кроме того, есть большое количество вирусных инфекций, для противодействия которым до сих пор не разработано специфичных антивирусных средств (гепатит C, гепатит B, лихорадка Западного Нила и др.).
Многие антивирусные лекарственные средства обладают побочными токсическими эффектами. В действительности приблизительно 50% пациентов в конечном счете не воспринимают антивирусную терапию. Неудачи в лечении в большинстве случаев вызваны появлением вирусной устойчивости. Вирусная устойчивость, в свою очередь, вызвана быстрым оборотом вируса при проявлении инфекции в сочетании с высокой скоростью вирусных мутаций. При этих обстоятельствах неполная вирусная супрессия, вызванная недостаточной активностью лекарственного средства, - недостаточный отклик на множество сложных лекарственных средств, так же как и внутренние фармакологические барьеры при взаимодействии формируют основу для появления устойчивости вируса к лекарственным веществам. Появление новых штаммов известных вирусов, устойчивых к стандартной антивирусной терапии, наряду с наличием огромного количества вирусных инфекций, для которых специфическая терапия вообще не разработана, делает разработку новых противовирусных средств крайне необходимой.
Технической задачей настоящего изобретения является поиск новых соединений и лекарственных средств, обладающих антивирусной активностью.
Для решения этой задачи заявителем были созданы новые химические соединения на основе производных бензотрополона.
В настоящее время нет известных противовирусных лекарственных средств, на основе производных бензотрополона, описываемых в настоящем изобретении. Некоторые производные бензотрополона были описаны, как имеющие иную, терапевтически полезную активность.
Так, патент WO 92/20332 описывает фармацевтические композиции, содержащие пурпурогаллин
и его моно и диглюкозиды как антиоксиданты и цитопротекторы.
В патенте US 2006/0241154 описана пурпурогаллинкарбоновая кислота
и некоторые другие природные и синтетические бензотрополоны в качестве эффективных антиоксидантов и противовоспалительных средств.
Патент US 5650439 описывает природный бензотрополон состава:
как эффективный ингибитор катехоламин-O-метилтрансферазы.
Патент JP 2004-359575 описывает бензотрополоны вида:
и похожие соединения, как вещества, индуцирующие процесс апоптоза злокачественных клеток и пригодные для химиотерапии раковых заболеваний.
Имеется ряд публикаций, описывающих производные бензотрополона, как потенциальные лекарственные вещества.
В статье "Ингибирование метилирования эстрадиола бензотрополонами: кинетика и моделирование in silico" (Bioorganic and Medicinal Chemistry, Vol.13, p.2501-2507, 2005) авторы описывают природные и синтетические производные бензотрополона, которые являются ингибиторами метилирования гидроксиэстрадиола катехоламин-О-метилтрансферазой.
В статье "Новые производные трополона, повреждающие ДНК, выделенные из Goupia glabra" (Eur. J. Med. Chem., 2003, p.4243-4247) авторы описывают выделение бензотрополона:
и его действие в качестве генотоксина, а также его возможное применение в качестве противоракового лекарственного средства.
В статье "Открытие, характеризация и изучение соотношения структура-активность полифенолов, вызывающих апоптоз и воздействующих на белки В-cell Lyphocyte/Leukemia-2" (J. Med. Chem., Vol.46, p.4259-4264, 2003) было показано, что пурпурогаллин и его производные способны вызывать апоптоз злокачественных клеток.
Некоторые производные бензотрополона образуются в результате окисления катехиновых соединений при ферментации в процессе приготовления черного чая. Такие соединения получили название теафлавины, причем их доля может составлять до 2-6% от сухого веса качественного черного чая.
Недавно теафлавины привлекли значительное внимание, поскольку обнаружилось, что они обладают богатым спектром биологической активности, включая следующие воздействия на организм:
противовоспалительное и цитотоксическое (Bioorganic and Medicinal Chemistry, Vol.12, p.459-467, 2004);
антимутагенное (Mutat. Res. Vol.389, p.167, 1997);
подавление активности изоформы цитохрома Р450 1А1 в клеточной культуре (Agric. Food Chem., Vol.50, p.213, 2002);
антикластогенный эффект на клетках костного мозга мышей (Life Sci., Vol.69, р.2735, 2001);
подавление межклеточных взаимодействий и развития клеток (Carcinogenesis, Vol.20, р.733, 1999);
противовоспалительное и профилактическое противораковое действие (Biochem. Pharm., Vol.59, р.59, 2000).
Все перечисленные публикации не описывают предлагаемые заявителем производные бензотрополона, их фармацевтически приемлемые соли; фармацевтические композиции на их основе, предназначенные для ингибирования репликации вирусов, экспрессирующих металлосодержащие ферменты.
Методы получения производных бензотрополона (или их выделения из природных источников) известны и были опубликованы в соответствующей научной литературе (J. Am. Chem. Soc, Vol.52, 1930, р.3647; J. Chem. Soc., 1948, р.117; J. Chem. Soc., 1951, p.1313; J. Cem. Soc., 1951, p.1318; J. Chem. Soc., 1951, p.1325; J. Chem. Soc., 1952, p.3705; J. Chem. Soc. Japan (Pure Chem. Sect.), Vol.75, 1954, p.620; J. Chem. Soc. Japan (Pure Chem. Sect.), Vol.77, 1956, p.305; Chem., Bd.69, 1957, p.723; Naturforsch., Bd.l4b, 1959, p.742; Chem. Ber., Bd.97, 1964, p.307; Chem. Ber., Bd.97, 1964, p.312; Chem., Bd.98, 1967, p.872; Tetrahedron, Vol.23, 1967, p.2829; Eur. J. Org. Chem., 2003, p.4243).
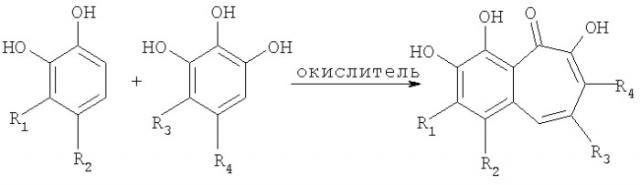
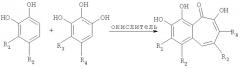
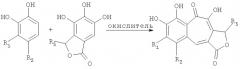
В соответствии с одним из методов, бензотрополоновое ядро может быть получено совместным окислением смеси катехоловой и пирогаллоловой компонент подходящим окислителем в водной или органической или водно-органической среде:
или
Предпочтительным окислителем является иодат калия или натрия, но многие другие органические и неорганические окислители также пригодны для проведения этой реакции: феррицианид калия, перекись водорода, перекись водорода в присутствии ферментов каталазы или пероксидазы, азотная кислота, висмутат натрия, висмутат калия, полифенолоксидаза, бихромат калия, перманганат калия, феррат бария, пара-бензохинон, тетрахлор-орто-бензохинон, тетрабром-орто-бензохинон и т.д.
Имея синтезированное бензотрополоновое ядро, другие производные бензотрополона, описанные в настоящем изобретении могут быть приготовлены стандартными методами органической химии - электрофильным замещением в бензотрополоновом ядре, модификацией функциональных групп - окислением, восстановлением, снятием защитных групп, образованием или гидролизом сложных или простых эфиров, амидов, оксимов, гидроксамовых кислот, сульфамидов и т.д.
В настоящем изобретении, если не определено иное, используются следующие определения.
«С1-6алкил» представляет собой алкильную группу, содержащую неразветвленную или разветвленную углеводородную цепь, содержащую от 1 до 6 атомов углерода, например метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил и так далее.
«OC1-6алкил представляет собой алкоксильную группу, содержащую неразветвленную или разветвленную углеводородную цепь, содержащую от 1 до 6 атомов углерода, например метокси, этокси, н-пропокси, изопропокси и так далее.
«C1-6алкил, замещенный одним или более атомами галогена», представляет собой алкильную группу, содержащую неразветвленную или разветвленную углеводородную цепь, содержащую от 1 до 6 атомов углерода, замещенную одним или более атомами галогена, например фторметил, дифторметил, трифторметил, хлорметил, дихлорметил, трихлорметил и так далее.
«ОС1-6алкил, замещенный одним или более атомами галогена» представляет собой алкоксильную группу, содержащую неразветвленную или разветвленную углеводородную цепь, содержащую от 1 до 6 атомов углерода, замещенную одним или более атомами галогена, например фторметокси, дифторметокси, трифторметокси, хлорметокси и так далее.
«Галоген» означает хлор, бром, йод или фтор.
Фармацевтически приемлемой может считаться любая соль, образуемая активным соединением Формулы (А), если она не токсична и не препятствует адсорбции и фармакологическому действию активного соединения. Эта соль может быть получена действием на соединение Формулы (А) органического или неорганического основания, такого как гидроксид натрия, гидроксид калия, гидроксид аммония, метиламин, этиламин и тому подобных.
Термин "фармацевтически приемлемый носитель" означает, что носитель должен являться совместимым с другими ингредиентами композиции и не наносить вреда его реципиенту, то есть быть нетоксичным для клеток или млекопитающих в тех дозах и концентрациях, в которых его применяют. Часто фармацевтически приемлемый носитель представляет собой водный рН буферный раствор. Примеры физиологически приемлемых носителей включают буферы, такие как фосфаты, цитраты и другие соли органических кислот, антиоксиданты, включающие аскорбиновую кислоту; полипептиды с низким молекулярным весом (меньше 10 остатков); протеины, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глютамин, аспарагин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатообразующие агенты, такие как ЭДТА; сахарные спирты, такие как маннитол или сорбитол.
Терапевтически эффективное количество - это количество, необходимое для достижения эффекта подавления репликации ВИЧ в организме млекопитающего.
«Млекопитающее», как используется здесь, включает в себя представителей отряда приматов (например, человек, человекообразные обезьяны, нечеловекообразные обезьяны, низшие обезьяны), отряда хищных (например, кошки, собаки, медведи), отряда грызунов (например, мышь, крыса, белка), отряда насекомоядных (например, землеройка, крот) и др.
В результате решения указанной выше технической задачи заявитель предлагает к защите новые химические соединения - производные бензотрополона общей структурной формулы (А),
где R1 представляет собой водород;
R2 представляет собой OC1-6алкил;
R3, R4, R5 каждый независимо представляет собой водород;
G выбирают из группы, состоящей из (структуры I-II):
где k=0, 1;
R6 представляет собой водород;
R7 представляет собой группу (CH2)bCOOR9;
R8 выбирают из С1-6алкила, замещенного одним или более атомами галогена;
W представляет собой О;
R9 выбирают из водорода, C1-6алкила;
b принимает целые значения в диапазоне от 1 до 5;
или их фармацевтически приемлемые соли.
Наиболее предпочтительными являются производные бензотрополона или их фармацевтически приемлемые соли, где
R1 представляет собой водород;
R2 выбирают из ОСН3;
R3, R4, R5 представляют собой водород;
G представляет собой структуру (I);
R6 представляет собой водород;
R7 представляет собой CH2Y;
где Y выбирают из группы, состоящей из СООН, СООС1-6алкил.
В настоящем изобретении описывается также фармацевтическая композиция, предназначенная для лечения и/или профилактики болезненных состояний, вызываемых репликацией в организме млекопитающего вирусов, экспрессирующих в процессе жизненного цикла металлосодержащие ферменты, содержащая терапевтически эффективное количество производного бензотрополона по пункту 1 или его фармацевтически приемлемой соли, и фармацевтически приемлемый носитель.
Активный ингредиент в таких составах включает от 0.1 процента до 99.9 процента от массы состава, предпочтительно от 5 до 90 процента.
Фармацевтические композиции могут быть получены в соответствии с известными методиками, использующими известные и легко получаемые ингредиенты. Такие композиции по настоящему изобретению могут быть разработаны, чтобы обеспечить быстрое, устойчивое или замедленное введение активного ингредиента после введения пациенту в соответствии с применяемыми процедурами, известными среднему специалисту. При получении фармацевтической композиции активный ингредиент обычно смешивают с носителем или разбавляют носителем или заключают в носитель, который может быть в форме капсулы, драже или в таблетированной форме. Когда носитель является разбавителем, то он может быть твердым веществом, полутвердым или жидким материалом, который действует как связующее средство или инертный наполнитель для активного ингредиента.
Таким образом, лекарственные средства на основе фармацевтических композиций могут быть в форме таблеток, пилюль, порошков, шариков,, суспензий, эмульсий, растворов, сиропов, аэрозолей, мягких и твердых капсул желатина, свечей, растворов для инъекций и т.п. Лекарственные средства и фармацевтические композиции изготавливаются обычными технологическими методами. Лекарственные средства могут применяться в качестве внутренних или наружных медицинских средств. Лекарственные средства могут применяться перорально, парэнтерально или интраназально.
При применении соединений, описанных в настоящем изобретении в составе фармацевтических композиций, они могут быть смешаны с подходящими добавками, инертными наполнителями, разбавителями, диспергирующими веществами, стабилизаторами, консервантами, буферными составами, эмульгаторами, отдушками, красителями, подсластителями, и другими известными фармацевтическими добавками, такими как вода, растительные масла, спирты (например, этанол, бензиловый спирт и т.д.), полиэтиленгликоль, триацетат глицерина, желатин, полиэтоксилированные растительные масла, углеводы (например, лактоза, крахмал), стеарат магния, тальк, ланолин, петролатум и т.п.
Настоящее изобретение охватывает также способ ингибирования репликации вирусов, экспрессирующих в процессе жизненного цикла металлосодержащие ферменты, включающий введение млекопитающим терапевтически эффективного количества соединения по п.1 или его фармацевтически приемлемой соли.
Описываемые в настоящем изобретении производные бензотрополона формулы (А) способны блокировать ионные центры ферментов путем образования хелатных комплексов с одним или более ионами, например, ионами магния. Таким образом, ингибируя активность металлсодержащих вирус-специфичных ферментов, описываемые в настоящем изобретении производные бензотрополона формулы (А) ингибируют репликацию вирусов и могут использоваться как противовирусные средства.
На основе настоящего изобретения описывается также способ лечения и/или профилактики болезненных состояний млекопитающих, вызываемых репликацией в организме вирусов, экспрессирующих в процессе жизненного цикла металлосодержащие ферменты, включающий введение млекопитающему терапевтически эффективного количества соединения по п.1 или его фармацевтически приемлемой соли.
Применяемые дозы зависят от возраста млекопитающего, его веса, симптомов, эффекта от лечения, метода введения и т.п. Обычно дозы составляют от 0.1 мг до 5 г, предпочтительно от 10 мг до 2 г на одну особь млекопитающего за одно введение. Таких введений может быть от одного до 10 в течение суток, либо перорально, либо путем внутривенных, внутримышечных или подкожных инъекций, либо внутривенных инфузий.
Описание изобретения сопровождается чертежами.
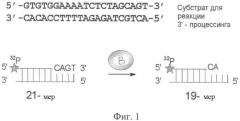
На Фиг.1 схематически изображен 3'-процессинг U5-дуплекса, осуществляемый ВИЧ-1 интегразой.
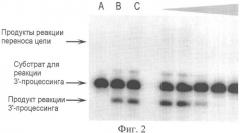
На Фиг.2 показан радиоавтограф денатурирующего полиакриламидного геля, демонстрирующий влияние ингибиторов на 3'-процессинг активность интегразы в соответствии с методикой, описанной далее в Примере 5.
На Фиг.3 показана графическая зависимость ингибирования 3'-процессинга от концентрации ингибитора, получаемая в процессе обработки экспериментальных результатов, в ходе которого определяются параметры экспоненциальной кривой ингибирования первого порядка, наилучшим образом проходящей через экспериментальные точки. Параметры экспоненциальной кривой используются для определения величины IC50 ингибирования 3'-процессинг активности ВИЧ-1 интегразы данным ингибитором.
На Фиг.4 схематически изображен процесс переноса полинуклеотидной цепи, осуществляемый ВИЧ-1 интегразой.
На Фиг.5 показан радиоавтограф денатурирующего полиакриламидного геля, демонстрирующий влияние ингибитора на активность интегразы относительно стадии переноса цепи в соответствии с методикой, описанной далее в Примере 5.
На Фиг.6 показана графическая зависимость ингибирования реакции переноса цепи от концентрации ингибитора, получаемая в процессе обработки экспериментальных результатов, в ходе которого определяются параметры экспоненциальной кривой ингибирования первого порядка, наилучшим образом проходящей через экспериментальные точки. Параметры экспоненциальной кривой используются для определения величины IC50, характеризующей ингибирующую активность данного вещества по отношению к процессу переноса цепи, катализируемому ВИЧ-1 интегразой.
Для того чтобы предмет настоящего изобретения был более понятен, ниже приведены некоторые примеры получения производных бензотрополона (Примеры 1-4) и их использования в качестве ингибиторов интегразы и антивирусных лекарственных соединений. Примеры носят иллюстративный характер, причем содержание данного изобретения ни в коей мере не ограничивается представленными примерами.
Пример 1
Синтез метилового эфира 7-метокси-8,9-дигидроксибензотрополон-4-метиленкарбоновой кислоты:
(i) метиловый эфир 3,4,5-тригидроксифенилуксусной кислоты
Кипятят 1.130 г (5 ммоль) 3,4,5-триметоксифенилуксусной кислоты в 25 мл конц. HBr, в атмосфере аргона на протяжении 12.5 часов. Затем растворитель отгоняют в вакууме (10 Торр, 80-90°С). Остаток сушат в вакууме (2 Торр, 20°С) над NaOH в течение 3 дней. Технический продукт, содержащий 3,4,5-тригидроксифенилуксусную кислоту, растворяют в метаноле (10 мл) и охлаждают до 0÷+5°С. К охлажденному метанольному раствору добавляют 0.51 мл (0.833 г, 7 ммоль) тионилхлорида. Кипятят реакционную смесь с обратным холодильником 2.5 часа, затем растворитель отгоняют, остаток сушат в вакууме (2 Торр, комнатная температура) над NaOH в течение 2 часов. Полученный метиловый эфир 3,4,5-тригидроксифенилуксусной кислоты может быть использован в последующем синтезе без дополнительной очистки.
(ii) метиловый эфир 7-метокси-8,9-дигидроксибензотрополон-4-метиленкарбоновой кислоты
Растворяют метиловый эфир 3,4,5-тригидроксифенилуксусной кислоты, полученный на предыдущей стадии и 0.686 г (4.900 ммоль) 3-метоксипирокатехина в смеси воды (25 мл) и ацетона (5 мл). К полученному раствору при комнатной температуре и интенсивном перемешивании добавляют раствор 1.049 г (4.900 ммоль) иодата калия в 35 мл воды. Реакционная смесь становится коричневой и вскоре начинается выделение углекислого газа и осаждение продукта реакции. Перемешивание продолжают 1.5 часа и затем оставляют реакционную смесь стоять еще 30 минут. Отфильтровывают осадок, промывают его трижды небольшим количеством воды (3×5 мл) и сушат на воздухе.
Технический бензотрополон растворяют в ацетоне и упаривают с 2 мл перлита, высушивают смесь в вакууме 2 мм рт. ст. Загружают смесь в аппарат для непрерывной экстрактивной хроматографии (нейтральный силикагель 100/160, 3 мл) и экстрагируют гексаном 2 суток. Получают 0.300 г (20%) чистого метилового эфира 7-метокси-8,9-дигидроксибензотрополон-4-метиленкарбоновой кислоты. Температура плавления 172-173°С. 1H-ЯМР (500 МГц; ДМСО-д6): δ 3.65 (с, 3Н, 4-СООСН3), 3.60 (с, 2Н, 4-СН2), 3.97 (с, 3Н, 7-ОСН3), 7.09 (с, 1Н, 3-Н), 7.10 (с, 1H, 5-Н), 7.50 (с, 1H, 6-Н), 9.38 (с, 1H, 8(9)-ОН), 9.53 (с, 1Н, 9(8)-ОН), 15.00 (с, 1Н, 2-ОН).
Пример 2
Синтез 7-метокси-8,9-дигидроксибензотрополон-4-метиленкарбоновой кислоты:
Кипятят 0.240 г (0.667 ммоль) метилового эфира 7-метокси-8,9-дигидроксибензотрополон-4-метиленкарбоновой кислоты в смеси 3 мл уксусной кислоты и 0.1 мл конц. соляной кислоты 4 часа, затем упаривают в вакууме (10 Торр) при 90-95°С и сушат на воздухе. Получают 0.129 г (66%) 7-метокси-8,9-дигидроксибензотрополон-4-метиленкарбоновой кислоты. Температура плавления 201-203°С.
Пример 3
Получение натриевой соли 7-метокси-8,9-дигидроксибензотрополон-4-метиленкарбоновой кислоты
Растворяют 0.278 г (1 ммоль) 7-метокси-8,9-дигидроксибензотрополон-4-метиленкарбоновой кислоты в растворе метилата натрия, приготовленном заранее из 0.023 г натрия и 30 мл метанола. Метанол отгоняют на роторном испарителе, остаток сушат в вакууме (10 Торр). Получают 0.3 г натриевой соли 7-метокси-8,9-дигидроксибензотрополон-4-метиленкарбоновой кислоты.
Пример 4
Синтез 7,8,10-тригидрокси-6-метокси-1-трихлорметил-2-оксобензо[f]азулен-3,9-диона
К раствору 0.7 г (5.000 ммоль) о-метоксипирокатехина и 1.498 г (5.000 ммоль) 4,5,6-тригидрокси-3-трихлорметил-3H-изобензофуран-1-она (синтезирован согласно J. Chem. Soc. 119, 208 (1921)) в 6 мл ацетона при перемешивании быстро прибавляют раствор 1.070 г (5 ммоль) иодата калия в 60 мл воды; смесь становится темно-фиолетового цвета, затем начинает выпадать продукт и выделяется диоксид углерода. Перемешивают смесь 1.5 ч, дают постоять без перемешивания 30 мин, отфильтровывают осадок, промывают три раза по 5 мл воды и сушат на воздухе. Технический бензотрополон растворяют в ацетоне и упаривают с 2 мл перлита, высушивают смесь в вакууме (2 Торр) 1 час при 90°С. Загружают смесь в аппарат для непрерывной экстрактивной хроматографии (нейтральный силикагель 100/160, 5 мл) и экстрагируют МТБЭ 7 ч, получают 1.427 г 7,8,10-тригидрокси-6-метокси-1-трихлорметил-2-оксобензо[f]азулен-3,9-диона красного цвета. Его промывают на фильтре два раза по 0.2 мл ацетона, затем три раза по 0.2 мл гексана и сушат на воздухе. Получают 0.588 г (57%) чистого вещества. Температура разложения >253°С. 1H-ЯМР (500 МГц; ДМСО-д6): δ 4.00 (с, 3Н, 6-ОСН3), 6.57 (с, 1H, 1-Н), 7.57 (с, 1Н, 5-Н), 8.19 (с, 1H, 4-Н), 10.15 (уш.с, 1Н, 7(8)-ОН), 11.03 (с, 1H, 8(7)-ОН), 14.50 (с, 1H, 10-ОН).
Приведенные ниже примеры 5-7 иллюстрируют измерения ингибирующей способности описываемых в настоящем изобретении производных бензотрополона по отношению к биохимическим реакциям, катализируемым металлопротеинами, экспрессируемыми вирусами, в частности ВИЧ-1 интегразой, а также измерения ингибирующей способности этих соединений по отношению к репликации ВИЧ в культуре человеческих лимфоидных клеток. Также приводится пример испытания описываемых в настоящем изобретении соединений на острую летальность на мышах при внутрибрюшинном введении.
Пример 5
Способность соединений ингибировать работу ВИЧ-1 интегразы определялась по следующей методике.
Влияние на 3'-процессинг активность интегразы.
Свободная от детергента рекомбинантная ВИЧ-1 интеграза нарабатывалась в культуре Escherichia coli, последующие выделение и очистка производились в соответствии с методикой: Leh, Н., Brodin, P., Bischerour, J., Deprez, Е., Tauc, P., Brochon, J.C., LeCam, E., Coulaud, D., Auclair, C. & Mouscadet, J.F., 2000,
Determinants of Mg2+ -dependent activities of recombinant human immunodeficiency virus type 1 integrase. Biochemistry 39, 9 285-9294. В олигонуклеотид U5B (10 pmol) была введена радиоактивная метка при помощи Т4 полинуклеотидкиназы (Fermentas) и 50 µCi [γ-32Р]АТР (3000 Ci/mmol). После инкубации при 37°С в течение 1 часа Т4 полинуклеотидкиназа инактивировалась добавлением EDTA и нагреванием до 65°С в течение 5 минут. Затем производился отжиг олигонуклеотида U5B с эквимолярным количеством комплементарного олигонуклеотида U5A. Образовавшийся дуплекс U5B/U5A окончательно отмывался от непрореагировавшего [γ-32Р]АТР на колонке MicroSpin G-25 (Amersham Biosciences).
Влияние на 3'-процессинг активность интегразы в условиях конкурентного ингибирования.
В 10 мкл буфера (20 мМ HEPES 7.5 рН, 1 мМ ДТТ, 7.5 мМ хлорид магния) готовили 3 нМ раствор 32Р-меченого субстрата U5B/U5A, содержащего радиоактивно меченую процессируемую цепь U5B (смесь I) и тестируемый ингибитор в диапазоне концентраций 0.1-100 µМ. 10 мкл 200 нМ раствора интегразы в этом же буфере добавляли к смеси I и выдерживали в термостате 2 часа при температуре 37°С. По завершении реакции к смеси добавляли 80 мкл стоп-смеси (9 мМ Tris-HCl, 6 мМ ЭДТА, 0.4 М СН3COONa, 0.125 мг/мл гликогена), фермент экстрагировали 100 мкл смеси фенол/хлороформ/изоамиловый спирт (25:24:1). Нуклеотидный материал осаждали 5-кратным избытком этилового спирта при температуре 0°С и анализировали с помощью электрофореза в 20%-ном денатурирующем ПААГ с последующей визуализацией геля на приборе STORM 840ТМ Phosphorlmager (Molecular Dynamics, США) и обсчетом средствами программы ImageQuant 4.1. О степени протекания реакции 3'-концевого процессинга судили по появлению на радиоавтографе полосы, соответствующей укороченной на два нуклеотида цепи U5B (19-звенный продукт). По соотношению интенсивностей излучения полос, соответствующих 21- и 19-звенным олигонуклеотидам, определяли эффективность процессинга. По полученным значениям эффективности рассчитывали концентрацию продукта реакции. Данные усредняли по трем независимым экспериментам. Значения IC50 ингибиторов были рассчитаны по экспериментальным зависимостям ингибирования каталитического превращения U5-субстрата интегразы от концентрации взятого ингибитора. При оценке степени превращения субстрата учитывалась суммарная концентрация ДНК, подвергшейся 3'-концевому процессингу, а также следующей за ним стадии переноса цепи - [Р]Σ. Добавление в реакционную смесь ингибитора приводило к снижению суммарной концентрации продуктов вследствие подавления каталитического превращения субстрата. Остаточная концентрация продуктов при добавлении ингибитора в наибольшей взятой концентрации обозначена как [P]fin. Экспериментальные зависимости образования продуктов каталитического превращения U5-субстрата от концентрации ингибитора аппроксимировали экспоненциальной функцией вида:
[P]Σ=[P]fin+А×ехр(-[I]/В),
где [I] и [Р] - общие концентрации ингибитора и суммы продуктов реакции соответственно, а А, В - вычисляемые параметры.
Эмпирические параметры А и В использовались для нахождения значения IC50, были рассчитаны значения IC50 ингибиторов, как
IC50=В×ln(2A/(A-[P]fin)).
Процесс определения IC50 для ингибирования активности 3'-процессинга ВИЧ-1 интегразы проиллюстрирован на Фиг.1, 2 и 3, которые демонстрируют полученный гель и графическую зависимость ингибирования 3'-процессинга одним из соединений. На Фиг.2 показан радиоавтограф геля, причем дорожка А соответствует исходной 32Р-меченой олигонуклеотидной цепи, дорожка В соответствует продуктам реакции в присутствии интегразы без добавления ингибитора и ДМСО, дорожка С - продуктам реакции в присутствии интегразы без добавления ингибитора, но в присутствии 10% ДМСО. Остальные дорожки соответствуют продуктам реакции в присутствии интегразы и ингибитора в последовательно увеличивающихся концентрациях (показано треугольником). Так как измерения с участием ингибиторов проводятся в присутствии 10% (объемных) ДМСО, то эксперимент, представленный дорожкой С необходим для контроля активности интегразы в присутствии 10% ДМСО.
Влияние на 3'-процессинг активность интегразы в условиях предварительно сформированного комплекса ДНК-интеграза.
Для формирования комплекса интегразы с субстратной ДНК 21-звенный меченый субстрат 32P-U5B/U5A (3 нМ) инкубировали вместе со 100 нМ интегразой в течение 30 минут при комнатной температуре в 18 мкл буфера (20 мМ HEPES 7.5 рН, 1 мМ ДТТ, 7.5 мМ хлорид магния). Затем к предварительно сформированному таким образом комплексу интегразы с субстратом добавляли 2 µL раствора ингибитора в возрастающих концентрациях таким образом, чтобы после прибавления раствора концентрация интегразы составила 100 нМ, концентрация субстрата - 3 нМ, а концентрация ингибитора 0.1-100 µМ. После добавления ингибитора реакционная смесь инкубировалась при 37°С в течение 2 часов. Последующие операции аналогичны описанным выше в разделе "Влияние на 3'-процессинг активность интегразы в условиях конкурентного ингибирования".
Влияние на активность интегразы в процессе переноса цепи (strand transfer).
Исследование влияния ингибиторов на процесс переноса полинуклеотидной цепи, катализируемый ВИЧ-1 интегразой проводили в условиях, аналогичных ингибированию 3'-процессинга в конкурентных условиях. Субстрат для изучения процесса переноса цепи представлял собой процессированный аналог U5 дуплекса, меченый 32Р. Концентрация субстрата составляла 10 нМ. Все другие компоненты присутствовали в реакционной смеси в приведенных выше концентрациях (см. раздел "Влияние на 3'-процессинг активность интегразы в условиях конкурентного ингибирования"). Степень конверсии субстрата оценивали по появлению радиоактивных полос, соответствующих полинуклеотидам, обладающим в процессе электрофореза меньшей подвижностью, чем исходная 19-мерная полинуклеотидная цепь. Отношение между радиоактивностью, связанной с этими медленными полосами, и радиоактивностью, содержащейся в полосе, обусловленной наличием исходной 19-мерной полинуклеотидной цепи, использовалось для оценки эффективности реакции переноса цепи. Величина IC50 определялась в соответствии с вышеописанной процедурой (см. раздел "Влияние на 3'-процессинг активность интегразы в условиях конкурентного ингибирования"). Для реакции переноса цепи использовалось уравнение аналогичного вида за исключением того, что в качестве переменной [Р] рассматривалась концентрация только продуктов данной реакции. Процесс определения величины IC50 для ингибирования стадии переноса цепи проиллюстрирован на Фиг.4, 5 и 6. На Фиг.5 представлен радиоавтограф геля, а Фиг.6 представляет графическую зависимость ингибирования стадии переноса цепи от концентрации одного из ингибиторов. На Фиг.5 дорожка А соответствует исходной 32Р-меченой олигонуклеотидной цепи, дорожка В соответствует продуктам реакции в присутствии интегразы без добавления ингибитора и ДМСО, дорожка С - продуктам реакции в присутствии интегразы без добавления ингибитора, но в присутствии 10% ДМСО.
Соединения, описанные в настоящем изобретении, демонстрируют ингибирующую активность в отношении ВИЧ-1 интегразы во всех трех тестах. Некоторые из соединений, описанных в примерах 1-4, характеризуются величинами IC50 менее 5 мкМ во всех трех тестах. Так, для 7-метокси-8,9-дигидроксибензотрополон-4-метиленкарбоновой кислоты (получение см. Пример 2) и ее натриевой соли (получение см. Пример 3) получены IC50=4.8 мкМ.
Пример 6
Ингибирующая активность соединений, описанных в настоящем изобретении, по отношению к репродукции вируса ВИЧ-1 определялась в соответствии с описанной ниже процедурой. Человеческие лимфобластоидные клетки МТ-4 (3.0-5.0·105 клеток на мл) инфицировали вирусом ВИЧ-1 (штамм BRU) в дозе 100 ТЦИД50 и инкубировали затем 5 дней в культуральной среде RPMI 1640, содержащей 10% (объемных) сыворотки новорожденных телят и 100 мкг/мл гентамицина при 37°С в атмосфере, содержащей 5% углекислоты при 98% влажности. Одновременно с внесением ВИЧ-1 инфекции в культуральную среду добавляли тестируемое соединение в виде растворов, полученных в результате последовательного разбавления. По истечении 5 дней количество живых клеток определяли по методу окрашивания трипановым синим. Для тестируемого соединения величина EC50 определялась, как концентрация этого соединения в культуральной среде, при которой происходило подавление на 50% цитопатического эффекта, вызванного размножением вируса в культуре клеток МТ-4.
Соединения, описанные в настоящем изобретении, демонстрируют ингибирующую активность в отношении репликации ВИЧ-1 в культуре лимфобластоидных клеток МТ-4.
Некоторые из соединений, описанных в примерах 1-4, характеризуются величинами ЕС50 менее 10 мкМ в описанном выше тесте на ингибирование репродукции ВИЧ-1. Так, для 7-метокси-8,9-дигидроксибензотрополон-4-метиленкарбоновой кислоты (получение см. Пр