Способ извлечения брома из природных хлоридных вод с получением бромидного концентрата
Иллюстрации
Показать всеИзобретение относится к области технологии неорганических веществ и касается процессов извлечения брома из природных хлоридных вод и рассолов с получением бромидного концентрата. Способ включает окисление бромида до элементарного брома на аноде двухкамерного электролизера, разделенного катионообменной мембраной, после чего отделяют бром от анолита, извлекают бром из фазы носителя контактом с оборотным католитом с последующим восстановлением брома на катоде с получением бромидного солевого концентрата. Исходный бромсодержащий хлоридный раствор подкисляют соляной кислотой до 4-7 г/л. В анодную камеру направляют часть бромсодержащего хлоридного раствора до 10 объемных процентов, которую подкисляют и после анодного окисления объединяют с основной массой бромсодержащего раствора. В католит добавляют бромид железа до общей концентрации железа 5-6 г/л. Бромид железа регенерируют и возвращают в процесс. Технический эффект - повышение безопасности получения бромидного концентрата при переработке бромсодержащих природных хлоридных вод, устранение поставок на производство токсичного хлора, вывоз потребителю нетоксичного бромидного солевого концентрата, снижение реагентных и энергетических затрат. 4 з.п. ф-лы, 4 ил.
Реферат
Изобретение относится к области технологии неорганических веществ и касается процессов извлечения брома из природных хлоридных вод и рассолов с получением бромидных концентратов.
Известен ряд способов извлечения брома из природных вод и рассолов с получением бромидных концентратов, безопасных для транспортировки. В частности, бромид-ион окисляют хлором, выделившийся элементарный бром отдувают воздухом или паром и поглощают из парогазовой смеси щелочными реагентами: гидроксидами или карбонатами щелочных металлов [В.И.Ксензенко, Д.С.Стасиневич. Химия и технология брома, йода и их соединений. М. Химия. 1995 г. С.163]. Недостатками этих процессов являются использование элементарного хлора, завоз которого в труднодоступные районы, где располагаются известные месторождения бромсодержащих рассолов, небезопасен, а также значительный расход щелочных реагентов.
Предложено использовать для окисления брома хлор, получаемый электрохимически на аноде электролизера [патент РФ №98123657, опубликован 2000.12.27], или проводить прямое окисление брома на аноде [патент РФ №2171862, опубликован 2001.08.10]. Однако устранение использования привозного хлора, по предлагаемым способам, не обеспечивает безопасность функционирования предприятий, использующих данные способы, ввиду предусматриваемого вывоза токсичного продукта производства - элементарного брома. Кроме того, предлагаемые способы отличаются повышенным расходом электроэнергии и нерациональным ее использованием, заключающимся в ее расходовании не только на выделение хлора, но и разложение соляной кислоты на катоде с выделением водорода.
Наиболее близким к предлагаемому способу является традиционный, используемый на практике в странах СНГ, процесс извлечения брома с получением бромжелеза [В.И.Ксензенко, Д.С.Стасиневич. Химия и технология брома, йода и их соединений. М. Химия. 1995 г.], который заключается в окислении бромидов хлором, отделении брома от исходного хлоридного раствора отдувкой воздухом или паром (жидкостной экстракцией или сорбцией), поглощении брома бромистым железом и упаркой бромидного раствора на заключительной стадии.
Недостатками способа является необходимость доставки больших количеств токсичного хлора на место переработки бромсодержащих растворов (для России, нередко в труднодоступные районы: Якутия (тр. «Удачная»), Туруханский район и Эвенкия Красноярского края и др.), а при его электрохимическом получении - высокие затраты электроэнергии.
Целью предлагаемого способа является повышение безопасности производства по извлечению брома из природных хлоридных вод, снижение реагентных и энергетических затрат.
Поставленная цель обеспечения безопасности производства достигается за счет устранения поставок на производство токсичного хлора и вывоза потребителю брома в виде солевого концентрата, что обеспечивается анодным окислением бромидов в двухкамерном электролизере, разделенном катионообменной мембранной, селективным переносом брома из исходного раствора (анолита) в католит традиционными методами (отдувкой воздухом или паром, экстракцией, сорбцией), с последующим катодным восстановлением брома в оборотном католите с получением бромистого концентрата.
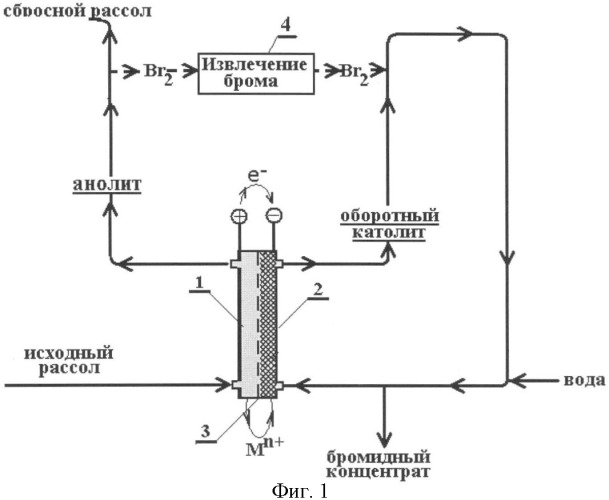
Принципиальная схема процесса приведена на фиг.1.
При непрерывном процессе на электродах протекают реакции:
анод: MBrn(анолит) -ne-→n/2Br2(анолит)+Мn+ (анолит)
катод: n/2Br2(католит) +ne-+Мn+ (католит)→MBrn(католит)
Катион Мn+ переносится из фазы анолита (поз.1, фиг.1) в фазу католита (поз.2) электромиграцией через катионообменную мембрану (поз.3):
Мn+ (анолит)→Мn+ (католит)
бром - посредством гетерофазных процессов на стадиях (поз.4) извлечения, например, экстракцией органическим растворителем и реэкстракцией оборотным католитом.
Многократное снижение или полное устранение реагентных затрат в этом процессе достигается за счет использования природного хлоридного раствора, как поставщика катионов для связывания брома в бромидную соль, а снижение энергетических затрат - за счет совмещения процесса окисления бромидов на аноде электролизера с восстановлением образующегося брома на катоде и значительного концентрирования бромидов в концентрате при использовании оборотного католита в качестве бром поглощающей фазы.
Для повышения эффективности поглощения брома католитом, например, при использовании извлечения брома воздушной отдувкой, в католит добавляют небольшое количество бромида железа (0,05-0,1 моль/л). В этом случае эффективность поглощения брома обеспечивается за счет протекания реакции окисления железа(2+):
2Fe2++Br2→2Fe3++2Br-,
которое регенерируется затем на катоде по реакции:
Fe3++е-→Fe2+
Относительное количество бромида железа в оборотном католите (бромидном концентрате) невелико (0,05-0,1 моль/л, при содержании бромидиона 4-6 моль/л). При необходимости бромный концентрат очищают от железа экстракцией трибутилфосфатом и реэкстракцией его водой.
Для предотвращения образования осадков гидроксидов в катодном пространстве, обусловленного незначительным разложением воды (до 2-5% от общего выхода по току), раствор подкисляют, что может быть достигнуто введением соляной кислоты в исходный хлоридный раствор и переносом катиона водорода через катионообменную мембрану.
Пример 1. Электрохимическое получение бромидного концентрата с применением экстракции брома.
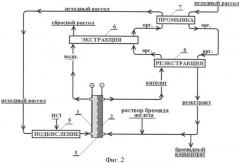
Общая технологическая схема процесса приведена на фиг.2. Установка включает двухкамерный электролизер, включающий анодную (поз.1, фиг.2) и катодную (поз.2) камеры, разделенные катионообменной мембраной (поз.3), лабораторный пятиступенчатый противоточный экстрактор типа «смеситель-отстойник» для проведения процессов экстракции (поз.6), промывки (поз.7) и реэкстракции (поз.8), дозирующие лабораторные насосы.
В качестве анода электролизера используют титановую пластину толщиной 2 мм с оксидным рутений-титановым покрытием ОРТА (площадь электрода 10 см2), в качестве катода -углеграфитовый пористый материал (ватин, толщина электрода 5 мм, площадь контакта с мембраной 10 см2). Катодное пространство электролизера разделяют катионообменной мембраной МК-40 (площадь, соответственно -10 см2). Расстояние между электродами составляет 3-4 мм.
Объем камеры смешения экстракторов составляет 60 мл, камеры отстоя 300 мл.
Исходный хлоридный рассол (карьерная вода кимберлитовой тр. «Удачная» - Республика Саха-Якутия), состава: Na+ 25 г/л; К+ 12,9 г/л; Са2+ 67 г/л; Mg2+ 15,8 г/л; Cl- 210 г/л; Br- 3,9 г/л, подкисляют соляной кислотой (поз.5, фиг.2) до концентрации 4-7% (0,15-0,2 М) и подают в анодную камеру электролизера (поз.1) с потоком 0,8 л/ч. В катодную камеру электролизера (поз.2) подают с тем же потоком (0,8 л/ч) оборотный католит, первоначально содержащий бромид железа с концентрацией 5-6 г/л по железу (0,1 М). Величину тока на электролизере устанавливают на уровне 1,0 а, что обеспечивает 90% окисление брома (контроль по окислительно-восстановительному потенциалу анолита). При установлении стационарного режима процесса напряжение на электродах электролизера составляет 3,9-4,2 в. Анолит с электролизера направляют на противоточную 3-х ступенчатую экстракцию (поз.6). В качестве экстрагента используют предельный углеводород - растворитель экстракционный деароматизированный (промышленное название РЭД). Величина потока экстрагента 0,8 л/ч. Извлечение брома в органическую фазу на этой стадии составляет свыше 99,9%. Для отмывки органической фазы от небольшого количества хлора, экстракт промывают в одноступенчатом экстракторе исходным рассолом, поступающим на окисление брома (поз.7). Реэкстрагируют бром раствором католита, подаваемого в одноступенчатый экстрактор (скорость 0,8 л/ч) (поз.8). За 1 ступень достигается количественное восстановление брома и полное извлечение его в водный раствор.
При достижении концентрации бромид-иона в католите 4,5М (360 г/л) бромный концентрат отбирают со скоростью около 7,5-8 мл/ч с одновременным добавлением к католиту равного объема (7,5-8 мл/ч) раствора бромида железа с концентрацией 5-6 г/л по железу (0,1 М).
При достижении стационарного режима работы установки для достижения 90% извлечения брома величину тока увеличивают до 1,1 а. Некоторое увеличение расхода электроэнергии обусловлено незначительным 7-10% обратным переносом бромид- иона из катодного в анодное пространство через катионообменную мембрану.
В результате получают продукт состава: Na+ 20,5 г/л; К+ 8,5 г/л; Са2+ 55 г/л; Mg2+ 4,0 г/л; Feобщ 5,9 г/л, Cl- 15 г/л; Br- 365 г/л.
Общее извлечение брома составило 91%; расход электроэнергии 1,5 кВт·ч/кг брома.
Пример 2. Электрохимическое получение бромидного концентрата с применением экстракции брома
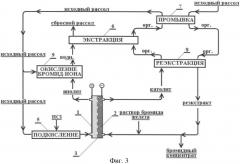
Схема установки для проведения процесса была изменена (фиг.3). С целью снижения расхода соляной кислоты 1/10 часть потока бромсодержащего хлоридного рассола, (10 объемных процентов) подкисляли соляной кислотой до концентрации 7 г/л (около 0,2М) (поз.5, фиг.3) и подавали в анодную камеру (поз.1) электролизера. Остальную часть (90 объемных процентов) нейтрального исходного раствора направляли в обход электролизера, а для окисления брома его смешивали с анолитом, содержащим элементарный хлор (поз.9). Снижение скорости подачи подкисленного рассола в анодную камеру обеспечило более эффективный расход соляной кислоты. При этом изменение условий привело к незначительному росту напряжения на электролизере, которое в стационарном режиме составило 4,1-4,4 в.
В остальном условия эксперимента остались прежними: бром экстрагировали растворителем РЭД (поз.6), органическую фазу промывали исходным рассолом (поз.7) и реэкстрагировали католитом (8), содержащим 10 г/л по железу, подаваемым из катодного пространства (поз.2) электролизера.
В результате было достигнуто получение бромного концентрата с содержанием брома около 350 г/л (хлорида 12 г/л).
Общее извлечение брома также составило около 90%;
- расход электроэнергии 1,6 кВт·ч/кг брома;
- расход 31% соляной кислоты снизился почти в 7-8 раз и составил 0,5 л/кг брома.
Пример 3 Электрохимическое получение бромидного концентрата с применением воздушной отдувки брома
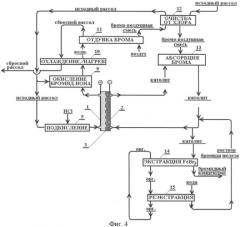
Схема установки для электрохимического получения бромидного концентрата с применением воздушной отдувки брома приведена на фиг.4. В этом эксперименте, также как и в предыдущем случае, в целях снижения расхода соляной кислоты часть общего потока рассола (10%) подкисляли соляной кислотой (поз.5, фиг.4) и направляли в анодную камеру (поз.1). Далее основную часть бромсодержащего рассола смешивали с анолитом (поз.9), что обеспечивало окисление брома хлором, раствор нагревали до 50-60°С (поз.10) и отдували бром воздухом в вертикальной стеклянной колонне высотой 1,5 м, снабженной 5 тарелками (поз.11). Для очистки бромовоздушной смеси от примесей хлора ее пропускали через бромсодержащий исходный рассол (поз.12). Из бромовоздушной смеси бром извлекали пропусканием ее через раствор католита (поз.13).
Бром извлекали из рассола состава (рассол Сухотунгусского месторождения Красноярского края): Na+ 60 г/л; К+ 20,5 г/л; Са2+ 55 г/л; Mg+ 8,6 г/л; Cl- 220 г/л; Br- 4,9 г/л. Рассол, подаваемый в анодную камеру, подкисляют до концентрации 4-7 г/л (0,15-0,2 М). Общая скорость потока рассола 0,8 л/ч, скорость потока оборотного католита 0,8 л/ч. Содержание бромида железа в католите 5-6 г/л (0,1 М). Величина тока на электролизере составляет 1,2-1,3 а, напряжение на электродах электролизера 3,7-4,1 в.
В результате получают промежуточный продукт состава: Na+ 30,5 г/л; К+ 23 г/л; Са2+ 19,5 г/л; Mg2+ 3,0 г/л; Feобщ 5,8 г/л, Cl- 11 г/л; Br- 240 г/л.
Для очистки продукта от железа и его возвращения в процесс провели 2-х ступенчатую экстракцию бромида железа 80% раствором трибутилфосфата в керосине при равном отношении объемов водной и органической фаз (поз.14, фиг.4). Извлечение железа в органическую фазу составляет на этой стадии свыше 99,9%.
Полученный продукт содержит 200 г/л брома, остаточная концентрация железа составляет 0,005 г/л.
Из органической фазы бромид железа реэкстрагируют водой при O:В=1:1 (поз.15, фиг.4). Однократная обработка обеспечивает количественное извлечение железа в водную фазу.
Общее извлечение брома в продукт составляет около 89%;
- расход электроэнергии 1,5 кВт·ч/кг брома;
- расход 31% соляной кислоты составляет 0,4 л/кг брома.
Таким образом, предлагаемый способ позволяет извлечь бром из природных хлоридных вод не менее чем на 89-90% и получить солевой бромидный концентрат с содержанием брома 200-350 г/л с затратами электроэнергии 1,5-1,6 кВт·ч/кг брома и расходом соляной кислоты 0,4-0,5 л/кг брома. При экстракционной очистке продукта расход бромида железа на получение концентрата может быть практически сведен к нулю и не превысит 1-2 г/кг брома.
Использование окисления брома в электролизере на стадии извлечения и его восстановления при выделении его в продукт обеспечивают безопасность производства за счет устранения поставок на производство токсичного хлора и вывоза потребителю брома в виде солевого концентрата.
Перечень чертежей к заявке на изобретение «СПОСОБ ИЗВЛЕЧЕНИЯ БРОМА ИЗ ПРИРОДНЫХ ХЛОРИДНЫХ ВОД С ПОЛУЧЕНИЕМ БРОМИДНОГО КОНЦЕНТРАТА».
Фиг.1. Принципиальная схема получения бромного концентрата при переработке хлоридно-бромидных природных вод и рассолов.
Фиг.2. Схема электрохимического получения бромидного концентрата с применением экстракции брома (к примеру 1).
Фиг.3. Схема электрохимического получения бромидного концентрата с применением экстракции брома (к примеру 2).
Фиг.4. Схема электрохимического получения бромидного концентрата с воздушной отдувкой брома (к примеру 3) и возвратом железа в цикл
1. Способ извлечения брома из природных хлоридных вод с получением бромидного концентрата, включающий окисление бромида до элементарного брома, отделение брома от исходного раствора отдувкой, экстракцией или сорбцией, отличающийся тем, что окисление бромида до элементарного брома осуществляют на аноде двухкамерного электролизера, разделенного катионообменной мембраной, отделяют бром от анолита, извлекают бром из фазы носителя контактом с оборотным католитом с последующим восстановлением брома на катоде с получением бромидного солевого концентрата.
2. Способ по п.1, отличающийся тем, что исходный бромсодержащий хлоридный раствор подкисляют соляной кислотой до 4-7 г/л.
3. Способ по п.1, отличающийся тем, что в анодную камеру направляют часть бромсодержащего хлоридного раствора до 10 об.%, которую подкисляют и после анодного окисления объединяют с основной массой бромсодержащего раствора.
4. Способ по п.1, отличающийся тем, что в католит добавляют бромид железа до общей концентрации железа 5-6 г/л.
5. Способ по п.4, отличающийся тем, что бромид железа регенерируют и возвращают в процесс путем извлечения из бромидного концентрата экстракцией трибутилфосфатом и реэкстракцией водой.