Средство, стимулирующее апоптоз клеток лейкемии человека
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности, в частности к средству, стимулирующему апоптоз клеток лейкемии человека. Применение тритерпеновых гликозидов из голотурий в качестве средства, стимулирующего апоптоз клеток лейкемии человека. Применение тритерпеновых гликозидов из голотурий для приготовления фармацевтической композиции, стимулирующей апоптоз клеток лейкемии человека. Вышеописанное средство эффективно стимулирует апоптоз клеток лейкемии человека и не оказывает воздействие на нормальные клетки иммунной системы человека. 2 н. и 1 з.п. ф-лы, 14 ил.
Реферат
Изобретение относится к медицине и касается средств, обладающих способностью стимулировать апоптоз клеток лейкемии человека.
Лейкозы представляют собой опухоли, диффузно поражающие гемопоэтическую ткань костного мозга. Уровень заболеваемости лейкозами в разных странах мира колеблется в широком диапазоне: от 3 до 10 человек на 100000 населения. При этом мужчины болеют различными формами лейкоза примерно в 1,5 раза чаще, чем женщины. Максимальный уровень заболеваемости хроническими лейкозами наблюдается у людей старше 40-50 лет, а острыми - в возрасте до 10-18 лет.
Для лейкозов характерны:
- безграничный рост, неконтролируемое размножение клеток - гиперплазия;
- морфологическая анаплазия - потеря способности клетки к дифференцировке, созреванию, незрелость;
- угнетение нормального кроветворения за счет быстрого разрастания опухолевых элементов, «вытеснения» ими нормальных ростков кроветворения (метаплазия).
Основным методом лечения лейкозов является химиотерапия [В.И.Махолкин и др. Внутренние болезни. М.: Медицина, 1999]. В качестве лекарственных средств используют, как препараты, полученные химическим синтезом, так и выделенные из природных источников. По механизму действия на опухолевый процесс их можно условно разделить на две основные группы; а) антиметаболиты - вещества, нарушающие метаболизм основных биохимических процессов, протекающих в быстроделящейся клетке (опухолевой), б) цитостатики - вещества, воздействующие непосредственно на процесс деления клеток.
К первым относятся такие лекарственные средства как метотрексат, меркаптопурин, тиогуанин, цитарабин, флударабин, гидроксимочевина, ко вторым - митосантрон, винкристин, винбластин, тенипозид, рубомицин, доксорубомицин и другие [М.Д.Машковский. Лекарственные средства, т.2, изд. 14. М.: ООО «Новая Волна», 2001, с. 407].
К сожалению, химиотерапия, как правило, имеет ряд сильно выраженных побочных эффектов. Вследствие слабой избирательности цитостатические препараты воздействуют как на больные, так и на здоровые клетки крови, что приводит к быстрой гибели значительного их числа и развитию почти полной цитопении - угнетению роста всех кровяных клеток (лейкоцитов, тромбоцитов и эритроцитов).
Наиболее опасным при этом является развитие лейкопении, так как лейкоциты представляют собой один из главных компонентов естественной защиты организма против инфекции. Степень и длительность лейкоцитопении, развивающейся после химиотерапии, в значительной степени определяет количество жизнеопасных инфекционных осложнений.
Тромбоцитопения также представляет клиническую проблему, обусловливая геморрагические осложнения, нередко фатальные, особенно при наличии сопутствующей инфекции.
Тяжелым осложнением применения химиотерапии при лечении лейкозов является угнетение роста нейтрофилов - нейтропения, которая приводит к инфекционным осложнениям. Учитывая высокую вероятность развития и потенциальную тяжесть инфекционных осложнений в условиях нейтропении, проводятся меры, направленные на ограничение попадания возбудителей инфекции в организм пациентов извне с воздухом, пищей и водой, а также меры по борьбе с микроорганизмами, колонизирующими организм. Последний подход включает профилактическое назначение антибиотиков и противогрибковых препаратов.
Острые лейкозы при своевременной диагностике излечиваются в 80-90% случаев. Хронические лейкозы излечиваются всего лишь в 20-40% случаев; больные лечатся годами, длительное время им необходим тщательный врачебный уход и применение разнообразных лекарственных средств, вследствие сравнительно быстрого привыкания опухолевых клеток к действию одного препарата.
Все это свидетельствует о необходимости поиска новых препаратов для лечения лейкозов, основанных на подходах, отличных от вышеупомянутых.
В начале 70-х годов XX века биологами было введено в научный оборот новое представление - алоптоз, описывающее систему клеточной смерти, отличающуюся от некроза отсутствием воспалительных реакций и токсического отравления организма, характерного для некротического варианта распада клеток, наблюдающегося при применении традиционных противоопухолевых препаратов [Schutze-Osthoff К. et al. Apoptosis signaling by death receptors. Eur. J. Biochem. 1998, vol.254, p.439-459; Blatt N.B., Glick G.D. Signaling pathways and effector mechanisms pre-programmed cell death. Bioorg. Med. Chem. 2001, vol.9, p.1371-1384].
В ходе апоптоза клетки подвергаются характерным морфологическим изменениям, включающим конденсацию и фрагментацию ядра, сжатие цитоплазмы и образование так называемых апоптотических тел, которые содержат фрагменты ядра, окруженные цитоплазмой и клеточной мембраной. Апоптотические клетки быстро всасываются макрофагами.
Позже было осознано, что апоптоз происходит во всех тканях организма, как часть нормального круговорота клеток. Например, апоптоз протекает в ходе эмбриогенеза в котором отдельные клетки (части тела) «приговариваются» к смерти в ходе развития организма.
Апоптоз можно условно разделить на три этапа. На первом этапе клетка получает апоптотический сигнал. Большое число внутренних и внешних стимулов воздействия на клетку может активировать в ней апоптотическую последовательность реакций. Эти стимулы включают связывание с клеточными рецепторами на ее поверхности, удаление важнейших факторов роста или воздействие на нее различных химических агентов. Кроме того, окислительный стресс, облучение клетки УФ-светом либо ионизирующей радиацией, нагревание или изменение осмотического давления также являются факторами, индуцирующими апоптоз.
На следующей ступени развития апоптоза клетка интегрирует поступающие отовсюду сигналы и может перейти (а может и не перейти) к процессу апоптоза, в ходе которого активируются ферментные системы, включается синтез вторичных мессенджеров липидного обмена, изменяется экспрессия генов и активируются специализированные протеазы (каспазы). Окончательное решение клетки на переход к апоптозу зависит от многих факторов. На финальном этапе апоптоза общий сигнальный механизм деградации одномоментно активируется таким образом, что клетка разом приобретает характерные морфологические особенности, присущие апоптозу.
Одним из возможных подходов к уничтожению раковых лейкемических клеток может стать принудительная стимуляция (индукция) лейкозных клеток к апоптозу путем воздействия на них подходящими биологически-активными природными соединениями [S.-Y. Sun, N. et al. Apoptosis as a novel target for cancer. J. Natl. Cancer Inst, 2004, v.96, No 9, p.662-672]. В частности, в этом аспекте привлекают внимание морские природные соединения и их синтетические аналоги и производные, которые способны вызывать апоптоз раковых клеток.
Присутствие тритерпеновых гликозидов - характерный признак морских беспозвоночных животных, принадлежащих к классу Holothurioidea (тип Echinodermata).
Тритерпеновые гликозиды голотурий демонстрируют широкий спектр биологических активностей: антифунгальную, противоопухолевую, гемолитическую, цитостатическую и иммуномодуляторную [Stonik, V.A. et al. Handbook of natural toxins and venoms; Tu A., Ed.; Marcel Dekker Inc.: New York, 1988; vol.3, pp.107-120]. Экстракты из голотурий используются как противоопухолевые препараты в нетрадиционной (народной) медицине в некоторых странах. Сообщается также о применении многих препаратов из голотурий в традиционной восточной медицине. Лечебные свойства пищевых продуктов, приготовленных из промысловых голотурий, приписывают тритерпеновым гликозидам [Левин В.С. Дальневосточный трепанг; Далькнижиздат: Владивосток, 1982].
Тритерпеновые гликозиды из голотурий обладают сильным мембранолитическим действием на клеточные и модельные мембраны, содержащие Δ5- стерины. Такой эффект является результатом образования ионных каналов и пор. Образование каналов и пор в мембранах клеток является также причиной гемолитической, антифунгальной и противоопухолевой активностей этих соединений. Антиопухолевые свойства тритерпеновых гликозидов из голотурий впервые были обнаружены Нигрелли [Nigrelli, R.F. Zoologica, 1952, 37, 89-90]. Противоопухолевая активность гликозидных фракций из голотурий, собранных около Большого Барьерного Рифа (Австралия) и Западного Самоа, были изучены Кузнецовой и сотрудниками [Kuznetsova, ТА. et al. Сотр. Biochem. Physiol., 1982, 73 С, 41-43]. Гликозиды из 19 видов семейств Holothuriidae и Stichopodidae ингибировали рост опухолевых клеток Sarcoma-37 в концентрациях от 6.2 до 100 µg/ml в опытах in vitro. Известно также, что фрондозид А из голотурии Cucumaria frondosa применяют в качестве иммуномодуляторного средства [патент US 7163702, 2007.01.16].
В литературе есть также сведения о том, что гликозиды, выделенные из голотурии Penlacia quadrangulari, филинопсиды А и Е, вызывают апоптоз в тканях мышиной саркомы-180 и микроваскулярных эндотелиальных клетках человека НМЕС [Tong, Y et al. J. Int. J.Cancer, 2005, 114, 843-853; Tian, F., et. al. J. Cancer Biology & Therapy, 2005, 4(8), 874-882], а тритерпеновый гликозид из голотурии Cucumaria frondosa, фрондозид А, обладает антипролиферативным действием в отношении раковых клеток поджелудочной железы человека AsPC-1 благодаря индукции апоптоза [патент US 7144867, 2006.12.05]. Однако использование филинопсидов А и Е или фрондозида А в качестве средства, индуцирующего апоптоз в клетках лейкемии человека, не описано.
Авторами в доступной патентной и другой научно-технической литературе не найдено указание на использование экстрактов или индивидуальных веществ из морских голотурий как средств, индуцирующих апоптоз в клетках лейкемии человека.
Задача изобретения - расширение арсенала средств и фармацевтических композиций, способных избирательно стимулировать апоптоз лейкемических клеток.
Задача решена применением тритерпеновых гликозидов (или их смесей) из голотурий в качестве средств, индуцирующих апоптоз в клетках лейкемии человека.
Тритерпеновые гликозиды из голотурий представляют собой кукумариозид А2-2 (А2-2) или кукумариозид А4-2 (A4-2) или их смесь, а также стихопозид С (STC) или стихопозид D (STD) или их смесь.
Эти соединения получают путем выделения и очистки из природного сырья. Так, А2-2 и A4-2 были выделены из промысловой, съедобной голотурии Cucumariajaponica, а STC и STD - из голотурии Thelenota anax. Процесс выделения тритерпеновых гликозидов из голотурий является стандартной процедурой, описанной, к примеру, Авиловым и соавторами [Авилов С.А. и др. Строение четырех новых тритерпеновых гликозидов из голотурии Cucumariajaponica II Химия природ, соедин. 1990. №6. С.787-792]. Сущность способа заключается в следующем: животных измельчали и экстрагировали дважды горячим этанолом; объединенные экстракты упаривали досуха на роторном испарителе и сухой остаток хроматографировали на колонке с тефлоновым порошком или другим гидрофобным носителем, уравновешенным в воде. Неорганические соли и полярные примеси вымывали с колонки водой, а фракцию, содержащую гликозиды, - 50% этанолом в воде. Затем фракцию наносили на колонку с силикагелем; элюент - система хлороформ-этанол-вода (100:100:17). В результате были выделены две главных фракции: первая содержала моносульфатированные гликозиды, а вторая - более полярные гликозиды. Обе фракции были подвергнуты повторной хроматографии на силикагеле, а затем индивидуальные гликозиды выделяли методом высокоэффективной колоночной хроматографии (HPLC) с использованием обращенно-фазовых колонок. Обычно, после использования метода колоночной хроматографии получают смесь гликозидов А2-2 и A4-2 или стихопозидов С и D, а уже после использования метода HPLC получают индивидуальные гликозиды.
Известно, что кукумариозиды А2 и А4, а также стихопозиды С и D обладают гемолитическим действием [Kalinin, V.I. et al. J. Nat. Toxins., 1992, 7, 17-30; Kalinin, V.I. et al. Toxicon, 1996, 34, 475-483], цитотоксической и антиопухолевой активностью [Анисимов М.М. и др. Проблемы научных исследований и освоения Мирвого океана: Тез. Докл. IV Всесоюз. Конф. Владивосток, 1983. С.77-88; Agafonova, I.G. et al. J. Agric. Food. Chem., 2003, 51, 6982-6986], антивирусными и антигрибковыми свойствами [Grishin, Y. et al. In 8th conference of young scientists on organic and bioorganic chemistry; Latvian Academy of Sciences, Institute of Organic Synthesis: Riga, 1991; p.181; Мальцев И.И. и др. Хим.-фармацевт. Журн. 1985, 79, 54-56; RU 2184556 C1, A61K 35/56, A61P 31/12, 10.07.2002], ингибирующим действием на Na+, K+-АТФазу [Gorshkova, I.A. et al. Toxicon, 1989, 27, 927-936], радипротекторным действием [RU 2141833 C1, 27.11.1999.; Гришин, Ю. И.; и др. Радиобиология, 1990, 30, 556; Kovalevskaya, et al. In VI-th international congress "Actual problems of creation of new medicinal preparations of natural origin"; Saint Petersburg, 2002; pp.406-09], и иммуностимулирующими свойствами [Aminin, D.L et al. J. Med. Food., 2001, 4, 127-135].
Однако новое назначение кукумариозидов А2-2 и А4-2 и стихопозидов С и D в качестве средств, обладающих способностью стимулировать апоптоз клеток лейкемии человека, не вытекает с очевидностью из их известных свойств и обнаружено авторами впервые.
Задача решена также применением кукумариозида A2-2 или кукумариозид А4-2 или их смеси, стихопозида С или стихопозида D или их смеси для приготовления фармацевтической композиции, стимулирующей апоптоз клеток лейкемии человека.
Фармацевтические композиции, стимулирующие апоптоз клеток лейкемии человека, получают, смешивая эффективное количество тритерпеновых гликозидов из голотурий с традиционными фармацевтически или фармакологически приемлемыми наполнителями. Выражение «фармацевтически или фармакологически приемлемый» обозначает молекулярные компоненты и композиции, которые не вызывают негативных, аллергических или иных нежелательных реакций при введении их животному или человеку. Природа наполнителя зависит от способа введения. Например, если желательным является пероральное введение, то может быть выбран твердый наполнитель, тогда как для внутривенного введения может быть использован жидкий солевой раствор.
Технический результат, обеспечиваемый изобретением, заключается в способности соединений А2-2 и А4-2, а также STC и STD или их смесей индуцировать алоптоз клеток лейкемии человека, а также в возможности использования этих веществ для приготовления фармацевтических композиций, стимулирующих апоптоз клеток лейкемии человека.
Исследования показали, что тритерпеновые гликозиды голотурий не оказывают существенного воздействия на нормальные клетки иммунной системы человека (нейтрофилы). Это снижает риск возникновения нейтропении, сопровождающий лечение лейкемии традиционными противораковыми препаратами.
Изобретение расширяет арсенал средств и фармацевтических композиций, стимулирующих апоптоз клеток лейкемии человека.
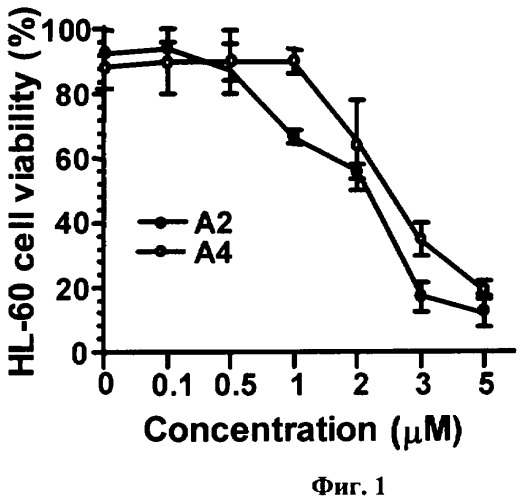
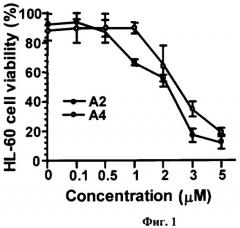
На фиг.1 представлен дозозависимый цитотоксический эффект соединений A2-2 и А4-2 в отношении клеток лейкемии человека HL-60, определенный методом МТТ после 6 часов инкубирования клеток с веществами. Каждая точка на графике соответствует усредненному числу живых клеток, выраженному в процентах ± SD (стандартное отклонение от среднего), полученному из трех независимых опытов, по три образца на каждую концентрацию вещества в каждом из опытов.
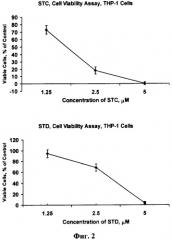
На фиг.2 представлен дозозависимый цитотоксический эффект гликозидов STC и STD в отношении клеток лейкемии человека ТНР-1, определенный методом МТТ после 24 часов инкубирования клеток с веществами. Каждая точка на графике соответствует усредненному числу живых клеток, выраженному в процентах ± SD (стандартное отклонение от среднего), полученному из трех независимых опытов, по три образца на каждую концентрацию вещества в каждом из опытов.
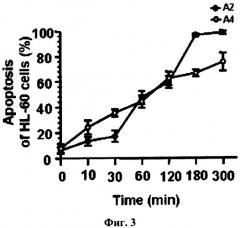
На фиг.3 представлена времязависимая индукция апоптоза кукумариозидами А2-2 и А4-2, взятыми в концентрации 5 µМ, в клетках лейкемии HL-60, определенная методом проточной цитометрии. Каждая точка на графике соответствует усредненному количеству апоптотических клеток в процентах ± SD (стандартное отклонение от среднего), полученному из трех независимых экспериментов.
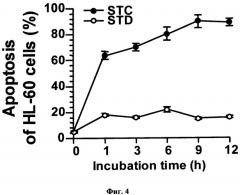
На фиг.4 представлена времязависимая индукция апоптоза гликозидами STC и STD, взятыми в концентрации 0.3 µM, в клетках лейкемии HL-60, определенная методом проточной цитометрии. Каждая точка на графике соответствует усредненному количеству апоптотических клеток в процентах ± SD (стандартное отклонение от среднего), полученному из трех независимых экспериментов.
На фиг.5 представлена дозозависимая индукция апоптоза кукумариозидами A2-2 и
А4-2 в клетках лейкемии HL-60, определенная методом проточной цитометрии через 6 часов инкубирования веществ с клетками. Каждая точка на графике соответствует усредненному количеству апоптотических клеток в процентах ± SD (стандартное отклонение от среднего), полученному из трех независимых экспериментов.
На фиг.6 представлен эффект индукции апоптоза кукумариозидами A2-2 и
А4-2, взятыми в концентрациях 0.5 и 1 µМ, через 24 часа инкубирования с клетками лейкемии HL-60, полученный методом проточной цитометрии с окрашиванием апоптотических клеток флуоресцентными красителями Annexin V-FITC и PI. Эффект представлен в виде числа апоптотических клеток, выраженного в процентах (правый нижний квадрант-ранний апоптоз; правый верхний квадрант - поздний апоптоз). Представлен один из трех независимых экспериментов.
На фиг.7 представлен эффект индукции апоптоза STC и STD, взятыми в концентрациях 0.05-1.0 µM, через 24 часа инкубирования с клетками лейкемии HL-60, полученный методом проточной цитометрии. Эффект представлен в виде числа апоптотических клеток, выраженного в процентах (правый нижний квадрант - ранний апоптоз; правый верхний квадрант - поздний апоптоз). Представлен один из трех независимых экспериментов.
На фиг.8 представлен эффект индукции апоптоза кукумариозидами А2-2 и А4-2, взятыми в концентрации 5 µМ, в лейкемических клетках различных типов, определенный методом проточной цитометрии через 6 часов инкубирования веществ с клетками. Каждый "столбик" соответствует усредненному количеству апоптотических клеток в процентах ± SD (стандартное отклонение от среднего), полученному из трех независимых опытов.
На фиг.9 представлен эффект индукции апоптоза STC и STD, взятыми в концентрации 0.3 µM, в лейкемических клетках различных типов, определенный методом проточной цитометрии через 24 часа инкубирования веществ с клетками. Каждый "столбик" соответствует усредненному количеству апоптотических клеток в процентах ± SD (стандартное отклонение от среднего), полученному из трех независимых опытов.
На фиг.10 представлен тест Тунель (TUNEL) на индукцию апоптоза в клетках лейкемии HL-60, обработанных кукумариозидами А2-2 и А4-2 в концентрации 5 µM в течение 6 часов. Представлен один из трех независимых экспериментов.
На фиг.11 представлен эффект кукумариозидов А2-2 и А4-2, взятых в концентрации 1 µМ, на клеточный цикл клеток лейкемии HL-60, определенный методом проточной цитометрии через 24 часа инкубирования клеток с веществами. Эффект представлен в виде числа клеток, находящихся в той или иной фазе клеточного цикла, причем число клеток, находящихся в фазе Sub G1 выражено в процентах. Представлен один из трех независимых экспериментов.
На фиг.12 представлен эффект STC и STD, взятых в концентрации 0.3 µМ, на клеточный цикл клеток лейкемии HL-60, определенный методом проточной цитометрии через 24 часа инкубирования веществ с клетками. Эффект представлен в виде числа клеток, находящихся в той или иной фазе клеточного цикла, причем число клеток, находящихся в фазе Sub G1, выражено в процентах. Представлен один из трех независимых экспериментов.
На фиг.13 представлен эффект А2-2 и А4-2 в концентрации 1 µM на внутриклеточный уровень прокаспазы-3 в клетках HL-60. Представлен один из трех независимых экспериментов.
На фиг.14 представлен эффект STC и STD, взятых в концентрации 0.3 и 1 µМ, соответственно, на внутриклеточные уровни прокаспаз-3, -8, 9, 12, а также белков PARP и BID в клетках HL-60. Представлен один из трех независимых экспериментов.
Приготовление фармацевтических композиций иллюстрируется следующими примерами.
Пример 1. Кукумариозид A2-2 в эффективном количестве смешивают с соответствующим количеством смеси крахмала и гипса и прессуют в таблетку.
Пример 2. Фармацевтическую композицию готовят, как описано в примере 1, но в качестве тритерпенового гликозида используют кукумариозид А4-2, а в качестве наполнителя - смесь сорбита и стеарата кальция.
Пример 3. Фармацевтическую композицию готовят, как описано в примере 1, но в качестве тритерпенового гликозида используют стихопозид С.
Пример 4. Фармацевтическую композицию готовят, как описано в примере 2, но в качестве тритерпенового гликозида используют стихопозид D.
Пример 5. Смесь гликозидов, кукумариозидов А2-2 и А4-2 в эффективных концентрациях растворяют в соответствующем количестве физраствора.
Пример 6. Фармацевтическую композицию готовят, как описано в примере 5, но в качестве смеси гликозидов используют смесь стихопозида С и стихопозида D.
Исследование биологической активности
I. Материалы и методы.
1. Принятые сокращения.
А2-2 - кукумариозид А2-2; А4-2. - кукумариозид А4-2; STC - стихопозид С; STD - стихопозид D; mM - миллимоль/литр; µМ - микромоль/литр; µл - микролитр; SD - стандартное отклонение от среднего; МТТ - метод определения цитотоксичности веществ; Annexin V-FITC - флуресцентный краситель; PI - пропидиум иодид, флуоресцентный краситель; TUNEL - метод определения апоптоза; Sub-Gi - одна из фаз клеточного цикла, характерная для клеток, находящихся в апоптозе; PARP и BID - белки, принимающие непосредственное участие в процессе апоптоза в клетке; PBS - фосфатно-солевой буферный раствор; FBS - сыворотка крови бычьих эмбрионов; ДМСО - диметилсульфоксид.
2. Культивирование клеток.
HL-60, THP-1, NB4 или К562 клетки (АТСС, Rockville, MD) культивировали в среде RPMI-1640, содержащей 10% FBS, 100 µг/мл пенициллина и 100 µг/мл стрептомицина, в атмосфере, содержащей 5% СО2, при 37°С, и пересеивали каждые 2 дня.
3. Приготовление растворов веществ.
Базовые (стоковые) растворы гликозидов с концентрацией вещества 20 mM готовили в диметилсульфоксиде (ДМСО) (Fisher, USA), из которого получали растворы нужной концентрации разбавлением в культуральной среде. Содержание ДМСО в разбавленных растворах не превышало 0,5% во всех опытах.
4. Определение цитотоксичности.
3-(4,5-этилтиазол-2-ил)-2,5-дифенилтетразол бромид (МТТ) (Sigma, St. Louis, МО, USA) был использован для определения цитотоксичности веществ. HL-60 или THP-1 клетки были высеяны в 96-луночный планшет (1×104 клеток на лунку) и затем обработаны указанными концентрациями кукумариозидов А2-2 или А4-2. Затем раствор МТТ (5 мг/мл) был добавлен в каждую лунку и клетки инкубировали при 37°С и 5% СО2 в течение 4 часов. Клеточную суспензию центрифугировали при 1000 об/мин в течение 5 мин и клетки в каждой лунке экстрагировали затем 100 мкл диметилсульфоксида. Оптическую плотность растворов в каждой лунке затем определяли на планшетном ридере-спектрофотометре при 550 нм. Процентное содержание живых клеток затем вычисляли по формуле (ОПэксп/ОПетрл)×100,
где ОПэксп - оптическая плотность экспериментальной лунки, ОПктрл - оптическая плотность контрольной лунки.
5. Определение апоптоза методом проточной цитометрии.
Клетки (1×106) обрабатывали гликозидами в указанных концентрациях, инкубировали в течение указанного промежутка времени, затем промывали фосфатным буфером (PBS) путем центрифугирования при 1000 об/мин в течение 5 мин. Затем клетки обрабатывали для обнаружения раннего и позднего апоптоза флуоресцентными красителями Аннексии V-FITC и пропидиум иодид (PI) в соответствии с рекомендациями фирмы-производителя. Клетки (1×105-5×105) ресуспендировали в 500 µл связывающего буфера (Annexin V-FITC Apoptosis Detection kit. Medical & BiologicalLaboratories), добавляли 5 µл Annexin V-FITC и 5 µл PI и инкубировали в течение 15 мин в темноте при комнатной температуре. Затем клетки (1×104) анализировали на проточном цитометре производства США (Beckton Dickinson, Franklin Lakes, NJ) для обнаружения раннего и позднего апоптоза.
6. Анализ методом TUNEL.
Клетки HL-60 (1×104 клеток на лунку) были высеяны в 96-луночный планшет и обработаны кукумариозидами А2-2 или А4-2 в концентрации 5 µМ в течение 6 часов. Затем клетки были отмыты центрифугированием и зафиксированы в 100 µл на каждую лунку свежеприготовленного 4% формальдегида в PBS (рН 7.4) в течение 10 мин. Полученные слайды были проинкубированы в течение 5 мин с 0.1% Тритон Х-100, промыты дважды PBS и высушены. Набор реагентов TUNEL (Roche, Basel, Switzerland) был использован для обнаружения апоптоза, в соответствии с рекомендациями фирмы-производителя. Клетки инкубировали в течение 60 мин при 37°С с реакционной смесью (50 µл на каждый слайд), содержащей флуоресцеин-12-dUTP, в присутствии терминальной деоксинуклеотидил трансферазы (TdT), при этом зеленая флуоресцентная метка присоединялась по свободным 3'-ОН группам фрагментированной ДНК. Затем образцы промыли три раза PBS, обработали 500 µл буферного раствора, содержащего PI, в течение 15 мин, и проанализировали с помощью флуоресцентного микроскопа (Carl Zeiss, LSM 510) при длине волны возбуждения 450-500 нм и длине волны обнаружения 515-565 нм.
7. Анализ клеточного цикла.
Клетки (1×106) обрабатывали гликозидами в указанных концентрациях, инкубировали в течение 24 часов, затем промывали фосфатным буфером (PBS) путем центрифугирования при 1000 об/мин в течение 5 мин. После этого клетки были суспендированы в PBS и зафиксированы холодным 70% этанолом в течение 3 часов. Фиксированные клетки были прокрашены 50 µг/мл PI (пропидиум-иодида), содержащим 50 µг/мл РНКазы А, при 37°С в течение 30 мин. ДНК клеток (10,000 клеток на экспериментальную группу) была затем проанализирована с помощью клеточного цитометра.
8. Вестерн-блоттинг анализ.
HL-60 клетки (1×107 клеток в чашке Петри, 10 см диаметром) инкубировали с соответствующими растворами (1 µМ для гликозидов А2-2 или А4-2; 0.3 или 1 µМ для гликозидов STC или STD) в 10 мл среды RPMI-1640, содержащей 10% FBS, в течение 24 час. Затем клетки промыли холодным PBS (2×10 мл), суспендировали в лизирующем буфере, содержащем 20 mM Tris-HCl, рН 7.4, 50 mM NaCl, 1.0% Triton X-100, 50 mM NaF, 2,5 mM Na3VO4 и ингибиторы протеаз (1 mM PMSF, 20 ед/мл апротинина). Лизаты (25 µг) подвергли электрофорезу на 10% додецилсульфат-полиакриламидном геле, перенесли на нитроцеллюлозную мембрану, которую блокировали в течение 1 час при 25°С в блокирующем буфере (10 mM Tris-HCl, 0,15 М NaCl, 0,1% азида натрия и 5% обезжиренного молока) и инкубировали в течение ночи при 4°С с соответствующими первичными антителами в разбавлении (1:1000). Затем мембраны инкубировали с вторичными антителами против IgG в разбавлении 1:5000 в блокирующем буфере. Сигналы комплексов белок-антитело регистрировали по хемилюминисцентному свечению.
II. Результаты исследования биологической активности кукумариозидов А3-2 и А4-2, а также стихопозидов С и D и их обсуждение.
Все исследованные гликозиды (или их смеси) уже в нецитотоксических концентрациях проявили апоптоз-стимулирующую активность на нескольких линиях клеток лейкемии человека, что подтверждается данными по исследованию цитотоксичности, изучению апоптоза методами проточной цитометрии и TUNEL, а также данными по воздействию на клеточный цикл и данными экспериментов по вестерн-блоттингу. Было обнаружено, что кукумариозиды А2-2 и А4-2 или стихопозиды С и D индуцируют апоптоз клеток лейкемии человека при оптимальных концентрациях 0.3-5 µМ. Оптимальное время воздействия на опухолевые клетки 3-24 часа. Апоптотические изменения (ранний и поздний апоптоз) в клетках измерялись с использованием флуоресцентных красителей Аннексии V-FITC и пропидиум-иодид (PI). При этом также наблюдалось значительное увеличение числа клеток, находящихся в фазе клеточного цикла Sub-G1, что характерно именно для клеток, находящихся в состоянии апоптоза. В клетках, подвергшихся обработке кукумариозидами А2-2 и А4-2 или стихопозидами С и D, также регистрировалась характерная для апоптоза фрагментация ДНК. Исследованные гликозиды вызывали апоптоз в различных линиях лейкемических клеток, включая HL-60 (острая промиелоцитарная лейкемия), NB4 (острая промиелоцитарная лейкемия), ТНР-1 (острая моноцитарная лейкемия), К562 (хроническая миелогенная лейкемия).
Цитотоксическая активность.
А2-2 и А4-2, а также STC и STD показали цитотоксические свойства на HL-60 и ТНР-1 клетках лейкемии человека. Цитотоксический эффект оценивали МТТ-методом.
Так, был изучен доз-зависимый цитотоксический эффект А2-2 и А4-2 (см. фиг.1) и STC и STD (см. фиг.2) в отношении клеток лейкемии человека HL-60 и ТНР-1, соответственно. Полученные данные свидетельствуют о том, что А2-2 и А4-2 проявляют высокую цитотоксическую активность в отношении клеток лейкемии человека HL-60 уже через 6 часов инкубирования с клетками, в пределах концентраций 1-5 µM, причем A2-2 проявляет более сильный эффект, чем А4-2. В паре гликозидов STC и STD (см. фиг.2) более сильным цитотоксическим действием обладает STC. Так, при концентрации STC 2.5 µМ выживают лишь около 20% ТНР-1 клеток, а при воздействии на клетки той же концентрации STD выживают уже около 70% ТНР-1 клеток. Об этом же свидетельствуют IC50 STC и STD в отношении ТНР-1 клеток: 1.7 и 3 µМ, соответственно.
Оценка апоптоза с использованием метода проточной цитометрии
Углубленное исследование причины цитоксических изменений, вызываемых А2-2
и А4-2, а также STC и STD в лейкемических клетках проводили методом проточной цитометрии. В этом методе апоптотические изменения клеток, наступающие под воздействием гликозидов, приводят к выходу на внешнюю поверхность лейкемических клеток фосфатидилсерина, с которым избирательно связывается белок Аннексин-V FITC, ковалентно сшитый с флуоресцентным красителем. Появление среди клеток, обработанных гликозидами популяции клеток несущих зеленую флуоресцентную метку, связанную с белком Аннексин-V FITC, является свидетельством вхождения клеток в фазу раннего апоптоза. Через некоторое время (6-24 час) клетки претерпевают более глубокие изменения, позволяющие флуоресцентному красителю пропидиум иодид проникнуть в клетку, что приводит к окрашиванию компонентов ядра в красный цвет. Как видно из представленных на фиг.3-9 результатов, А2-2 и А4-2, как и STC и STD индуцируют апоптоз в различных типах лейкемических клеток человека. При этом процент апоптотических клеток зависит от концентрации гликозидов (фиг.5-7), от продолжительности воздействия гликозидов на клетки (фиг.3, 4), от типа лейкемических клеток (фиг.8, 9), а также от химической структуры самих гликозидов (фиг.3-9). Здесь, так же, как и в опытах по цитотоксическому действию, А2-2 более активен, чем А4-2, а STC более активен, чем STD, что особенно хорошо видно на фиг.8 и 9. Из этих же результатов (фиг.8 и 9) следует, что исследуемые гликозиды стимулируют апоптоз в HL-60, ТНР-1, NB-4 и К562 линиях клеток лейкемии человека. Концентрации, при которых гликозиды стимулируют апоптоз в клетках лейкемии человека, находятся в интервале 0.3-5 µМ, что зависит не только от структуры гликозида, но и от времени инкубации клеток с веществами. Таким образом, исследуемые гликозиды A2-2, A4-2, STC и STD индуцируют апоптоз в клетках лейкемии человека уже в нецитотоксических концентрациях. Так, из результатов, представленных на фиг.5 и 6, следует, что процент апоптоза, вызываемого кукумариозидами А2-2
и А4-2, взятыми в концентрации 3 µM, и при времени инкубации с клетками, равном 6 часам (см. фиг.5), равен проценту апоптоза, вызываемому теми же гликозидами, но при концентрации 1 µM и времени инкубации 24 часа (см. фиг.6). В целом, результаты, представленные на фиг.3-9, демонстрируют, что A2-2 и А4-2, как и STC и STD способны индуцировать 15-90% апоптоз в различных типах лейкемических клеток человека в пределах концентраций 0.3-5 µМ, при времени воздействия 3-24 часа и что антилейкемические свойства исследуемых гликозидов, по крайней мере частично, можно объяснить индукцией апоптоза.
Наблюдение апоптоза методом TUNEL
Еще одно доказательство индукции апоптоза исследуемыми гликозидами было получено методом TUNEL на примере А2-2 и А4-2. (см. фиг.10). В этом методе фрагментированная ДНК, которая появляется в клетке в ходе апоптотических превращений, окрашиваается красителем FITC и дает зеленую флуоресцентную окраску, а геномная ДНК контрольных, необработанных, не подвергшихся апоптозу клеток окрашивается только пропидиум иодидом (PI) в красный цвет. Клетки лейкемии HL-60 (фиг.10), обработанные А2-2 и А4-2 в концентрации 5 µM в течение 6 часов, показали, в отличие от контрольных клеток, включение зеленой флуоресцентной метки, что свидетельствует о наличии фрагментированной ДНК и является признаком апоптоза.
Исследование клеточного цикла методом проточной цитометрии
Анализ клеточного цикла HL-60 клеток, обработанных в течение 24 часов растворами А2-2 и А4-2 (фиг, 11) в концентрации 1 µМ и STC и STD в концентрации 0.3 µМ (фиг.12), показал существенный рост популяции клеток, находящихся в фазе клеточного цикла sub-G1 по сравнению с контрольными клетками, что является несомненным признаком наступившего апоптоза. И в этом эксперименте А2-2 был активнее, чем А4-2, а STC значительно активнее, чем STD. Так, воздействие А2-2 приводило к переходу 20.1% клеток в фазу sub-G1, в то время как А4-2 вызывал переход меньшего количества клеток, 17.6% (фиг.11). Разница в аналогичном действии на клетки гликозидов STC и STD гораздо более значительна: 36.7 и 2.8%, соответственно (фиг.12).
Доказательство стимуляции апоптоза методом вестерн иммуно-блоттинга.
На поздних стадиях апоптоза в клетках происходит активация набора внутриклеточных белков, ферментов, каспаз, вызывающих расщепление внутриклеточных биополимеров. В нормальных клетках эти белки находятся в неактивной форме, в виде предшественников - прокаспаз. В экспериментах по вестерн иммуно-блоттингу, проведенных на клетках лейкемии HL-60, установлено, что исследуемые гликозиды А2-2 и A4-2 снижают внутриклеточный уровень белка прокаспазы-3 (фиг.13), a STC и STD снижают уровень белков прокаспаз-3, -8, -9, 12 в клетках (фиг.14). Это связано с превращением прокаспаз в активную форму после обработки клеток лейкемии исследуемыми гликозидами. Этот эксперимент представляет собой еще одно несомненное доказательство стимуляции апоптоза исследуемыми гликозидами и позволяет предположить, что апоптоз, индуцируемый А2-2 и А4-2, а также STC и STD в лейкемических клетках HL-60 и ТНР-1 является каспаз-зависимым.
1. Применение тритерпеновых гликозидов из голотурий в качестве средства, стимулирующего апоптоз клеток лейкемии человека.
2. Применение по п.1, где указанные тритерпеновые гликозиды из голотурий представляют собой кукумариозид А2-2, или кукумариозид A4-2, или их смесь, или стихопозид С, или стихопозид D, или их смесь.
3. Применение тритерпеновых гликозидов из голотурий, как они определены в любом из пп.1 и 2, для приготовления фармацевтической композиции, стимулирующей апоптоз клеток лейкемии человека.