Композиции менингококковых вакцин с адъювантами
Иллюстрации
Показать всеИзобретение относится к вакцинам, а также к области молекулярной биологии и генетической инженерии. Предложена иммуногенная композиция, содержащая антиген Neisseria, содержащий белок серогруппы В Neisseria meningitides, выбранный из группы, состоящей из белка NadA, белка 287, белка 741, белка 953; CpG-олигонуклеотид; а также биологически разлагаемые микрочастицы, представляющие собой сополимер D, L лактида с гликолипидом - PLG. Кроме того, предложены способ повышения гуморального ответа млекопитающего, способ защиты млекопитающего и применение композиции для производства лекарственного средства. Изобретение может быть использовано для получения вакцин. 4 н. и 11 з.п. ф-лы, 11 табл.
Реферат
Все документы, процитированные здесь, включены со ссылкой на них во всей их полноте.
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к вакцинам, более конкретно к вакцинам против Neisseria meningitidis.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Геномные последовательности для Neisseria meningitidis (менингококк) серогрупп А (1) и В (2, 3) были описаны. Последовательность для серогруппы В была изучена в отношении идентификации вакцинных антигенов (например, ссылки с 4 по 9), и антигены-кандидаты были подвергнуты манипуляциям с целью улучшения гетерологичной экспрессии (ссылки с 10 по 12).
Антигены обычно требуют совместного введения адъювантов для усиления их иммуногенности в вакцинах (13). Для менингококков серогруппы В использовали адъювант Фрейнда (9), а в лицензированной вакцине MenjugateТМ против серогруппы С используют гидроксид алюминия (14). Сообщалось также об усилении бактерицидной активности антигенов Neisseria при использовании олигонуклеотидных адъювантов, содержащих мотивы CpG (15).
Объектом данного изобретения является получение дополнительных и улучшенных адъювантов для антигенов Neisseria.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Было обнаружено, что комбинация CpG-олигонуклеотидов и полимерных микрочастиц является чрезвычайно эффективным адъювантом для антигенов Neisseria, причем комбинация дает значительно более хорошие результаты, чем любой из отдельных компонентов. Данное изобретение поэтому представляет композицию, состоящую из: (а) антигена Neisseria; (b) CpG-олигонуклеотида и (с) биологически разлагаемых полимерных микрочастиц.
Антиген Neisseria
Антиген Neisseria может быть белковым антигеном, нуклеиновой кислотой, кодирующей белковый антиген, или сахаридным антигеном. Антиген предпочтительно вызывает бактерицидный или защитный иммунный ответ (например, гуморальный иммунный ответ) у млекопитающего-реципиента.
Антиген может происходить из любого вида Neisseria, включая N.gonorrhoeae, N.lactamica и N.meningitidis. Предпочтителен антиген N.meningitidis, и он может быть из любой серогруппы. Когда антиген происходит из серогруппы В, предпочтительно использовать белковый антиген; когда он происходит из серогрупп А, С, W135 или Y, то предпочтительно использовать сахаридный антиген. Когда используют сахаридные антигены, их обычно получают из капсульных полисахаридов бактерий (например, олигосахаридов, таких как олигосахариды, полученные путем гидролиза), и они будут обычно конъюгированы с белками-носителями (например, с CRM197).
Предпочтительными белковыми антигенами, получаемыми из N.meningitidis серогруппы В, являются:
- белок, описанный в любом из источников 4, 5, 6, 7, 8 или 9 (в частности, 446 четных SEQ ID (т.е. 2, 4, 6, …, 890, 892), описанных в источнике 4, 45 четных SEQ ID (т.е. 2, 4, 6, …, 88, 90), описанных в источнике 5, и 1674 четных SEQ ID 2-3020, четных SEQ ID 3040-3114 и все SEQ ID 3115-3241, описанные в источнике 6);
- белок, содержащий иммуногенный фрагмент из одного или более белков, описанных в любом из источников 4, 5, 6, 7, 8 или 9;
- белок, содержащий последовательность, имеющую идентичность последовательности (предпочтительно более 50%, например 60%, 70%, 80%, 90%, 95%, 99% или более) с одним или более белков, описанных в любом из источников 4, 5, 6, 7, 8 или 9;
- белок, описанный в любом из источников 10, 11 или 12;
- белок, содержащий последовательность, имеющую идентичность последовательности (предпочтительно более 50%, например 60%, 70%, 80%, 90%, 95%, 99% или более) с одним или более белков, описанных в любом из источников 10, 11 или 12.
Особенно предпочтительным белковым антигеном из N.meningitidis серогруппы В является белок '287'. Этот белок можно использовать в форме дикого типа (например, GenBank поступление gi:7228690; выравнивания полиморфных форм 287 показаны на фиг.5 и 15 из источника 8), но можно использовать и производные белка дикого типа. Например, можно использовать белки, имеющие 50% или более идентичность последовательности (например, 60%, 70%, 80%, 90%, 95%, 99% или более) с gi:7228690. Можно использовать варианты данного белка - белки с укорочением или делецией, такие как усеченные на N-конце формы, описанные в источниках с 10 по 12 (в частности '∆G287', в котором N-конец белка вплоть до и включая шесть повторяющихся глициновых остатков удален). Можно использовать слитые белки, содержащие такие последовательности 287. Все из данных форм 287, а более конкретно те, которые сохраняют иммуногенность белков 287 дикого типа, входят в значение '287', как оно использовано здесь.
Другим, особенно предпочтительным белковым антигеном из N.meningitidis серогруппы В является белок '961', известный также как 'NadA' (16). Данный белок можно использовать в форме дикого типа (например, GenBank поступление gi:7227256; аллели 961 описаны в источнике 17), но можно использовать и производные белка дикого типа. Например, можно использовать белки, имеющие 50% или более идентичность последовательности (например, 60%, 70%, 80%, 90%, 95%, 99% или более) с gi:7227256. Можно использовать варианты данного белка - белки с усечением или делецией, такие как белки, описанные в источниках с 10 по 12 ('961 с', в частности, у которого отсутствует С-концевой мембранный якорь). Можно использовать слитые белки, содержащие такие последовательности 961. Все из данных форм 961, и особенно формы, которые сохраняют иммуногенность белков 961 дикого типа, входят в значение '961' или 'NadA', которое использовано здесь.
Другими предпочтительными белковыми антигенами являются белок '741' и белок 'ORF46.1', и белки 'ORF1', 'ORF4', 'ORF25', 'ORF40', 'ORF83', 'NMB1343', '230', '233', '292', '594', '687', '736', '907', '919', '936', '953' и '983'. Другими предпочтительными белковыми антигенами являются гибридные белки, описанные в источниках с 10 по 12, особенно белки, включающие один или более из: белок 287, белок 953, белок 936 и/или белок 741.
Белковые антигены можно получить из любого штамма N.meningitidis. Предпочтительно использовать антигены из штаммов 2996, МС58, 95N477 и 394/98.
Помимо вариантов штамма могут быть произведены единичные или множественные замены консервативных аминокислот с изменением иммуногенности антигенов, используемых в соответствии с данным изобретением.
В дополнение к белковым антигенам или вместо них в композиции данного изобретения могут быть включены нуклеиновые кислоты, кодирующие белковый антиген. Нуклеиновые кислоты будут экспрессироваться in vivo при введении реципиенту-млекопитающему, и будет продуцироваться белковый антиген. Такая иммунизация нуклеиновыми кислотами хорошо известна (например, источники с 18 по 23 и др.) Нуклеиновая кислота будет обычно плазмидной ДНК.
Предпочтительным сахаридным антигеном, получаемым из N.meningitidis серогруппы С, является олигосахаридный конъюгат, используемый в MenjugateTM (24, 25), который содержит от 12 до 22 моносахаридных единиц из капсульного полисахарида серогруппы С.
Предпочтительным сахаридным антигеном, получаемым из серогруппы А, является олигосахарид, в котором одна или более из гидроксильных групп в составных моносахаридных элементах замещены блокирующей группой (26).
Дополнительные олигосахаридные антигены из серогрупп А, W135 и Y описаны в источнике 27.
Композиция данного изобретения может включать более одного антигена Neisseria. Когда включены сахариды из обеих серогрупп А и С N.meningitidis, предпочтительно, чтобы отношение (вес/вес) сахарид MenA:сахарид MenC было более 1 (например,
2:1, 3:1, 4:1, 5:1, 10:1 или более).
Композиция данного изобретения является предпочтительно иммуногенной композицией или вакциной. Такие композиции включают иммунологически эффективное количество антигена. Под “иммунологически эффективным количеством” подразумевается, что введение индивидууму композиции данного изобретения, содержащей такое количество антигена (или в разовой дозе, или в виде части серии), является эффективным для формирования терапевтического или профилактического иммунного ответа. Это количество меняется в зависимости от состояния здоровья и физического состояния индивидуума, которого нужно лечить, возраста, таксономической группы индивидуума, которого нужно лечить (например, примата, не являющегося человеком, примата и т.д.), способности иммунной системы индивидуума синтезировать антитела, степени желаемой защиты, состава вакцины, суждения лечащего врача о медицинской ситуации и других значимых факторов. Данное количество может соответствовать относительно широкому интервалу, который может быть определен путем обычных испытаний. Антигены обычно присутствуют в концентрации, по меньшей мере, 1 мкг/мл каждого.
Режим дозирования для лечения может состоять из единственной дозы или множественных доз (например, включая ревакцинирующие дозы).
CpG-олигонуклеотид
Известно, что CpG-олигонуклеотиды используют в качестве адъювантов в вакцинах (например, ист.28), и они вызывают сильный иммунный Th1-ответ. Они пригодны в качестве адъювантов для парентерального введения и для нанесения на слизистые оболочки (29).
CpG-олигонуклеотид, используемый в соответствии с данным изобретением, является нуклеиновой кислотой, которая включает, по меньшей мере, один динуклеотид CG, т.е. цитозиновый нуклеотид, за которым следует гуанозиновый нуклеотид. Олигонуклеотид может содержать множественные динуклеотиды CG.
CG-последовательность в олигонуклеотиде может быть флангирована двумя пуринами с 5'-стороны и двумя пиримидинами с 3'-стороны, т.е. RRCGYY.
Цитозиновые нуклеотиды в олигонуклеотиде CpG могут быть метилированы, но предпочтительно они должны быть неметилированными.
Цитозиновые и гуанозиновые нуклеотиды предпочтительно являются дезоксинуклеотидами, и нуклеиновой кислотой предпочтительно является ДНК. Для повышения устойчивости к нуклеазам олигонуклеотид может содержать модифицированную скелетную цепь, такую как фосфоротиоатную скелетную цепь. В качестве альтернативы использованию ДНК можно использовать ПНК (пептидно-нуклеиновая кислота). Кроме того, олигонуклеотиды могут включать замещения групп сахаров и азотистых оснований.
Олигонуклеотид предпочтительно состоит из от 6 до примерно 100 нуклеотидов, более предпочтительно от примерно 8 до примерно 50 нуклеотидов, наиболее предпочтительно от примерно 10 до примерно 40 нуклеотидов.
Олигонуклеотиды, содержащие, по меньшей мере, один динуклеотид CG, могут быть получены удобным образом с применением обычного олигонуклеотидного синтеза.
Примеры CpG-олигонуклеотидных адъювантов находятся в источниках с 30 по 55.
Биологически разлагаемые полимерные микрочастицы
Биологически разлагаемые полимерные микрочастицы, как известно, используются в качестве вакцинных адъювантов (например, ист.56). Они пригодны в качестве адъювантов для парентерального введения и для нанесения на слизистые оболочки.
Кроме того, что он является биоразлагаемым, полимер, используемый для получения микрочастиц, обычно должен быть стерилизуемым и нетоксичным (биосовместимым). Подходящие биоразрушаемые полимеры можно легко приобрести, и они включают полимеры, которые получают из полигидроксимасляной кислоты; поликапролактона; полиортоэфира; полиангидрида; полигидроксибутирата и поли-α-гидроксикислоты. Предпочтительные полимеры получают из одной или более из поли-α-гидроксикислот, например поли-L-лактида, поли-D,L-лактида, сополимеров D,L-лактида и гликолида (такого как статистический сополимер D,L-лактид с гликолидом) или сополимер D,L-лактида или капролактона. Микрочастицы, полученные из статистического сополимера D,L-лактида с гликолидом (PLG), являются предпочтительными.
Существуют полимеры с разными молекулярными массами, и подходящая молекулярная масса для данного антигена может быть легко определена. Для поли-L-лактида подходящая молекулярная масса будет составлять порядка от примерно 2000 до 250000. Для PLG подходящая молекулярная масса будет обычно находиться в интервале от примерно 10000 до примерно 200000, предпочтительно от примерно 15000 до примерно 150000 и наиболее предпочтительно от примерно 50000 до примерно 100000.
Для микрочастиц из PLG можно использовать лактид:гликолид в разном соотношении, и отношение большей частью является делом выбора, зависящего частично от вводимого вместе с ними антигена и от степени желаемого их разрушения. Например, PLG 50:50, содержащий 50% D,L-лактида и 50% гликолида, будет давать быстро рассасывающийся сополимер, тогда как PLG 75:25 разлагается более медленно, а 85:15 и 90:10 еще более медленно из-за повышенного содержания лактидного компонента. Подходящее отношение лактид:гликолид легко определить на основе природы рассматриваемых антигена и заболевания. Кроме того, смеси микрочастиц с разным отношением лактид:гликолид найдут применение в препаратах для того, чтобы достичь желаемой кинетики высвобождения для данного антигена, и чтобы получить как первичный, так и вторичный иммунный ответ. Скорость разложения микрочастиц данного изобретения можно также регулировать с помощью таких факторов, как молекулярная масса полимера и кристалличность полимера.
Термин «микрочастица», как он использован здесь, относится к частице диаметром от примерно 100 нм до примерно 150 мкм, более предпочтительно диаметром от примерно 200 нм до примерно 30 мкм и наиболее предпочтительно диаметром от примерно 500 нм до примерно 10 мкм. Предпочтительно микрочастицы будут диаметром, который дает возможность парентерального введения без закупоривания игл и капилляров. Размер микрочастиц легко определить методами, хорошо известными в данной области техники, такими как фотонная корреляционная спектроскопия, лазерная дифрактометрия и/или сканирующая электронная микроскопия. Термин «микрочастица» включает «наночастицы» (57) в их границах. Предпочтительными микрочастицами являются микросферы, хотя можно также использовать ламеллярные частицы (58).
Микрочастицы можно получить, применяя любой из нескольких методов, хорошо известных в данной области техники (например, источник 59). Например, для получения микрочастиц можно использовать методы двойного выпаривания эмульсии/растворителя (например, источники 60 и 61). Эти методики включают образование первичной эмульсии, состоящей из капелек раствора полимера, содержащего антиген (если антиген должен заключаться в микрочастице), которую затем смешивают с непрерывной водной фазой, содержащей стабилизатор частиц/поверхностно-активное вещество.
Более конкретно, систему с выпариванием растворителя вода-в-масле-в-воде (в/м/в) можно использовать для получения микрочастиц, как описано в источниках 62, 63 и 64. При данной методике конкретный полимер соединяют с органическим растворителем, таким как этилацетат, диметилхлорид (также называемый метиленхлоридом и дихлорметаном), ацетонитрил, ацетон, хлороформ и тому подобное. Данный полимер будет представлен в примерно 2-15% растворе в органическом растворителе. Добавляют примерно равное количество раствора антигена (например, в воде) и эмульгируют раствор полимер/антиген, используя, например, гомогенизатор. Эмульсию затем объединяют с большим объемом водного раствора стабилизатора эмульсии, такого как поливиниловый спирт (PVA) или поливинилпирролидон. Стабилизатор эмульсии обычно представлен в примерно 2-15% растворе, более типично в примерно 4-10% растворе. Смесь затем гомогенизируют с получением стабильной двойной эмульсии (в/м/в). Органические растворители затем выпаривают.
Параметрами препарата можно манипулировать, чтобы обеспечить возможность получения небольших (<5 мкм) и больших (>30 мкм) микрочастиц (например, 63, 65). Например, сниженное перемешивание дает в результате микрочастицы большего размера, что дает увеличение объема внутренней фазы. Мелкие частицы продуцируются с помощью небольших объемов водной фазы при помощи высоких концентраций PVA.
Микрочастицы могут быть также сформированы с применением распылительной сушки и коацервации (например, источники 66, 67 и 68); методики взвешенного слоя, такие как сушка во взвешенном слое и слой Wurster (69, 70), ионное гелеобразование (71).
Перед использованием микрочастиц содержание антигена обычно определяют с тем, чтобы соответствующее количество микрочастиц можно было ввести субъекту для получения адекватного иммунного ответа.
Содержание антигена в микрочастицах можно определить известными специалистам методами, такими как разрушение микрочастиц и экстрагирование заключенного в них антигена. Например, микрочастицы можно растворить в диметилхлориде и экстрагировать белок в дистиллированную воду (например, источники 72, 73, 74). Альтернативно, микрочастицы можно диспергировать в 0,1 М NaOH, содержащем 5% (в/о) ДСН. Образец взбалтывают, центрифугируют и проводят количественный анализ супернатанта на антиген, применяя подходящий метод анализа (75).
Антиген и/или CpG-олигонуклеотиды можно включить в микрочастицы. Захват будет обычно осуществляться путем обеспечения присутствия антигена/олигонуклеотида при образовании микрочастиц, в то время как адсорбция на поверхности достигается путем добавления антигена/олигонуклеотида к предварительно полученным микрочастицам.
Одним из методов адсорбции антигена/олигонуклеотида на предварительно полученных микрочастицах является следующий. К микрочастицам добавляют воду и диспергируют до по существу мономерной суспензии микрочастиц, используя диализируемые анионные и катионные детергенты. Подходящие детергенты включают, но не ограничиваются ими, любой из разнообразных N-метилглюкамидов (известных как MEGA), таких как гептаноил-N-метилглюкамид (MEGA-7), октаноил-N-метилглюкамид (MEGA-8), нонаноил-N-метилглюкамид (MEGA-9) и деканоил-N-метилглюкамид (MEGA-10); холевая кислота; холат натрия; дезоксихолевая кислота; дезоксихолат натрия; таурохолевая кислота; таурохолат натрия; тауродезоксихолевая кислота; тауродезоксихолат натрия; 3-((3-холамидопропил)диметиламмонио)-1-пропансульфонат (CHAPS); N-октилглюкозид; 3-((3-холамидопропил)диметиламмонио)-2-гидрокси-1-пропансульфонат (CHAPSO); N-додецил-N,N-диметил-3-аммонио-1-пропансульфонат (ZWITTERGENT 3-12); N,N-БИС-(3-D-глюконамидопропил)-дезоксихоламид (DEOXYBIGCHAP); монолаурат сахарозы; гликохолевая кислота/гликохолат натрия; лауросаркозин (натриевая соль); гликодезоксихолевая кислота/гликодезоксихолат натрия; додецилсульфат натрия (ДСН; SDS); и гексадецилтриметиламмония бромид (СТАВ); додецилтриметиламмония бромид; гексадецилтриметиламмония бромид; тетрадецилтриметиламмония бромид; бензилдиметилдодециламмония бромид; бензилдиметилгексадециламмония хлорид; бензилдиметилтетрадециламмония бромид. Вышеперечисленные детергенты доступны для приобретения. В качестве детергентов можно также использовать различные катионные липиды, известные в данной области техники (76, 77).
Смесь микрочастиц/детергента затем физически растирают, например, используя керамическую ступку и пестик, до образования однородной густой суспензии. Затем добавляют подходящий водный буфер, такой как забуференный фосфатом солевой раствор (ФСБ; PBS) или забуференный Tris солевой раствор, и полученную смесь обрабатывают ультразвуком или гомогенизируют до тех пор, пока микрочастицы полностью не суспендируются. К суспензии микрочастиц затем добавляют антиген/олигонуклеотид и систему диализируют для удаления детергента. Микрочастицы из полимера и детергентную систему предпочтительно выбирают так, что антиген/олигонуклеотид будет адсорбироваться на поверхности микрочастиц, в то же время сохраняя активность. Полученные микрочастицы, содержащие адсорбированные на поверхности антиген/олигонуклеотид, можно отмыть от несвязанного антигена/олигонуклеотида и хранить в виде суспензии в соответствующем буферном составе или лиофилизировать с подходящими вспомогательными веществами, которые описаны далее ниже.
Комбинация антигена/CpG/микрочастицы
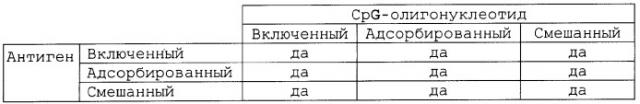
Различные физические взаимоотношения возможны между тремя основными компонентами композиций данного изобретения. Данные взаимоотношения возникают из-за того, что микрочастицы обладают внутренним объемом и поверхностью, оба из которых могут быть использованы для расположения CpG-олигонуклеотида и/или антигена.
Таким образом, данный антиген может быть заключен внутри микрочастиц, он может быть адсорбирован на микрочастицах или он может быть в простой смеси с микрочастицами без включения или адсорбции. Адсорбция является предпочтительной.
Подобным же образом CpG-олигонуклеотид может быть включен в микрочастицы, он может быть адсорбирован на микрочастицах или он может быть в простой смеси с микрочастицами. Адсорбция может быть достигнута при использовании таких детергентов, как CTAB.
CpG-олигонуклеотид и антиген, оба могут одинаково взаимодействовать как с микрочастицами, так и друг с другом, или взаимодействие может быть различным. Также CpG-олигонуклеотид и антиген могут быть адсорбированы на одних и тех же микрочастицах или CpG-олигонуклеотид и антиген могут быть адсорбированы на разных микрочастицах. Все возможные комбинации охватываются данным изобретением:
Композиции данного изобретения могут включать смеси, приведенные выше, например некоторые микрочастицы в композиции имеют заключенный в них антиген, а некоторые имеют адсорбированный антиген.
Фармацевтические композиции
Для фармацевтического применения композиции данного изобретения будут обычно включать фармацевтически приемлемый носитель. Это дает фармацевтическую композицию данного изобретения.
Фармацевтически приемлемый носитель может быть любым веществом, которое само не вызывает продукции антител, опасных для пациента, получающего композицию, и который может вводиться без чрезмерной токсичности. Подходящие носители могут быть представлены большими медленно метаболизируемыми макромолекулами, такими как белки, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, аминокислотные сополимеры и инактивированные вирусные частицы. Такие носители хорошо известны специалистам в данной области. Фармацевтически приемлемые носители могут включать жидкости, такие как вода, физиологический раствор, глицерин и этанол. Вспомогательные вещества, такие как улучшающие смачивание или эмульгирующие средства, буферные вещества для рН и тому подобное, также могут присутствовать в таких носителях. Подходящими носителями являются липосомы. Полное обсуждение фармацевтических носителей можно найти в источнике 78.
Композиции данного изобретения могут быть получены в разных формах. Например, композиции могут быть изготовлены в виде инъекционных форм, или растворов, или суспензий в жидкостях. Могут быть также изготовлены твердые формы, пригодные для получения растворов или суспензий в жидких носителях перед инъекциями. Может быть изготовлена композиция для местного применения, например мазь, крем или порошок. Может быть изготовлена композиция для перорального введения, например, в виде таблетки или капсулы, или сиропа (необязательно с корригентами). Данная композиция может быть изготовлена для легочного введения, например, в виде ингалятора с использованием тонкоизмельченного порошка или аэрозоля. Данная композиция может быть изготовлена в виде суппозитория или пессария. Может быть изготовлена композиция для назального введения, введения в уши или в глаза, например, в виде капель, в виде аэрозоля или в виде порошка (например, 79).
Фармацевтическая композиция является предпочтительно стерильной. Предпочтительно она является апирогенной. Она предпочтительно является буферной, например, с рН 6 и рН 8, обычно около рН 7.
Фармацевтическая композиция может быть лиофилизированной.
Данное изобретение представляет также устройство для доставки, содержащее фармацевтическую композицию данного изобретения. Устройство может представлять собой, например, шприц.
Медицинское лечение и использование
Композиции данного изобретения можно использовать терапевтически (т.е. для лечения существующей вызванной нейссериями инфекции) или профилактически (т.е. для предупреждения вызванной нейссериями инфекции в будущем).
Данное изобретение представляет композицию данного изобретения для использования в качестве лечебного средства.
Данное изобретение представляет также способ повышения антительного ответа у млекопитающего, включающий введение фармацевтической композиции данного изобретения млекопитающему. Антительный ответ является предпочтительно ответом IgA или IgG и предпочтительно он является бактерицидным.
Данное изобретение представляет также способ лечения млекопитающего, страдающего вызванными нейссериями инфекцией и/или заболеванием, включающий введение пациенту фармацевтической композиции данного изобретения.
Данное изобретение представляет также способ защиты млекопитающего от вызванных нейссериями инфекции и/или заболевания, включающий введение млекопитающему фармацевтической композиции данного изобретения.
Данное изобретение представляет также использование (а) антигена нейссерий, (b) CpG-олигонуклеотида и (с) биологически разлагаемых полимерных микрочастиц в производстве лекарственного средства для профилактики или лечения заболевания и/или инфекции у млекопитающего.
Млекопитающее является предпочтительно человеком. Человек может быть взрослым или предпочтительно ребенком. Композиции данного изобретения особенно полезны для иммунизации детей и подростков.
Применение и способы данного изобретения особенно пригодны для лечения/защиты от инфекций, вызванных N.meningitidis. Применение и способы особенно полезны для профилактики/лечения заболеваний, включая бактериальный менингит.
Эффективность терапевтического лечения может быть испытана путем отслеживания вызываемой Neisseria инфекции после введения композиции данного изобретения. Эффективность профилактического лечения может быть испытана путем контроля иммунного ответа на Neisseria после введения данной композиции.
Композиции данного изобретения будут обычно вводить непосредственно пациенту. Прямая доставка может быть осуществлена путем парентеральной инъекции (например, подкожно, внутрибрюшинно, внутривенно, внутримышечно или в интерстициальное пространство ткани) или путем ректального, перорального, вагинального введения, местного применения, трансдермального, в глаза, назального, в уши или пульмонарного введения. Предпочтительны инъекции и интраназальное введение.
Дозировка при лечении может быть представлена режимом с введением единственной дозы или режимом с многократным введением доз.
Дополнительные компоненты
Композиции данного изобретения могут включать адъюванты в дополнение к CpG-олигонуклеотидам и полимерным микрочастицам. Предпочтительные дополнительные адъюванты включают, но не ограничиваются этим: (А) соединения алюминия (например, гидроксид алюминия, фосфат алюминия, гидроксифосфат алюминия, оксигидроксид, ортофосфат, сульфат и т.д. (например, смотрите главы 8 и 9 источника 13)), или смеси разных соединений алюминия, причем соединения принимают любую подходящую форму (например, вид геля, кристаллический, аморфный и т.д.), и предпочтительной является адсорбция; (В) MF59 (5% сквален, 0,5% твин 80 и 0,5% спен 85, изготовленные в виде субмикронных частиц с использованием аппарата для микропсевдоожижения) (смотрите, глава с 10 из 13; см. также ист.80); (С) липосомы (см. главы 13 и 14 из ист.13); (D) ISCOM (см. глава 23 из ист.13), которые могут не содержать дополнительный детергент (81); (Е) SAF, содержащий 10% сквалена, 0,4% твин 80, 5% плурониевого блокполимера L121 и thr-MDP, или микропсевдоожиженный до субмикронной эмульсии или встряхиваемый до получения эмульсии с крупными частицами (см., глава 12 из ист.13); (F) адъювантную систему Ribi™ (RAS), (Ribi Immunochem), содержащую 2% сквалена, 0,2% твин 80 и один или более из компонентов бактериальной клеточной стенки из группы, состоящей из монофосфориллипида А (MPL), димиколата трегалозы (TDM) и каркаса клеточной стенки (CWS), предпочтительно MPL+CWS (Detox™); (G) сапониновые адъюванты, такие как QuilA или QS21 (см. главу 22 из ист.13), известный также как стимулон™ (Stimulon™) (82); (Н) хитозан (например, 83); (I) полный адъювант Фрейнда (ПАФ; CFA) и неполный адъювант Фрейнда (НАФ; IFA); (J) цитокины, такие как интерлейкины (например, IL-1, IL-2, IL-4, IL-5, IL-6, IL-7, IL-12 и т.д.), интерфероны (например, интерферон-г), стимулирующий колонии макрофагов фактор, фактор некроза опухолей и т.д. (см. главы 27 и 28 из ист.13); (К) монофосфориллипид А (MPL) или 3-О-дезацилированный MPL (3dMPL) (например, глава 21 из ист.13); (L) комбинации 3dMPL с, например, QS21 и/или эмульсиями масло-в-воде (84); (М) простой эфир полиоксиэтилена или сложный эфир полиоксиэтилена (85); (N) поверхностно-активное вещество (ПВА) - сложный эфир полиоксиэтиленсорбитана в сочетании с октоксинолом (86) или ПВА - простой эфир или сложный эфир полиоксиэтиленалкила в комбинации с, по меньшей мере, одним дополнительным неионным ПВА, таким как октоксинол (87); (N) частицы соли металла (88); (О) сапонин и эмульсия масло-в-воде (89); (Р) сапонин (например, QS21)+3dMPL+IL-12 (необязательно+стерол) (90); (Q) термолабильный энтеротоксин («LT») E.coli или его детоксифицированные мутанты, такие как мутанты К63 или R72 (например, глава 5 из ист.91); (R) холерный токсин («ХТ») или его детоксифицированные мутанты (например, глава 5 из ист.91); (S) двунитевая РНК и (Т) другие вещества, которые действуют как иммуностимулирующие средства для повышения эффективности композиции (например, см. главу 7 из ист.13). Квасцы (особенно алюминия фосфат и/или гидроксид) и MF59 являются предпочтительными дополнительными адъювантами для парентеральной иммунизации. Мутантные токсины являются предпочтительными мукозными адъювантами.
Мурамиловые пептиды включают N-ацетилмурамил-L-треонил-D-изоглютамин (thr-MDP), N-ацетилнормурамил-L-аланил-D-изоглютамин (nor-MDP), N-ацетилмурамил-L-аланил-D-изоглютаминил-L-аланин-2-(1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)этиламин МТР-РЕ) и т.д.
Помимо антигена(ов) Neisseria композиция может также включать дополнительные антигенные компоненты. Антигены, которые могут быть включены в композицию данного изобретения, включают:
- антигены из Helicobacter pylori, такие как CagA (c 92-95), VacA (96, 97), NAP (98, 99, 100), HopX (например, 101), HopY (например, 101) и/или уреаза;
- препарат везикул наружной мембраны (OMV) из N.meningitidis серогруппы В, такой как описанный в ист.102, 103, 104, 105 и т.д.;
- сахаридный антиген из Streptococcus pneumoniae (например, 106, 107, 108);
- антиген из вируса гепатита А, такой как инактивированный вирус (например, 109, 110);
- антиген из вируса гепатита В, такой как поверхностные и/или ядерные антигены (например, 110, 111);
- антиген из вируса гепатита С (например, 112);
- антиген из Bordetella pertussis, такой как коклюшный голотоксин (РТ) и гемагглютинин микроворсинок (FHA) из B. pertussis, необязательно также в сочетании с пертактином и/или агглютиногенами 2 и 3 (например, ист.113 и 114);
- дифтерийный антиген, такой как дифтерийный токсоид (например, глава 3 из ист.115), например мутанта CRM197 (например, 116);
- столбнячный антиген, такой как столбнячный токсоид (например, глава 4 из ист.115);
- сахаридный антиген из Haemophilus influenzae B (например, 23);
- антиген из Chlamidya pneumoniae (например, 117, 118, 119, 120, 121, 122, 123);
- антиген из Chlamidya trachomatis (например, 124);
- антиген из Porphyromonas gingivalis (например, 125);
- полиоантиген(ы) (например, 126, 127), такие как IPV или OPV;
- антиген(ы) бешенства (например, 128), такие как лиофилизированный инактивированный вирус (например, 129, RabAvert™);
- антиген(ы) кори, паротита и/или краснухи (например, главы 9, 10 и 11 из ист.115);
- антиген(ы) из вируса гриппа (например, глава 19 из ист.115), такие как гемагглютинин и/или нейраминидазные поверхностные белки;
- антиген(ы) из парамиксовирусов, таких как респираторно-синцитиальный вирус (RSV (130, 131)) и/или вирус парагриппа (PIV3 (132));
- антиген из Moraxella catarrhalis (например, 133);
- антиген из Streptococcus agalactiae (стрептококки группы В) (например, 134, 135);
- антиген из Streptococcus pyogenes (стрептококки группы A) (например, 135, 136, 137);
- антиген из Staphylococcus aureus (например, 138);
- антиген из Bacillus anthracis (например, 139, 140, 141);
- антиген из вируса семейства Flaviviridae (род Flavivirus), такой как из вируса желтой лихорадки, вируса японского энцефалита, четырех серотипов вирусов Денге, вируса клещевого энцефалита, вируса лихорадки западного Нила;
- пестивирусный антиген, такой как из вируса классической свиной лихорадки, вируса диареи крупного рогатого скота и/или вируса пограничного заболевания;
- парвовирусного антигена, например, из парвовируса В19;
- прионный белок (например, прионный белок CJD);
- амилоидный протеин, такой как бетапептид (142);
- раковый антиген, такой как антигены, перечисленные в таблице 1 из ист.143 или в таблицах 3 и 4 из ист.144.
Композиция может включать один или более из этих дополнительных антигенов.
Антигены, являющиеся белками токсинов, могут быть детоксифицированы, когда необходимо (например, детоксификация коклюшного токсина химическими и/или генетическими средствами (114)).
Когда в композицию включают дифтерийный антиген, предпочтительно также включить столбнячный антиген и коклюшные антигены. Подобным же образом, когда включен столбнячный антиген, предпочтительно также включать дифтерийный антиген и коклюшные антигены. Подобным же образом, когда включен коклюшный антиген, предпочтительно также включать дифтерийный антиген и столбнячный антиген.
Антигены предпочтительно адсорбируют на соли алюминия.
Антигены в композиции будут обычно присутствовать в концентрации, равной, по меньшей мере, 1 мкг/мл, каждый. В основном концентрация любого данного антигена будет достаточной для получения иммунного ответа против этого антигена.
В качестве альтернативы использования белковых антигенов в композиции данного изобретения можно использовать нуклеиновые кислоты, кодирующие данные антигены. Белковые компоненты композиций данного изобретения могут быть, таким образом, заменены нуклеиновыми кислотами (предпочтительно ДНК, например, в виде плазмид), которые кодируют белки.
Определения
Термин «содержащая» означает «включающая», а также «состоящая из», например композиция, «содержащая» Х, может состоять исключительно из Х или может включать что-нибудь дополнительное, например Х+Y.
Упоминания о проценте идентичности последовательности между двумя аминокислотными последовательностями означает при выравнивании процент аминокислот, которые являются одинаковыми при сравнении двух последовательностей. Это выравнивание и процент гомологии или идентичности последовательности можно определить с использованием программного обеспечения, известного в данной области техники, например программ, описанных в разделе 7.7.18 источника 145. Предпочтительное выравнивание определяется по алгоритму поиска гомологии Smith-Waterman с использованием поиска аффинного интервала с удалением открытого интервала, равным 12, и с удлинением интервала удаления, равным 2, матрица BLOSUM из 62. Алгоритм поиска гомологии Smith-Waterman указан в источнике 146.
СПОСОБЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Парентеральное примирование и вторичная иммунизация через слизистую антигеном Neisseria meningitidis серогруппы В
В источнике 6 описан белок из N.meningitidis серогруппы В, названный '287'. В источниках с 10 по 12 описаны пути улучшения его экспрессии. Один из путей включает делецию N-конца у белка до и включая шесть повторяющихся глициновых остатков. Этот белок назван “ДG287”.
Мышей примировали и повторно иммунизировали антигеном MenB ДG287 (20 мкг/дозу) из штамма 2996, приготовленного в форме для внутримышечного (IM) введения путем адсорбции на микрочастицах из PLG, с CpG-олигонуклеотидом или без него (также адсорбированным на микрочастицах). В качестве дополнительного препарата для интраназального (IN) введения использовали адъювант LT-К63. Мыши получали или 3 дозы IM или 2 дозы IM, затем 2 дозы IN (дозы вводили на: день 0; 28 день; 84 день и, необязательно, 98 день).
| Таблица 1 | ||||||
| Группа | Препарат | Путь | Доза | Антитела GMT через 2 недели | ||
| доза 2 | доза 3 | доза 4 | ||||
| 1 | PLG/287 | IM | 1,2,3 | 10,729 | 2,853 | - |
| 2 | PLG/287+PLG/CpG | IM | 1,2,3 | 15,673 | 4,163 | - |
| 3 | PLG/287 | IM | 1,2 | 9,064 | 7,948 | 9,412 |
| 287+LT-К63 | IN | 3,4 | ||||
| 4 | PLG/287+PLG/CpG | IM | 1,2 | 34,891 | 15,167 | 16,556 |
| 287+LT-К63 | IN | 3,4 |
Таким образом, включение CpG-олигонуклеотида повышало титры антител против введенного внутримышечно белка MenB 287 (сравниваемые группы 1 и 2). Титры могли быть повышены