Усовершенствованные конъюгаты n4 хелатообразующих агентов
Иллюстрации
Показать всеНастоящее изобретение относится к хелатообразующим агентам и их комплексам с технецием, которые могут быть использованы в качестве радиофармацевтических средств и охарактеризованы формулой I
где X является -NR-, -CO2-, -СО-,
-NR(C=S)-, -NR(C=O)-, -CONR- или Q; Y представляет собой аминокислоту, -СН2-, -СН2OCH2-, -ОСН2СН2O- или X; Z - группировка из пептидов, их аналогов, субстратов, антагонистов или ингибиторов ферментов, рецептор-связывающих соединений, олигонуклеотидов, олиго-ДНК- или олиго-РНК-фрагментов; n - число от 1 до 8; m - число от 0 до 30; R представляет собой Н, С1-4алкил, С2-4алкоксиалкил, С1-4гидроксиалкил или С1-4фторалкил; Q представляет собой остаток сукцинимида, А - фармацевтически приемлемый анион. Технический результат - получение новых хелатообразующих агентов, пригодных для получения комплексов технеция. 5 н. и 17 з.п. ф-лы, 3 ил., 2 табл.
Реферат
Область изобретения
Настоящее изобретение относится к усовершенствованным конъюгатам тетрааминных хелатообразующих агентов с обеспечивающими направленную доставку биологическими молекулами, пригодным для образования металлических комплексов с радиоактивным металлом 99mTc. Эти радиоактивные металлические комплексы полезны в качестве 99mTc-радиофармацевтических средств. Предложены также наборы и предшественники.
Предшествующий уровень техники
В US 5489425 (Dow Chemical) раскрыт целый ряд функционализированных тетрааминных хелатообразующих агентов с открытой цепью и макроциклических, пригодных для образования комплексов металлов, в частности комплексов радиоактивного и нерадиоактивного родия, конкретно комплексов радиоактивного 105Rh или 101mRh. Конкретные раскрытые тетраамины включают:
Бифункциональные хелатообразующие агенты описаны как пригодные для конъюгирования с моноклональными антителами или их фрагментами в терапевтических или диагностических целях. В US 5489425 указано (Примеры 21, 22а и 23), что хелатный конъюгат антитело-радиометаллический комплекс получают сначала образованием комплекса металла 105Rh, затем взаимодействием с антителом с последующей очисткой. В US 5489425 не упоминаются конъюгаты антитело-хелатообразующий агент, которые находятся не в форме комплекса, то есть не имеют координированного радиоактивного металла. В US 5489425 нет сведений о том, как разграничивать боковую аминогруппу и четыре аминогруппы хелатообразующего агента в таких реакциях конъюгирования с антителом. В US 5489425 утверждается, что бифункциональные хелатообразующие агенты "могли бы быть использованы также в образовании комплексов технеция и рения", но не раскрыто, как этого можно достичь, не раскрыты также какие-либо реальные комплексы технеция.
В US 5650134 раскрыт конъюгат соматостатиновый пептид-хелатообразующий агент из ряда хелатообразующих агентов. В Примере 1 описано конъюгирование 6-(п-изотиоцианатобензил)-1,4,8,11-тетраазаундекана с октреотидным пептидом.
В ЕР 1181936 А1 раскрыты конъюгаты бомбезина (то есть тетрадекапептида) с тетрааминными хелатообразующими агентами, полученные с использованием бифункциональных хелатообразующих агентов BBN-1 и BBN-2, и их 99mTc-комплексы:
где Boc - трет-бутоксикарбонильная защитная группа.
Указано, что комплексы 99mTc демонстрируют быстрый клиренс из мышиного организма через почки и мочевую систему. В ЕР 1181936 А1 не дано, однако, никакого описания или ссылки на синтез BBN-1 или BBN-2, кроме ссылки на стадию, где их конъюгируют с N-концом бомбезина. Конъюгирование BBN-2 с бомбезином и 99mTc-мечение с образованием потенциального радиофармацевтического средства для визуализации опухолей было описано Nock et al. [Eur. J. Nucl. Med., 30(2), 247-258
(2003)]. Сообщается, что комплекс 99mTc придает улучшенную гидрофильность по сравнению с бомбезин-хелатными конъюгатами предшествующего уровня техники и поэтому ожидается, что он благоприятствует экскреции через почки и мочевую систему.
Конъюгирование BBN-1 с октреотидом и 99mTc-мечение с образованием потенциального радиофармацевтического средства для визуализации опухолей у пациентов-людей было описано Maina et al. [Eur. J. Nucl. Med., 30(9), 1211-1219 (2003)]. Ни в одной из вышеуказанных публикаций, касающихся BBN-1 или BBN-2, не приведен синтез BBN-1 или BBN-2.
Сущность изобретения
Согласно настоящему изобретению предложены конъюгаты тетрааминных хелатообразующих агентов с обеспечивающими направленную доставку биологическими группировками, которые связаны посредством линкерной группы, и их комплексы с технецием в качестве радиофармацевтических средств. Линкерная группа такова, что хелатообразующий агент монофункционализирован в положении головы мостика и обеспечивает как гибкость, так и отсутствие арильных групп для минимизации липофильности и стерической объемистости. Предложены соответствующим образом защищенные варианты хелатообразующих агентов, которые позволяют осуществлять конъюгирование с самыми разнообразными, обеспечивающими направленную доставку молекулами без взаимодействий с аминными атомами азота тетрааминного хелатообразующего агента. Описаны синтезы функционализированных хелатообразующих агентов вместе с бифункциональными хелатными предшественниками.
Описаны радиофармацевтические композиции, содержащие комплексы металла технеция по изобретению, и нерадиоактивные наборы для получения таких радиофармацевтических средств.
Подробное описание изобретения
В первом воплощении настоящего изобретения предложен катионный комплекс технеция 99mTc формулы (I)
,
где Х представляет собой -NR-, -CO2-, -CO-, -NR(C=S)-, -NR(C=O)-, -CONR- или группу Q;
каждый Y независимо представляет собой D- или L-аминокислоту, -СН2-, -CH2OCH2- или -OCH2CH2O-, или группу X;
Z представляет собой синтетическую обеспечивающую направленную доставку биологическую группировку;
n означает целое число от 1 до 8;
m означает целое число от 0 до 30;
R представляет собой Н, С1-4алкил, С2-4алкоксиалкил, С1-4гидроксиалкил или С1-4фторалкил;
Q представляет собой
А представляет собой противоион;
при условии, что цепь атомов X1-(Y)m не имеет связей, где один гетероатом непосредственно связан с другим.
Радиоактивный изотоп технеция может быть γ-излучателем, таким как 99mTc, или позитронным излучателем, подходящим для визуализации методом позитронно-эмиссионной томографии (PET), таким как 94mTc. Предпочтительно радиоактивный изотоп технеция представляет собой 99mTc или 94mTc, наиболее предпочтительно 99mTc.
Х предпочтительно представляет собой -CONR-, -NR(C=O)- или группу Q. Наиболее предпочтительно Х представляет собой -CONR- или -NR(C=O)-, причем -CONH- и -NH(C=O)- особенно предпочтительны.
Линкерная группа -(CH2)n-X-(Y)m- в соединении формулы (I) выбрана таким образом, что цепь атомов Х1-(Y)m не имеет связей, в которых один гетероатом непосредственно связан с другим, где термин "гетероатом" означает атом, не являющийся атомом углерода, такой как атом азота, кислорода или серы. Это означает, что эта цепь не имеет таких связей, как O-O, N-N или O-N.
Представляется, что роль линкерной группы -(CH2)n-X-(Y)m- в соединении формулы (I) заключается в том, чтобы дистанцировать комплекс технеция от активного сайта связывания обеспечивающей направленную доставку биологической группировки (Z) in vivo. Это дает возможность гарантировать, что относительно объемный комплекс технеция стерически не будет ингибировать связывание с активными сайтами in vivo. Алкиленовая группа -(СН2)n- имеет преимущество в том, что отсутствуют значительные взаимодействия с конъюгированной обеспечивающей направленную доставку биологической группировкой (Z) с образованием водородных связей, так что линкер не наматывается на Z. В предпочтительных алкиленовых группах n равно числу от 1 до 6, наиболее предпочтительно от 2 до 4 и особенно предпочтительно 2.
Линкерные группы по настоящему изобретению не имеют арильных колец. Это способствует минимизации липофильности технециевого комплекса с линкерной группой, которая присоединена к обеспечивающей направленную доставку биологической группировке (Z) конъюгата. Также минимизируются стерическая объемистость и молекулярная масса линкерной группы (и, следовательно, технециевого комплекса), при этом гибкость связи сохраняется.
Природа линкерной группы может быть также использована для модификации биораспределения визуализирующего агента. Так, например, введение простых эфирных групп в -(Y)m- будет способствовать минимизации связывания белков плазмы. В тех случаях, когда -(Y)m- содержит полиэтиленгликолевый (PEG) структурный элемент или пептидную цепь из 1-10 аминокислотных остатков, линкерная группа может выполнять функцию модификатора фармакокинетики и почечного клиренса визуализирующего агента in vivo. Такие линкерные группы-"биомодификаторы" могут ускорять выведение технециевого визуализирующего агента из фоновой ткани, такой как мышца или печень, и/или из крови, что позволяет получить более качественное диагностическое изображение благодаря меньшим фоновым помехам. Линкерная группа-биомодификатор может быть также использована для способствования конкретному пути экскреции, например через почки, а не через печень. Альтернативно такие линкерные группы могут пролонгировать срок пребывания в крови, обеспечивая аккумулирование большего количества агента в сайте-мишени in vivo.
В тех случаях, когда -(Y)m- содержит пептидную цепь из аминокислотных остатков, эти аминокислотные остатки предпочтительно выбраны из глицина, лизина, аспарагиновой кислоты, глутаминовой кислоты или серина. Количество аминокислот в пептидной цепи составляет предпочтительно от 1 до 10, наиболее предпочтительно от 1 до 3.
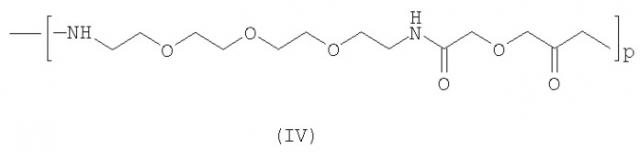
В тех случаях, когда -(Y)m- содержит группировку PEG, она предпочтительно содержит группу формулы (-OCH2CH2O)w-, где w означает целое число, имеющее значение от 3 до 25. Целым числом w предпочтительно является число от 6 до 22. Особенно предпочтительной PEG-содержащей группой -(Y)m- является группировка, образующаяся в результате полимеризации монодисперсной PEG-подобной структуры 17-амино-5-оксо-6-аза-3,9,12,15-тетраоксагептадекановой кислоты формулы (IV)
,
где р означает целое число от 1 до 10.
Под термином "фторалкил" подразумевается алкильная группа с по меньшей мере одним заместителем фтором, то есть этот термин охватывает группы от монофторалкильной (например, -CH2F) до перфторалкильной (например, CF3).
Группа -(Y)m- предпочтительно содержит группировку дигликолевой кислоты, малеимидную группировку, группировку глутаровой кислоты, группировку янтарной кислоты, группировку на основе полиэтиленгликоля или PEG-подобную группировку формулы IV.
Термин "синтетический" имеет общепринятое значение этого термина, то есть созданный человеком в отличие от выделенного из природных источников, например из организма млекопитающего. Такие соединения имеют преимущество в том, что их производство и показатели чистоты можно полностью контролировать. Таким образом, моноклональные антитела и их фрагменты не входят в объем настоящих притязаний.
Под термином "обеспечивающая направленную доставку биологическая группировка" подразумеваются 3-100-мерные пептиды или пептидные аналоги, которые могут представлять собой линейные пептиды или циклические пептиды, или их комбинации; или субстраты, антагонисты или ингибиторы ферментов; синтетические рецептор-связывающие соединения; олигонуклеотиды или олиго-ДНК- или олиго-РНК-фрагменты.
Термин "циклический пептид" означает последовательность из 5-15 аминокислот, в которой две концевые аминокислоты связаны вместе ковалентной связью, которая может представлять собой пептидную или дисульфидную связь, или синтетическую непептидную связь, такую как тиоэфирная, фосфодиэфирная, дисилоксановая или уретановая связь.
Под термином "аминокислота" подразумевается L- или D-аминокислота, аналог аминокислоты или миметик аминокислоты, которые могут быть оптически чистыми, то есть могут представлять собой единственный энантиомер и, следовательно, хиральный, или смесь энантиомеров. Предпочтительно аминокислоты по настоящему изобретению являются оптически чистыми.
Термин "миметик аминокислоты" относится к синтетическим аналогам встречающихся в природе аминокислот, которые являются изостерами, то есть имитируют стерическую и электронную структуру природного соединения. Такие изостеры общеизвестны в данной области и включают депсипептиды, ретроинверсопептиды, тиоамиды, циклоалканы или 1,5-дизамещенные тетразолы [смотри М.Goodman, Biopolymers, 24, 137, (1985)], но не ограничиваются ими.
Подходящие пептиды для использования в настоящем изобретении включают:
- соматостатин, октреотид и аналоги;
- пептиды, которые связываются с ST-рецептором, где ST относится к термостабильному токсину, продуцируемому E.coli и другими микроорганизмами;
- фрагменты ламинина, например YIGSR, PDSGR, IKVAV, LRE и KCQAGTFALRGDPQG;
- N-формильные пептиды для направленной доставки к сайтам аккумуляции лейкоцитов;
- тромбоцитарный фактор 4 (PF4) и его фрагменты;
- RGD (Arg-Cly-Asp)-содержащие пептиды, которые могут, например, направлено воздействовать на ангиогенез [R.Pasqualian et al., Nat Biotechnol. 1997 Jun; 15(6): 542-6; E.Ruoslahti, Kidney Int. 1997 May, 51(5); 1413-7];
- пептидные фрагменты α2-антиплазмина, фибронектина или бета-казеина, фибриногена или тромбоспондина; аминокислотные последовательности α2-антиплазмина, фибронектина, бета-казеина, фибриногена и тромбоспондина можно найти в следующих публикациях: предшественник α2-антиплазмина [М.Tone et al., J. Biochem, 102, 1033, (1987)], бета-казеин [L.Hansson et al., Gene, 139. 193 (1994)], фибронектин [A.Gutman et al., FEBS Lett, 207. 145 (1996)], предшественник тромбоспондина-1 [V.Dixit et al., Proc. Natl. Acad. Sci., USA, 83, 5449 (1986)], R.F.Doolittle, Ann. Rev. Biochem., 53, 195 (1984);
- пептиды, которые являются субстратами или ингибиторами ангиотензина, такие как ангиотензин II Asp-Arg-Val-Tyr-lle-His-Pro-Phe (E.C.Jorgensen et al., J. Med. Chem., 1979, Vol.22, 9, 1038-1044),
[Sar, lie] ангиотензин II: Sar-Arg-Val-Tyr-lle-His-Pro-lle (R.K.Turker et al., Science, 1972, 177, 1203),
- ангиотензин I: Asp-Arg-Val-Tyr-lle-His-Pro-Phe-His-Leu.
Предпочтительно пептиды по настоящему изобретению содержат пептиды антиплазмина или ангиотензина II. Пептиды антиплазмина содержат аминокислотную последовательность, взятую с N-конца:
1) α2-антиплазмина,
то есть NH2-Asn-Gln-Glu-Gln-Val-Ser-Pro-Leu-Thr-Leu-Thr-Leu-Leu-Lys-OH,
или варианты этой последовательности, в которых одна или более аминокислот заменены, добавлены или удалены, такие как:
NH2-Asn-Gln-Glu-Gln-Val-Ser-Pro-Leu-Thr-Leu-Thr-Leu-Leu-Lys-Gly-OH,
NH2-Asn-Gln-Glu-Ala-Val-Ser-Pro-Leu-Thr-Leu-Thr-Leu-Leu-Lys-Gly-OH,
NH2-Asn-Gln-Glu-Gln-Val-Gly-OH, или
2) казеина,
то есть Ac-Leu-Gly-Pro-Gly-Gln-Ser-Lys-Val-lle-GIy.
Синтетические пептиды по настоящему изобретению могут быть получены стандартным твердофазным синтезом, как описано в Р.Lloyd-Williams, F.Albericio and E.Girald; Chemical Approaches to the Synthesis of Peptides and Proteins, CRC Press, 1997.
Подходящие субстраты, антагонисты или ингибиторы ферментов включают глюкозу и аналоги глюкозы, такие как фтордезоксиглюкоза; жирные кислоты, или ингибиторы эластазы, ангиотензина II или металлопротеиназы. Предпочтительным непептидным антагонистом ангиотензина II является лозартан.
Подходящие синтетические рецептор-связывающие соединения включают эстрадиол, эстроген, прогестин, прогестерон и другие стероидные гормоны; лиганды для дофаминового D-1 или D-2 рецептора или транспортеры дофамина, например тропаны, и лиганды для серотонинового рецептора.
Обеспечивающая направленную доставку биологическая группировка (Z) предпочтительно имеет молекулярную массу менее 5000, наиболее предпочтительно менее 4000, идеально менее 3000. Это дает преимущество в том, что улучшенные биологические характеристики тетрааминных комплексов технеция по изобретению могут оказывать влияние на общее биораспределение, в частности клиренс, технециевого комплекса конъюгата формулы I. Когда n равно 3 и Х содержит атом азота, непосредственно связанный с группой (СН2)n, тогда выбранный Z является синтетическим и имеющим молекулярную массу менее 4000. Предпочтительными обеспечивающими направленную доставку биологическими группировками являются 3-20-мерные пептиды или субстраты ферментов, антагонисты ферментов или ингибиторы ферментов.
Противоион (А-) представляет собой анион, который присутствует в эквимолярном количестве и, таким образом, уравновешивает положительный заряд на Tc(V) диоксотехнециевом комплексе формулы I. Анион (А) соответственно является одно- или многозарядным при условии, что присутствует в уравновешивающем заряд количестве. Подходящий анион образует неорганическая или органическая кислота. Примеры подходящих анионов включают галогенидные ионы, такие как хлорид или бромид, сульфатный, нитратный, цитратный, ацетатный, фосфатный и боратный ионы. Предпочтительными анионами являются хлоридные.
Комплексы технеция формулы I имеют преимущество в том, что они стабильны после комплексообразования и содержат авидный хелатообразующий агент (cheland), который связывает технеций предпочтительно с обеспечивающей направленную доставку биологической группировкой. Поэтому маловероятно, что комплекс технеция будет подвергаться реакциям трансхелатирования с биологическими макромолекулами или конкурирующими лигандами in vivo. Комплексы технеция небольшие и компактные, что полезно, поскольку они оказывают минимальное стерическое влияние на конъюгированную обеспечивающую направленную доставку биологическую группировку (Z). Постоянный катионный обмен и Tc(V) диоксоядро означают, что комплексы также являются гидрофильными и поэтому вряд ли будут распределяться внутриклеточно в другие компартменты, и, следовательно, будут более быстро выводиться из фоновых органов и тканей in vivo, например из кровотока.
Комплексы технеция формулы I могут быть получены путем взаимодействия подходящего источника технеция с конъюгатом хелатообразующего агента, имеющим формулу II, как описано во втором воплощении ниже.
Во втором воплощении настоящего изобретения предложен конъюгат хелатообразующего агента формулы II
где X, Y, Z, n и m такие, как определено выше;
Q1-Q6 независимо представляют собой группы Q, где Q представляет собой Н или защитную группу для аминогрупп.
Эти конъюгаты хелатообразующего агента используют в получении комплексов технеция формулы I первого воплощения.
Под термином "защитная группа" подразумевается группа, которая ингибирует или подавляет нежелательные химические реакции, но которая достаточно реакционноспособна, чтобы ее можно было отщепить от функциональной группы в достаточно мягких условиях, в которых остальная часть молекулы не подвергается модификации. После удаления защитных групп получают целевой продукт. Защитные группы для аминогрупп общеизвестны специалистам в данной области и соответственно выбраны из Boc (Boc означает трет-бутилоксикарбонил), Fmoc (Fmoc означает флуоренилметоксикарбонил), трифторацетила, аллилоксикарбонила, Dde [то есть 1-(4,4-диметил-2,6-диоксоциклогексилиден)этила] или Npys (то есть 3-нитро-2-пиридинсульфенила). В некоторых случаях характер защиты может быть таким, что защитными группами являются как группы Q1/Q2, так и Q5/Q6, то есть на ассоциированном атоме азота амина связь NH отсутствует. Использование других защитных групп описано в "Protective Groups in Organic Synthesis", Theorodora W.Greene and Peter G.M.Wuts (John Wiley & Sons, 1991). Предпочтительными защитными группами для аминогрупп являются Вое и Fmoc, наиболее предпочтительно Вос. Если используют Вос, то обе группы Q1 и Q6 представляют собой Н, а группы Q2, Q3, Q4 и
Q5, каждая, представляют собой трет-бутоксикарбонил.
В конъюгатах формулы II защитные группы для аминогрупп служат в основном для защиты функциональных аминогрупп тетрааминного хелатообразующего агента в ходе химического синтеза до реакции образования комплекса с технецием. Однако, если обеспечивающая направленную доставку биологическая группировка (Z) способна вступать в реакцию с первичными и/или вторичными аминами, то эти защитные группы могут быть также полезны для предотвращения нежелательных химических реакций между хелатообразующими аминами и Z перед образованием комплекса с технецием.
Предпочтительные конъюгаты формулы II имеют по меньшей мере один незащищенный аминный атом азота (то есть одна из групп Q3 или Q4 представляет собой Н или обе группы Q1/Q2 или Q5/Q6 представляют собой Н). Одна или более свободных аминогрупп означает, что конъюгат более быстро растворяется в водной среде, которая является предпочтительным растворителем для получения комплекса технеция формулы I. Свободная аминогруппа также означает, что образование комплекса с технецием происходит более быстро, поскольку комплексообразование не зависит от предварительного удаления защитной группы, что также препятствовало бы образованию металлического комплекса. Если конъюгированная обеспечивающая направленную доставку биологическая группировка (Z) не восприимчива к дальнейшей реакции с аминами, то удобно использовать конъюгат формулы II в полностью лишенной защиты форме (то есть каждая из групп Q1-Q6 представляет собой Н), и такой конъюгат хелатообразующего агента формулы II является особенно предпочтительным. Полностью лишенная защиты форма предпочтительна для реакции комплексообразования с получением комплекса технеция формулы I.
Комплексы технеция формулы I по настоящему изобретению могут быть получены путем взаимодействия раствора радиоактивного металла в подходящем состоянии окисления с конъюгатом хелатообразующего агента формулы II при подходящем рН. Раствор возможно может содержать лиганд, который образует слабый комплекс с технецием (такой как глюконат или цитрат), то есть комплекс технеция получают путем обмена лигандов или трансхелатированием. Такие условия часто используют для подавления нежелательных побочных реакций, таких как гидролиз иона технеция, но они менее важны при использовании хелатообразующих агентов по настоящему изобретению, поскольку они быстро образуют комплексы с технецием. Если радиоактивный изотоп представляет собой 99mTc, то обычно исходным веществом является пертехнетат технеция из 99Мо генератора. Технеций присутствует в 99mTc-пертехнетате в состоянии окисления Tc(VII), в котором он относительно нереакционноспособен. Поэтому получение комплексов технеция в более низком состоянии окисления от Тс(I) до Tc(V) обычно требует добавления подходящего фармацевтически приемлемого восстановителя, такого как дитионат натрия, бисульфит натрия, аскорбиновая кислота, формамидин-сульфиновая кислота, ион олова, Fe(II) или Cu(I), чтобы способствовать комплексообразованию. Фармацевтически приемлемый восстановитель предпочтительно представляет собой соль двухвалентного олова, наиболее предпочтительно хлорид двухвалентного олова, фторид двухвалентного олова или тартрат двухвалентного олова.
Конъюгаты хелатообразующего агента формулы II могут быть получены конъюгированием обеспечивающей направленную доставку биологической молекулы (Z) с бифункциональным хелатообразующим агентом формулы III, как описано в пятом воплощении ниже.
В третьем воплощении настоящего изобретения предложено радиофармацевтическое средство, которое содержит комплекс технеция первого воплощения, где А представляет собой фармацевтически приемлемый противоион, вместе биосовместимым носителем в форме, подходящей для введения человеку.
Фраза "в форме, подходящей для введения человеку" означает, что композиция стерильна, апирогенна, не содержит соединений, которые вызывают токсические и вредные эффекты, и приготовлена в виде препарата с биосовместимым рН (приблизительно рН 4,0-10,5). В таких композициях нет включений, которые могли бы стать причиной эмболии in vivo, и они приготовлены так, что при контакте с биологическими жидкостями (например, кровью) преципитация не происходит. Кроме того, такие композиции содержат только биологически совместимые эксципиенты и предпочтительно являются изотоническими.
"Биосовместимый носитель" представляет собой текучую среду, в частности жидкость, в которой радиофармацевтическое средство суспендировано или предпочтительно растворено, такую, чтобы композиция была физиологически приемлемой, то есть чтобы ее можно было вводить в организм млекопитающего без токсического воздействия или чрезмерного дискомфорта. Подходящим биосовместимым носителем является инъекционный носитель-жидкость, такой как стерильная, апирогенная вода для инъекций; водный раствор, такой как физиологический раствор (который предпочтительно может быть сбалансирован так, чтобы конечный продукт для инъецирования был или изотоническим, или не гипотоническим); водный раствор одного или более веществ, регулирующих тоничность (например, солей катионов плазмы с биосовместимыми противоионами), сахаров (например, глюкозы или сахарозы), сахарных спиртов (например, сорбита или маннита), гликолей (например, глицерина) или других неионных полиолов (например, полиэтиленгликолей, пропиленгликолей и тому подобного).
Под термином "фармацевтически приемлемый противоион" подразумевается анион (то есть отрицательный ион), который не вызывает токсических или вредных эффектов при введении в организм млекопитающего in vivo и совместим химически и/или токсикологически с другими ингредиентами фармацевтической композиции. Химическая совместимость для радиофармацевтических средств на основе технеция по настоящему изобретению означает, что анион не конкурирует эффективно с тетрааминным хелатообразующим агентом за технеций. Подходящие такие анионы включают галогениды (например, хлорид, йодид и бромид); С1-2алкилсульфонаты (например, мезилат или этилсульфонат); арилсульфонаты (например, фенилсульфонат или тозилат); С1-2алкилфосфонаты; ди(С1-2)алкилфосфаты (например, диметилфосфат, диэтилфосфат или диглицеролфосфат); арилфосфонаты; арилфосфаты; алкиларилфосфонаты; алкиларилфосфаты; С1-2алкилкарбоксилаты (например, ацетаты, пропионаты, глутаматы или глицераты); арилкарбоксилаты (например, бензоаты) и тому подобное, но не ограничиваются ими. Предпочтительными фармацевтически приемлемыми противоионами являются хлорид, фторид, ацетат, тартрат, гидроксид и фосфат.
Такие радиофармацевтические средства соответственно поставляются в контейнере, который снабжен уплотняющей прокладкой, подходящей для однократного или многократного прокалывания иглой для подкожных инъекций (например, обжимной уплотняющей прокладкой-крышкой) и в то же время сохраняющей стерильность. Такие контейнеры могут содержать однократные или многократные дозы для пациентов. Предпочтительные многодозовые контейнеры представляют собой отдельный объемистый флакон (например, емкостью от 10 до 100 см3), который содержит многократные дозы для пациента, поэтому однократные дозы для пациента можно отбирать в клинические шприцы через различные промежутки времени в течение срока годности препарата в соответствии с клинической ситуацией. Предварительно заполненные шприцы спроектированы таким образом, чтобы содержать однократную дозу для человека и, следовательно, предпочтительно представляют собой одноразовые или другие шприцы, подходящие для клинического применения. Предварительно заполненные шприцы могут быть снабжены защитным экраном для защиты оператора от радиоактивной дозы. Подходящие защитные экраны для шприца с радиофармацевтическим средством известны в данной области и предпочтительно содержат либо свинец, либо вольфрам.
Радиофармацевтические средства по настоящему изобретению содержат радиоактивные изотопы технеция 99mTc или 94mTc, наиболее предпочтительно 99mTc. Если изотоп технеция представляет собой 99mTc, то величина радиоактивности, подходящая для радиофармацевтического средства для диагностической визуализации, находится в пределах от 180 до 1500 МБк 99mTc в зависимости от участка, предназначенного для визуализации in vivo, поглощения и соотношения мишень/фон.
Радиофармацевтические средства на основе технеция по настоящему изобретению могут быть получены различными способами:
1) асептические производственные технологии, когда образование технециевого комплекса, описанное выше для второго воплощения, осуществляют в помещении с чистой окружающей средой;
2) конечная стерилизация, когда образование технециевого комплекса проводят не в условиях асептического производства и затем стерилизуют на последней стадии (например, гамма-излучением или автоклавированием);
3) методология набора, когда стерильный, лиофилизированный нерадиоактивный препарат-набор, содержащий конъюгат хелатообразующего агента формулы II и фармацевтически приемлемый восстановитель плюс другие возможные эксципиенты, подвергают взаимодействию с аликвотой стерильного 99mTc-пертехнетата из генератора 99mTc.
Способ (3) является предпочтительным, а наборы для использования в этом способе описаны в четвертом воплощении (ниже).
В четвертом воплощении настоящего изобретения предложен нерадиоактивный набор для приготовления радиофармацевтической композиции, описанной выше, который включает в себя конъюгат формулы (II) вместе с биосовместимым восстановителем. Такие наборы предназначены для приготовления стерильных радиофармацевтических продуктов, подходящих для введения человеку, например, инъецированием прямо в кровоток. Конъюгаты лиганда и их предпочтительные аспекты описаны во втором воплощении выше.
Для 99mTc набор предпочтительно лиофилизирован и предназначен для разведения стерильным 99mTc-пертехнетатом (TCO4 -) из генератора радиоизотопа 99mTc для получения раствора, подходящего для введения человеку без дополнительных манипуляций. Подходящие наборы включают в себя контейнер (например, флакон с уплотняющей прокладкой), содержащий конъюгат хелатообразующего агента в форме либо свободного основания, либо соли с кислотой, вместе с биосовместимым восстановителем, таким как дитионит натрия, бисульфит натрия, аскорбиновая кислота, формамидинсульфиновая кислота, ион олова, Fe(II) или Cu(I). Биосовместимый восстановитель предпочтительно представляет собой соль двухвалентного олова, такую как хлорид олова или тартрат олова. Альтернативно набор возможно может содержать комплекс нерадиоактивного металла, который при добавлении технеция подвергается трансметаллированию (то есть металлообмену) с получением целевого продукта.
Нерадиоактивные наборы возможно могут также включать в себя дополнительные компоненты, такие как трансхелатообразующий агент, радиопротектор, противомикробный консервант, рН-регулирующий агент или наполнитель. "Трансхелатообразующий агент" представляет собой соединение, которое быстро взаимодействует с образованием слабого комплекса с технецием, а затем вытесняется хелатообразующим агентом. Это минимизирует риск образования восстановленного гидролизованного технеция (RHT) вследствие быстрого восстановления пертехнетата, конкурирующего с процессом образования комплекса с технецием. Подходящими такими трансхелатообразующими агентами являются соли слабой органической кислоты, то есть органической кислоты, имеющей рКа в пределах от 3 до 7, с биосовместимым катионом. Под термином "биосовместимый катион" подразумевается положительно заряженный противоион, который образует соль с ионизированной, отрицательно заряженной анионной группой, где указанный положительно заряженный противоион также является нетоксичным и, следовательно, подходящим для введения в организм млекопитающего, в частности в организм человека. Примеры подходящих биосовместимых катионов включают щелочные металлы, натрий или калий; щелочно-земельные металлы, кальций и магний, и ион аммония. Предпочтительными биосовместимыми катионами являются натрий и калий, наиболее предпочтительно натрий. Подходящими такими слабыми органическими кислотами являются уксусная кислота, лимонная кислота, винная кислота, глюконовая кислота, глюкогептоновая кислота, бензойная кислота, фенолы или фосфоновые кислоты. Соответственно, подходящими солями являются ацетаты, цитраты, тартраты, глюконаты, глюкогептонаты, бензоаты, феноляты или фосфонаты. Предпочтительными такими солями являются тартраты, глюконаты, глюкогептонаты, бензоаты или фосфонаты, более предпочтительно фосфонаты, наиболее предпочтительно дифосфонаты. Предпочтительным таким трансхелатообразующим агентом является соль MDP, то есть метилендифосфоновой кислоты, с биосовместимым катионом.
Под термином "радиопротектор" подразумевается соединение, которое ингибирует реакции деградации, такие как окислительно-восстановительные процессы, путем захвата высокореакционноспособных свободных радикалов, таких как кислородсодержащие свободные радикалы, образующиеся в результате радиолиза воды. Радиопротекторы по настоящему изобретению соответственно выбраны из аскорбиновой кислоты, пара-аминобензойной кислоты (то есть 4-аминобензойной кислоты или РАВА), гентизиновой кислоты (то есть 2,5-дигидроксибензойной кислоты) и их солей с биосовместимым катионом, как он определен выше.
Термин "противомикробный консервант" означает агент, который подавляет рост потенциально опасных микроорганизмов, таких как бактерии, дрожжи или плесени. Противомикробный консервант может также проявлять некоторые бактерицидные свойства в зависимости от дозы. Главная роль противомикробного(ых) консерванта(ов) по настоящему изобретению заключается в подавлении роста любого такого микроорганизма в радиофармацевтической композиции после ее разведения, то есть в самом радиоактивном диагностическом продукте. Однако противомикробный консервант возможно может быть использован также для подавления роста потенциально опасных микроорганизмов в одном или более чем одном компоненте нерадиоактивного набора по настоящему изобретению перед разведением. Подходящие противомикробные консерванты включают парабены, то есть метил-, этил-, пропил- или бутилпарабен или их смеси, бензиловый спирт; фенол; крезол; цетримид и тиомерсал. Предпочтительным противомикробным(и) консервантом(ами) являются парабены.
Термин "рН-регулирующий агент" означает соединение или смесь соединений, используемое(ая) для обеспечения рН разведенного набора в приемлемых пределах (приблизительно рН от 4,0 до 10,5) для введения человеку или млекопитающему. Подходящие рН-регулирующие агенты включают фармацевтически приемлемые буферы, такие как трицин, фосфат или TRIS (то есть трис(гидроксиметил)аминометан), и фармацевтически приемлемые основания, такие как карбонат натрия, бикарбонат натрия или их смеси. При использовании конъюгата в форме соли с кислотой рН-регулирующий агент возможно может находиться в отдельном флаконе или контейнере, чтобы пользователь набора мог регулировать рН, выполняя это как часть многостадийной процедуры.
Под термином "наполнитель" подразумевается фармацевтически приемлемый, увеличивающий объем агент, который может облегчить обращение с материалом в процессе производства и лиофилизации. Подходящие такие наполнители включают неорганические соли, например хлорид натрия, и водорастворимые сахара или сахарные спирты, такие как сахароза, мальтоза, маннит или трегалоза.
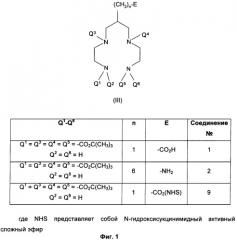
В пятом воплощении настоящего изобретения предложено соединение формулы III
где Q1-Q6 и n такие, как определено для формул I и II выше;
Е представляет собой функциональную группу, подходящую для конъюгирования с обеспечивающей направленную доставку группировкой (Z) первого воплощения,
с условиями, что
1) когда n равно 3, тогда по меньшей мере один из Q1-Q6 представляет собой защитную группу для аминогрупп;
2) когда n равно 3 или 5, тогда Е не является ОН.
Соединение формулы III представляет собой "бифункциональный хелатообразующий агент", то есть хелатообразующий агент с одной или более присоединенными функциональными группами (Е). Функциональная группа (Е) является группой, подходящей для конъюгирования с биологической обеспечивающей направленную доставку группировкой (Z). Подходящие такие функциональные группы (Е) включают амин, тиоцианат, малеимид и активные сложные эфиры. Предпочтительно Е не содержит неактивированную гидроксильную (-ОН) группу. Термин "активный сложный эфир" означает эфирное производное карбоновой кислоты, которое является лучшей уходящей группой и, следовательно, обеспечивает более легкое взаимодействие с нуклеофилами, присутствующими на биологической обеспечивающей направленную доставку группировке, например а