Гибридный белок cfp10-esat6, индуцирующий реакцию гиперчувствительности замедленного типа в отношении m.tuberculosis, кодирующая его химерная нуклеиновая кислота и рекомбинантный плазмидный экспрессирующий вектор, ее содержащий, способ получения гибридного белка и дозированная лекарственная форма для внутрикожной инъекции на его основе
Иллюстрации
Показать всеПредложен новый гибридный белок CFP10-ESAT6 из М.tuberculosis, индуцирующий реакцию гиперчувствительности замедленного типа в отношении М.tuberculosis. Описана химерная НК, кодирующая предложенный белок. Раскрыт способ получения предложенного белка путем культивирования клеток штамма BL21(DE3) E.Coli, трансформированных сконструированным рекомбинантным вектором экспрессии на основе плазмиды pET22b(+). Предложена дозированная лекарственная форма, содержащая предложенный белок, для внутрикожного введения для диагностики туберкулезной инфекции. Изобретение позволяет получить высокой выход белока CFP10-ESAT6, обладающего специфической иммуногенностью. 5 н. и 3 з.п. ф-лы, 2 ил., 7 табл.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к области медицины, фармакологии и биотехнологии, конкретно к новому диагностикуму в виде дозированной лекарственной формы для внутрикожного введения, позволяющему осуществить диагностику туберкулезного процесса, новому гибридному белку CFP10-ESAT6, полученному с помощью новой рекомбинантной плазмидной ДНК.
Уровень техники
Исследования, проведенные Всемирной организацией здравоохранения (ВОЗ), показали, что проблема туберкулеза (ТБ) по-прежнему стоит чрезвычайно остро, о чем свидетельствует уровень инфицированности населения земного шара, составляющий свыше 1 миллиарда человек. Около 8 миллионов человек заболевают туберкулезом каждый год. При этом 44% болеют легочной формой этого заболевания. Около 2 млн. человек умирает ежегодно, что составляет 23% смертельных исходов в мировом масштабе и превышает 50% летальности в Африканских странах (Dye С., Scheele S., Dolin P., Pathania V. and Ravinglione M. С., 1999, JAMA, 282, 7,677-686).
Для контроля за распространением ТБ и значительного снижения риска распространения этого заболевания необходимо, в том числе, создание эффективных реагентов для специфичной диагностики.
Базовым методом выявления туберкулезной инфекции многие годы является реакция Манту.
В основе этого метода лежит определение гиперчувствительности замедленного типа в отношении антигенных детерминант микобактерий. Реагент для постановки кожной пробы представляет собой суммарный экстракт антигенов из Mycobacterium bovis, что предопределяет очень низкий уровень специфичности реакции Манту. Положительная проба не выявляет различий между активной формой заболевания, предварительной сенсибилизацией в результате контакта с М.tuberculosis, БЦЖ (BCG) вакцинацией или перекрестной сенсибилизацией другими видами микобактерий. Более того, антигенные компоненты пробы не стандартизованы и поэтому пробы из разных источников могут различаться по кожной реакции (Mustafa A.S., T-cell subsets and cytokines interplay in infectious diseases, pp.201-211).
Таким образом, сложилась настоятельная необходимость идентифицировать антигены М.tuberculosis, которые могут стать кандидатами для производства улучшенных вакцин с универсальной эффективностью и специфических диагностических реагентов для детекции ТБ.
Развитие биотехнологии, в частности использование технологий ДНК клонирования и экспрессии, значительно облегчило идентификацию нескольких основных антигенов M.tuberculosis.
На основе некоторых из идентифицированных антигенов M.tuberculosis (в основном это белки "теплового шока", такие как hspl8, hsp60, hsp70 и секретируемые белки-антигены) были разработаны методы диагностики гиперчувствительности замедленного типа (ГЗТ) (см., например, патент US 6458366, «Compounds for diagnosis of tuberculosis and methods of their use». Патент WO 0021983 «ТВ vaccine and diagnostic based on antigens from M.tuberculosis cell». Патент US 6120776 «Diagnostic skin test for tuberculosis»).
Общим недостатком этих подходов является отсутствие полной специфичности используемых белковых, полипептидных в том числе, гибридных реагентов в отношении M.tuberculosis, так как подобные белки-полипептиды имеются в штаммах других микобактерий и в вакцинном штамме БЦЖ. В случае наличия последнего обстоятельства, разработанные подходы не пригодны для дифференциальной диагностики инфекционного иммунитета от поствакцинального.
В последние годы в результате сравнительного анализа геномов различных микобактерий было установлено, что M.tuberculosis обеспечивает синтез двух секреторных белков ESAT6 и CFP10, которые отсутствуют у М.bovis и большинства непатогенных бактерий (Mustafa A.S., 2001, Carrent Pharmaceutical Biotechnology, 2, 157-173).
На основе только пептидов белка ESAT6 была создана специфическая диагностическая система, позволяющая уверенно дифференцировать гиперчувствительность замедленного типа (ГЗТ) поствакцинального происхождения и ГЗТ, появляющуюся при инфицировании М.tuberculosis (патент WO 00262248 «Tuberculosis diagnostic test»).
На основе этого диагностикума был разработан метод диагностики туберкулезной инфекции путем индукции реакции гиперчувствительности замедленного типа инкубацией Т-лимфоцитов преимущественно периферической крови пациента в условиях in vitro со смесью указанных выше антигенов. В случае положительной реакции с помощью чувствительных иммунологических методов фиксировался повышенный уровень синтеза γ-интерферона.
Однако известный способ очень сложен в постановке, требует дорогостоящего оборудования и реагентов, а потому не пригоден для массового применения в качестве скринингового метода.
В связи с чем, авторами предлагаемого в данной заявке изобретения был сконструирован неприродный гибридный белок, содержащий антигенные детерминанты двух секреторных белков ESAT-6 (early secreted antigenic target) и CFP-10 (culture filtrate protein) М.tuberculosis, которые отсутствуют у М.bovis и большинства непатогенных микобактерий (патент РФ №2277540 «Способ диагностики туберкулезной инфекции, рекомбинантная плазмидная ДНК, кодирующая синтез гибридного CFP10-ESAT6 из Mycobacterium tuberculosis, способ его получения, гибридный белок CFP10-ESAT6 и его применение» - принят за прототип). При этом удалось экспрессировать гибридный белок в клетках кишечной палочки и получить его в очищенном виде, пригодном для постановки кожной пробы. С помощью этого полипептида удается дифференцировать инфекционный иммунитет и иммунные реакции, развивающиеся в результате вакцинации.
Однако на стадии предклинических исследований этого рекомбинантного белка была установлена его повышенная неспецифическая иммуногенность, в связи с чем точность диагностики была не всегда удовлетворительной, кроме того, выход белка был не достаточно высок, что усложняло процесс получения конечного чистого продукта.
Раскрытие изобретения
Задачей настоящего изобретения является устранение указанных недостатков, а именно повышение точности и функциональных возможностей диагностики туберкулезной инфекции, увеличение экономических показателей у получаемого диагностикума.
Цель достигается предложенной совокупностью существенных признаков взаимосвязанной группы изобретений.
Так, сконструирована химерная НК, кодирующая гибридный белок CFP10-ESAT6 из М.tuberculosis, индуцирующий реакцию гиперчувствительности замедленного типа в отношении М.tuberculosis, первичная структура которого описывается аминокислотной последовательностью SEQ ID №1 (приведена в конце данного описания).
Химерная НК может иметь следующую нуклеотидную последовательность (SEQ ID №2) (приведена в конце данного описания) или аналогичную последовательность с учетом вырожденности генетического кода.
Наиболее предпочтительным способом получения химерной НК является отдельная сборка генов Cfp 10: CFP_F1, CFP_F2, CFP_F3, CFP_F4, CFP_R1, CFP_R2, CFP_R3, CFP_R4; Esat6: ESAT_F1, ESAT_F2, ESAT_F3, ESAT_F4, ESAT_R1, ESAT_R2, ESAT_R3, ESAT_R4 в реакции ПЦР из синтетических олигонуклеотидов и клонированием их в векторе pGEM5Z по сайту EcoRV.
Предлагается также рекомбинантный вектор экспрессии pET_Cfp_Esat, содержащий химерную НК, кодирующую полипептид CFP 10- ESAT6 с аминокислотной последовательностью SEQ ID №1, оперативно встроенную в плазмиду pET22b(+) по сайтам рестрикции Nde I и Not I.
Патентуется также способ получения гибридного белка CFP10-ESAT6 для диагностики туберкулезной инфекции, включающей культивирование штамма E.Coli, трансформированного рекомбинантным вектором экспрессии, разрушение клеток штамма в буферном растворе ультразвуком и выделение белка из очищенных телец включения и из промывок телец включения методом лигандообменной хроматографии, отличием которого является то, что в качестве рекомбинантного вектора экспресии используют описанный выше плазмидный рекомбинантный вектор pET_Cfp_Esat, которым трансформируют клетки штамма BL21(DE3) E.Coli.
Патентуется также гибридный белок CFP10-ESAT6 из М.tuberculosis для диагностики туберкулезной инфекции, первичная структура которого описывается аминокислотной последовательностью SEQ ID №1 и предпочтительно полученного вышеуказанным способом.
Предлагается также дозированная лекарственная форма для диагностики туберкулезной инфекции, которая представляет собой инъекционный раствор для внутрикожного введения, содержащий гибридный белок CFP10-ESAT6 из M. tuberculosis, отличием которой является использование в качестве гибридного белка, описанного выше, в дозе 0,2 мкг в 0,1 мл физиологического раствора на одно введение.
Совокупность существенных признаков группы изобретений не известна из предшествующего уровня техники, была установлена опытным путем и неочевидным образом связана с достигаемым техническим результатом.
Краткое описание чертежей
Сущность изобретения поясняется с помощью чертежей:
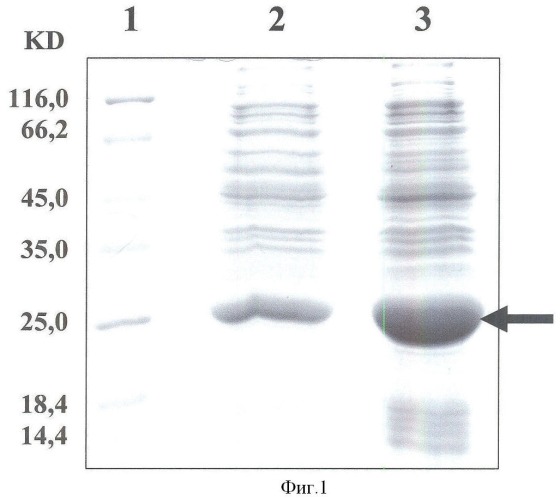
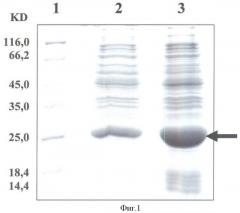
фиг.1 содержит сравнительный анализ экспрессии гибридного белка CFP10-ESAT6 в векторных системах pTBD16 и рЕТ-22b. Электрофорез суммарных белков E.Coli, несущих плазмиду pTBD16 (№2) и рЕТ-22b (№3) осуществлен после 2-х часовой индукции ИПТГ; №1 - маркеры молекулярного веса.
фиг.2 содержит сравнительный анализ эффективности хелатной хроматографии белков CFP-ESAT с N- и С- концевой локализацией полигистидинов.
Электрофорез гибридного белка, полученного методом хелатной хроматографии биомассы клеток Е.Coli, несущих плазмиду:
№1 - рЕТ-22b (С-концевая локализация полигистидинов)
№2 - pTBD16 (N-концевая локализация полигистидинов)
Осуществление изобретения
Изобретение иллюстрируется следующими примерами.
Пример 1.
Конструирование рекомбинантного вектора для экспрессии гибридного белка CFP10-ESAT6 RD1 комплекса М.tuberculosis. Выявленные замены в нуклеотидной структуре гибридного белка CFP10-ESAT6 по прототипу.
При анализе нуклеотидной последовательности гибридного гена Cfp10-Esat6, клонированного в плазмиде pTBD16 (патент РФ №2277540), обнаружено несколько значимых нуклеотидных замен (с природным сиквенсом гена Cfp10 можно ознакомиться в базе данных Pub Med по ссылке: http://www.ncbi.nlm.nih.gov/sites/entrez?term=CFP10&cmd=Search&db=nuccore&QuervKe y=1
гена Esat 6:
http://www.ncbi.nlm.nih.gov/sites/entrez?term=ESAT%206&cmd=Search&db=nuccore&Que ryKey=4).
Эти замены показаны жирным шрифтом и курсивом, соответствующие участки правильной последовательности подчеркнуты, двойной рамкой - кодоны в месте сочленения генов (SEQ ID №3) (приведена в конце данного описания).
Гены Cfp10 и Esat6 по предлагаемому изобретению собирали в ПЦР из синтетических олигонуклеотидов. Полученные гены отдельно клонировали в вектор pGEM5Z по сайту EcoRV.
CFP_F1_Nde atccatatggcagagatgaagaccgatgccgctaccctcgcgcaggaggcaggt
CFP_F2 ctcgcgcaggaggcaggtaatttcgagcggatctccggcgacctgaaaacccagatc
CFP_F3 acctgaaaacccagatcgaccaggtggagtcgacggcaggttcgttgcagggccag
CFP_F4 aggttcgttgcagggccagtggcgcggcgcggcggggacggccgcccaggccgcgg
CFP_R1 cttctgcttattggctgcttcttggaagcgcaccaccgcggcctgggcggccgtc
CFP_R2 ctgacgaatattcgtcgagatctcgtcgagttcctgcttctgcttattggctgc
CFP_R3 gctgctcctcgtcggccctcgagtattggacgccggcctgacgaatattcgtcgag
CFP_R4_Bam atcggatccacctccgaagcccatttgcgaggacagcgcctgctgctgctcctcgtcggc
ESAT_F1_Bgl atcagatctacagagcagcagtggaatttcgcgggtatcgaggccgcggcaagcgcaatc
ESAT_F2 gccgcggcaagcgcaatccagggaaatgtcacgtccattcattccctccttgacgag
ESAT_F3 cattccctccttgacgaggggaagcagtccctgaccaagctcgcagcggcctggggcggtag
ESAT_F4 agcggcctggggcggtagcggttcggaggcgtaccagggtgtccagcaaaaatg
ESAT_R1 ctgcagcgcgttgttcagctcggtagccgtggcgtcccatttttgctggacaccctg
ESAT_R2 cattgcctgaccggcttcgctgatcgtccgcgccaggttctgcagcgcgttgttcagc
ESAT_R3 ccgctgcgaacatcccagtgacgttgccttcggtcgaagccattgcctgaccggcttc
ESAT_R4_Not atcgcggccgctgcgaacatcccagtg
Рекомбинантные клоны отбирали в ПЦР (с использованием внешних праймеров М13), безошибочность последовательности генов Cfp10 и Esat6 в векторах pGEM_Esat и pGEM_Cfp подтверждали сиквенированием по Сенгеру с универсальных праймеров плазмидной ДНК отобранных клонов.
Вектор pGEM_Esat гидролизовали по сайтам BgI II, Sac I, полученный фрагмент клонировали по сайтам Sac I и Barn H1 в вектор pGEM_Cfp. Рекомбинанты слитного белка (pGEM_Cfp_Esat) отбирали в ПЦР (с использованием внешних праймеров М13). Плазмидную ДНК из отобранных клонов обрабатывали Nde I, Not I и встраивали полученный фрагмент в вектор pET22b(+) по тем же сайтам (целиком последовательность pET22b(+), ее карту и очень подробное описание участка клонирования/экспрессии можно найти на сайте: http://www.emdbiosciences.com/html/NVG/home.html). Отбирали рекомбинанты и сиквенировали гибридный ген по Сенгеру. Таким образом, в результате конструирования, отбора и сиквенирования получили экспрессионную конструкцию pET_Cfp_Esat; последовательности слитного белка CFP_ESAT и гибридного гена Cfp_Esat показаны ниже (жирным шрифтом помечены линкер GGGS и С-концевая последовательность AAALEHHHHHH: (SEQ ID №1, SEQ ID №2, соответственно).
Как следует из приведенной нуклеотидной и аминокислотной последовательностей, в составе новой версии гибридного белка отсутствует последовательность энтерокиназного сайта (ее удаление, как оказалось, приводило к исчезновению воспалительной реакции, что показано в таблице 1), а полигистидиновый кластер расположен на С-конце рекомбинантного белка.
| Таблица 1Тестирование диагностического реагента на основе гибридного белка (ГБ) для определения неспецифической воспалительной реакции** | ||
| Дозировка (мкг) | Диаметр эритемы после внутрикожного введения (мм) | |
| ГБ+Flag* | ГБ | |
| 0,05 | 0 | 0 |
| 0,1 | 2,0±1,0 | 0 |
| 0,5 | 3,0±1,3 | 0 |
| 1 | 3,5±1,5 | 0 |
| 5 | 4,5±1,6 | 0 |
| ГБ+Flas* - белок, содержащий последовательность энтерокиназного сайта.**В качестве моделей использовали здоровых морских свинок. В выбритый участок кожи экспериментальным животным вводили внутрикожно по 0,05; 0,1; 0,5; 1 и 5 мкг антигенов в 0,1 мл PBS. Через 24 часа оценивали диаметр эритемы. |
Конструкцией pET_Cfp_Esat (pET-22b) трансформировали клетки BL21(DE3) и из трансформантов отбирали клоны по уровню биосинтеза целевого белка. С целью получения максимального выхода целевого белка, подбирали временные условия индукции. SDS-PAAG анализ клона с максимальной продукцией CFP-ESAT представлен в примере 2.
Пример 2.
Получение гибридного белка ESAT6-CFP10.
2.1. Индукция синтеза белка.
Получали ночные культуры BL21(DE3) E.coli, несущие плазмиду pET-22b (pET_Cfp_Esat).
Ночные культуры засевали 1:100 в LB-агаре и выращивали на шейкере при 37°С до OD600=0,4. Затем вносили IPTG до 0,5 мМ и продолжали инкубацию в течение 3 часов.
Синтез целевого белка контролировали при помощи ПААГ-электрофореза, сопоставляя спектр белков до и после индукции. Наблюдали синтез белка ожидаемого размера: 27 kD (соответствует данным Berthet, et al., 1998 о подвижности CFP10 и ESAT6 в ПААГЭ).
2.2. Сравнительный анализ экспрессии CFP10-ESAT6 в векторных системах pTBD16 и pET-22b.
Клетки E.coli. содержащие плазмидные ДНК pTBD16 и pET-22b со встроенными генами, выращивали в стандартных условиях до оптической плотности 0,5-0,6, затем в культуральную среду вносили IPTG в качестве индуктора экспрессии генов. После 2-х часов инкубации бактериальные клетки лизировали и белковый состав анализировали в полиакриламидном геле. Результаты данных экспериментов представлены на фиг.2. Как следует из приведенных данных, уровень синтеза целевого белка в клетках E.coli, содержащих плазмиду pET-22b с геном Cfp-Esat, значительно превышает таковой в клетках, несущих плазмиду pTBD16.
2.3. Сравнительный анализ эффективности хелатной хроматографии белков CFP-ESAT с N- и С-концевой локализацией полигистидинов.
Экспериментальные данные приведены на фиг.2.
Для хроматографической очистки целевого белка CFP-ESAT использовали лизаты двух штаммов E.coli, содержащих примерно равное количество гибридного белка и рекомбинантные плазмиды pTBD16 и рЕТ-22b, в которых полигистидиновый кластер имел N-концевую локализацию в случае (pTBD16) и С-концевую локализацию в случае (рЕТ-22b). После проведения хроматографии и элюции сорбированного на хелатном носителе белка проводили электрофоретический анализ собранного материала. Как видно из представленной фиг.2 , выход целевого продукта значительно выше в случае С-концевой локализации полигистидинов.
2.4. Технология выделения белка CFP10-ESAT6.
Протокол выделения рекомбинантного белка CFP10-ESAT6 из биомассы штамма-продуцента Е.Coli методом лигандообменной хроматографии.
Буферные растворы.
А. 0.1М трис-HCl буфер, 6М гуанидинхлорид, рН 8,0.
В. 0.02М Трис-HCl, 0.3М NaCl, 2 мМ PMSF, рН 8.0
С. 0.05М трис-HCl буфер, 6М мочевины, 0.4М NaCl и 0.02М имидазола, рН 8.0.
D. 0.05М трис-HCl буфер, 6М мочевины, 0.4М NaCl и 0.3М имидазола, рН 8.0.
Е. 0.05М трис-HCl буфер, 6М мочевины и 0.4М NaCl, рН 8.0.
F. 0.1М трис-HCl буфер, 0.5М NaCl и 2 мМ ЭДТА, рН 8.0.
G. 0.01M трис-HCl буфер, 0.15М NaCl, рН 8.0.
Подготовка сорбента к работе.
1 мл коммерческой иминодиацетат-сефарозы Chelating Sepharose CL-6B (Amersham Pharmacia Biotech) помещают в Column Linbro Plastics колонку (ICN, каталожный номер 158690) и отмывают от консерванта (20%-ный этанол) 10 мл деионизованной воды (здесь и далее все процессы на колонке проходят самотеком). Затем через колонку пропускают 2 мл раствора (10 мг/мл) NiSO4·7H2O (ГОСТ 446574), после чего сорбент промывают 10 мл деионизованной воды и уравновешивают колонку 5 мл буфера А.
Колонка используется для выделения белка из 150 мл биомассы.
Получение телец включения.
1. К влажной биомассе из 150 мл культуральной среды добавляют 5 мл буфера В, гомогенизируют ультразвуком в течение 1 мин (22-23 кГц, 100 Вт), гомогенат разливают по 1,5 мл пластиковым пробиркам типа "Eppendorf" и центрифугируют при 10000 об/мин 10 мин на настольной центрифуге "Eppendorf C5415" или аналогичной. Супернатант собирают отдельно.
2. Осадок суспендируют в 3 мл буфера В без PMSF и снова центрифугируют при 14000 об/мин (30 мин, +4°С) на центрифуге "Eppendorf MiniSpin" или аналогичной. Процедуру промывки осадка повторяют 5 раз. Отмытые тельца включения тщательно отделяют от супернатанта и хранят при - 30°С.
Выделение белка из тел включения.
1. Осадок телец включения из 150 мл культуральной среды растворяют в 5 мл буфера А при перемешивании на магнитной мешалке в течение 2 ч при комнатной температуре. Раствор центрифугируют при 14000 об/мин (20 мин, +20°С) на центрифуге "Eppendorf MiniSpin", осадок отбрасывают, супернатант используют для получения рекомбинантного белка CFP10-ESAT6.
2. Супернатант из п.1. наносят на колонку с 1 мл подготовленного сорбента с помощью автоматической пипетки "Ленпипет".
3. Колонку промывают 10 мл буфера А, затем 10 мл буфера С, нанося растворы на колонку с помощью автоматической пипетки "Ленпипет" порциями по 2 мл, не давая сорбенту просохнуть.
4. Белок элюируют 5 мл буфера D в пенициллиновый флакон на 10 мл.
5. Элюат разбавляют 5 мл буфера Е, затем диализуют (18 ч, +40°С) сначала против 1 л буфера F, затем дважды против 1 л буфера G (2×18 ч, +4°С).
6. Диализат центрифугируют при 4000×g (30 мин, +4°С), осадок отбрасывают, к супернатанту добавляют азид натрия до 0,02% и хранят при +4°С.
7. В супернатанте измеряют концентрацию белка методом ВСА (калибровка по бычьему сывороточному альбумину), чистоту белка определяют с помощью электрофореза по Лэмми в 13%-ном ПААГ.
Выделение рекомбинантного белка CFP10-ESAT6 из промывок телец включения. Все промывки телец включения разбавляют в 2 раза буфером А, центрифугируют при 14000 об/мин (20 мин, +20°С) на центрифуге "Eppendorf MiniSpin", осадок отбрасывают, супернатант используют для получения рекомбинантного белка CFP10-ESAT6, начиная с п.2. Далее по методике.
Данные о чистоте полученного продукта приведены на электрофореграмме белка в 13%-ном ПААГ по Лэмми (фиг.1)
Пример 3.
Клинические испытания кожного теста на пациентах с различными формами туберкулезной инфекции. Изучение побочных реакций и оптимизация дозы (Разрешения Министерства здравоохранения и социального развития РФ №480 от 15 декабря 2006 года, №221 от 29 мая 2007 года, №412 от 17 октября 2007 года). Всего исследовано 55 человек (см. Табл.2-5). Из них здоровых 20 человек, больных туберкулезом 35 человек.
| Таблица 2Результаты клинических исследований препарата «Диаскинтест» и ППД -Л 2ТЕ на добровольцах (40 человек) | |||
| Всего | |||
| ППД - Л 2ТЕ | Диаскинтест | ||
| Здоровые | 20 | 8 - отр | 18 - отр |
| 1 - сомнит | 2* - пол | ||
| 11 - сл + (5-9 мм) | |||
| Больные ТБ (без диссеминации) | 20 | 3 - отр | |
| 1 - сл.+ | 13 - отр | ||
| 13 - пол | 7 - пол | ||
| 3 - не проводили |
*Работники Цниитуб и МосЦентра по борьбе с туб. (17 и 13 мм)
| Таблица 3Доза 0,1 мкг в 0,1 мл физиологического раствора (20 человек) | |||
| Всего | ППД-Л2ТЕ | Диаскинтест | |
| Здоровые | 10 | 10 - отр | |
| Больные ТБ (без диссеминации) | 10 | 10 - пол | 7 - отр |
| на момент исследования | 3 - ++ (17,7 мм) |
| Таблица 4Доза 0,2 мкг в 0,1 мл физиологического раствора (20 человек) | |||
| Всего | ППД-Л 2ТЕ | Диаскинтест | |
| Здоровые | 10 | 8 - отр | |
| 2* - пол | |||
| Больные ТБ (без диссеминации) | 10 | 2 - отр | 6 - отр |
| 8 - ++ | 4 - пол |
*Работники Цниитуб и МосЦентра по борьбе с туб. (17 и 13 мм)
Заключение.
Изучение безопасности и реактогенности «Диаскинтеста» на 40 добровольцах (20 здоровых и 20 больных туберкулезом легких) показало отсутствие гиперергических, необычных, а также побочных системных и местных реакций на препарат, как в дозе 0,1 мкг, так в дозе 0,2 мкг в 0,1 мл физиологического раствора. Препарат не вызывает положительных реакций у здоровых людей. Положительная реакция на «Диаскинтест» у больных туберкулезом легких указывает на незавершенность туберкулезного процесса и возможность инфицирования практически здоровых или латентный туберкулез.
Определение оптимальной дозы препарата «Диаскинтест»: результаты исследования пробы с «Диаскинтестом» у больных туберкулезом легких в Московском Городском Центре (15 человек).
| Таблица 5Результаты реакций на «Диаскинтест» в дозе 0,1 мкг; 0,2 мкг в 0,1 мл физиологического раствора и пробы Манту у больных туберкулезом легких | |||
| Код больно го | Доза «Диаскинтеста» | Результат реакции Манту (отрицательная, положительная, размер папулы в мм) | Результат реакции на «Диаскинтест» (отрицательная, положительная, размер папулы в мм) |
| 1 группа (манифестные формы туберкулеза легких) | |||
| 011 | 0,1 мкг в 0,1 мл | Отрицательная | 12 |
| 012 | 0,1 мкг в 0,1 мл | 12 | 12 |
| 013 | 0,1 мкг в 0,1 мл | 10 | 14 |
| 014 | 0,1 мкг в 0,1 мл | Отрицательная | Отрицательная |
| 015 | 0,1 мкг в 0,1 мл | 18 | 10 |
| 2 группа (манифестные формы туберкулеза легких) | |||
| 002 | 0,2 мкг в 0,1 мл | 17 | 14 |
| 005 | 0,2 мкг в 0,1 мл | Отрицательная | 10 |
| 007 | 0,2 мкг в 0,1 мл | 10 | 15 |
| 009 | 0,2 мкг в 0,1 мл | 10 | 10 |
| 010 | 0,2 мкг в 0,1 мл | 10 | 15 |
| 3 группа (туберкулез легких в фазе стабилизации и разрешения процесса) | |||
| 001 | 0,2 мкг в 0,1 мл | 10 | 12 |
| 003 | 0,2 мкг в 0,1 мл | 9 | Отрицательная |
| 004 | 0,2 мкг в 0,1 мл | 10 | 9 |
| 006 | 0,2 мкг в 0,1 мл | 12 | Отрицательная |
| 008 | 0,2 мкг в 0,1 мл | 5 | Отрицательная |
| Таблица 6Результаты пробы с «Диаскинтестом» в дозе 0,2 мкг в 0,1 мл физиологического раствора, Манту (2ТЕ ППД-Л) в зависимости от активности туберкулезного процесса | ||
| «Диаскинтест» / 2ТЕ ППД-Л | Активность туберкулеза легких по данным клинико-лабораторных и рентгенологических исследований (10 человек) | |
| Активный процесс 7 человек | Не активный процесс 3 человека | |
| Реакция есть | 7/6 | 0/3 |
| Реакции нет | 0/1 | 3/0 |
Для «Диаскинтест» в дозе 0,2 мкг характерны максимальная чувствительность теста (100%) и специфичность (100%). Соответственно, прогностическая ценность положительного результата теста и прогностическая ценность отрицательного результата теста оказались максимальными (1,0). В то же время чувствительность теста - пробы Манту (2ТЕ ППД-Л) составила 0,875, а прогностическая ценность положительного теста 0,67.
Заключение.
Изучение реактогенности «Диаскинтеста» у 15 больных туберкулезом легких показало отсутствие гиперергических, необычных, а также побочных системных и местных реакций на препарат, как в дозе 0,1 мкг, так в дозе 0,2 мкг в 0,1 мл физиологического раствора. В результате сопоставления данных, полученных в дозе 0,1 мкг и 0,2 мкг «Диаскинтеста» и результатов пробы Манту 2ТЕ ППД-Л, установлена более высокая специфическая активность «Диаскинтеста» в дозе 0,2 мкг в 0,1 мл физиологического раствора.
Результаты исследования свидетельствуют о том, что положительная реакция на «Диаскинтест» в дозе 0,2 мкг наблюдается у больных с активным туберкулезом легких, а отрицательная - у больных с завершенным (по клинико-рентгенологическим и лабораторным показателям) туберкулезным процессом. При исключении систематических и случайных ошибок для «Диаскинтеста» в дозе 0,2 мкг в 0,1 мл характерна максимально высокая (1,0) прогностическая ценность положительного и отрицательного результатов теста. В то же время по результатам исследования прогностическая ценность положительного результата пробы Манту (2ТЕ ППД-Л) составила 0,67.
Интерпретации результатов.
| Таблица 7Возможная интерпретация получаемых результатов при сочетанном применении двух тестов | ||
| Результат реакции Манту | Результат «Диаскинтеста» | Интерпретация |
| отрицательная | отрицательная | Этот результат свидетельствует о том, что у испытуемого отсутствует ТБ и в то же время отсутствует напряженный иммунитет против ТБ. |
| положительная | отрицательная | Этот результат свидетельствует о том, что у испытуемого отсутствует ТБ, в то же время имеется напряженный иммунитет против микобактерий. |
| положительная | положительная | Этот результат свидетельствует о том, что испытуемый инфицирован ТБ. |
| отрицательная | положительная | Этот результат свидетельствует об инфицированности ТБ и об отсутствии иммунитета против ТБ, но в норме этого не может происходить. Скорее этот результат свидетельствует о технических ошибках при постановке реакции, неправильном хранении реагентов и т.п. |
1. Химерная НК, кодирующая гибридный белок CFP10-ESAT6 из М.tuberculosis, индуцирующий реакцию гиперчувствительности замедленного типа в отношении M.tuberculosis и первичная структура которого описывается аминокислотной последовательностью SEQ ID №1.
2. Химерная НК по п.1, которая имеет нуклеотидную последовательность SEQ ID №2.
3. Химерная НК по п.1, которая получена клонированим отдельных фрагментов генов Cfp 10: CFP_F1, CFP_F2, CFP_F3, CFP_F4, CFP_R1, CFP_R2, CFP_R3, CFP_R4; Esat6: ESAT_F1, ESAT_F2, ESAT_F3, ESAT_F4, ESAT_R1, ESAT_R2, ESAT_R3, ESAT_R4 в реакции ПЦР из синтетических олигонуклеотидов.
4. Рекомбинантный вектор экспрессии pET22b pET_Cfp_Esat, содержащий химерную НК, кодирующую полипептид CFP10-ESAT6 с аминокислотной последовательностью SEQ ID №1, оперативно встроенную в плазмиду pET22b(+) по сайтам рестрикции Nde I и Not I с С-концевой локализацией полигистидинов.
5. Способ получения гибридного белка CFP10-ESAT6 для диагностики туберкулезной инфекции, включающей культивирование штамма E.Coli, трансформированного рекомбинантным вектором экспрессии, разрушение клеток штамма в буферном растворе ультразвуком и выделение белка из очищенных телец включения и из промывок телец включения методом лигандообменной хроматографии, отличающийся тем, что в качестве рекомбинантного вектора экспрессии используют плазмидный рекомбинантный вектор pET22b pET_Cfp_Esat, которым трансформируют клетки штамма BL21(DE3) E.Coli.
6. Гибридный белок CFP10-ESAT6 из M.tuberculosis для диагностики туберкулезной инфекции, первичная структура которого описывается аминокислотной последовательностью SEQ ID №1.
7. Гибридный белок CFP10-ESAT6 по п.6, который получен способом по п.5.
8. Дозированная лекарственная форма для диагностики туберкулезной инфекции, которая представляет собой инъекционный раствор для внутрикожного введения, содержащий гибридный белок CFP10-ESAT6 из М.tuberculosis, отличающаяся тем, что она содержит гибридный белок по любому из пп.6 и 7 в дозе 0,2 мкг в 0,1 мл физиологического раствора на одно введение.