Покрытие на имплантат из титана и его сплавов и способ его получения
Иллюстрации
Показать всеИзобретение относится к области медицины. Описано покрытие на костных имплантатах для травматологии и ортопедии. Покрытие на титане и его сплавах содержит оксиды титана и оксид меди в определенном количественном соотношении. Формирование покрытия осуществляют путем электрохимического оксидирования предварительно пескоструйно обработанных титана и его сплавов (ВТ1-0, ВТ1-00, ВТ-6, ВТ-16 и др.) постоянным током последовательно в двух электролитах, при этом сначала формируют слой оксидов титана в электролите концентрацией 200 г/л серной кислоты в дистиллированной воде, затем в него добавляют раствор концентрацией 50 г/л сульфата меди в дистиллированной воде и проводят последующее оксидирование с образованием второго слоя смеси оксидов титана и оксида меди. Способ позволяет получить поверхностно-пористое биосовместимое покрытие, обладающее антисептическими свойствами. 2 н.п. ф-лы, 2 табл., 3 ил.
Реферат
Изобретение относится к медицинской технике, а именно к покрытиям имплантатов из титана и его сплавов и способам их получения, и может быть использовано для создания биосовместимого покрытия на костных имплантатах для травматологии и ортопедии.
Высокая статистическая частота операционных неудач при вживлении костных имплантатов во многом определяется травмированием биоткани и аллергическими реакциями организма на чужеродное тело в послеоперационный период. Указанные явления приводят к раздражению, воспалению и нагноению прилегающей костной ткани, а также последующему отторжению имплантата. Неудовлетворительность данных результатов способствовала поиску новых путей решения этой проблемы, обеспечивающих нормальную остеоинтеграцию имплантатов, минимизацию послеоперационных осложнений и снижение частоты операционных неудач.
Известно оксидное покрытие титана и его сплавов, содержащее оксид титана (а.с. 534525, СССР). Данное покрытие обладает высокой твердостью, износостойкостью, но не обладает антисептическими свойствами.
Известно покрытие имплантата, которое взято авторами за прототип (патент РФ №2154463). Данное покрытие содержит оксид титана и кальцийфосфатные соединения типа гидроксиапатита, обеспечивающие остеоиндуктивные свойства и не вызывающие нагноения и аллергической реакции костной ткани. Недостатком покрытия является его низкая поверхностная пористость, ограничивающая остеоинтеграцию, что сдерживает широкое применение имплантатов в медицине, например в стоматологии.
Задачей изобретения является получение биопокрытия с высокими остеоинтеграционными и антисептическими свойствами.
Поставленная задача достигается тем, что покрытие, содержащее оксиды титана, состоит из двух слоев, первый слой толщиной 20-30 мкм - из оксидов титана, в основном TiO2, второй слой толщиной 2-5 мкм из смеси оксидов титана и оксида меди при следующем соотношении компонентов, мас.%:
оксид титана (TiO2) 65-75
оксид меди 15-25
остальное другие типы оксидных фаз титана (TiO, Ti3О5).
Известен способ изготовления стоматологического имплантата с многослойным биоактивным покрытием, получаемым плазменным напылением. Данный способ включает предварительную пескоструйную обработку поверхности имплантата (патент РФ №2146535) для получения шероховатости поверхности титана, которая позволяет обеспечить адгезионную прочность покрытия, однако не создает поверхностной пористости имплантата. В результате полученное данным способом покрытие не обладает антисептическими свойствами.
Известен способ нанесения покрытия на имплантат из титана и его сплавов, взятый за прототип (патент РФ №2154463), заключающийся в анодировании титана и его сплавов импульсным током в условиях искрового разряда, при этом процесс ведут в насыщенном растворе гидроксиапатита в фосфорной кислоте концентрацией 5-20% или 3-5%-ной суспензии гидроксиапатита дисперсностью менее 100 мкм в этом насыщенном растворе.
Данный способ не позволяет получить достаточную поверхностную пористость покрытия, в результате снижается уровень его остеоинтеграции.
Задачей изобретения является создание биопокрытия с высокими остеоинтеграционными и антисептическими свойствами.
Для получения такого технического результата в предлагаемом способе, содержащем анодирование титана и его сплавов постоянным током, осуществляют предварительную пескоструйную обработку поверхности имплантата частицами оксида алюминия с последующим получением на ней двухслойного покрытия, при этом при получении первого слоя покрытия процесс ведут в электролите концентрацией 200 г/л серной кислоты в дистиллированной воде, а при получении второго слоя покрытия процесс ведут в этом же электролите с добавлением раствора 50 г/л сульфата меди.
Заявляемый способ позволяет за счет предварительной пескоструйной обработки поверхности имплантата получить шероховатую металлическую поверхность, на которой за счет использования двух электролитов сформировать поверхностно-пористое двухслойное покрытие, при этом в электролите, содержащем 200 г/л серной кислоты, в дистиллированной воде создается основной слой из оксидов титана, в основном из TiО2, с необходимыми биомеханическими качествами, в электролите концентрацией 200 г/л серной кислоты с добавлением раствора 50 г/л сульфата меди в дистиллированной воде создается антисептический слой, включающий смесь оксидов титана и оксида меди. Слои имеют заданную толщину и определенное количественное соотношение компонентов. В результате получаются костные имплантаты с покрытием, обладающим высокими остеоинтеграционными и антисептическими свойствами.
С учетом вышеизложенного следует считать заявляемое изобретение соответствующим критерию «существенные отличия».
Пример. Предлагаемый способ осуществляется следующим образом:
берут имплантат из титана или его сплава и подвергают его поверхность пескоструйной обработке частицами оксида алюминия дисперсностью 250-400 мкм при давлении воздушно-абразивной струи 0,65 МПа в течение 5 мин. Затем готовый к покрытию шероховатый имплантат погружают в электрохимическую ванну с подготовленным электролитом, представляющим раствор 200 г/л серной кислоты в дистиллированной воде и имеющим температуру 50°С. Через электролит пропускают постоянный ток напряжением 100 В, плотностью анодного тока 50 мА/см2. Процесс оксидирования ведут в течение 30-40 мин при постоянном перемешивании электролита, в результате толщина получаемого титанооксидного слоя составляет 20-30 мкм. Затем в данный электролит добавляют раствор 50 г/л сульфата меди в дистиллированной воде и проводят оксидирование при температуре 25°С, напряжении постоянного тока 30 В, плотности анодного тока 15 мА/см2 в течение 10 мин при постоянном перемешивании электролита, в результате толщина слоя смеси оксидов титана и оксида меди равна 2-5 мкм.
Пескоструйная обработка поверхности имплантата обеспечивает ее исходную шероховатость, морфологически гетерогенный профиль которой повторяется титанооксидным слоем, за счет чего в покрытии получаются открытые поры различного размера. Полученная поверхностная пористость покрытия придает имплантату высокие остеоинтеграционные способности.
Второй слой состоит из смеси оксидов титана, в основном ТiO2, и оксида меди при следующем соотношении компонентов, мас.%:
оксид титана (ТiO2) 65-75
оксид меди 15-25
остальное другие типы оксидных фаз титана (TiO, Тi3O5).
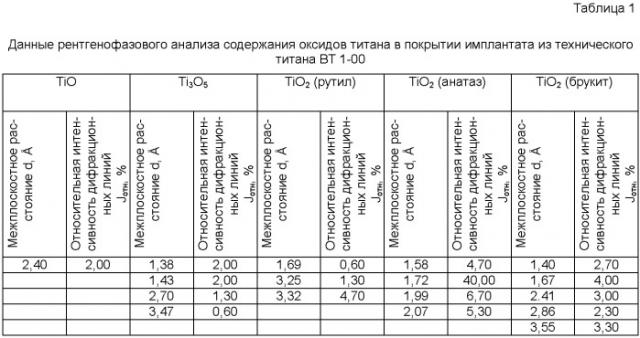
Приведенные пределы содержания во втором слое покрытия компонентов с соотношением: оксид (ТiO2) титана (65-75 мас.%), оксид меди (15-25 мас.%), дающим в сумме 90 мас.%, обусловлены неизбежным образованием в покрытии 10 мас.% других типов оксидных фаз титана (TiO, Ti3О5), которые составляют остальную массу покрытия, как показал рентгенофазовый анализ (табл.1).
Указанное соотношение компонентов в слое обеспечивает необходимое антисептическое действие поверхности имплантата и снижает уровень аллергической реакции биотканей. Пониженное содержание оксида меди в слое не обеспечивает достаточное антисептическое действие покрытия, повышенное содержание данного оксида создает условия для протекания канцерогенных процессов в окружающих тканях.
Заявленный технический результат, а именно высокие остеоинтеграционные и антисептические свойства оксидного покрытия, был определен путем клинических испытаний титановых имплантатов на подопытных животных в условиях стационара факультета «Ветеринарная медицина» Саратовского государственного аграрного университета им. Н.И.Вавилова. Животные (кролики породы «черный великан») имели возраст 9 месяцев, живую массу 4,5-5,0 кг и были разделены на 2 опытные группы по 5 и 7 животных.
Животным под нейролептаналгезией рометаром и золетилом выполнялся флексионный перелом большой берцовой кости в области средней трети диафиза, затем в отломках просверливались каналы для вворачивания стержневых имплантатов.
Клиническая оценка остеоинтеграционных и антисептических свойств имплантатов проводилась путем выявления характеристик состояния животных, включающих регистрацию температуры организма, поведение животных, опороспособность конечности, микроподвижность имплантатов, реакцию животных на прижатие имплантатов, а также по признакам развития воспалительных осложнений с использованием микробиологического исследования мазков, по уровню сопротивления вывертыванию имплантатов (см. табл.2).
| Таблица 2 | ||
| Протокол клинического исследования остеоинтеграционных и антисептических свойств анодно-оксидных покрытий стержневых имплантатов | ||
| Материал имплантатов | Технический титан ВТ 1-00 | Титановый сплав ВТ-16 |
| Метод обработки | Анодное оксидирование в электролитах, заявленного состава | |
| Состав покрытия | 1-й слой - оксиды титана, 2-й слой - смесь из оксидов титана и оксида меди | |
| Количество животных | 5 | 7 |
| Дата установки аппарата с имплантатами | 14 мая 2006 г. | |
| Костный сегмент | Большая берцовая кость | |
| Вид перелома | Флексионный, в средней трети диафиза | |
| Время появления естественной воспалительной реакции на имплантат | 3 суток | 3 суток |
| Период полного сращения перелома | 5 недель | 6 недель |
| Дата снятия аппарата | 28 июня 2006 г. | |
| Внешний вид поверхности имплантатов | Шероховатая, со значительными костными фрагментами | |
| Результаты микробиологического анализа мазков экссудата имплантационной зоны | Отсутствие патогенной микрофлоры и аллергической реакции тканей |
Визуальные и оптико-микроскопические исследования поверхности имплантатов с оксидным покрытием заявляемого состава показали высокую остеоинтеграционную способность покрытия уже через 5 недель после имплантации.
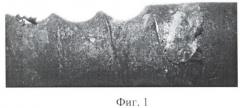
Изложенное подтверждается фотографиями, приведенными на фиг.1-3, где представлены изображения участков стержневого титанового имплантата с покрытием заявляемого состава. Так, на фиг.1 показано фото, где представлен участок стержневого титанового имплантата с анодно-оксидным покрытием заявляемого состава, на котором после 1-й недели клинических испытаний образовался тонкий слой костной ткани. На фиг.2 показано фото, где представлен участок стержневого титанового имплантата с анодно-оксидным покрытием заявляемого состава, на котором после 3-х недель клинических испытаний образовались значительные костные частицы и видны явные признаки остеоинтеграции. На фиг.3 показано фото участка стержневого титанового имплантата с анодно-оксидным покрытием заявляемого состава, который после 5-ти недель клинических испытаний имеет уже значительные фрагменты костной ткани.
Проведенные микробиологические исследования мазков, полученных на границе имплантатов и мягких тканей, не выявили наличия патогенной микрофлоры, что указывает на хорошее антисептическое действие оксида меди в составе покрытия.
Выводы
1. Биопокрытие (по прототипу), содержащее оксид титана, оксид кальция, оксид фосфора, не обладает высокой поверхностной пористостью, что ограничивает или делает невозможным его применение на внутрикостных имплантатах длительного функционирования, например стоматологических. Оно может быть использовано только при изготовлении стержневых и спицевых чрескостных остеофиксаторов, вводимых в костную ткань на короткий период.
2. Биопокрытие (заявляемое изобретение) обладает высокой поверхностной пористостью и антисептическим действием, обеспечивающими имплантату прочное сцепление с окружающей биотканью при отсутствии воспалительных явлений в зоне имплантации. Заявляемое покрытие, полученное заявляемым способом, является универсальным при использовании костных имплантатов в различных клинических ситуациях.
1. Покрытие на имплантат из титана и его сплавов, содержащее оксиды титана, отличающееся тем, что оно состоит из двух слоев, первый слой толщиной 20-30 мкм - из оксидов титана, в основном TiO2, второй слой толщиной 2-5 мкм - из смеси оксидов титана и оксида меди при следующем соотношении компонентов, мас.%:
| оксид титана (TiO2) | 65-75 |
| оксид меди | 15-25 |
| остальное | другие типы оксидных фаз титана (TiO, Ti3O5) |
2. Способ получения покрытия по п.1, заключающийся в анодировании титана и его сплавов постоянным током, отличающийся тем, что осуществляют предварительную пескоструйную обработку поверхности имплантата частицами оксида алюминия с последующим получением на ней двухслойного покрытия, при получении первого слоя покрытия процесс ведут в электролите концентрацией 200 г/л серной кислоты в дистиллированной воде, а при получении второго слоя покрытия процесс ведут в этом же электролите с добавлением раствора 50 г/л сульфата меди.