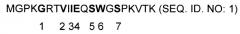Пептиды hsp60 и их apl-производные и фармацевтические композиции
Иллюстрации
Показать всеПредложены пептиды белка теплового шока человека 60 кДа, которые представляют собой эпитопы для Т-клеток, а также их пептидные производные, которые модифицированы по участкам контакта с молекулами МНС, способные индуцировать механизмы периферической толерантности, в частности механизмы анергии или механизмы, опосредуемые клонами регуляторных Т-клеток у пациентов с ревматоидным артритом. Настоящее изобретение также относится к фармацевтическим композициям, включающим указанные пептиды для лечения ревматоидного артрита. 6 н. и 3 з.п. ф-лы, 14 ил., 3 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к пептидам белка теплового шока человека 60 kDa (сокращенно hHsp60) и полученным из них измененным пептидным лигандам (сокращенно APL). Кроме того, изобретение связано с фармацевтическими композициями для лечения ревматоидного артрита (RA), включающими указанные пептиды.
Уровень техники
RA - аутоиммунная болезнь неизвестной этиологии, которая затрагивает приблизительно 1% мирового населения. Это - синдром, характеризующийся хроническим воспалением суставов, хотя могут также наблюдаться системные явления. Эта болезнь начинается с воспаления синовиальной мембраны и часто вызывает эрозийное разрушение смежного хряща и кости, которое приводит к умеренной нетрудоспособности 80% пациентов и ранней смертности (Moctezuma J.F. (2002) Manifestaciones articulares de la Artritis Reumatide. Revista Mexicana de Reumatologia 17:211-219). RA может проявляться в любом возрасте, без различий расовых или этнических групп, но максимальная частота возникновения указанного заболевания встречается между 25 и 55 годами. Среди людей с RA женщины опережают мужчин в пропорции три к одному (Emery P. (2002). Early referral recommendation for newly diagnosed rheumatoid arthritis: evidence based development of to clinical guide. Ann Rheum Dis. 61:290-297).
Причина RA неизвестна. Это - болезнь, которая включает присутствие генетических, экологических, иммунологических и гормональных факторов. С тенденцией к развитию RA связаны определенные гены, играющие роль в иммунной системе. В то же время, некоторые люди с RA не имеют этих генов, а у других людей, имеющих эти гены, болезнь никогда не развивается. Поэтому предположили, что генетический фон важен, но не является решающим.
В моделях аутоиммунного заболевания микробные антигены со структурой, подобной собственным антигенам, могут вызывать перекрестный ответ на аутоантигены, производя изменение в механизмах толерантности и фиксируя аутоиммунный ответ. В общем смысле, повреждение и местный некроз в ткани, вызванные инфекционным агентом, могут выявить скрытую аутоантигенную детерминанту, которая способна активизировать аутореактивные T-клетки (Albert L.J. (1999) Mechanisms of Disease: Molecular Mimicry and autoimmunity. N Engl J Med 341:2068-2074).
Фаза перехода T-лимфоцита между толерантностью и иммунной/аутоиммунной активностью регулируется на различных уровнях. Двумя важными параметрами в указанном переходе являются состояние созревания антиген-презентирующих клеток (сокращенно APC) и уровни аутоантигенов, которые детектируются иммунной системой (Ohashi, P.S. (2002) Making and breaking tolerance. Current Opinion in Immunology 14:744-759).
Одна из текущих гипотез, которая пытается объяснить развитие аутоиммунных заболеваний, отмечает, что APC в отсутствие сигналов врожденной иммунной системы или сигналов опасности остаются относительно незрелыми и вызывают толерантность аутореактивных T-клеток, когда им презентируются собственные пептиды (Steiman R.M. (2000) The induction of tolerance by dendritic cells that have captured apoptotic cells. J Exp Med. 191:411-416). Индукция периферической толерантности также коррелирует с концентрацией собственного антигена (Kurts, C. (1999) CD8 T cell ignorance or tolerance to islet antigens depends on antigen dose. PNAS 96:12703-12707). Повышение уровня презентирования собственных антигенов из-за повышения уровней их экспрессии позволяет аутореактивным некомпетентным T-клеткам детектировать их. Если уровни собственных антигенов увеличены в отсутствие явлений, которые ускоряют созревание APC, толерантность к этим антигенам сохраняется, в противном случае в присутствии провоспалительных сигналов или других явлений, которые ускоряют созревание APC, толерантность нарушается активацией некомпетентных T-клеток и развиваются аутоиммунные заболевания (Janeway C.A. (2002) Innate immune recognition. Annu Rev Immunol. 20:197-216). Инфекционными агентами, которые были объектом исследования как причина RА, являются среди прочих: вирус Эпштейна-Барра, ретровирус, вирус гепатита C, Mycobacterium tuberculosis (сокращенно Mt), а также Helicobacter pilory.
Патогенез RА характеризуется совместным действием различных типов клеток, которые вызывают прогрессивное разрушение хряща и кости. В нормальных условиях существует баланс между воспалительными цитокинами, такими как: TNFα, IL-1, IL-6, IL-15, IL-16, IL-17, IL-18 и IFNγ, и противовоспалительными, такими как IL-4, IL-11, IL-13 и антагонистами IL-1 или TNFα. В случае RА указанный баланс перемещается, однако, в пользу воспалительных цитокинов (Arend W.P. (2001) Cytokine imbalance in the pathogenesis of rheumatoid arthritis: The role of interleukin-1 receiving antagonist. Semin Arthritis Rheum 30 (2):1-6).
Узнавание экзогенного антигена или аутоантигена вероятно является причиной ряда событий, которые вызывают разрушение суставов у пациентов с RА. Это явление вызывает активацию CD4+ T-лимфоцитов, которая наряду со стимуляцией различных цитокинов ведет к их дифференцировке в Th1-клетки с последующим высвобождением провоспалительных цитокинов (IL-2 и INFy) (Simόn A.J. (2001) Biological therapy in Rheumatoid Arthritis. Magazine of Clinical Investigation 53 (5):452-459). Многие исследователи соглашаются с тем, что хроническое воспаление суставов вызвано указанными активированными T-клетками, которые проникают в синовиальную мембрану. Действие этих цитокинов на макрофаги вызывает выработку большого количества TNFα и IL-1. Они вызывают ряд местных и общих эффектов, таких как регулирование экспрессии молекул адгезии в эндотелиальных клетках (LFA1, ICAM-1), которые привлекают другие клетки к участкам воспаления. Они также стимулируют макрофаги, фибробласты, хондроциты и остеокласты к высвобождению других медиаторов воспаления, таких как IL-15 и IL-8. TNFα и IL-1 стимулируют пролиферацию синовиальной мембраны, что вызывает формирование паннуса, они могут также вызвать дифференцировку B-лимфоцитов в клетки, продуцирующие антитела, которые потенциально участвуют в разрушении сустава. Они также ингибируют выработку противовоспалительных цитокинов (IL-4 и IL-14), вырабатываемых Th2-клетками, и стимулируют гепатоциты к выделению IL-6. IL-6 способствует выработке белков острой фазы, которые участвуют в данном процессе, усиливая иммунный ответ (Forre O. (2000) New possibilities of treatment in AR. Scand J Rheumatol 29 (2):73-84).
Среди аутоантигенов, вовлеченных в патогенез RA, присутствует белок Hsp60, который принадлежит семейству Hsp-белков, которые являются иммуногенными белками с исключительной эволюционной консервативностью. Иммунный ответ против чужеродного Hsp - важный механизм защиты против бактериальных инфекций. Антитела против этих белков могут присутствовать в изобилии и у здоровых людей, и у пациентов с аутоиммунными заболеваниями, и они могут перекрестно реагировать с собственными антигенами (Chen W. (1999) Human 60-kDa Heat-Shock Protein: To Danger Signal to the Innate Immune System. J Immunol. 162:3212-3219).
Hsp65 из Mt гомологичен Hsp60 млекопитающих. Это означает, что Hsp60 может быть признан как аутоантиген у пациента с RA. У пациентов с RA, по сравнению с пациентами с остеоартритом, имеется увеличение пролиферативного ответа B-лимфоцитов в синовиальной жидкости на Hsp65 микобактерий. Интенсивность ответа коррелирует с синовиальным воспалением. Данный ответ не является специфическим для RA по сравнению с другими воспалительными заболеваниями (Life P. (1993) Responses to Gram negative enteric bacterial antigens by synovial T cells from patiens with juvenile chronic arthritis: recognition of heat shock protein hsp60. J Rheumatol. 20:1388-1396).
Концентрация Hsp является возможным сигналом опасности для иммунной системы, который высвобождается из мертвых клеток, и может индуцировать воспалительный ответ и вызвать созревание APC. Hsp-белки являются внутриклеточными белками, которые не только не экспрессируются в клеточной мембране, но и не секретируются, поэтому Hsp являются привлекательными кандидатами на роль молекул, которые представляют собой сигналы опасности (Van den Berg, WB. (1998): Joint inflammation and cartilage destruction may occur uncoupled. Springer Semin lmmunopathol. 20:149-164).
Для лечения некоторых аутоиммунных патологий были предложены несколько препаратов, в которых используется Hsp60 или производные от него пептиды. Например, в патенте EPO262710 предложено использование нескольких пептидов Hsp60 из Mt для лечения и диагностики аутоиммунных заболеваний, особенно артритных состояний. Данное изобретение основано на том факте, что предыдущие инфекции, вызванные несколькими бактериями, могут инициировать развитие аутоиммунных заболеваний у генетически восприимчивых людей, например: пациенты с RA могут показать высокую реактивность к микробным антигенам. Эти же авторы в патенте EPO322990 предлагают использование других пептидов Hsp60 из Mt с той же самой целью, как и в предыдущем патенте. В заявке на патент WО 9610039 предполагается использование пептида Hsp60 из Mt для диагностики и лечения аутоиммунного артрита.
В заявке на патент WО 9711966 авторы предполагают использование пептидов из неконсервативных областей hHsp60, которые не совпадают с Hsp60 бактерий, что может вызвать толерантность T-клеток у пациентов с RA.
В заявке на патент WO 0143691 предлагается использование фармацевтических композиций, специфически составленных из пептидов hHsp60 и их вариантов для профилактики воспалительных заболеваний, таких как RA.
В патенте US 6180103 авторами предполагается использование пептида Hsp60, обозначенного p277, и его аналогов для диагностики и профилактики диабета типа I.
Патент US 5993803 защищает использование Hsp60, пептида p277 и группы пептидов-производных указанного белка для уменьшения тяжести иммунного ответа во время трансплантации органов.
Недавно было установлено, что атеросклероз обнаруживает ряд особенностей, подобных аутоиммунным процессам. В заявке на патент WO 0072023 авторы предлагают способ лечения и диагностики атеросклероза и коронарных заболеваний с использованием препарата, который включает белок Hsp60.
В заявке на патент WO 02057795 защищен новый метод для диагностики и лечения остеопороза с использованием белков семейства Hsp и белков из патогенных микроорганизмов, таких как вирусы и бактерии.
В настоящее время лечения для RA не существует. Современные способы лечения сосредоточены на облегчении боли, уменьшение воспаления, замедление повреждений суставов и на улучшение самочувствия пациентов. Недавно были разработаны иммуномодулирующие лекарственные препараты, которые блокируют цитокины, участвующие в развитии и поддержании воспалительного ответа при RA, с целью остановки или замедления прогрессирования заболевания. Для данного вида терапии существуют два типа лекарственных препаратов: блокирующие действие фактора некроза опухолей (сокращенно TNFα), и те, которые ингибируют действие интерлeйкина 1 (IL-1).
Хотя при терапиях с анти-TNFα и анти-IL-1 результаты являются многобещающими, процент инфекций высок. У многих пациентов, лечившихся этими препаратами, развиваются тяжелые инфекции, которые являются в некоторых случаях фатальными, включая другие аутоиммунные заболевания, неоплазии и т.д. Кроме того, они являются очень дорогими лекарственными средствами (Breshinan B. (1998) Treatment of rheumatoid arthritis with recombinant human antiinterleukin-1 antagonist. Arthritis Reum. 41:2196-2204).
Оральная толерантность была предложена как способ создания периферической толерантности по отношению к определенным антигенам. Она может быть вызвана механизмами активной супрессии, анергии или делеции клона, в зависимости от доз и частоты введения антигена. Указанным способом можно индуцировать регуляторные T-клетки, которые специфическим образом активируются антигеном, но проявляют свое действие независимо (активная супрессия). Поскольку имеет место регулирующее действие, нет необходимости вводить не только потенциально патогенный антиген, но и любой другой, способный вызвать активную супрессию в центре воспаления при ингибировании деятельности патогенных эффекторных клеток. Коллаген типа II (сокращенно CII) является аутоантигеном, который наиболее часто используется в указанном направлении. Результаты исследований, проведенных с пациентами, страдающими RA, с использованием куриного и бычьего CII дали противоречивые результаты (Trentham D.E. (1993) Effects of oral administration of type II collagen in rheumatoid arthritis. Science 261:1727-1730; Sieper J. (1996) Oral type II collagen treatment in early rheumatoid arthritis: to double-blind, placebo-controlled, randomize trial. Arthritis Rheum. 39:41-51).
Патент US 6153200 предполагает использование пептида из Hsp70, белка, принадлежащего семейству Hsp, для индуцирования толерантности оральным путем у пациентов с RA.
Другой вариант, который был предложен для индукции толерантности посредством APL-пептидов, основан на том, что T-клетки активируются, если CD4+ T-лимфоциты, специфичные к определенному антигенному пептиду, узнают антиген, презентированный компетентными APC. Тем не менее, если та же самая T-клетка изначально активирована другой формой антигена, в котором один из участков контакта с TcR слегка изменен, это может привести к неполной активации или даже инактивации T-клеток. Эти антигены называют APL. APL подобны иммуногенным пептидам, которые запускают каскад необходимых событий для полной активации T-клеток, с одной или несколькими заменами в положениях, существенных для контакта с TcR или с MHC.
По существу, среди других воздействий, для усиления ответа T-клеток на специфические антигены могут быть разработаны APL со свойствами, подобными свойствам иммуногенного пептида (агониста). Этот эффект выгоден при патологических состояниях, таких как инфекционные заболевания. Также могут быть разработаны пептиды с антагонистическими свойствами по отношению к иммуногенному пептиду, которые могут быть полезными в контроле над аутоиммунными заболеваниями, так как они могут блокировать ответ T-клеток, действуя в роли антагонистов к TcR (M. De Magistris (1992) Antigen analog-major complex histocompatibility complexes act as antagonist of the T cell receptor. Cell 68:625-634), частичных агонистов или индукторов популяции регуляторных T-клеток, которые опосредуют активную супрессию (Evavold B.D. (1991) Separation of IL-4 production from Th cell proliferation by an altered T cell ligand. Science 252:1308-1310). Возможность экспериментально регулировать характерные свойства пептидных лигандов позволяет изменять природу, направление и силу иммунного клеточного ответа, соответственно.
До настоящего времени на людях были проведены два клинических испытания с использованием пептидов APL-типа для лечения аутоиммунных заболеваний. В обоих испытаниях пептиды происходили из эпитопа в положении 83-93 из основного белка миелина. В одном из этих испытаний участвовало 142 пациента с рассеянным склерозом, но оно было приостановлено, так как у 9% пациентов развилась гиперчувствительность (Ludwig Kapposi (2000) Induction of non-encephalitogenic type 2 T helper-cell autoimmune response in multiple sclerosis after administration of an altered peptide ligand in to placebo controlled, randomized phase II trial. Nature Medicine 10:1176-1182).
Другое испытание включало 25 пациентов и было также прервано, потому что у трех пациентов наблюдалось обострение болезни (Bibiana Bielekova (2000) Encephalitogenic potential of the myelin basic protein peptide (amino acids 83-99) in multiple sclerosis: Results of to phase II clinical trial with an altered peptide ligand. Nature Medicine 6:1167-1175). Главный автор указанной работы анализирует возможные факторы, которые определили эти отрицательные результаты, и отмечает, что изменения, произведенные в сайтах APL, могут образовать новые участки связывания с HLA (как это случилось в случае связывания APL с DRB1*0404, как показано у пациента I), комплекс APL-HLA может также стимулировать T-клетки, не исключенные при отрицательной селекции, и которые могут быть перекрестно активированы нативным аутоантигеном. В данном испытании использовались фармацевтические композиции с высокими концентрациями APL, которые могут стимулировать Т-клетки с высоким сродством к аутоантигену и вызывать гетероклитический Т-клеточный ответ (Bibiana Bielekova and Roland Martin (2001) Antigen-specific immunomodulation via altered peptide tying. J Mol Med. 79:552-556).
Для того чтобы провести эти два клинических испытания, авторы предварительно не анализировали у пациентов Т-клеточный ответ на APL in vitro. Они также не оценивали типы молекул HLA, экспрессируемые у подвергнутых лечению пациентов.
Главная проблема в лечении аутоиммунных заболеваний состоит в разработке терапевтических стратегий, с помощью которых можно специфично устранить патогенные Т-клетки, не затрагивая другие Т-клетки. Таким образом, терапевтический поиск должен дать безопасный, специфичный и эффективный способ выключения развитого аутоиммунного процесса. Настоящее изобретение, в отличие от предыдущего уровня техники, предлагает использование пептидов hHsp60 и их APL-производных, которые специфическим путем индуцируют ингибиторные молекулярные механизмы в процессе RA.
Сущность изобретения
Настоящее изобретение направлено на решение вышеуказанной задачи по обеспечению пептидами белка теплового шока человека 60 кДа, несущими эпитопы T-клеток, для индукции механизмов толерантности, в частности механизмов индукции анергии или механизмов, опосредованных клонами регуляторных T-клеток у пациентов с RА, и которые представлены следующими последовательностями:
E18-12 MGPKGRTVIIEQSWGSPKVTK (SEQ. ID. NO:1)
E18-3 SIDLKDKYKNIGAKLVQDVANNTNEEAG (SEQ. ID. NO:2)
F19-6 IIDPTKVVRTALLDAA (SEQ. ID. NO:3)
В заявке на патент WO 9711966 предложено использование пептидов hHsp60 из Mt, основанное на том факте, что они могут индуцировать толерантность у T-клеток и предотвращать RА. Указанные авторы подтверждают определенное улучшение в ходе болезни при введении этих пептидов мышам (артрит был предварительно вызван пристином). В противоположность указанной заявке авторы изобретения продемонстрировали, что пептиды по изобретению индуцируют механизмы активной супрессии, которые вызывают периферическую толерантность очень эффективным способом, подтверждая существенное увеличение IL-10 в двух животных моделях артрита так же, как и в анализах "ex vivo" с использованием мононуклеарных клеток пациентов.
Известно, что основной ответ T-клеток в модели адъювант-индуцированного артрита (AIA) направлен против Hsp60. С помощью указанной модели авторы изобретения установили, что пептиды по изобретению, производные hHsp60, проявляют весьма заметную терапевтическую защиту, вызывая увеличение уровней IL-10 и уменьшение уровней TNFα. Такой же терапевтический эффект, вызванный этими пептидами, авторы также регистрировали на животной модели коллаген-индуцированного артрита (CIA), где основной ответ направлен против коллагена типа II.
Эти факты указывают на то, что терапевтические возможности пептидов по изобретению независимы от индуцирующего агента и могут опосредовать механизмы активной супрессии в участке воспаления, которые могут быть распространены на другие аутоантигены, присутствующие в суставах и которые прогрессивно содействуют иммунопатогенному процессу, имеющему место в процессе RА. Эти результаты подтверждают возможности терапевтического использования наших препаратов для лечения RА.
Согласно настоящему изобретению указанные пептиды в особенности полезны для разработки вариантов пептидных APL-производных E18-12 (SEQ. ID. NO:1) и E18-3 (SEQ. ID. NO:2), модифицированных по сайтам взаимодействия с молекулой MHC человека и APL-производных пептида F19-6 (SEQ. ID. NO:3), модифицированных по сайтам взаимодействия с молекулой MHC крысы. Далее приведены соответствующие аминокислотные последовательности:
где аминокислота в положении 1 замещена на: A,F,I,L,M,V,W, или Y
в положении 2 на: A,D,E,F,G,H,I,K,L,M,N,Q,R,S,T,V,W, или Y
в положении 3 на: A,K,V,R,T,I,P,L,N,S,G,Y, или M
в положении 4 на: A,D,E,F,G,H,I,K,L,M,N,Q,R,S,T,V,W, или Y
в положении 5 на: A,D,E,F,G,H,I,K,L,M,N,Q,R,S,T,V, или Y
в положении 6 на: A,D,E,F,G,H,I,K,L,M,N,P,Q,R,S,T,V,W, или Y
в положении 7 на: A,D,E,F,G,H,I,K,L,M,N,Q,R,S,T,V, или Y
где аминокислота в положении 1 замещена на: L,I,V,M,Y,W,F, или A
в положении 2 на: A,D,E,F,G,H,I,K,L,M,N,Q,R,S,T,V,W, или Y
в положении 3 на: A,F,I,K,L,M,P,R,S,T,V,W, или Y
в положении 4 на: L,I,V,M,Y,W,F, или A
в положении 5 на: A,D,E,F,G,H,I,K,L,M,N,Q,R,S,T,V,W, или Y
в положении 6 на: A,D,E,F,G,H,I,K,L,M,N,Q,R,S,T,V,W, или Y
в положении 7 на: A,F,I,K,L,M,P,R,S,T,V,W, или Y
в положении 8 на: A,D,E,F,G,H,I,K,L,M,N,Q,R,S,T,V,W, или Y
где аминокислота в положении 1 замещена на H и аминокислота в положении 2 замещена на E.
В частных случаях выполнения пептидные производные APL-типа имеют аминокислотную последовательность, выбранную из группы, состоящей из: SEQ. ID. NO:4, SEQ. ID. NO:5, SEQ. ID. NO:6, SEQ. ID. NO:7, SEQ. ID. NO:8, SEQ. ID. NO:9, SEQ. ID. NO:10, SEQ. ID. NO:11, SEQ. ID. NO:12, SEQ. ID. NO:13, SEQ. ID. NO:14, SEQ. ID. NO:15, SEQ. ID. NO:16, SEQ. ID. NO:17, SEQ. ID. NO:18, SEQ. ID.NO:19, SEQ. ID. NO:20 и SEQ. ID. NО:21.
Пептиды по настоящему изобретению могут быть получены стандартными способами пептидного синтеза. Определенный состав каждого пептида может быть оценен по уровню и качеству иммунного ответа, который указанный пептид вызывает в экспериментах, как это описано в примерах, которые будут представлены далее.
Все последовательности, описанные выше, и последовательности в примерах являются перспективными и могут также использоваться в качестве основы для разработки и синтеза пептидных производных с улучшенными свойствами.
Изобретение также включает фармацевтические композиции, которые включают один или несколько вышеперечисленных пептидов и, необязательно, фармацевтически приемлемый носитель.
Введение фармацевтических препаратов пациентам может осуществляться в соответствии с молекулами HLA класса II, которые экспрессируются у каждого конкретного пациента.
Способ введения фармацевтических композиций будет зависеть от профиля цитокинов, который эти препараты индуцируют в тестах "ex vivo". Фармацевтические препараты, включающие APL-пептиды, индуцирующие регуляторный ответ, будут вводиться внутрикожно или подкожно. Фармацевтические препараты, включающие исходные пептиды, вызывающие TH1-ответ, могут быть введены орально.
Дозы пептидов в фармацевтических композициях настоящего изобретения эквивалентны дозам, вызывающим эффективный иммунный ответ в организме-хозяине. Эффективная доза является дозой, которая при введении индуцирует молекулярные механизмы, которые значительно снижают показатели воспалительных симптомов RA и останавливают рост показателей разрушения суставов в процессе заболевания. Количество фармацевтической композиции, вводимой организму-хозяину, может также изменяться в зависимости от нескольких факторов, которые включают: используемые пептиды, ACR-шкалу (Американская Коллегия Ревматологии, сокращенно ACR), HLA типа II, время течения болезни, возраст, пол, общее состояние здоровья, а также уровень иммунного ответа в целом. Настоящее изобретение также относится к способу лечения RА, который включает введение пациенту эффективных доз пептидов или фармацевтических композиций, описанных выше.
Краткое описание чертежей
Результаты частично представлены графически на следующих чертежах:
Фиг.1: Оценка клинических признаков артрита у крыс, обработанных внутрикожно пептидами F19-6 и F19-7 в AIA модели.
Фиг.2: Модуляция уровней TNFα, индуцированных пептидами F19-6 и F19-7 в мононуклеарных клетках крыс в AIA модели на 15 день после индукции болезни.
Фиг.3: Модуляция уровней IL-10, индуцированных пептидами F19-6 и F19-7 в мононуклеарных клетках крыс в AIA модели на 15 день после индукции болезни.
Фиг.4: Оптическая микроскопия среза сустава, принадлежащего больному животному, не получавшему лечения. IS: внутрисуставное пространство, EC: эрозия хряща, P: паннус. Окрашено гематоксилин-эозином.
Фиг.5: Оптическая микроскопия среза сустава, принадлежащего животному, подвергнутому воздействию пептида F19-7, введенного внутрикожно. IS: внутрисуставное пространство. Окрашено гематоксилин-эозином.
Фиг.6: Модуляция уровней TNFα, индуцированных пептидами F19-6 и F19-7 в мононуклеарных клетках крыс в CIA модели на 21 день после индукции болезни.
Фиг.7: Модуляция уровней IL-10, индуцированных пептидами F19-6 и F19-7 в мононуклеарных клетках крыс в СIA модели на 21 день после индукции болезни.
Фиг.8: Модуляция уровней TNFα, пептидами F19-6 и F19-7 в мононуклеарных клетках пациентов с RA.
Фиг.9: Модуляция уровней TNFα, пептидами E18-3 и E18-12 в мононуклеарных клетках пациентов с RA.
Фиг.10: Модуляция уровней IL-10, пептидами E18-3 и E18-12 в мононуклеарных клетках пациентов с RA.
Фиг.11: Модуляция уровней IL-10, индуцированных пептидами E18-3 и E18-12 и их APL-производными в мононуклеарных клетках пациентов с RA.
Фиг.12: Модуляция уровней TNFα, индуцированных пептидами E18-3 и E18-12 и их APL-производными в мононуклеарных клетках пациентов с RA.
Фиг.13: Соотношение уровней IL-10 и TNFα, индуцированных пептидами E18-3 и E18-12 и их APL-производными.
Фиг.14: Оценка клинических признаков артрита у крыс, подвергнутых воздействию пептидов E18-12 и E18-12APL1, введенных внутрикожным путем, в модели AIA.
Подробное описание настоящего изобретения
ПРИМЕРЫ
Пример 1
Пептиды hHsp60, презентированные человеческим HLA
Были отобраны те пептиды hHsp60, для которых подтверждалось, что они являются эпитопами Т-клеток человека в соответствии с используемыми программами: SYFPEITHI (Hans-Georg Rammensee, Jutta Bachmann, Niels Nikolaus Emmerich, Oskar Alexander Bachor and Stefan Stevanovic. 1999. Immunogenetics 50:213-219. SYFPEITHI: database for MHC ligands and peptide motifs, (access via: http://www.uni-tuebingen.de/uni/kxi /)) and ProPred (Singh H. and Raghava, G.P.S. 2001. ProPred: Prediction of HLA-DR binding sites. Bioinformatics, 17(12): 1236-37). Последовательности, соответствующие этим пептидам, показаны в таблице 1.
| Таблица 1 | ||
| Последовательность пептидов hHsp60, презентированных человеческим HLA | ||
| Пептиды | Положение в последовательности | Аминокислотная последовательность |
| E18-12 | 55-75 | MGPKGRTVIIEQSWGSPKVTK (SEQ. ID. NO:1) |
| E18-3 | 83-110 | SIDLKDKYKNIGAKLVQDVANNTNEEAG (SEQ. ID. NO:2) |
Пример 2
Пептид hHsp60 для эпитопа крыс Льюиса
Начиная с последовательности hHsp60, отбирают пептид, который связывается с молекулой MHC-II крысы RT1.BI в соответствии с участком последовательности, описанной в базе данных SYFPEITHI (Hans-Georg Rammensee, Jutta Bachmann, Niels Nikolaus Emmerich, Oskar Alexander Bachor, Stefan Stevanovic. 1999. Immunogenetics 50:213-219. SYFPEITHI: database for MHC ligands and peptide motifs (access via: http://www.uni-tuebingen.de/uni/kxi /)).
Программа, которая анализирует все пептиды из 9 аминокислот, была разработана для поиска тех пептидов, которые отвечают указанному участку. Авторы изобретения также включали варианты, которые в одном из положений не были включены в указанные остатки в качестве якорных или предпочтительных. Последовательность, соответствующая одному из этих пептидов (F19-6), показана в таблице 2.
| Таблица 2 | ||
| Последовательность пептидов hHsp60, отобранных для крыс | ||
| Пептид | Положение в последовательности | Аминокислотная последовательность |
| F19-6 | 518-533 | IIDPTKVVRTALLDAA (SEQ. ID. NO:3) |
Пример 3
Конструирование APL с модификациями аминокислот, включенных в связывание с MHC
Начиная с пептидов, отобранных в примерах 1 и 2, изменили положения, включенные в связывание с определенным MHC (положения 1, 3, 4, 6, 8 или 9), с целью увеличить аффинность пептида к молекуле HLA. Эти пептиды были проанализированы на наличие оптимальных остатков в каждом из этих положений, которые могут представлять собой якорные остатки в том случае, если бы пептид был отобран методом, использующим участки связывания (SYFPEITHI), либо остатки, способные увеличить рейтинг пептида как лиганда MHC, если пептид был выбран с использованием другого типа алгоритма (ProPred). В результате этих исследований в пептиде E18-12 были проведены замены в положениях 1-7 каждой из аминокислот, которые перечислены далее:
где аминокислота в положении 1 замещена на: A,F,I,L,M,V,W или Y
в положении 2 на: A,D,E,F,G,H,I,K,L,M,N,Q,R,S,T,V,W или Y
в положении 3 на: A,K,V,R,T,I,P,L,N,S,G,Y или M
в положении 4 на: A,D,E,F,G,H,I,K,L,M,N,Q,R,S,T,V,W или Y
в положении 5 на: A,D,E,F,G,H,I,K,L,M,N,Q,R,S,T,V или Y
в положении 6 на: A,D,E,F,G,H,I,K,L,M,N,P,Q,R,S,T,V,W или Y
в положении 7 на: A,D,E,F,G,H,I,K,L,M,N,Q,R,S,T,V или Y
где аминокислота в положении 1 замещена на: L,I,V,M,Y,W,F или A в положении 2 на: A,D,E,F,G,H,I,K,L,M,N,Q,R,S,T,V,W или Y
в положении 3 на: A,F,I,K,L,M,P,R,S,T,V,W или Y
в положении 4 на: L,I,V,M,Y,W,F или A
в положении 5 на: A,D,E,F,G,H,I,K,L,M,N,Q,R,S,T,V,W или Y
в положении 6 на: A,D,E,F,G,H,I,K,L,M,N,Q,R,S,T,V,W или Y
в положении 7 на: A,F,I,K,L,M,P,R,S,T,V,W или Y
в положении 8 на: A,D,E,F,G,H,I,K,L,M,N,Q,R,S,T,V,W или Y
В пептиде F19-6 по положениям 1 и 2 были осуществлены замены на аминокислоты, перечисленные далее:
где аминокислота в положении 1 замещена на H,
а аминокислота в положении 2 замещена на E.
Пример 4
Индукция артрита адъювантом и коллагеном у крыс Льюиса
В эксперименте использовались инбредные самки крыс Льюиса (RT1.BI MHC), предоставленные Национальным Центром Производства Лабораторных Животных (CENPALAB, Cuba). Крысы с приблизительным весом 101-120 г и 5-8 недель возраста были отобраны случайным образом.
Одним из агентов-индукторов болезни был Mt (H37Ra, Difco, England) в неполном адъюванте Фрейнда (IFA) (Sigma, USA). Другим агентом-индуктором артрита являлся бычий коллаген типа II в IFA.
В настоящем примере для развития артрита у крыс, вызванного иммунным ответом против двух различных аутоантигенов, использовались два различных индуцирующих агента. Хорошо известно, что в животной модели артрита, в которой в качестве индуктора болезни используется Mt, фундаментальный ответ T-клеток направлен против Hsp60 (Anderton, SM (1995) Activation of T cells recognizing self 60-kD heat shock protein can protect against experimental arthritis. J. Exp. Med. 181: 943-952). В модели, в которой в качестве индуктора используется коллаген, заметный ответ антител, а также клонов T-клеток развивается против указанного антигена (M Griffiths (1988) lmmunogenetics of collagen-induced arthritis in rats. Inten. Rev. Immunology 4:1-15).
Основная цель изобретения получения этих двух животных моделей состояла в том, чтобы оценить пептиды по изобретению на обеих моделях с целью демонстрации того, являлся ли защитный эффект этих пептидов независимым или нет по отношению к аутоантигену, используемому в качестве агента индукции артрита у крыс.
Пример 5
Оценка клинических признаков
Уровень воспаления, связанный с развитием артрита, который показывала каждая крыса, был оценен в соответствии со следующим средним значением, подготовленным для этой цели:
0 единиц: нормальная лапка.
1 единица: Легкая, но характерная краснота лодыжки или очевидная краснота и воспаление, ограниченное отдельным пальцем, независимо от количества затронутых пальцев.
2 единицы: Умеренная краснота и воспаление лодыжки.
3 единицы: Тяжелая краснота и воспаление целой лапки, включая пальцы.
4 единицы: Максимальное воспаление и деформация лапки, вовлекающие большое количество суставов.
Четыре лапки были оценены по отдельности согласно установленной шкале, причем каждая лапка могла получить до 4 пунктов. Таким образом, каждая крыса могла получить максимум 16 пунктов.
Визуальная оценка проводилась после индукции болезни каждые пять дней.
Клиническая оценка признаков артрита демонстрировала, что были существенные статистические различия между животными, соответствующими здоровой контрольной группе (группа IV), где болезнь не была вызвана, и животными, соответствующими больной контрольной группе (группа III), где болезнь была вызвана, но им не вводили пептиды, как это показано на фиг.1.
Пример 6
Синтез пептидов
Пептиды синтезировали в соответствии со стратегией Fmoc/tBu в шприцах. Использовали смолу Fmoc-AM-MBHA (0,54 ммоль/г), и протокол синтеза был продолжен с механическим перемешиванием. После обработки ТФУ, пептид был лиофилизирован и охарактеризован с помощью ВЭЖХ и масс-спектрометрии.
Пример 7
Внутрикожное введение пептидов
Животные были разделены на четыре группы по 12 крыс в каждой. Болезнь была вызвана в трех группах животных (группы I- III), причем двум группам вводили пептиды, а одна группа являлась контролем индукции болезни. Две группы животных, которым вводили пептиды, получили 200 мкг пептида на каждую крысу в 100 мкл PBS, на 12, 17 и 22 дни после индукции болезни при помощи Mt. Животные, разделенные на четыре группы, были подвергнуты терапии следующим образом:
- группа I: животные, подвергнутые обработке пептидом F19-6;
- группа II: животные, подвергнутые обработке пептидом F19-7;
- группа III: животные, не подвергнутые обработке пептидами (контроль индукции болезни);
- группа IV: животные, у которых не была вызвана болезнь и которые не подверглись обработке пептидами (отрицательный контроль).
В дни 15, 21, 28 и 35 после индукции в группе умерщвляли по три животных, извлекали селезенку и отбирали пробы из суставов для гистопатологического анализа.
Как это показано на фиг.1, признаки, связанные с развитием артрита, развивались постепенно. У животных группы III, по сравнению с контрольной группой развития болезни, с 10 дня после индукции артрита стало наблюдаться развитие воспалительного процесса, который начался с легкой красноты нижнего сустава и который продвинулся, распространяясь в остальную часть сустава, пока не стал тяжелым у некоторых крыс. Из указанной фигуры видно, что введение пептида F19-6, соответствующего исходному эпитопу hHsp60, и их варианту APL F19-7, вызвало существенное уменьшение клинических признаков артрита у животных, подвергнутых обработке обоими пептидами. Среди групп, подвергнутых обработке пептидами F19-6 и F19-7, были получены статистически существенные различия, и эта группа была взята в качестве положительного контроля болезни (P<0,05).
Результаты, полученные в данном исследовании, подтверждают, что пептиды F19-6 и F19-7 проявляют защитный эффект у животных, подвергнутых обработке, так как у крыс можно было наблюдать почти полную ремиссию заболевания.
Пример 8
Выделение мРНК
Мононуклеарные клетки, выделенные из селезенки крыс, инкубировали в течение приблизительно 20 часов. Затем отбросили супернатант и в каждую лунку добавили 1 мл реактива: TRI REAGENT TM (SIGMA, USA) и оставили на 5 минут при комнатной температуре. После чего выделение мРНК выполнили по методике, рекомендованной фирмой-производителем.
Пример 9
Обратная транскрипция РНК
Для получения комплементарной ДНК была использована система Gene Amp RNA PCR Kit (Perkin-Elmmer, USA). По методике использовали 1 мг мРНК, соответствующей каждому образцу, после чего опыт провели по методике, рекомендованной фирмой-производителем. Реакция была проведена в амплификаторе (Minicycler, MJ Research, USA) по следующей схеме: первый цикл 1 час при 42°С, затем 5 минут при 95°С и 5 минут при 4°С.
Пример 10
Полимеразная цепная реакция
Полимеразная цепная реакция (ПЦР) была проведена в отношении цитокинов: TNFα и IL-10, а также конститутивного гена, кодирующего фермент GAP-DH (глицеральдегид-3-фосфат дегидрогеназу, сокращенно GAP-DH).
В каждой реакции использовали 10 пмоль каждого из праймеров, 5 мл ДНК матрицы, 0,25 мл термостабильной ДНК-полимеразы (Taq-Pol) (Perkin-Elmmer, США) в буфере, рекомендованном фирмой-производителем (KCl 50 мМ, Трис-HCl 10 мМ, pH 9,0, Тритон X-100 до 0,1% и 1,5 мМ MgCl2) в конечном объеме 25 мкл.
Реакция для GAP-DH была проведена в амплификаторе (Minicycler, MJ Research, U.S) согласно следующей программе: первый цикл 3 мин при 94°C (температура денатурации), 1 мин при 94°C, 1 мин при 58°C (температура отжига) и 1 мин при 72°C (температура элонгации), далее 35 циклов: 1 мин при 94°C, 1 мин при 58°C и 1 мин при 72°C в каждом цикле. В заключении стадия достройки 3 мин при 72°C.
Для цитокинов была использована предыдущая схема, только с изменением температуры отжига. Для IL-10, 54°C и для TNFα 64°C.
Пример 11
Анализ ПЦР-продуктов с помощью электрофореза в агарозном геле
Продукт ПЦР был проанализирован с помощью электрофореза в агарозном геле. Изображения электрофореза были зафиксированы и проанализированы с помощью Molecular Program Analyst (BioRad). Результаты были представлены как относительные уровни мРНК для каждого цитокина.
Пример 12
Статистический анализ относительных уровней мРНК для каждого цитокина
Чтобы определить различия между профилем цитокинов (в соответствии с относительными уровнями мРНК для каждого) среди групп обработанных животных, были использованы тесты Крускала-Валлиса и Стьюдента-Ньюмана-Кеулса (Statistical package Sigma Stat v 2 1997, GraphPad Software, Inc).
Статистические исследования показали, что на 15 день после индукции болезни пептиды значительно снижают уровни TNFα по сравнению с контрольной группой заболевания.
Эти результаты показаны на фиг.2, где GI соответствует животным, обработанным пептидом F19-6, GII представляет собой группу крыс, подвергнутых обработке пептидом F19-7, GIII представляет группу не подвергнутых обработке больных животных, и GIV включает здоровых животных. Было четко подтверждено, что терапия пептидами вызвала уменьшение относительных уровней указанного цитокина, в наибольшей мере ответственного за стимуляц