Нанобиочип, используемый для регистрации белков и белковых комплексов, способ его получения и способ регистрации белков и белковых комплексов с использованием зондовой микроскопии
Иллюстрации
Показать всеИзобретение относится к медицине, в частности к медицинской диагностике. Предложен нанобиочип для регистрации белков и белковых комплексов и способ его получения. В качестве подложки биочипа используют нерасслаивающийся материал, например поликарбонат или полистирол, на котором выполняют рельефную сетку, а затем поверхность выравнивают с помощью штампа, обеспечивающего ровную поверхность с размером неровностей не более 1 мм, после чего осуществляют модификацию и иммобилизацию молекул-зондов, способных специфически взаимодействовать с исследуемыми белками и белковыми комплексами на поверхности чипа. Способ позволяет повысить надежность получаемого биочипа за счет исключения его расслоения и повысить достоверность диагностики за счет повышения чувствительности регистрации специфических белков и белковых комплексов. 3 н. и 9 з.п. ф-лы, 2 ил.
Реферат
Область техники
Изобретение относится к медицине, в частности к медицинской диагностике, и касается диагностики онкологических заболеваний путем регистрации специфических белков и их комплексов в исследуемой крови. Изобретение может быть использовано для диагностики других соматических и инфекционных заболеваний. Кроме того, изобретение относится к технологии изготовления чипов, используемых в зондовой микроскопии.
Основной проблемой медицинской протеомики и ранней диагностики является низкий уровень чувствительности, не более 10-12 М. Для решения задачи повышения чувствительности методов в протеомике и диагностике необходимо использовать молекулярные детекторы, позволяющие проводить регистрацию белков на уровне единичных молекул. К таким детекторам относятся детекторы на базе сканирующих зондовых микроскопов, включающих атомно-силовые микроскопы (АСМ). Атомно-силовой детектор включает в себя чип с ровной поверхностью и сам атомно-силовой микроскоп. Чип, имеющий на своей модифицированной поверхности неровности не более 1 нм, с нанесенным на него молекулами-зондами, способными формировать комплексы с макромолекулами-партнерами, представляет собой нанобиочип (далее - чип).
Основная проблема в использовании зондовых, в том числе атомно-силовых детекторов для протеомики и диагностики, заключается
1) в создании технологии изготовления чипов с гладкой поверхностью, размер неровностей рельефа которой гораздо меньше размеров белков, адсорбированных на поверхности чипа, то есть не превышает 1 нм;
2) в создании технологии получения биослоя биомолекул-зондов на поверхности чипа, обладающих повышенным сродством к макромолекулам-партнерам, которые вылавливаются специфически из раствора аналита, что приводит к повышению чувствительности метода на основе зондовой микроскопии.
Уровень техники
Известны чипы, способы регистрации макромолекул с их использованием и технологии их изготовления, в которых макромолекулы-зонды, иммобилизированы в ячейки гидрогеля на общей подложке и образуют матрицу (пат. США 5552270 и 5552271).
Известен способ получения чипов, согласно которому ячейки чипа получают полимеризацией композиций в каплях, нанесенных на подложку с помощью микропипетки (F.N.Rehman, M.Audeh, E.S.Abrams, P.W.Hammond, M.Kenney and T.C.Boles, Nucleic Acids Research, 1999, v.27, 15, p.649-655).
К недостаткам применительно к сканирующей зондовой микроскопии известных способов и используемых чипов относятся низкая воспроизводимость свойств ячеек. Технически сложная технология изготовления чипов, не обеспечивающая необходимой однородности и воспроизводимости свойств молекул аналита, и самое главное, это образование материалами типа адсорбированных гелей, структур с неровностями рельефа, превышающими размеры анализируемых макромолекул.
Кроме того, известен белковый чип, способ его изготовления и способ регистрации, использующий этот чип. Чип представляет собой расположенные на твердой подложке макромолекулы (антитела, антигены или их фрагменты), с помощью чипа осуществляют диагностику путем идентификации биологических макромолекул, специфичных для инфекционного заболевания (гепатит В, С, сифилис и др. (CN 1373365).
Недостатком данного чипа является неконтролируемый рельеф поверхности и процедуры иммобилизации.
Наиболее близкими к предлагаемому чипу, способу его изготовления и регистрации макромолекул с его помощью являются решения, описанные в патентной заявке №2003109969 от 08.04.2003 г., в частности, чип на основе слюды, где макромолекулы адсорбированы на поверхность чипа. В этом патентом документе раскрыт способ регистрации макромолекул, в частности белков, с использованием сканирующей зондовой микроскопии, и чип на основе слюды.
Слюда является наиболее подходящей подложкой при изготовлении чипов для зондовой микроскопии, в частности для атомно-силового микроскопа при визуальной регистрации макромолекул с размерами порядка нанометров (к ним относятся белки, белковые комплексы, олигонуклеотиды и т.д.), поскольку при скалывании на ее поверхности образуются протяженные атомарно-гладкие площадки, на которых для анализа с помощью сканирующей зондовой микроскопии можно иммобилизовать макромолекулы. Недостатком же чипа на основе слюды является его способность к расслаиванию во время проведения процедуры инкубации слюды с иммобилизованными молекулами-зондами в растворе, что приводит к деструкции чипа.
Сущность изобретения
Заявленная группа изобретений направлена на преодоление описанных недостатков известных решений.
Технический результат заключается в повышении надежности получаемого чипа за счет исключения его расслоения и повышении достоверности диагностики за счет повышения чувствительности регистрации специфических белков и белковых комплексов.
Технический результат достигается за счет того, что в чипе для регистрации белков и белковых комплексов с использованием сканирующей зондовой микроскопии, выполненном в виде подложки, поверхность которой модифицирована и на которую нанесено поле иммобилизованных молекул-зондов, способных специфически взаимодействовать с исследуемыми белками и белковыми комплексами, в качестве подложки использован нерасслаивающийся материал, например поликарбонат или полистирол, на поверхность которого с помощью разогретого штампа нанесена рельефная координатная сетка для разделения зон при нанесении маркеров и затем с помощью штампа, имеющего рабочую поверхность из свежесколотой слюды, выполнена ровная поверхность с размером неровностей не более 1 нм.
Чип имеет поверхность подложки, химически модифицированную силаном, к силанизированной поверхности которой иммобилизованы молекулы-зонды с использованием кросс-линкеров или
чип имеет поверхность подложки, подвергнутую ультрафиолетовому облучению с последующей иммобилизацией на обработанной поверхности молекул-зондов с использованием фотокросс-линкеров.
Иммобилизованные молекулы-зонды представляют собой антитела, антигены, аптамеры, олигонуклеотиды, их фрагменты, иммобилизованные отдельно или в любых их комбинациях.
Способ получения чипа для идентификации белков и белковых комплексов с использованием сканирующей зондовой микроскопии включает использование подложки, на модифицированной поверхности которой иммобилизованы молекулы-зонды, способные специфически взаимодействовать с исследуемыми белками и белковыми комплексами и которые ковалентно сшивают, новым в способе является то, что заготовку вырезают из нерасслаивающегося материала, например поликарбоната или полистирола, с помощью первого штампа наносят на поверхность заготовки рельефную координатную сетку, с помощью второго штампа, рабочая поверхность которого представляет собой свежесколотую слюду, на заготовке отпечатывают атомарно-ровную поверхность с размером неровностей не более 1 нм, разрезают готовую заготовку на чипы, после чего осуществляют модификацию поверхности подложки чипа и иммобилизацию на ней молекул-зондов.
Модификацию поверхности подложки чипа осуществляют силаном или ультрафиолетовым излучением и непосредственно иммобилизируют на поверхность чипа молекулы-зонды с использованием фотокросс-линкеров.
Способ регистрации белков и белковых комплексов с использованием канирующей зондовой микроскопии заключается в помещении чипа в биологическую среду, содержащую исследуемые белки и белковые комплексы, вылавливании белков и белковых комплексов за счет специфического взаимодействия с иммобилизованными на поверхности подложки чипа молекулами-зондами и ковалентного сшивания и регистрации белков и белковых комплексов после отмывания поля чипа от неспецифических белков и белковых комплексов новым в способе является использование в качестве чипа чип по пп.1-4.
В качестве сканирующего зондового микроскопа используют одноканальный или многоканальный атомно-силовой микроскоп, сканирующий туннельный микроскоп или оптический ближнепольный микроскоп.
Регистрацию осуществляют в газовой среде, в вакууме или в жидкости.
Описание графических материалов
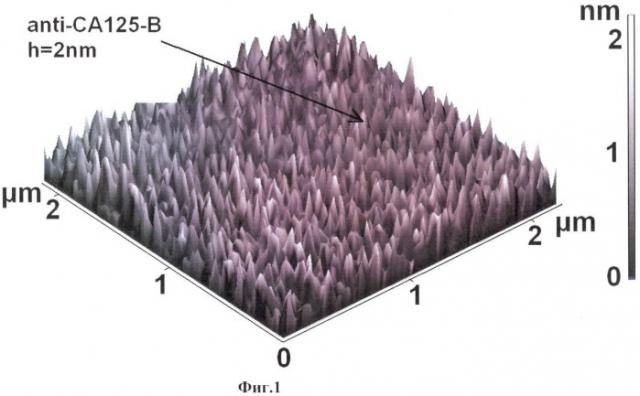
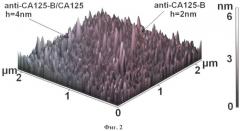
Ниже заявленные изобретения будут описаны более подробно со ссылками на графические материалы, где на фиг.1 представлено изображение поверхности чипа с иммобилизованными молекулами-зондами, в частности антителами к СА-125 (А); на фиг.2 - изображение чипа с комплексами (антител к СА-125/ СА-125) на его поверхности, изображения получены с помощью АСМ.
Раскрытие изобретений
Авторы пришли к выводу, что преодоление указанных выше недостатков известных технических решений возможно за счет использования в качестве подложки неслоистого материала - специальным образом обработанного поликарбоната или полистирола.
В соответствии с поставленной задачей изобретение связано с созданием чипа к сканирующему зондовому микроскопу для регистрации белков и белковых комплексов на основе специальным образом обработанного поликарбоната. В соответствии с поставленной задачей создан чип для идентификации макромолекул с использованием сканирующей зондовой микроскопии, состоящий из поля иммобилизованных молекул, расположенных на подложке, в котором в качестве подложки использован поликарбонат или полистирол. Поликарбонат (полистирол) является полимером и неслоистым материалом. Для изготовления чипа из поликарбоната (полистирола) осуществляется процедура из 3 основных операций.
1. Вырезается заготовка чипа из поликарбоната или полистирола. На поликарбонатную основу с помощью разогретого штампа наносится координатная сетка - путем контакта разогретого металлического штампа с определенным рельефом с поликарбонатной поверхностью заготовки.
2. Для получения атомарно-гладкой поверхности проводится выравнивание размеченной по п.1 поверхности с помощью другого штампа, рабочая поверхность которого представляет собой свежесколотую (непосредственно перед штамповкой) слюду. Вместо слюды возможно использование кремния, алмаза или сапфира, т.е. материалов, на которых при обработке возможно получить шероховатость не более 1 нм. Таким образом получается готовая заготовка, которая затем разрезается на чипы (например, размером 7×10 мм).
3. Для иммобилизации молекул зондов на поверхности поликарбонатного чипа он модифицируется.
Модификация такого чипа для получения нанобиочипа может проводится двумя способами:
a) модификация силаном и дальнейшее использование кросс-линкеров для иммобилизации зондов;
b) обработка ультрафиолетовым излучением и непосредственная иммобилизация на чипе зон молекул-зондов с использованием фотокросс-линкера.
Такой подход обеспечивает создание чипа к сканирующему зондовому микроскопу с рельефом порядка 1 нм, что достаточно для регистрации белков в протеомике и диагностике.
До настоящего времени использовалась технология получения биослоя биомолекул-зондов на поверхности чипа путем модификации молекул-партнеров биотином для образования связи биотин-стрептавидин (авидин), обладающей повышенным Kd~10-15 M [http://meeting.biophysj.org/cgi/reprint/82/1/337/d.pdf]. Эта технология непригодна для чипов, используемых в протеомике и диагностике, где раствор аналита включает не одну модельную молекулу, а сразу много типов молекул. Это связано с тем, что при иммобилизации молекул-стрептавидина (авидин) на поверхности чипа можно специфически регистрировать только биотинилированные молекулы-партнеры, а не все белки из многокомпонентной смеси аналита, которые образуют комплексы с иммобилизованными молекулами-зондами.
Преодоление этого недостатка, связанного с низким Kd возможно за счет применения модификации кросс-линкерами молекул-зондов, таких как антитела, антигены, аптамеры, олигонуклеотиды или их фрагменты с помощью методов химической, электрохимической фотохимической, радиохимической обработки этих молекул как непосредственно на чипе, так и до их иммобилизации на поверхности чипа с целью проведения реакции ковалентного связывания иммобилизованных на поверхности чипов к сканирующему зондовому микроскопу молекул-зондов с макромолекулами-партнерами. Это приводит к необратимому сшиванию молекул-зондов с макромолекулами-партнерами в комплексах на поверхности чипа к зондовому микроскопу.
Предложенная технология анализа белков и их комплексов с помощью сканирующей зондовой микроскопии заключается в
1) создании технологии изготовления нерасслаивающихся чипов к сканирующему зондовому микроскопу с поверхностью, что позволяет достичь размера неровностей рельефа которой меньше или, по крайней мере, не превышает размера белков, адсорбированных на поверхности чипа;
2) создании технологии получения биослоя молекул-зондов на поверхности чипа, обладающих повышенным сродством с макромолекулами-партнерами, что достигается модификацией молекул-зондов как непосредственно на чипе, так и до их иммобилизации на поверхности чипа кросс-линкерами, посредством которых проводится реакции ковалентного связывания иммобилизованных на поверхности чипов к сканирующему зондовому микроскопу молекул-зондов с макромолекулами-партнерами из раствора аналита, и
3) регистрации образованных комплексов на поверхности чипа с помощью сканирующей зондовой микроскопии.
Пример 1. В качестве примера реализации поставленной задачи был создан чип, состоящий из зон молекул, иммобилизованных на подложке поликарбонатного чипа к сканирующему атомно-силовому микроскопу.
На фиг.1 в качестве примера осуществления предлагаемого изобретения представлены полученные с помощью атомно-силового микроскопа изображения чипа для антител к СА-125 - онкологического маркера (А), где изображены макромолекулы антител, ковалентно иммобилизованные на подложке из поликарбоната, модифицированной силаном; на фиг.2 изображены в позиции (В) - СА125 макромолекулы, сконцентрированные из раствора аналита на поверхности чипа и ковалентно пришитые к ковалентно иммобилизованным антителам СА-125 с помощью кросс-линкера. Изображения получены в полуконтактной моде измерения. Как видно, размеры комплексов (антитело к СА125/ СА125) превышает размеры антител СА125, что означает, что чип на поликарбонате позволяет регистрировать маркерные белки онкологических заболеваний.
Сходные результаты получены на подложках из полистирола с площадками кремния, графита и слюды с закрепленными торцами для упрочнения ее структуры, модифицированной в поле электрического разряда.
С помощью чипа из поликарбоната и слюды с закрепленными торцами были зарегистрированы белки HCVcoreAg - маркеры заболевания гепатита, находящиеся в аналите при концентрации С до 10-17 М, что указывает на увеличение чувствительности более чем на 2 порядка по сравнению с существующими в настоящее время протеомными методами.
Аналогичные результаты были получены, когда в качестве иммобилизованных на подложке макромолекул использовались антигены, аптамеры, олигонуклеотиды или их фрагменты как в виде отдельного чипа, так и любые комбинациях этих молекул в виде поля.
При использовании нанополя - подложки к сканирующим зондовым микроскопам с иммобилизованными молекулами разных типов с разными типами иммобилизованных зондов предлагаемый способ позволяет проводить регистрацию различных типов заболеваний по регистрации комплексов зонд/мишень одновременно.
Применение вместо 1-канального многоканального, например 24-50 канального атомно-силового микроскопа (АСМ), позволяет поднять производительность метода зондовой микроскопии в соответствующее число раз, например 24-50 раз, а при использовании АСМ в режиме одновременного измерения во многих точках нанополя увеличить чувствительность до зептомолярного уровня в режиме измерения, при котором в этих точках иммобилизован один и тот же тип молекул.
В качестве сканирующих зондовых микроскопов в данном способе регистрации макромолекул и чипов с нанесенным проводящим покрытием к ним могут быть использованы, кроме атомно-силовых, также и сканирующие туннельные микроскопы.
При использовании флуоресцирующих иммобилизованных молекул и/или макромолекул или введении специальных флуоресцирующих меток в иммобилизованные молекулы макромолекулы для получения флуоресценции в выбранном спектральном диапазоне вместо атомно-силового микроскопа могут быть использованы ближнепольные сканирующие оптические микроскопы.
1. Нанобиочип для регистрации белков и белковых комплексов с использованием сканирующей зондовой микроскопии, выполненный в виде подложки, поверхность которой модифицирована и на которую нанесено поле иммобилизованных молекул-зондов, способных специфически взаимодействовать с исследуемыми белками и белковыми комплексами и которые ковалентно сшивают, отличающийся тем, что в качестве подложки использован нерасслаивающийся материал, например поликарбонат или полистирол, на поверхность которого с помощью разогретого штампа нанесена рельефная координатная сетка, и затем с помощью штампа, имеющего рабочую поверхность из свежесколотой слюды, образована ровная поверхность с размером неровностей не более 1 нм.
2. Нанобиочип по п.1, отличающийся тем, что имеет поверхность подложки, химически модифицированную силаном, к которой с использованием кросслинкеров иммобилизованы молекулы-зонды.
3. Нанобиочип по п.1, отличающийся тем, что имеет поверхность подложки, подвергнутую ультрафиолетовому облучению с последующей иммобилизацией на обработанной поверхности молекул-зондов с использованием фотокросслинкеров.
4. Нанобиочип по пп.1, 2 или 3, отличающийся тем, что иммобилизованные молекулы-зонды представляют собой антитела, антигены, аптамеры, олигонуклеотиды, их фрагменты, иммобилизованные отдельно или в любых их комбинациях.
5. Способ получения нанобиочипа для идентификации белков и белковых комплексов с использованием сканирующей зондовой микроскопии, включающий использование подложки, на модифицированной поверхности которой иммобилизованы молекулы-зонды, способные специфически взаимодействовать с исследуемыми белками и белковыми комплексами и которые можно ковалентно сшивать, отличающийся тем, что вырезают заготовку из нерасслаивающегося материала, например поликарбоната или полистирола, с помощью первого штампа наносят на поверхность заготовки рельефную координатную сетку, с помощью второго штампа, рабочая поверхность которого представляет собой свежесколотую слюду, образуют поверхность с размером неровностей не более 1 нм, после чего осуществляют модификацию поверхности подложки чипа и иммобилизацию на ней молекул-зондов.
6. Способ по п.5, отличающийся тем, что модификацию поверхности подложки чипа осуществляют силаном.
7. Способ по п.5, отличающийся тем, что модификацию поверхности подложки чипа проводят ультрафиолетовым излучением и непосредственно иммобилизируют на поверхность чипа молекулы-зонды с использованием фотокросс-линкеров.
8. Способ регистрации белков и белковых комплексов с использованием сканирующей зондовой микроскопии, заключающийся в помещении нанобиочипа в биологическую среду, содержащую исследуемые белки и белковые комплексы, специфического вылавливания белков и белковых комплексов, ковалентного связывания их с иммобилизированными на поверхности подложки чипа молекулами-зондами и регистрации белков и белковых комплексов после отмывания поля нанобиочипа от неспецифических белков и белковых комплексов, отличающийся тем, что в качестве нанобиочипа используют чип по пп.1-4.
9. Способ по п.8, отличающийся тем, что в качестве сканирующего зондового микроскопа используют одноканальный или многоканальный атомно-силовой микроскоп, сканирующий туннельный микроскоп или оптический ближнепольный микроскоп.
10. Способ по п.8 или 9, отличающийся тем, что регистрацию осуществляют в газовой среде.
11. Способ по п.8 или 9, отличающийся тем, что регистрацию осуществляют в вакууме.
12. Способ по п.8 или 9, отличающийся тем, что регистрацию осуществляют в жидкости.