Способ консервирования биологических органов
Иллюстрации
Показать всеИзобретение относится к медицинской технике, а именно к методам консервации биологических органов, предназначенных для трансплантации. Способ консервирования биологических органов включает сохранение в контейнере емкости с биологическим органом, снабженным перфузатом, при этом контейнер изготавливают из материала с модулем Юнга не менее 216 ГПа, стенки которого имеют толщину с пределом прочности 0,15-0,85 ГПа, при этом контейнер на 80-85% его объема заливают дистиллированной водой, помещают заполненную перфузатом и выполненную из полимерного материала, например полиэтилена, емкость с биологическим объектом в центре верхней трети объема контейнера, доливают дистиллированную воду до полного объема контейнера, герметизируют и охлаждают до температуры -20 - -22°С в течение 1-1,5 часа со скоростью 0,3-0,5 град/мин. Изобретение обеспечивает повышение эффективности способа и увеличение срока хранения органов любых размеров, поскольку позволяет избежать образование экстра- и интрацеллюлярных кристаллов льда, являющихся основным деструктивным фактором при криоконсервировании, и не предполагает применение криопротекторов, оказывающих цитотоксическое воздействие на трансплантат. 3 ил.
Реферат
Изобретение относится к медицинской технике, а именно к методам консервации биологических органов, предназначенных для трансплантации.
Существует несколько способов сохранения (консервации) донорских органов на период времени между изъятием и трансплантацией: криоконсервация - замораживание (см. патент США №4067091; А.С. СССР №1655426); перфузионный - постоянное промывание органа специальным раствором (см. А.С. СССР №814307) и бесперфузионный (А.С. СССР №1400575) - орган после промывания специальным раствором сохраняется, находясь в этом же растворе. В настоящее время используется, в основном, бесперфузионный метод консервации донорских органов.
В качестве растворов, применяемых для промывания органа после изъятия и консервации на срок до трансплантации, в настоящее время применяются растворы «ЕВРОКОЛЛИНЗ», «КУСТОДИОЛ», «ВИАСПАН». Они содержат оптимальный набор электролитов, антиоксидантов и стабилизаторов клеточных мембран для сохранения жизнеспособности донорского органа. Эти растворы предназначены для консервации различных донорских органов, например для почек - «ЕВРОКОЛЛИНЗ», «КУСТОДИОЛ»; для печени и сердца - «ВИАСПАН» и др. Сроки консервации составляют от 24 до 72 часов при температуре +4°С. Безусловно, столь малые сроки эффективной консервации позволяют провести только транспортировку органа до места проведения трансплантации и исследования по подбору пар донор-реципиент по эритроцитарным изоаптигенам (группа крови) и антигенам гистосовместимости, так как трансплантационный антигенный барьер является основным фактором, определяющим срок функции трансплантата в организме реципиента, а порой и успех самой трансплантации.
Также важнейшей проблемой трансплантологии является отсутствие банков органов, обусловленное невозможностью на сегодняшний день производить длительную консервацию органов, обеспечивающую функциональную полноценность трансплантатов. Методики криоконсервации, применяемые сегодня, дают хорошие результаты при консервации малых биологических объектов (клеток, спермы, яйцеклеток, эмбрионов, тканевых и органных суспензий), так как именно в малые и сверхмалые объекты возможна равномерная диффузия криопротекторов, позволяющих максимально снизить клеточную деструкцию.
Известен способ консервирования биологических объектов, например пантов северных оленей, путем поэтапного охлаждения в вакууме 0,094-0,096 МПа (см. патент РФ №2261101, Кл. А01N 1/02, 2005).
Также известен способ консервирования биологических органов (см. ЕПВ з.№0125847, Кл. A01N 1/02, 1984 г. - прототип), включающий сохранение в контейнере емкости с биологическим органом, снабженным перфузатом.
Общим недостатком известных технических решений является то, что в тканях биологических объектов средних и больших размеров (органы, целые организмы) не удается равномерно распределить криопротекторы в нужной концентрации, в результате чего в процессе замораживания и оттаивания наблюдается цепь физико-химических процессов, связанных с экстра- и интрацеллюлярным формированием кристаллов льда, повышением концентрации осмотических компонентов, приводящей к денатурации белковых структур, рекристаллизацией ледяных кристаллов в процессе оттаивания. Все эти процессы обусловливают повреждение и гибель клеточных структур. После оттаивания в тканях, подвергшихся глубокому замораживанию, развиваются реактивные процессы (нарушение микроциркуляции крови и тканевых жидкостей, гипоксия и ишемия, локальная эдема, выход тканевых макрофагов, развитие воспалительных и локальных иммунологических процессов), которые довершают разрушение оставшихся неповрежденных структур и приводят к формированию зоны асептического некроза. Скорость, с которой происходит оттаивание, оказывает сильное влияние на конечную степень развития некротических процессов. При быстром оттаивании мелкие нестабильные кристаллы льда легко тают, не повреждая ткани, тогда как при медленном оттаивании они подвергаются рекристаллизации в диапазоне температур от -40 до -20°С. При этом слияние мелких кристаллов с образованием крупных кристаллических структур является мощным повреждающим фактором.
Техническим решением задачи является повышение эффективности криоконсервации органов и увеличение срока хранения органов и организмов любых размеров за счет избежания образования экстра- и интрацеллюлярных кристаллов льда - главного деструктивного фактора при криоконсервации и отказа от применения криопротекторов, которые в эффективной концентрации оказывают цитотоксическое воздействие на трансплантат.
Поставленная задача достигается тем, что в способе консервирования биологических органов, включающем сохранение в контейнере емкости с биологическим органом, снабженным перфузатом, согласно изобретению контейнер изготавливают из материала с модулем Юнга не менее 216 ГПа, стенки которого имеют толщину, выдерживающую предел прочности 0,15-0,85 ГПа, при этом контейнер на 80-85% его объема заливают дистиллированной водой, помещают заполненную перфузатом и выполненную из полимерного материала, например полиэтилена, емкость с биологическим органом, доливают дистиллированную воду до полного объема контейнера, герметизируют и охлаждают до температуры минус -20 - -22°С в течение 1-1,5 часа со скоростью 0,3-0,5 град/мин.
Новизна заявляемого технического решения усматривается в том, что за счет использования контейнера с определенными техническими характеристиками, дистиллированной воды в качестве хладоагента и охлаждения до температуры, обеспечивающей внутри контейнера давление до 2200 атм (0,224 ГПа), которое при охлаждении воды в замкнутом объеме обеспечивает последовательный переход воды из одного фазового состояния в другое и дальнейшую стабилизацию многофазной системы при температуре -22°С и давлении 2200 атм, позволяет:
а) эффективно проводить криоконсервацию тканей, органов и организмов любых размеров;
б) избежать образования экстра- и интрацеллюлярных кристаллов льда - главного деструктивного фактора при криоконсервации.
в) отказаться от применения криопротекторов, которые в эффективной концентрации оказывают цитотоксическое воздействие на трансплантат;
г) увеличить срок криоконсервации биологических микро- и макрообъектов от 72 часов до нескольких месяцев и более с сохранением их функциональной полноценности.
По данным научно-технической и патентной литературы не обнаружена аналогичная заявляемой совокупность признаков, позволяющая получить технический результат, который ранее не достигался известными средствами, что позволяет судить об изобретательском уровне заявляемого предложения.
Заявляемое техническое решение промышленно применимо, поскольку воспроизводимо, работоспособно и возможно его широкое использование в медицине.
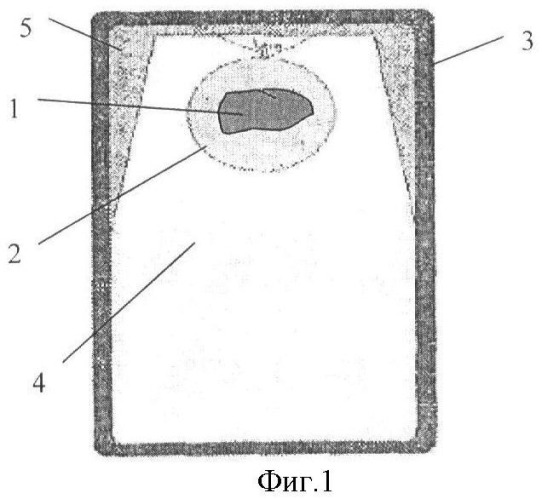
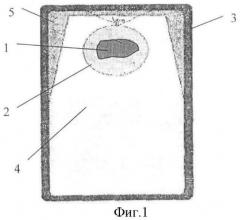
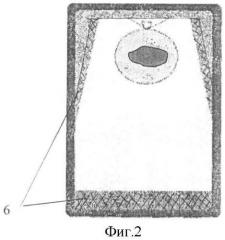
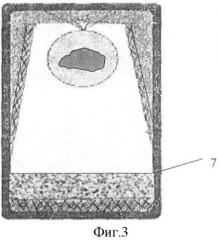
Сущность изобретения поясняется чертежами, где на фиг.1 представлен общий вид заполненного контейнера с начальным процессом образования льда модификации Лед-I; на фиг.2 - контейнер с образованием льда модификации Лед-II; фиг.3 - контейнер с образованием льда модификации Лед-III.
Сущность способа консервирования биологических органов (метода гипербарической гипотермии) основывается на аномальных свойствах воды в ее различных фазовых состояниях. В отличие от всех других химических веществ, у которых с ростом давления температура замерзания увеличивается, у воды наблюдается иная аномальная зависимость между давлением и температурой замерзания. Так, при давлении 500 атм дистиллированная вода замерзает при температуре -4°С. При дальнейшем повышении давления температура замерзания (плавления) воды падает, по мере увеличения давления до значений в 2200 атм, при котором температура замерзания воды -22°С. Но в дальнейшем при увеличении давления точка замерзания воды начинает расти: при давлении 3530 атм вода замерзает при минус 17°С; при 6380 атм - 0°С, при 16500 атм - при -60°С, а при 20670 атм - при -76°С. В последних двух случаях образуются так называемые «горячие льды».
В первой четверти прошлого века немецкий химик Г.Тамман и американский физик П.Бриджмен выявили шесть разновидностей льда, возникающих при различных давлениях, имеющих разную точку плавления, физическими свойствами которых и обуславливается аномальность при низких температурах и высоких давлениях.
Лед I - обыкновенный лед с плотностью 0,9 г/см3, существующий при давлениях до 2200 атм, при образовании возрастает в объеме примерно на 11%, что в замкнутом пространстве приводит к возникновению избыточного давления, достигающего 2500 атм, плотность льда этой модификации меньше, чем у воды.
Лед II - образуется с уменьшением объема на 18 - 20%, тонет в воде, т.к. его плотность 1,2 г/см3, очень неустойчив, с увеличением давления легко переходит в модификацию III.
Лед III - образуется при дальнейшем повышении давления из модификации II, тяжелее воды, его плотность 1,26 г/см3.
Таким образом, процесс охлаждения биологического органа происходит по схеме: ВОДА ЛЕД I=======ЛЕД II=======ЛЕД III.
Способ консервирования биологических органов осуществлялся следующим образом.
Биологический орган 1 (ткани, органы, системы органов, организмы) помещают в пластиковый пакет 2, который может быть выполнен из полиэтилена, заполненный перфузионным раствором. Предварительно кровеносные сосуды консервируемого органа заполняют аналогичным по составу перфузионным раствором. Контейнер 3 заполняют дистиллированной водой 4 на 80-85% его объема, затем в контейнер 3 помещают пластиковый пакет 2 с консервируемым биологическим органом 1, который фиксируют в центре верхней трети объема контейнера 3. После размещения в контейнере 3 консервируемого органа 1 контейнер 3 до 100% объема заполняют дистиллированной водой 4 и герметизируют. Для обеспечения качества консервации биологического органа необходимо, чтобы в перфузионном растворе не образовывались кристаллы льда, для этого в качестве хладоагента используют дистиллированную воду.
Использование дистиллированной воды объясняется тем, что из-за отсутствия солей она замерзает раньше, чем перфузионный раствор, если использовать обычную воду, то за счет солей она замерзает позже, чем перфузионный раствор, в результате в нем будут образовываться кристаллы льда.
Контейнер 3 изготавливают из материала с модулем Юнга не менее 216 ГПа, стенки которого имеют толщину, выдерживающую предел прочности 0,15-0,85 ГПа. Толщина стенки может быть ориентировочно определена по формуле δ=F/S, где δ - предел прочности металла; F - сила давления на стенку контейнера; S - толщина стенки контейнера. Контейнер может быть выполнен, например, из стали или титана или из их сплавов. В зависимости от материала и определяется толщина стенки контейнера. Контейнер с биологическим органом охлаждают до температуры в пределах -21 - -22°С в течение 1-1,5 часа со скоростью 0,3-0,5 град/мин и поддерживают в течение всего периода хранения биологического объекта. Консервация объекта происходит постепенно. При охлаждении воды в замкнутом объеме наблюдается последовательный переход воды из одного фазового состояния в другое и дальнейшая стабилизация многофазной системы при температуре -22°С и давлении 2200 атм. при массовой доле льда всех его трех модификаций (Лед-I; Лед-II; Лед-III) от 15 до 20% от общего объема воды. Так, при давлении 500 атм дистиллированная вода в закрытом объеме замерзает при температуре -4°С с образованием льда модификации Лед-1 (на фиг.1 обозначен позицией 5) с плотностью 0,9 г/см3, который располагается на поверхности воды, т.е. в верхней части контейнера.
При дальнейшем повышении давления температура замерзания (плавления) воды падает по мере увеличения давления до значений в 2200 атм, при котором температура замерзания воды -22°С, в данном случае образуется лед модификации Льда-II (на фиг.2 позиция 6) с плотностью 1,2 г/см3, которая больше, чем у воды, в результате он образуется в донной части контейнера, т.к. тяжелее воды. В дальнейшем при увеличении давления плотность льда увеличивается, достигает 1,26 г/см3, и образуется лед модификации Лед-III (на фиг.3 позиция 7). Такой лед образуется только в донной части контейнера.
Длительность хранения возможна от нескольких дней до нескольких месяцев. При проведении расконсервации объекта производят постепенное плавное снижение температуры контейнера до 0°С, затем вскрывают контейнер и извлекают пакет с сохраняемым образцом.
При повышении температуры наблюдается обратный переход фазовых состояний воды, процесс размораживания происходит по схеме:
ЛЕД III--------ЛЕД II----------ЛЕД I-----------ВОДА, при котором давление с 2200 атм падает до атмосферного давления.
Пример конкретного осуществления способа консервирования биологических органов
Эксперименты по консервированию биологических органов проводились в исследовательской лаборатории Краснодарского технологического университета и научно-производственной лаборатории «УНИАП» (г.Слявянск на Кубани).
В качестве контрольного и опытного образцов биологических органов были использованы почки и сердце кроликов. Контрольные образцы были обработаны перфузатом, охлаждены в два этапа постепенно, сначала до -6 - -8°С, затем выдерживали и далее опять охлаждали до -40 - -60°С и погружали в жидкий азот.
Опытные образцы почек и сердца животного поместили в контейнер, выполненный из стали со стенками толщиной 5 см. Загерметизированный контейнер помещали в холодильную камеру и охлаждали до -22°C со скоростью 0,3-0,5 град/мин. Длительность хранения составляла 1 месяц. Расконсервацию опытных образцов проводили постепенно, плавно повышали температуру контейнера до 0°С, затем вскрыли контейнер и извлекли пакет с сохраняемым образцом. Контрольные образцы извлекли из жидкого азота и также плавно повышали температуру до 0°С.
В результате проведенных сравнительных исследований оказалось: в контрольном образце (почки) 45% ткани были повреждены за счет рекристаллизации ледяных кристаллов в процессе оттаивания, а в опытном образце целостность тканей составила 95%. Что касается сердца, то в контрольном образце ткани были повреждены на 37%, а в опытном образце сохранность составила 96,3%.
Способ консервирования биологических органов, включающий сохранение в контейнере емкости с биологическим органом, снабженной перфузатом, отличающийся тем, что контейнер изготавливают из материала с модулем Юнга не менее 216 ГПа, стенки которого имеют толщину с пределом прочности 0,15-0,85 ГПа, при этом контейнер на 80-85% его объема заливают дистиллированной водой, помещают заполненную перфузатом и выполненную из полимерного материала, например полиэтилена, емкость с биологическим объектом в центре верхней трети объема контейнера, доливают дистиллированную воду до полного объема контейнера, герметизируют и охлаждают до температуры - 20 - -22°С в течение 1-1,5 ч со скоростью 0,3-0,5 град/мин.