Окисленные липиды и их применение для лечения воспалительных заболеваний и нарушений
Иллюстрации
Показать всеНастоящее изобретение относится к новым синтетическим окисленным липидам и способам применения окисленных липидов для лечения и профилактики воспаления, ассоциированного с эндогенным окисленным липидом. 11 н. и 32 з.п. ф-лы, 25 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к новым окисленным липидам и способам применения окисленных липидов для лечения или профилактики воспалений, ассоциированных с эндогенными окисленными липидами. Способы по настоящему изобретению можно применять для лечения или предотвращения воспалительных заболеваний и нарушений, таких как, например, атеросклероз и родственные нарушения, аутоиммунные заболевания или нарушения и пролиферативные заболевания или нарушения.
Сердечно-сосудистые заболевания представляют собой главный фактор риска для здоровья в промышленно развитых странах. Атеросклероз, наиболее распространенное сердечно-сосудистое заболевание, является основной причиной инфарктов, инсультов и гангрен конечностей и, как следствие этого, главной причиной смертности в США. Атеросклероз является комплексным заболеванием, обусловленным клетками многих типов и молекулярными факторами (для более детального ознакомления см. публикацию Ross, 1993, Nature 362:801-809). Процесс, возникающий в результате поражения эндотелиальных клеток и клеток гладких мышц (SMC) стенок артерии, включает образование отложений, состоящих из фиброзной, жировой и волокнистой ткани, или бляшек, предшествующих и сопутствующих воспалению. Дестабилизация бляшек может вызвать дальнейшие осложнения, такие как разрыв сосудов и тромбоз, которые возникают в результате воспалительной и фибропролиферативной реакции на многообразные формы повреждений. Например, считается, что сдвиговые напряжения являются причиной частого образования атеросклеротических бляшек в системе кровообращения на участках возникновения турбулентного потока крови, таких как разветвления сосудов и структуры неправильной формы.
Первым наблюдаемым явлением при образовании атеросклеротических бляшек является сцепление клеток зоны воспаления, таких как макрофаги, образуемые из моноцитов, с эндотелиальным слоем сосудов и проникновение в субэндотелиальное пространство. Повышенные уровни LDL в плазме вызывают отложение липидов на стенках сосудов, в результате которого расположенные рядом эндотелиальные клетки продуцируют окисленный липопротеин низкой плотности (LDL). Кроме того, захват липопротеина внеклеточным матриксом ведет к прогрессирующему окислению LDL липоксигеназами, активным кислородом, пероксинитритом и/или миелопероксидазой. Указанные окисленные LDL затем поглощаются в больших количествах моноцитами через фагоцитарные рецепторы, экспрессированные на их поверхностях.
Наполненные липидами моноциты и клетки гладких мышц (SМC), именуемые ксантомными клетками, являются главным компонентом жировых полосок. Взаимодействие между ксантомными клетками, эндотелиальными клетками и окружающими их клетками гладких мышц вызывает состояние хронического местного воспаления, которое в конечном счете ведет к активации эндотелиальных клеток, повышенному апоптозу макрофагов, пролиферации и миграции клеток гладких мышц и образованию фиброзных бляшек (Hajjar, D.P. and Haberland, M.E, J. Biol. Chem. 1997, Sep. 12; 272(37):22975-78). В результате разрушения бляшек и образования тромбов происходит закупорка кровеносных сосудов, которая препятствует кровотоку и вызывает ишемию, состояние, характеризующееся недостатком кислорода в тканях вследствие недостаточной перфузии. Когда блокируется подача крови к сердцу по указанным артериям, у субъекта возникает “инфаркт”; когда происходит закупорка артерий головного мозга, у данного субъекта возникает инсульт. При сужении артерий, снабжающих кровью конечности, появляется сильная боль, ухудшается физическая подвижность и может возникнуть необходимость в ампутации.
Окисленный LDL участвует в патогенезе атеросклероза и атеротромбоза, оказывая воздействие на моноциты и клетки гладких мышц, вызывая апоптоз эндотелиальных клеток и нарушая баланс антикоагулянта в эндотелии. Окисленный LDL также ингибирует антиатерогенное HDL-ассоциированное разрушение окисленных фосфолипидов (Mertens, A and Holvoet, P., FASEB J. 2001 Oct; 15(12):2073-84). Данная ассоциация подтверждена многими исследованиями, демонстрирующими присутствие окисленного LDL в бляшках в разных животных моделях атерогенеза и замедление атерогенеза в результате ингибирования окисления фармакологическими и/или генетическими средствами (см., например, Witztum J. and Steinberg, D, Trends Cardiovasc Med 2001 Apr-May; 11(3-4):93-102 для ознакомления с текущей научной литературой). Действительно, окисленный LDL и малондиальдегид (MDA)-модифицированный LDL недавно были предложены в качестве точных маркеров крови для определения 1-й и 2-й стадии коронарной болезни сердца (патент США № 6309888, выданный Holvoet et al., и патент США № 6255070, выданный Witztum et al.).
Снижение окисления и активности LDL легло в основу ряда предложенных клинических методов лечения и профилактики сердечно-сосудистых заболеваний. Букала и др. (Bucala, et al., патент США № 5869534) описали способы модуляции перокисления липидов в результате сокращения конечного продукта прогрессирующего гликозилирования, представляющего собой липид, характерный для образования ксантомных клеток вследствие возрастных изменений, заболевания и диабета. Танг и др. (Tang et al., at Incyte Pharmaceuticals, Inс., патент США № 5945308) описали способ идентификации и клинического применения рецептора окисленного LDL человека при лечении сердечно-сосудистых и аутоиммунных заболеваний, а также рака.
Атеросклероз и аутоиммунные заболевания
С учетом предполагаемой роли сильной воспалительной фибропролиферативной реакции в случае атеросклероза и ишемии многие ученые предприняли попытку определить аутоиммунный компонент поражения сосудов. В случае аутоиммунных заболеваний иммунная система узнает и атакует компоненты, которые обычно не являются антигенными (аутоантигены), помимо воздействия на проникающие в организм чужеродные антигены. Аутоиммунные заболевания классифицируются как заболевания, опосредуемые аутоантителами или клетками. Типичными аутоиммунными заболеваниями, опосредуемыми аутоантителами, являются миастения и идиопатическая тромботическая пурпура (ITP), и типичными клеткоопосредуемыми заболеваниями являются тиреоидит Хасимото и (юношеский) диабет типа I.
Признание того, что иммуноопосредуемые процессы преобладают в местах атеросклеротических поражений, стало возможным в результате исследования лимфоцитов и макрофагов на ранних стадиях, а именно жировых полосок. Было обнаружено, что указанные лимфоциты, которые включают преобладающую популяцию CD4+ клеток (остальные клетки являются CD8+ клетками), являются более многочисленными, чем макрофаги на ранних стадиях поражения при сравнении с более поздними стадиями поражения, когда данное соотношение меняется на обратное. При изучении полученных результатов возникают вопросы относительно того, отражает ли такое явление первичную иммунную сенсибилизацию на возможный антиген или альтернативно является простым эпифеноменом ранее индуцированного местного поражения тканей. Независимо от факторов, определяющих наполнение бляшки на начальной стадии образования указанными клетками зоны воспаления, они, по-видимому, характеризуют активированное состояние, определяемое сопутствующей экспрессией HLA-DR главного комплекса гистосовместимости класса II и рецептора интерлейкина (IL), а также общих лейкоцитарных антигенов (CD45R0) и интегрина очень позднего антигена 1 (VLA-1).
Воспалительная реакция, возникающая на ранних стадиях атеросклеротического поражения, может быть первичным инициирующим событием, вызывающим продуцирование разных цитокинов локальными клетками (то есть эндотелиальными клетками, макрофагами, клетками гладких мышц и клетками зоны воспаления), или может быть формой реакции защитной иммунной системы организма на опасный процесс. Некоторые цитокины, которые, как было установлено, более интенсивно продуцируются резидентными клетками, включают TNF-α, IL-1, IL-2, IL-6 IL-8, IFN-γ и хемоаттрактант моноцитов пептид-1 (МСР-1). Кроме того, установлено, что происходит сверхэкспрессия тромбоцитарного фактора роста (PDGF) и инсулиноподобного фактора роста (IGF) всеми клеточными компонентами в атеросклеротических бляшках, что, по-видимому, усиливает предварительную воспалительную реакцию в результате костимулирущего действия митогенного и хемотаксического факторов. Уемура и др. (Uyemura et al., Cross regulatory roles of IL-12 and IL-10 in atherosclerosis. J. Clin Invest. 1996, 97; 2130-2138) установили паттерн Т-клеточных цитокинов типа 1 в атеросклеротических поражениях человека, характеризующихся сильной экспрессией IFN-γ, а не мРНК IL-4 по сравнению с нормальными артериями. Кроме того, на пораженном участке была обнаружена сверхэкспрессия IL-12, фактора роста Т-клеток, продуцируемого главным образом активированными моноцитами и селективным индуктором паттерна цитокинов Th1, о чем свидетельствует большое количество его основной гетеродимерной формы мРНК р70 и р40 (его доминантный индуцибельный белок).
Аналогично явному свидетельству преобладания клеточной иммунной системы в атеросклеротической бляшке имеются также многочисленные данные, подтверждающие участие локальной гуморальной иммунной системы. Так, в бляшках было обнаружено отложение иммуноглобулинов и комплементарных компонентов помимо повышенной экспрессии рецепторов C3b и C3Bi в резидентных макрофагах.
Ценные свидетельства участия иммуноопосредуемого воспаления в развитии атеросклероза были получены в результате исследования животных моделей. У мышей с нарушенной иммунологической реактивностью (с отсутствием МНС класса I) атеросклероз развивается быстрее по сравнению с иммунокомпетентными мышами. Кроме того, введение мышам С57BL/6 (Emeson E.E., Shen M.L., Accelerated atherosclerosis in hyperlipidemic C57BL/6 mice treated with cyclosporin A. Am. J. Pathol 1993; 142:1906-1915) и новозеландским белым кроликам (Roselaar S.E., Schonfeld G., Daugherty A. Enhanced development of atherosclerosis in cholesterol fed rabbits by suppression of cell mediated immunity. J. Clin. Invest. 1995; 96:1389-1394) циклоспорина А, сильнодействующего супрессора транскрипции IL-2, вызывало значительно более сильный атеросклероз при “нормальной” “нагрузке” липопротеина. Последние исследования могут пролить свет на возможную роль иммунной системы в противодействии самопроизвольному воспалительному процессу в атеросклеротической бляшке.
Атеросклероз не является классическим аутоиммунным заболеванием, хотя некоторые из его проявлений, таких как образование бляшек, закупоривающих кровеносные сосуды, можно отнести к аберрантной иммунологической реактивности. В классическом аутоиммунном заболевании очень часто можно выявить сенсибилизирущий аутоантиген, атакуемый иммунной системой и компонентами иммунной системы, которые узнают данный аутоантиген (гуморальными, то есть аутоантителами, или клеточными, то есть лимфоцитами). Кроме того, известно, что такое заболевание может быть вызвано у здоровых животных в результате пассивного переноса указанных компонентов иммунной системы, или в случае человека данное заболевание может передаваться от больной беременной женщины ее ребенку. Многие из указанных признаков отсутствуют в атеросклерозе. Кроме того, данное заболевание имеет общие факторы риска, такие как гипертензия, диабет, пониженная физическая активность, курение и другие, указанное заболевание поражает пожилых людей и характеризуется другим генетическим предпочтением по сравнению с классическими аутоиммунными заболеваниями.
Лечение аутоиммунного воспалительного заболевания может быть направлено на подавление или изменение общей и/или специфичной для болезни иммунной реактивности. Так, например, Аелло (Aiello, патенты США №№ 6034102 и 6114395) описал применение эстрогеноподобных соединений для лечения и профилактики атеросклероза и развития атеросклеротического поражения путем ингибирования рекрутинга клеток зоны воспаления. Аналогичным образом Медфорд и др. (Medford et al., патент США № 5846959) описали методы профилактики образования окисленной PUFA для лечения сердечно-сосудистых и других воспалительных заболеваний, обусловленных молекулой межклеточной адгезии VCAM-1. Кроме того, Фалб (Falb, патент США № 6156500) описал ряд сигнальных молекул и молекул межклеточной адгезии, присутствующих в большом количестве в атеросклеротической бляшке, в качестве потенциальных мишеней для противовоспалительной терапии.
Так как окисленный LDL, несомненно, участвует в патогенезе атеросклероза (см. выше), было исследовано влияние, оказываемое основными компонентами бляшки на аутоиммунитет в процессах развития атероматозного заболевания.
Иммунологическая реактивность на окисленный LDL. Известно, что окисленный LDL (oxLDL) оказывает хемотаксическое действие на Т-клетки и моноциты. Известно также, что oxLDL и его побочные продукты индуцируют экспрессию таких факторов, как хемотаксический фактор моноцитов 1, секрецию колониестимулирующего фактора и активирующие свойства тромбоцитов, которые являются сильнодействующими стимуляторами роста.
Активное участие иммунной реакции клеток в атеросклерозе было обосновано Стеммом С. и др. (Stemme S., et al., Proc. Natl. Acad. Sci. USA 1995; 92:3893-97), которые выделили CD4+ в клонах бляшек, реагирующих на oxLDL в качестве стимулов. Клоны, соответствующие oxLDL (4 из 27), продуцировали в основном γ-интереферон, а не IL-4. Необходимо выяснить, является ли данная реакция способом контактирования вышеуказанных клонов Т-клеток с иммунной системой клетки при помощи сильного стимулирующего иммуногена (oxLDL) или данная реакция служит средством борьбы с неактивным атеросклеротическим процессом.
Данные, относящиеся к участию гуморальных механизмов и их значению, являются гораздо более спорными. В одном недавно выполненном исследовании было сообщено о повышенных уровнях антител против МDA-LDL, являющегося метаболитом окисления LDL, у женщин, страдающих заболеванием сердца и/или диабетом (Dotevall, et al., Clin. Sci. 2001 Nov; 101(5):523-31). Другие исследователи продемонстрировали антитела, узнающие многие эпитопы в окисленном LDL, что свидетельствует об иммунной реакции на липид и компоненты аполипопротеина (Steinerova A., et al., Physiol Res. 2001; 50(2): 131-41) в случае атеросклероза и других заболеваний, таких как диабет, вазоренальный синдром, уремия, ревматическая атака и системная красная волчанка. В нескольких научных публикациях были отмечены повышенные уровни антител к oxLDL по мере развития атеросклероза (определяемого по степени стеноза сонной артерии, тяжести заболевания периферических сосудов и т.д.). Недавно Шерер и др. (Sherer et al., Cardiology 2001; 95(1):20-4) продемонстрировали повышенные уровни антител к кардиолипину, бета 2GPI и оxLDL, при ишемической болезни сердца. Таким образом, по-видимому, существует согласие относительно присутствия антител к oxLDL в форме иммунных комплексов в атеросклеротических бляшках, хотя действительная значимость данного открытия до сих пор не установлена.
Существует гипотеза, что антитела к oxLDL играют активную роль в метаболизме липопротеина. Так, известно, что иммунные комплексы оxLDL и соответствующих им антител более эффективно поглощаются макрофагами в суспензии по сравнению с оxLDL. Из данного открытия нельзя сделать никаких выводов о патогенезе атеросклероза, так как до сих пор не получен ответ на вопрос, является ли ускоренное поглощение оxLDL макрофагами благоприятным или вредным фактором.
Важные данные, касающиеся значимости гуморальной иммунной системы в процессе атерогенеза, ученые получают при исследовании животных моделей. Установлено, что гипериммунизация кроликов с отсутствием рецептора LDL гомологичным окисленным LDL вызывает продуцирование большого количества антител против оxLDL, в результате чего происходит значительное уменьшение величины атеросклеротических поражений по сравнению с контрольной группой, которой вводили физиологический раствор с фосфатным буфером (PBS). Уменьшение образования бляшек было также достигнуто при иммунизации кроликов липосомами с большим содержанием холестерина при одновременном продуцировании антител против холестерина, причем данный эффект сопровождался 35% снижением уровней холестерина, содержащего липопротеин с очень низкой плотностью.
Таким образом, в лабораторных и клинических исследованиях была всесторонне продемонстрирована патогенная роль компонентов окисленного LDL и их значение в качестве аутоантигенов в случае атеросклероза и других заболеваний.
Опосредуемая слизистой оболочкой иммуномодуляция при лечении аутоиммунных заболеваний
В недавнем прошлом были разработаны новые методы и фармацевтические препараты, пригодные для лечения аутоиммунных заболеваний (и родственных опосредуемых Т-клетками воспалительных заболеваний, таких как отторжение аллотрансплантата и неврологические заболевания, обусловленные ретровирусами). Указанные методы лечения модулируют иммунную систему, вызывая толерантность к заболеванию, при пероральном введении или через слизистую оболочку, например, путем ингаляции, при использовании в качестве толерогенных аутоантигенов, антигенов-свидетелей или подавляющих болезнь фрагментов или аналогов аутоантигенов или антигенов-свидетелей. Такие методы лечения описаны, например, в патенте США № 5935577, выданном Вейнеру и др. Аутоантигены и антигены-свидетели рассмотрены ниже (для общего ознакомления с толерантностью, индуцируемой через слизистую оболочку, см. публикацию Nagler-Anderson, C., Crit. Rev. Immunol. 2000; 20(2):103-20). Установлено, что внутривенное введение аутоантигенов (и их фрагментов, содержащих иммунодоминантные эпитопные области их молекул) вызывает супрессию иммунной реакции под действием механизма, именуемого клональной толерантностью. Клональная толерантность дезактивирует только Т-клетки иммунной атаки, специфичные к определенному антигену, в результате чего происходит значительное снижение иммунной реакции на данный антиген. Таким образом, Т-клетки, стимулирущие аутоиммунную реакцию и являющиеся специфичными к аутоантигену с индуцированной толерантностью, больше не пролиферируют под воздействием данного антигена. Подобное уменьшение пролиферации снижает также иммунные реакции, определяющие симптомы аутоиммунного заболевания (такие, как поражение нервной ткани, наблюдаемое в случае рассеянного склероза). Кроме того, существуют данные, что пероральное введение аутоантигенов (или иммунодоминантных фрагментов) в виде однократной дозы или в значительно больших количествах по сравнению с теми, которые запускают “активную супрессию”, могут также индуцировать толерантность вследствие анергии (или делеции клона).
В научной литературе описан также метод лечения на основании активной супрессии. Механизм активной супрессии отличается от механизма клональной толерантности. Указанный метод, всесторонне описанный в заявке на патент РСТ/US93/01705, включает пероральное введение или введение через слизистую оболочку антигенов, специфичных к ткани, подвергающейся аутоиммунному воздействию. Указанные антигены именуются “антигенами-свидетелями”. Такое лечение вызывает индукцию регуляторных (супрессорных) Т-клеток в лимфоидной ткани, ассоциированной с кишечником (GALT), лимфоидной ткани, ассоциированной с бронхами (BALT), или чаще всего в лимфоидной ткани, ассоциированной со слизистой оболочкой (MALT) (MALT включает GALT и BALT). Указанные регуляторные клетки выделяются в кровь или лимфатическую ткань и затем мигрируют в орган или ткань, пораженную аутоиммунным заболеванием, и подавляют аутоиммунную атаку на пораженный орган или ткань. Т-клетки, выявленные антигеном-свидетелем (которые узнают по крайней мере одну антигенную детерминанту антигена-свидетеля, используемого для их выявления), направленно воздействуют на очаг аутоиммунной атаки, где они опосредуют локальное выделение определенных иммуномодуляторных факторов и цитокинов, таких как трансформирующий β-фактор роста (TGF-β), интерлейкин-4 (IL-4) и/или интерлейкин-10 (IL-10). Из вышеуказанных факторов TGF-β является антиген-неспецифическим иммуносупрессивным фактором в связи с тем, что он подавляет иммунную атаку независимо от антигена, запускающего данную атаку. (Однако поскольку толеризация антигеном-свидетелем, достигаемая при пероральном введении или при введении через слизистую оболочку, вызывает выделение TGF-β только в непосредственной близости от места аутоиммунной атаки, она не обеспечивает системную иммуносупрессию). IL-4 и IL-10 также являются антиген-неспецифическими иммунорегуляторными цитокинами. IL-4, в частности, усиливает реакцию Т-клеток-хелперов типа 2 (Th2), то есть воздействует на предшественники Т-клеток и вызывает их дифференцировку с образованием предпочтительно Th2-клеток за счет реакций Th1-клеток. IL-4 также косвенно ингибирует обострение, вызванное Th1-клетками. IL-10 является прямым ингибитором реакций Th1-клеток. После пероральной толеризации млекопитающих, страдающих аутоиммунным заболеванием, при помощи антигенов-свидетелей наблюдаются повышенные уровни TGF-β, IL-4 и IL-10 в очаге аутоиммунной атаки (Chen, Y. et al., Science, 265:1237-1240, 1994). Механизм подавления антигеном-свидетелем подтвержден фон Герретом и др. (von Herreth et al., J. Clin. Invest., 96:1324-1331, September 1996).
Пероральная иммуномодуляция, вызывающая пероральную толерантность, была эффективно применена в животных моделях при лечении воспалительного заболевания кишечника путем перорального введения пробиотических бактерий (Dunne, C., et al., Antonie Van Leeuwenhoek 1999 Jul-Nov; 76(1-4):279-92), аутоиммунного гломерулонефрита - путем перорального введения гломерулярной базальной мембраны (Reynolds, J. et al., J. Am. Soc. Nephrol. 2001 Jan; 12(1):61-70), экспериментального аллергического энцефаломиелита (ЕАЕ, который равнозначен рассеянному склерозу или MS), - путем перорального введения основного белка миелина (МВР), адъювантного и коллагенового артрита - путем перорального введения субъекту соответственно коллагена и HSP-65. В Бостонской компании Autoimmune было проведено несколько экспериментов с участием людей по предотвращению диабета, рассеянного склероза, ревматоидного артрита и увеита. Результаты экспериментов с участием людей были менее впечатляющими по сравнению с экспериментами на животных, отличных от человека, однако был достигнут некоторый успех по профилактике артрита.
Была также исследована иммуномодуляция путем индукции пероральной толерантности к аутоантигенам, обнаруженным в местах поражения атеросклеротическими бляшками. Исследование эпитопов, узнаваемых Т-клетками, и титров Ig в клинических и экспериментальных моделях атеросклероза позволили выявить три антигена-кандидата для подавления воспаления в атероматозных поражениях: окисленный LDL, вызываемый стрессом хитшоковый белок HSP 65 и кардиолипин-связывающий бета-белок 2GP1. В заявке на патент США № 09/806400 на имя Шоенфельда и др. (поданной 30 сентября 1999 г.), которая полностью включена в данное описание изобретения, описано сокращение примерно на 30% атерогенеза в артериях у генетически предрасположенных трансгенных мышей с отсутствием рецептора LDL-RD, которым перорально вводили окисленный LDL человека. Однако указанное защитное действие достигалось в результате перорального введения неочищенного антигенного препарата, включающего центрифугированный, фильтрованный и очищенный LDL из сыворотки человека, который подвергали продолжительному окислению Cu++ или малондиальдегидом (MDA). Хотя было достигнуто значительное ингибирование атерогенеза вследствие пероральной толерантности, не были идентифицированы специфические липидные антигены или иммуногенетические компоненты LDL. Другими возникшими препятствиями были неустойчивость, присущая неочищенному окисленному LDL in vivо вследствие ферментативной активности, поглощение окисленного LDL печенью, иммунные механизмы клетки и гетерогенность, свойственная разным донорам. Вполне вероятно, что устойчивый, лучше определенный аналог окисленного LDL обеспечит более эффективную иммуномодуляцию (например, в результате пероральной толерантности).
Индукция иммунной толерантности и последующее предотвращение или ингибирование аутоиммунных воспалительных процессов было продемонстрировано при введении супрессивных антигенов через слизистую оболочку, кроме слизистой оболочки кишечника. Мембранная ткань вокруг глаз и слизистая оболочка носовой полости и кишечника подвержены многим инвазиям, а также воздействию аутоантигенов и обладают механизмами иммунореактивности. Так Росси и др. (Rossi, et al., Scand J. Immunol 1999 Aug; 50(2):177-82) обнаружили, что введение глиадина через нос было таким же эффективным, как и внутривенное введение при ослаблении иммунной реакции на антиген в модели болезни органов брюшной полости у мышей. Аналогичным образом введение через нос антигена рецептора ацетилхолина было более эффективным, чем пероральное введение для замедления и уменьшения мышечной слабости и пролиферации специфических лимфоцитов в модели миастении у мышей (Shi, F.D. et al., J. Immunol. 1999 May 15; 162(10):5757-63). Поэтому иммуногенные соединения, предназначенные для введения через слизистую оболочку, для внутривенного или внутрибрюшинного введения, должны быть оптимально адаптированы для способов введения через нос и другие мембраны.
Таким образом, существует насущная потребность в новых, хорошо определенных синтетических производных окисленных фосфолипидов и родственных веществах, обладающих более высокой метаболической устойчивостью и эффективной иммуномодуляцией, вызываемой, например, в результате перорального, внутривенного, внутрибрюшинного введения и введения через слизистую оболочку.
Синтез окисленных фосфолипидов
Модифицированые фосфолипиды находят разное применение. Например, фосфолипиды, несущие активные соединения, растворяющиеся в липидах, могут быть введены в композиции, предназначенные для чрескожного и трансмембранного введения (патент США № 5985292, выданный Fournerou et al.), и производные фосфолипидов могут быть введены в липосомы и биовекторы, предназначенные для доставки лекарственных средств (см., например, патенты США № 6261597 и 6017513, выданные соответственно Куртцу, Бетбедеру и др., и патент США № 4614796). В патенте США № 5660855 описаны липидные конструкции холестерина, производного аминоманнозы, которые заключены в липосомы и пригодны для направленного воздействия на клетки или ткани гладких мышц. Указанные препараты уменьшают рестеноз артерий методами РТСА. Использование липосом для лечения атеросклероза далее описано в заявке WO 95/23592 Хоупа и Родригеза, которые предложили фармацевтические композиции из однослойных липосом, содержащих фосфолипиды. Липосомы, описанные в заявке WO 95/23592, позволяют оптимизировать приток холестерина из атеросклеротических бляшек и обычно являются неокисленными фосфолипидами.
Известно, что производные модифицированных фосфолипидов, имитирующие структуру фактора активации тромбоцитов (PAF), оказывают фармацевтически активное действие в случае разных нарушений и заболеваний, влияющих на такие функции, как проницаемость сосудов, кровяное давление, работа сердца и т.д. Существует предположение, что одна группа указанных производных может обладать противораковым действием (патент США № 4778912, выданный Inoue et al.). В патенте США № 4329302 описаны синтетические соединения фосфоглицеридов, а именно производные лизолецитина, которые опосредуют активацию тромбоцитов. Хотя соединения, описанные в патенте США № 4329302, представляют собой простой 1-О-алкиловый эфир или ацилфосфоглицериды 1-О-жирных кислот, установлено, что ацилирование короткой цепи лизолецитина позволяет получить соединения, активирующие тромбоциты, в отличие от ацилирования длинной цепи, и что простой 1-О-алкиловый эфир в биологическом отношении превосходит ацильные производные 1-О-жирной кислоты с точки зрения имитации PAF.
Влияние структуры разных фосфолипидов на их биологическую активность было исследовано Токумура и др. (Tokumura et al., Journal of Pharmacology and Experimental Therapeutics. July 1981, Vol. 219, No. 1) и описано в патенте США № 4827011, выданном Висснеру и др., применительно к гипертензии.
Другая группа эфирных производных модифицированных фосфолипидов описана в Китайском патенте № 642665, выданном Берхтольду. Было установлено, что указанные эфирные производные модифицированных фосфолипидов пригодны для использования в хроматографическом разделении, но могут оказывать некоторое физиологическое действие.
Окисление фосфолипидов происходит in vivo под действием свободных радикалов и в результате ферментативных реакций, часто возникающих в атеросклеротической бляшке. Получение окисленных фосфолипидов in vitro обычно включает простое химическое окисление естественного LDL или фосфолипидного компонента LDL. Исследователи, изучающие роль окисленного LDL, использовали, например, ионы железа и аскорбиновую кислоту (Itabe, H., et al., J. Biol. Chem. 1996; 271:33208-217), а также сульфат меди (George, J. et al., Atherosclerosis. 1998; 138:147-152; Ameli, S. et al., Arteriosclerosis Thromb Vasc. Biol. 1996; 16:1074-79) для получения молекул окисленного или умеренно окисленного фосфолипида, аналогичных молекулам, ассоциированным с компонентами бляшек. Было установлено, что аналогично полученные молекулы идентичны аутоантигенам, ассоциированным с атерогенезом, (Watson A.D et al., J. Biol. Chem. 1997; 272:13597-607) и способны индуцировать защитную иммунную толерантность против атерогенеза (заявка на патент США № 09/806400 на имя Шоенфелд и др., поданная 30 сентября 1999 г.) у мышей. Аналогичным образом Койке (Koike, патент США № 5561052) описывает способ получения окисленных липидов и фосфолипидов с использованием сульфата меди и пероксид-дисмутазы для получения окисленной арахидоновой или линолевой кислоты и окисленного LDL для диагностических целей. Дэвис и др. (Davies et al., J. Biol. Chem. 2001, 276:16015) описывают использование окисленных фосфолипидов в качестве агонистов активированных пролифератором рецепторов пероксисомы.
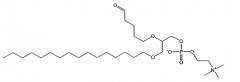
1-Пальмитоил-2-(5-оксовалероил)-sn-глицеро-3-фосфохолин (POVPC, см. пример I для ознакомления с описанием двухмерной структуры) и его производные, такие как 1-пальмитоил-2-глутароил-sn-глицеро-3-фосфохолин (PGPC), являются типичными примерами окисленных этерифицированных фосфолипидов, которые были исследованы в связи с атерогенезом (см., например, публикации Boullier et al., J. Biol Chem. 2000, 275:9163; Subbanagounder et al., Circulation Research, 1999, pp. 311). Было также исследовано действие других структурных аналогов, относящихся к данному классу окисленных фосфолипидов (см., например, Subbanagounder et al., Arterioscler. Thromb. Nasc. Biol. 2000, pp. 2248; Leitinger et al., Proc. Nat. Ac. Sci. 1999, 96:12010).
Однако недостатком применения in vivo вышеуказанных окисленных фосфолипидов является узнавание, связывание и метаболизм активного компонента в организме, в результате чего важное значение приобретают соображения дозирования и устойчивости после введения.
Кроме того, применяемые методы окисления являются недостаточно специфичными, в результате чего образуются разные окисленные продукты, что делает необходимым дальнейшую очистку или использование неочищенных антигенных соединений. Данная проблема становится еще сложнее в случае естественного LDL, даже если он очищен.
Таким образом, существует общепризнанная потребность в новых синтетических окисленных фосфолипидах, усовершенствованных способах синтеза указанных фосфолипидов и их применении в качестве иммуномодуляторов при отсутствии вышеуказанных ограничений.
Сущность изобретения
Одним объектом настоящего изобретения является соединение общей формулы I:
где:
n является целым числом от 1 до 6, причем если n=1, Cn, Bn, Rn, R'n и Y отсутствуют;
каждый из B1, B2, …Bn-1 и Bn независимо выбирают из группы, состоящей из кислорода, серы, азота, фосфора и кремния, причем каждый из указанного азота, фосфора и кремния замещен по крайней мере одним заместителем, выбранным из группы, состоящей из водорода, электронов неподеленной пары, алкила, галогена, циклоалкила, арила, гидрокси, тиогидрокси, алкокси, арилокси, тиоарилокси, тиоалкокси и оксо;
каждый из А1, А2, …Аn-1 и Аn независимо выбирают из группы, состоящей из CR''R''', C=O и С=S;
Y выбирают из группы, состоящей из водорода, алкила, арила, циклоалкила, карбокси, сахарида, фосфорной кислоты, фосфорилхолина, фосфорилэтаноламина, фосфорилсерина, фосфорилкардиолипина, фосфорилинозита, этилфосфохолина, фосфорилметанола, фосфорилэтанола, фосфорилпропанола, фосфорилбутанола, фосфорилэтаноламин-N-лактозы, фосфоэтаноламин-N-[метокси(пропиленгликоль)], фосфоинозит-4-фосфата, фосфоинозит-4,5-бифосфоната, пирофосфата, фосфоэтаноламиндиэтилентриаминпентаацетата, динитрофенилфосфоэтаноламина и фосфоглицерина; и
каждый из Х1, Х2, …Хn-1 независимо является насыщенным или ненасыщенным углеводородом общей формулы II:
где:
m является целым числом от 1 до 26; и
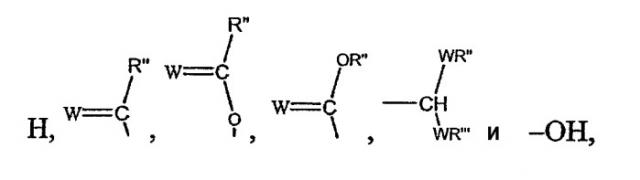
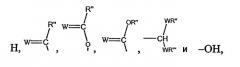
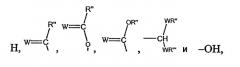
Z выбирают из группы, состоящей из:
где:
W выбирают из группы, состоящей из кислорода, серы, азота и фосфора, каждый из указанного азота и фосфора замещен по крайней мере одним заместителем, выбранным из группы, состоящей из водорода, электронов неподеленной пары, алкила, галогена, циклоалкила, арила, гидрокси, тиогидрокси, алкокси, арилокси, тиоарилокси, тиоалкокси и оксо; и
по крайней мере один из Х1, Х2, …Хn-1 Z не является водородом;
и где:
каждый из R1, R'1, R2, …Rn-1, Rn, R'n, каждый из R'' и R''' и каждый из Ra, R'a, Rb, R'b, …Rm-1, R'm-1, Rm и R'm независимо выбирают из группы, состоящей из водорода, связи, алкила, алкенила, алкинила, циклоалкила, арила, гетероарила, гетероалициклической группы, галогена, тригалогенметила, гидрокси, алкокси, арилокси, тиогидрокси, тиоалкокси, тиоарилокси, фосфоната, фосфата, фосфинила, сульфонила, сульфинила, сульфонамида, амида, карбонила, тиокарбонила, С-карбокси, О-карбокси, С-карбамата, N-карбамат, С-тиокарбокси, S-тиокарбокси и амино, или альтернативно по крайней мере два из R1, R'1, R2, …Rn-1, Rn и R'n и/или по крайней мере два из Ra, R'a, Rb, R'b, …Rm-1, R'm-1, Rm и R'm образуют по крайней мере одно четырех-, пяти- или шестичленное ароматическое, гетероароматическое, алициклическое или гетероалициклическое кольцо; и
каждый из С1, С2, …Сn-1, Сn и каждый из Са, Cb, …Cm-1 и Сm является хиральным или нехиральным атомом углерода, каждый хиральный атом углерода имеет S-конфигурацию и/или R-конфигурацию;
его фармацевтически приемлемая соль, пролекарство, гидрат или сольват.
В соответствии с другими признаками предпочтительных вариантов осуществления изобретения по крайней мере один из А1, А2, … и Аn-1 означает CR''R''' и по крайней мере один из А1, А2, … и Аn-1 связан с Х1, Х2 … или Хn-1, который включает Z, не являющийся водородом.
В соответствии с другими признаками предпочтительных вариантов осуществления изобретения n равно 3 и по крайней мере один из А1 и А2 означает CR''R'''. Предпочтительно А2 означает CR''R''' и Х2 включает Z, не являющийся водородом. Далее предпочтительно оба А1 и А2 означают CR''R'''.
В соответствии с другими признаками предпочтительных вариантов осуществления изобретения Z выбирают из группы, состоящей из
где W предпочтительно означает кислород и оба R'' и R''' независимо выбирают из группы, состоящей из водорода и алкила.
В соответствии с другими признаками предпочтительных вариантов осуществления изобретения n равно 1 и по крайней мере один из R1 и R'1 означает фосфат или фосфонат.
В соответствии с другими признаками предпочтительных вариантов осуществления изобретения n равно 5 или 6 и по крайней мере один из R1, R'1 и по крайней мере один из Rn и R'n образуют по крайней мере одно гетероалициклическое кольцо, например моносахаридное кольцо.
Другим объектом настоящего изобретения является фармацевтическая композиция, содержащая в качестве активного ингредиента описанное выше соединение и фармацевтически приемлемый носитель.
В соответствии с другими признаками предпочтительных вариантов осуществления изобретения фармацевтическая композиция упакована в упаковочный материал и идентифицирована оттиском, сделанным