Способ получения спинохрома а и белка морских ежей, взаимодействующего с полигидроксинафтохиноном
Иллюстрации
Показать всеИзобретение относится к медицине и биотехнологии и касается способа получения биологически активных веществ из панциря и игл промыслового вида морского ежа. Предложен способ получения спинохрома А и белка морских ежей, взаимодействующего с полигидроксинафтохиноном, характеризующийся тем, что сырье промывают водой, экстрагируют этиловым спиртом, деминерализуют 20% фосфорной кислотой, затем водно-кислотную смесь фильтруют, центрифугируют, далее полученный раствор наносят на полихром 1, примеси отмывают 3% фосфорной кислотой и дистиллированной водой, а комплекс белка с полигидроксинафтохиноном элюируют 10% этиловым спиртом, затем 40% этиловым спиртом, фракции объединяют; далее этиловый спирт удаляют, водный остаток лиофилизуют; полученный лиофильный порошок растворяют в воде, нерастворившийся осадок отделяют, а к водному раствору добавляют этиловый спирт при соотношении 1:9 и выдерживают в течение 18-24 часов при 4°С, выпавший белок отделяют, промывают этиловым спиртом и хроматографируют на сефакриле S-200 и лиофилизуют; затем спиртовые растворы объединяют, концентрируют досуха, сухой остаток растворяют в этиловом спирте и хроматографируют на сефадексе LH-20, затем отделяют фиолетовую фракцию спинохрома А, упаривают досуха, сухой остаток растворяют в ацетоне и кристаллизуют. Изобретение обеспечивает расширение спектра биологически активных веществ, полученных из морских ежей. 3 ил.
Реферат
Изобретение относится к технологии переработки природных объектов и касается способа получения полигидроксинафтохинона - спинохрома А и взаимодействующего с ним белка из панциря и игл промыслового вида морского ежа Strongylocentrotus nudus.
Известно, что нафтохиноновые пигменты обладают антиоксидантными свойствами. К ним относятся эхинохром А и спинохромы - родственные гидроксилированные производные 5,8-дигидрокси-1,4-нафтохиноны. Этот класс антиоксидантов отличает присутствие лабильной хиноидной структуры, подверженной окислительно-восстановительным превращениям, а гидроксильные заместители нафтохинонового цикла определяют антиоксидантные свойства полигидрокси-1,4-нафтохинонов (ПГНХ) [Лебедев А.В., Левицкая Е.Л., Тихонова Е.В. и др. Антиоксидантные свойства, автоокисление и мутагенная активность эхинохрома А в сравнении с его структурными аналогами.// Биохимия. 2001, т.66, с.885-893].
Антиоксидантные свойства спинохромов изучены на моделях инициированного окисления алкилбензолов, термического окисления метиленолеата и окисления минеральных и растительных масел. Антирадикальная активность спинохромов характеризуется константой взаимодействия с перекисными радикалами, сравнимой с константой ионола [Е.А.Кольцова. Диссертация на соискание ученой степени кандидата химических наук. Исследование химического строения и физиологической функции хиноидных пигментов морских ежей. Владивосток, 1983 г., с.84; Лебедев А.В., Иванова М.В., Красновид Н.М. и др. Кислотные свойства и взаимодействие с супероксид анион-радикалом эхинохрома А и его структурных аналогов // Вопросы медицинской химии. 1999, т.45, с.123-130].
Известен и успешно применяется в медицине природный полигидроксинафтохинон - эхинохром А, обладающий противоишемической и противоинфарктной активностью. Его активность обусловлена способностью улучшать снабжение периферийной ткани кислородом в результате взаимодействия как с клетками, так и отдельными ферментными системами [Н.П.Мищенко, С.А.Федореев, В.Л.Багирова. Новый оригинальный отечественный препарат Гистохром.// Хим.-фарм. журнал 2003. Том 37, вып. 8, с.49-53; А.В.Швилкин, Л.И.Серебрякова, О.В.Цкитишвили. Влияние эхинохрома на экспериментальное реперфузионное повреждение миокарда. // Кардиология. 1991. Том 31, №11, с.79-81].
Аналогичную активность могут проявлять и другие полигидроксинафтохиноны, входящие в состав оболочных клеток панцирей и игл морских ежей, которые изучены в меньшей степени, чем эхинохром А, в частности спинохром A [C.W.J.Chang, J.C.Moore. Pigments from Some Marine Speciments. Journal of Chemical Education, vol.50, p.102, 1973; E.A.Кольцова, О.Б.Максимов, Н.К.Уткина, А.П.Щедрин. Хиноидные пигменты иглокожих. // Рукопись деп. ВИНИТИ, № 106, с.74, 1974 г.].
Особый интерес представляют белки панцирей и игл иглокожих, взаимодействующие с нафтохиноновыми пигментами, в частности DT-диафораза, являющаяся составной частью другого фермента - синтазы оксида азота (NOS).
Как известно, NO-синтаза в организме продуцирует эндотелиальный фактор релаксации сосудов (NO, ЭФР), предотвращающий ишемическую болезнь сердца за счет улучшения снабжения периферийной ткани кислородом, который транспортируется по всей кровеносной системе эритроцитами. Кроме того, NO препятствует прилипанию лейкоцитов и кровяных пластинок к эндотелию сосудов и агрегации тромбоцитов. Это может иметь большое значение на стадиях развития тромбов не только в генезе атеросклеротических повреждений стенки сосудов, но и являться фактором активации антиоксидантной и иммунной систем организма.
Нафтохиноны в живых системах выполняют функции субстратов различных ферментов. При взаимодействии с ферментами (DT-диафоразой и NO-синтазой) они участвуют в синтезе Н2О2, NO и переносе электронов в окислительно-восстановительных реакциях при непосредственном использовании NADP(H+) и флавиновых коферментов. Это способствует улучшению снабжения периферийной ткани кислородом, снижая риск сердечно-сосудистых заболеваний, инфаркта и инсульта.
Известен способ получения хиноидных пигментов (спинохромов) путем растворения кальциевого скелета морских ежей в концентрированной соляной кислоте, нейтрализации кислого раствора бикарбонатом натрия, экстракции спинохромов серным эфиром, подкисления соляной кислотой для их восстановления в натриевой форме, обезвоживания эфирного экстракта безводным сульфатом натрия, упаривания эфирного раствора спинохромов в вакууме и хроматографической очистке на обработанном кислотой силикагеле с использованием 5% метанола в хлороформе в качестве элюента. Полученный элюат после концентрирования перерастворяют в этилацетате и упаривают в вакууме [С.W.J.Chang, J.C.Moore. Pigments from Some Marine Speciments. Journal of Chemical Education, vol.50, p.102, 1973].
Известен способ получения хиноидных пигментов иглокожих путем растворения кальциевого скелета в концентрированной или 6 N соляной кислоте, экстракции серным эфиром, отделения эхинохрома в виде водорастворимых натриевых производных, повторной экстракции серным эфиром или бензолом и последующей хроматографической очисткой эхинохрома на силикагеле или целлюлозе в системе хлороформ - метанол:петролейный эфир:гексан [Е.А.Кольцова, О.Б.Максимов, Н.К.Уткина, А.П.Щедрин. Хиноидные пигменты иглокожих. Рукопись деп. ВИНИТИ, №106, с.74, 1974 г.].
Известен способ получения эхинохрома А из морских ежей путем обработки сырья 18% раствором соляной кислоты в воде, жидкостной экстракции н-бутиловым спиртом, последующей хроматографической очистки целевого продукта на политетрафторэтилене (полихроме-1) с использованием в качестве элюирующего агента 40-50% этилового спирта и кристаллизации эхинохрома А из водного этилового спирта [SU 1233443 А1, 02.08.1986 г.].
Известен способ получения белка - гемагглютинина из целомической жидкости морских ежей Anthocidaris crassispina посредством ионообменной хроматографии на ДЕАЕ целлюлозе и последующей аффинной хроматографии с использованием теней человеческих эритроцитов, связанных глутаровым альдегидом, элюцией 10 mМ ЭДТА. С помощью SDS-электрофореза определен молекулярный вес полученного белка [Giga Y., Suutoh К., Ikai A. A new Multimeric Hemagglutinin from the Coelomic Fluid of the Sea Urchin Anthocidaris crassispina].
Известен способ выделения и очистки флавопротеина, обладающего ДТ-диафоразной активностью, из сырого экстракта говяжьей почки путем обработки экстракта сульфатом аммония, диализом, хроматографией на карбоксиметилцеллюлозе в фосфатном буфере с элюированием раствором сульфата аммония, осаждением белка этанолом при -2°С в соотношении 1:1,2, хроматографией на целлюлозе в фосфатном буфере с элюированием этим же буфером, обработкой элюата кальций-фосфатным гелем в соотношении 1:2 при 0°С, центрифугированием, обработкой раствором сульфата аммония и диализом [Liao S., Dulaney J.T., Williams-Ashman H.G. Purification and Properties of FlavoproteiCatalyzing the Oxidation of Reduced Ribosyl Nicotinamide. The Journal of Biological Chemistry, v.237, №9, 1962].
Способов одновременного получения подигидроксинафтохинона - спинохрома А и белка, взаимодействующего с полигидроксинафтохиноном, из морских ежей в доступной патентной и другой научно-технической литературе не обнаружено.
Морские ежи вида Strongylocentrotus nudus являются промысловым видом. После извлечения икры панцири с иглами попадают в отход. Вместе с тем, они могут служить источником биологически активных веществ - полигидроксинафтохинонов и их природных комплексов с белками.
Задача изобретения - разработка способа получения комплекса спинохрома А с белком из отходов промышленной переработки ежей (панцирей и игл морских ежей вида Strongylocentrotus nudus) и получение из него индивидуальных препаратов спинохрома А и белка.
Технический результат, обеспечиваемый изобретением, заключается в расширении спектра биологически активных веществ, получаемых из отходов промышленной переработки морских ежей.
В результате осуществления изобретения получают три продукта.
1. Комплекс спинохрома А с белком панциря и игл морских ежей, который может служить основой для разработки новых БАД, снижающих риск возникновения сердечно-сосудистых заболеваний, инфарктов и инсультов, являясь при этом питательным диетическим продуктом в профилактике лишнего веса и сопутствующих ему заболеваний (артритов, артрозов, диабета и прочих).
2. Спинохром А - эффективный антиоксидант (аналог эхинохрома А), возможно использование его для трансформаций в органическом синтезе;
3. Белок панциря и игл морских ежей, способный к связыванию и энзиматической трансформации полигидроксинафтохинонов, представляющий интерес как потенциальное антисклеротическое и иммуностимулирующее средство.
Сущность предлагаемого способа состоит в следующем.
Панцири с иглами промысловых морских ежей, оставшиеся после извлечения икры, свежие или дефростированные, промывают водой для удаления механических примесей и остатков внутренностей. Содержащиеся в панцире вещества липидной природы удаляют трехкратной экстракционной промывкой этанолом с последующей регенерацией этанола. Обезжиренный панцирь морских ежей подвергают деминерализации раствором минеральной кислоты до полного разложения карбонатного остова ежей.
Полученную водно-кислотную экстракционную смесь фильтруют для удаления нерастворенных остатков сырья и, при необходимости, центрифугируют для удаления микрочастиц. Полученный супернатант (водно-кислотный экстракт пигментов морского ежа) хроматографируют на гидрофобном сорбенте полихром-1.
Раствор окрашенных соединений наносят на хроматографическую колонку, адсорбированные компоненты отмывают от посторонних примесей слабым раствором минеральной кислоты и дистиллированной водой. Элюирование пигментных комплексов с полихрома-1 осуществляют ступенчатым градиентом этилового спирта (10% и 40% водными растворами этанола). Фракции, содержащие пигменты, объединяют, этиловый спирт удаляют концентрированием в вакууме. Концентрат лиофилизуют. Получают темно-красный лиофильный порошок, представляющий собой комплекс полигидроксинафтохинонов с белком панциря и игл морских ежей. Выход продукта составляет 0,2-0,3% от веса исходного сырья.
Полученный лиофильный порошок растворяют в дистиллированной воде. Нерастворившийся осадок отделяют центрифугированием. К водному раствору полученного комплекса добавляют этанол в соотношении 1:9. Для формирования осадка белка спиртовой раствор помещают на 18 часов в холодильник (4°С). Выпавший белок отделяют центрифугированием или фильтрованием и промывают этанолом. Собранный центрифугированием белок растворяют в дистиллированной воде и хроматографируют на сефакриле S-200 в дистиллированной воде. Собирают белковый окрашенный пик и лиофилизуют. Полученный белок анализируют методом SDS-электрофореза в 13% полиакриламидном геле. Выделенный белок имеет молекулярный вес около 28-29 кДа, что совпадает со значением молекулярной массы DT-диафоразы (27,3-31,0 кДа). DT-диафораза имеет огромное сродство к нафтохинонам и использует их в качестве субстратов при работе в клеточных структурах.
Объединенные спиртовые растворы концентрируют в вакууме, растворяют в минимальном объеме этанола и хроматографируют на сефадексе LH-20 в этиловом спирте. Выходящую сиренево-фиолетовую фракцию пигмента упаривают от этанола досуха. Получают индивидуальное соединение - спинохром-А.
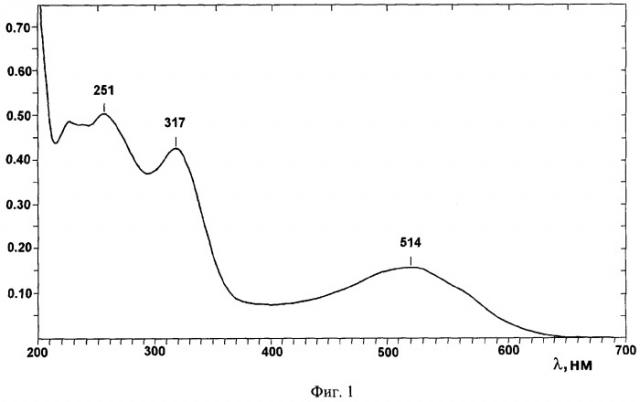
На фиг.1 представлен спектр поглощения спинохрома А, полученного из панциря и игл морских ежей. Спектральные максимумы λmах: 251, 317, 514 нм.
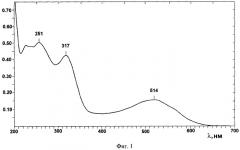
На фиг.2 представлен спектр поглощения белка, полученного из панциря и игл морских ежей. Спектральный максимум λ 270 нм.
На фиг.3 представлен SDS-электрофорез белка, полученного из панциря и игл морских ежей в 13% полиакриламидном геле.
Изобретение иллюстрируется следующим примером.
ПРИМЕР
Панцири с иглами морских ежей, оставшиеся после извлечения икры, в количестве 18 кг измельчают и промывают водой для удаления внутренних мягких тканей. Получают 15 кг исходного сырья.
Сырье загружают в реактор-экстрактор и экстрагируют трехкратно 96° этиловым спиртом (3×15 кг) до полного удаления веществ липидной природы. Спирт этиловый регенерируют. Обезжиренный панцирь с иглами морских ежей обрабатывают 15 л 20% фосфорной кислоты.
После разложения карбонатного остова ежей полученную водно-кислотную экстракционную смесь фильтруют через тканый фильтр и центрифугируют. Полученный раствор пигментов наносят на подготовленную колонку с 5 кг полихрома-1 в воде. Адсорбированные пигменты отмывают от посторонних примесей 15 литрами 3% раствором фосфорной кислоты в воде, а затем 20 л дистиллированной воды. Элюируют пигменты с полихрома-1 15 литрами 10% раствора этилового спирта, а затем 15 литрами 40% раствора этилового спирта.
Фракции, содержащие пигменты ежей, объединяют. Этиловый спирт удаляют концентрированием в вакууме при 60°С. Водный остаток лиофилизуют. Получают темно-красный лиофильный порошок - ферментный комплекс полигидроксинафтохинонов. Выход продукта составляет 42 г.
Полученный лиофильный порошок растворяют в 500 мл дистиллированной воды. Нерастворившийся осадок отделяют центрифугированием. К 400 мл водного раствора полученного комплекса добавляют 3600 мл 96° этилового спирта (соотношение 1:9). Водно-спиртовой раствор помещают на 18-24 часа в холодильник (4°С) для формирования осадка белка. Выпавший белок отделяют центрифугированием и промывают 500 мл 96° этилового спирта. Белок, полученный после осаждения и центрифугирования, растворяют в 100 мл дистиллированной воды и хроматографируют на сефакриле S-200 в дистиллированной воде. Собирают окрашенный белковый пик и лиофилизуют. Получают 2,45 г белкового порошка.
Спиртовые растворы объединяют и концентрируют в вакууме досуха при температуре 50-60°С. Сухой остаток в количестве 10 г растворяют в 500 мл 96° этилового спирта и хроматографируют на колонке с сефадексом LH-20 в этиловом спирте. Отделяют фиолетовую фракцию пигмента и упаривают в вакууме досуха при температуре 50-60°С, растворяют в сухом ацетоне и кристаллизуют. Получают 0,3 г порошка фиолетового цвета, представляющего собой индивидуальное соединение - спинохром-А.
Способ получения спинохрома А и белка морских ежей, взаимодействующего с полигидроксинафтохиноном, характеризующийся тем, что сырье промывают водой, экстрагируют трехкратно 96%-ным этиловым спиртом, деминерализуют 20%-ной фосфорной кислотой, затем водно-кислотную смесь фильтруют, центрифугируют, далее полученный раствор наносят на полихром 1, посторонние примеси отмывают 3%-ной фосфорной кислотой и дистиллированной водой, а комплекс белка с полигидроксинафтохиноном элюируют 10%-ным этиловым спиртом, затем 40%-ным этиловым спиртом, фракции объединяют; далее этиловый спирт удаляют концентрированием в вакууме, водный остаток лиофилизуют; затем полученный лиофильный порошок растворяют в воде, нерастворившийся осадок отделяют центрифугированием, а к водному раствору добавляют этиловый спирт при соотношении 1:9 и выдерживают в течение 18-24 ч при 4°С для формирования осадка белка, затем выпавший белок отделяют центрифугированием и промывают 96%-ным этиловым спиртом, далее полученный белок растворяют в воде, хроматографируют на сефакриле S-200 и лиофилизуют; затем спиртовые растворы объединяют и концентрируют в вакууме досуха, далее сухой остаток растворяют в 96%-ном этиловом спирте и хроматографируют на сефадексе LH-20, затем отделяют фиолетовую фракцию спинохрома А, упаривают в вакууме досуха, далее сухой остаток растворяют в ацетоне и кристаллизуют.