Способ фиксации клеток человека hela и hep-2 для иммуноцитохимического выявления ядерных аутоантигенов
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Разработан способ фиксации клеток человека HeLa и НЕр-2 для иммуноцитохимического выявления аутоиммунными сыворотками ядерных аутоантигенов в реакции непрямой иммунофлуоресценции. Зафиксированные таким образом препараты длительно хранятся без потери антигенных свойств и способности к иммуномечению аутоиммунными сыворотками. Изобретение может быть использовано для создания отечественных препаратов для первичного скрининга аутоиммунных сывороток в клинико-лабораторной диагностике органонеспецифических аутоиммунных заболеваний человека. 4 ил.
Реферат
Изобретение относится к биотехнологии и может быть использовано для создания отечественных препаратов для первичного скрининга аутоиммунных сывороток в клинико-лабораторной диагностике аутоиммунных заболеваний человека.
Известно, что выявление ядерных аутоантигенов в клетках HeLa и НЕр-2, которые используются в качестве стандартных субстратов при первичном скрининге сывороток больных органонеспецифическими аутоиммунными заболеваниями, возможно после фиксации клеток 1-4% параформальдегидом (Tsiakalou et al. Optimized detection of circulating anti-nuclear envelope autoantibodies by immunofluorescence. BMC Immunology. 2006, v.7, p.20). Однако, сохраняя общую морфологию клеток и возможность выявления аутоантигенов ядерной оболочки, этот фиксатор может препятствовать выявлению других антигенов ядра методами иммунофлуоресценции (Hoetelmans et al. Routine formaldehyde fixation irreversibly reduces immunoreactivity of Bcl-2 in the nuclear compartment of breast cancer cells, but not in the cytoplasm. Appl. Immunohistochem. Mol. Morphol. 2001, v.9, pp.74-80). При этом самым серьезным недостатком фиксации клеток параформальдегидом является невозможность хранения зафиксированных препаратов для последующего иммунофлуоресцентного окрашивания аутоиммунными сыворотками (Hahm D. and Anderer U. Establishment of НЕр-2 cell preparation for automated analysis of ANA fluorescence pattern. Cytometry A. 2006, v.69, pp.178-18.).
Известно, что фиксация клеток органическим фиксатором - абсолютным метанолом - сохраняет многие ядерные антигены доступными для иммунофлуоресцентного выявления (Zatsepina et al. Cell cycle-dependent translocations of a major nucleolar phosphoprotein, B23, and some characteristics of its variants. Eur J Cell Biol. 1997, v.73, pp.58-70). Однако метанол относится к одним из сильнейших ядов и его использование требует соблюдения серьезных мер безопасности (наличие вытяжного шкафа, использование перчаток и защитных очков, сбора использованного фиксатора в специальные контейнеры), что в значительной степени препятствует использованию метанола в качестве фиксирующего средства.
Известен наиболее близкий к заявленному способ фиксации клеток органическим фиксатором - абсолютным ацетоном. Способ может осуществляться без особых мер предосторожности и сохраняет многие ядерные антигены доступными для иммунофлуоресцентного окрашивания (Моnсé et al. A comparison of two fixatives on IFA HEp-2 slides for the detection of antinuclear antibodies. J. Immunoassay. 1994, v.15, pp.55-68; Hahm D. and Anderer U. Establishment of HEp-2 cell preparation for automated analysis of ANA fluorescence pattern. Cytometry A. 2006, v.69, pp.178-181). Однако для иммуномечения клеток различными антителами, включая аутоиммунные сыворотки, в способе использованы только свежеприготовленные препараты, зафиксированные ацетоном в течение короткого времени - от 2 до 10 мин.
Задачей изобретения является разработка способа фиксации клеток человека HeLa и НЕр-2, способствующего длительному сохранению ядерных антигенов и их последующему иммунофлуоресцентному выявлению с помощью аутоиммунных сывороток при клинико-лабораторном анализе.
Поставленная задача решается за счет того, что в способе фиксации клеток человека HeLa и НЕр-2 для иммуноцитохимического выявления аутоиммунными сыворотками ядерных аутоантигенов, включающем обработку выращенных клеток человека HeLa или НЕр-2 фосфатно-солевымм буфером (PBS) и фиксацию абсолютным ацетоном, фиксацию проводят в течение 30 мин с последующей сушкой на воздухе в течение 2-5 мин.
Клетки HeLa или НЕр-2 культивируют на стеклах в стандартных условиях (90% среды ДМЕМ, 10% эмбриональной сыворотки теленка, глутамина, стрептомицина и пенициллина - реактивы фирмы «ПанЭко», Россия) при 37°С и 5% СО2 и используют в логарифмической фазе роста. Клетки отмывают в фосфатно-солевом буфере PBS и помещают для фиксации в абсолютный ацетон (ч.д.а.), охлажденный до минус 18-20°С, на 30 мин. После завершения фиксации клетки высушивают на воздухе в течение 5 мин. В препаратах, приготовленных таким образом, большинство ядерных антигенов сохраняются доступными для иммунофлуоресцентного выявления в течение 6 месяцев при хранении при минус 18-20°С, до одного-трех месяцев при хранении при 4°С и до 7 дней при хранении при комнатной температуре (20°С).
Изобретение иллюстрируют следующие графические материалы:
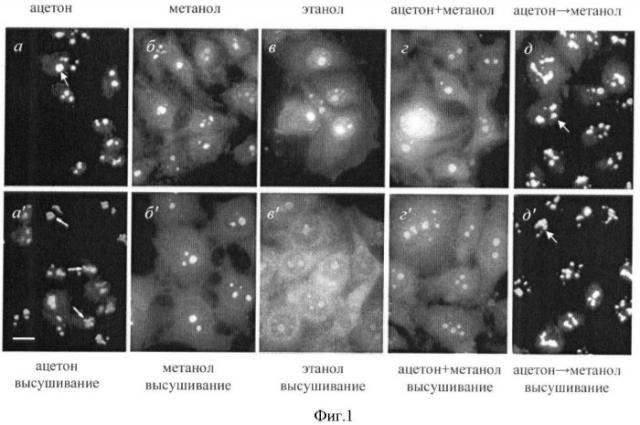
Фиг.1. Иммуноцитохимическое окрашивание клеток HeLa аутоиммунной сывороткой к белку ядрышка фибрилларина после фиксации клеток в разных условиях.
а-д: клетки зафиксированы ацетоном (а), метанолом (б), этанолом (в), в смеси ацетона и метанола (1:1) (г) или сначала ацетоном, а затем метанолом (д) в течение 5-10 мин и сразу использованы для иммуноокрашивания.
а'-д': клетки зафиксированы, как на (а-д), а затем высушены на воздухе и использованы для иммуноокрашивания.
Видно, что только при фиксации клеток ацетоном (а, а') либо ацетоном, а затем метанолом (д, д') ядрышки (стрелки) фибрилларина преимущественно выявляется в ядрышках, что соответствует литературным представлениям о его локализации в клетках млекопитающих (Мухарьямова и др. Сравнительная локализация белков ядрышка фибрилларина и В23 в делящихся клетках млекопитающих. Биологические мембраны. 1998, т. 15, стр.657-669). Масштабная линия, 20 мкм.
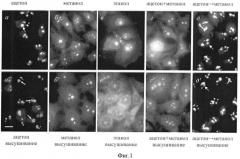
Фиг.2. Иммуноцитохимическое окрашивание клеток HeLa аутоиммунной сывороткой к белку ядрышка Nop52 после фиксации в разных условиях.
а-г: клетки зафиксированы ацетоном (а), метанолом (б), метанолом, а затем ацетоном (в) или этанолом (г) в течение 5-10 мин и использованы для иммуноокрашивания.
а'-г': клетки зафиксированы, как на (а-г), а затем высушены на воздухе и использованы для иммуноокрашивания.
Видно, что только при фиксации клеток ацетоном (а, а') или метанолом (б, б') ядрышки (стрелки) метятся наиболее четко, что соответствует литературным представлениям о локализации Nop52 в клетках млекопитающих (Savino et al. The nucleolar antigen Nop52, the human homologue of the yeast ribosomal RNA processing RRP1, is recruited at late stages of nucleologenesis J. Cell Sci. 1999, т.112, стр.1889-1900). Масштабная линия, 20 мкм.
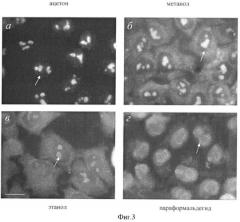
Фиг.3. Иммуноцитохимическое окрашивание клеток НЕр-2 антителом к белку ядрышка В23/нуклеофозмина после фиксации ацетоном (а), метанолом (б), этанолом (в) или параформальдегидом (г) и высушивания препаратов на воздухе.
Видно, что фиксация метанолом (б) или этанолом (в) приводит к мечению цитоплазмы, а после фиксации параформальдегидом (г) антитела окрашивают только периферию ядрышек. Этот характер иммуномечения противоречит существующим представлениям о локализации В23/нуклеофозмина в клетках млекопитающих (Zatsepina et al. Cell cycle-dependent translocations of a major nucleolar phosphoprotein, В23, and some characteristics of its variants. Eur J Cell Biol. 1997, т.73, стр.58-70). Характерная локализация белка в ядрышках проявлялась только при фиксации клеток ацетоном (а). Ядрышки указаны стрелками. Масштабная линия, 20 мкм.
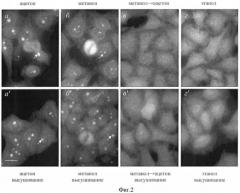
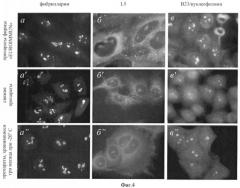
Фиг.4. Иммуноцитохимическое окрашивание клеток НЕр-2 аутоиммунными сыворотками к белкам фибрилларина (а-а”), Nop52 (б-б”) и В23/нуклеофозмина (в-в”), наблюдаемое на коммерческих препаратах фирмы «IMMUNOCONCEPT» (США) (а-в), свежих препаратах (а'-в') и препаратах, полученных с помощью заявляемого способа и хранившихся в течение 3-х месяцев при минус 18-20°С (а"-в").
Видно, что характер окрашивания препаратов, представленных на фиг.(а'-в') и (а"-в") практически одинаков. На коммерческих препаратах (а-в) проявляется неспецифичная - дискретная - окраска в цитоплазме (ц). Заметна также сильная деформация ядер. Масштабная линия, 20 мкм.
Изобретение иллюстрируют следующие примеры.
Пример 1.
Фиксация клеток абсолютным ацетоном.
Ацетон охлаждают до минус 18-20°С в закрытой посуде. Перед употреблением наливают в стеклянную чашку Петри (5 мл ацетона на чашку диаметром 60 мм). Стекла с прикрепленными к ним клетками HeLa (НЕр-2) споласкивают в PBS (2.7 мМ КСl, 0.14 М NaCl, 8.1 мМ Na2HPO4×12H2O, 1.5 мМ КН2PO4) и фиксируют в течение 30 мин. После окончания фиксации стекла помещают на фильтровальную бумагу клетками вверх и высушивают в течение 5 мин при комнатной температуре в защищенном от пыли месте. Препараты хранят в плотно закрывающихся емкостях при минус 18-20°С.
Пример 2.
Иммуноцитохимическое окрашивание зафиксированных клеток HeLa и НЕр-2
Препараты помещают в PBS на 3 мин при комнатной температуре и инкубируют с аутоиммунными сыворотками к ядерным аутоантигенам из расчета 50 мкл сыворотки, разведенной PBS в соотношении 1:50 на 1 см2 поверхности препарата, 40 мин при комнатной температуре. Отмывают клетки 3 раза по 10 мин в PBS и инкубируют со вторыми антителами (антителами к иммуноглобулинам человека, меченными FITC, «ИМТЕК», Россия) 30 мин при комнатной температуре. Вновь отмывают в PBS и инкубируют с 0.5 мкг/мл ДАФИ (4',6-диамидино-2-фенилиндол) в PBS 10-12 мин в темноте. Отмывают 10 мин в PBS и заключают в Мовиол (Calbiochem, Германия). Препараты изучают в эпифлуоресцентный микроскоп, используя объективы 100×, 63× или 40× и соответствующие наборы фильтров.
Способ фиксации клеток человека HeLa и НЕр-2 для иммуноцитохимического выявления аутоиммунными сыворотками ядерных аутоантигенов, включающий обработку выращенных клеток человека HeLa или НЕр-2 фосфатно-солевым буфером и последующую фиксацию абсолютным ацетоном, отличающийся тем, что фиксацию проводят ацетоном с температурой (-18)-(-20)°С в течение 30 мин с последующей сушкой на воздухе в течение 5 мин.