Применение вируса миксомы для терапевтического лечения рака и хронической вирусной инфекции
Иллюстрации
Показать всеИзобретение относится к области медицины и касается применения вируса миксомы для терапевтического лечения рака. Сущность изобретения включает способ ингибирования раковой клетки млекопитающего с дефектным противовирусным ответом, чувствительной к интерферону, включающим введение в клетку вируса миксомы. Вирус миксомы может использоваться при лечении рака. Преимущество изобретения заключается в упрощении способа. 8 н. и 37 з.п. ф-лы, 28 ил, 1 табл.
Реферат
Область, к которой относится изобретение
Настоящее изобретение в основном относится к терапевтическому применению вируса миксомы.
Предпосылки к созданию изобретения
Современные подходы к лечению различных типов раковых опухолей направлены на отравление или уничтожение раковых клеток. Те подходы лечения, которые являются токсичными для раковых клеток, также токсичны и для здоровых клеток. Более того, гетерогенная природа опухолей является одной из основных причин того, почему до сих пор не найден эффективный способ лечения рака. Основные подходы к лечению рака на настоящий момент, такие как химиотерапия и лучевая терапия, могут применяться в очень узких терапевтических рамках токсичности. Такие подходы к лечению считаются грубыми инструментами, применение которых ограничено из-за различия типов опухолевых клеток и ограниченных рамок, в которых эти виды лечения могут быть применены.
При разработке современных противораковых препаратов пытаются достичь селективной направленности в отношении опухолевых клеток, при этом уменьшить токсичность для здоровых клеток, тем самым увеличивая вероятность того, что здоровые клетки останутся неповрежденными.
Онколитическая вирусная терапия является одним из подходов, целью которых является использование клеточных различий между нормальными клетками и опухолевыми клетками. В этом подходе к лечению используют в качестве противораковых средств способные к репликации опухоле-селективные вирусные векторы. Онколитический вирус либо специфически нацелен на раковые клетки, либо с большей эффективностью репликцируется в раковых клетках, чем в здоровых клетках. Такие репликцирующиеся онколитические вирусы являются либо природными, либо полученными методами генной инженерии и являются высокоселективными и очень эффективными для воздействия на гетерогенную популяцию опухолей. Поскольку в нормальных (здоровых) клетках онколитические вирусы с селективной репликацией не могут эффективно реплицироваться, токсичность для пациента будет ниже, особенно по сравнению с обычными подходами к видам лечения, таким как химиотерапия и лучевая терапия.
Сообщалось о многочисленных исследованиях онколитической активности различных вирусных штаммов, среди которых наиболее перспективными онколитическими вирусами являются природные или генетически модифицированные варианты аденовируса, вируса простого герпеса 1 («HSV1»), реовируса, вируса коровьей оспы, вируса пузырькового (полостного) стоматита («VSV») или полиовируса. Модифицированные онколитические вирусы, исследуемые в настоящий момент в качестве противораковых агентов, включают в себя HSV, аденовирус, вирус болезни Ньюкастла («NDV»), реовирус и вирус коровьей оспы, вирус кори, VSV и полиовирус. Различные онколитические вирусы находятся в I и во II фазе клинических испытаний, и некоторые из них демонстрируют стабильную эффективность. Тем не менее, не известно, какие вирусы будут наиболее удовлетворять целям онколитической терапии, то есть длительной репликации, специфичности и высокой литической активности. Оптимальным кандидатом онколитического вирусного вектора мог бы стать вектор, у которого короткий жизненный цикл, который быстро образует зрелые вирусы, эффективно распространяется от клетки к клетке и имеет большой геном, доступный для осуществления вставок. Кроме того, экспериментальные данные показывают, что ингибирование природного раннего иммунного ответа и медленное развитие Th1 ответов очень важны для эффективной онколитической терапии. Очевидно, что вирусы человека являются высоко иммунногенными, что определяется высоким уровнем антител и Т-клеточными ответами, которые наблюдают в нормальной популяции многих вирусов, исследуемых для разработки онколитических вирусов.
Клиническое исследование показало, что современные онколитические вирусы являются действительно безопасными, но недостаточно эффективными в качестве препаратов монотерапии, то есть полностью клинически эффективными. Поскольку обычно не наблюдается достаточного или эффективного заражения опухолевых клеток, то современным направлением с целью повышения их эффективности является получение методами генетической инженерии кандидантных вирусов для экспрессии терапевтических трансгенов. Большинство из вышеупомянутых онколитических вирусов также исследовали в сочетании с другими общеизвестными онколитическими подходами к лечению.
Аденовирус может быть легко генетически изменен, и функция вирусных белков хорошо известна. Кроме того, он связан с заболеваниями легкой формы. Аденовирус человека ONYX-015 (Onyx Pharmaceuticals Inc.) является одним из наиболее изученных онколитических вирусов, которые были оптимизированы для клинического использования. Считается, что он предпочтительно реплицируется в р53-негативных опухолях и проявляет хороший потенциал в клинических испытаниях у пациентов с опухолями головы и шеи. Однако сообщалось, что только у 14% пациентов ONYX-015 демонстрирует требуемый клинический ответ. (Nemunaitis J, Khuri F, Ganly I, Arseneau J, Posner M, Vokes E, Kuhn J, McCarty T, Landers S, Blackburn A, Romel L, Randlev B, Kaye S, Kirn D. J. Clin. Oncol. 2001 Jan 15;19(2):289-98).
В WO96/03997 и W097/26904 описаны мутантный онколитический вирус простого герпеса (HSV), который ингибирует рост опухолевых клеток и является специфичным в отношении нейрональных клеток. Дополнительными преимуществами HSV является то, что он может быть легко генетически изменен, и существуют лекарственные средства для прекращения любых нежелательных репликаций вируса. Однако применение таких общеизвестных патогенов человека ограничено, поскольку, вероятно, большая часть населения подвергалась воздействию этого вируса и приобрела иммунный ответ в отношении него, что снизило бы литический эффект этого вируса. HSV также может вызывать серьезные побочные эффекты и потенциально смертельные заболевания.
Реовирус типа III связан с относительно легкими формами заболеваний и функция его вирусного гена достаточно хорошо известна. В настоящее время фирмой Oncolytic Biotech разработан реовирус типа III как средство для лечения рака, которое демонстрирует повышенные репликативные свойства в клетках, экспрессирующих мутантный онкоген ras, и, предпочтительно, растет в клетках PKR -/- (Strong J.E. and P.W. Lee, J. Virology, 1996. 70:612-616). Однако реовирус трудно поддается генетическим модификациям и его вирусную репликацию трудно остановить.
VSV связан с относительно легкими формами заболевания и функция вирусного гена также хорошо изучена. В WO99/04026 описано применение VSV в качестве вектора генной терапии для применения при лечении широкого круга. Однако применение VSV так же затруднено, как и применение реовируса, а именно из-за сложности проведения генетических модификаций и из-за того, что вирусная репликация не может быть быстро прекращена.
Другими кандидатами онколитических вирусов, описанных в данной области, являются вирус коровьей оспы и полиовирус, но они связаны с очень серьезными или потенциально смертельными заболеваниями.
В US 4806347 описано применение гамма интерферона и фрагмента IFNγ в отношении опухолевых клеток человека. В WO99/18799 описан способ лечения заболевания у млекопитающих, у которых больные клетки дефектны при интерферон-опосредованном антивирусном ответе, который заключается во введении млекопитающему терапевтически эффективного количества интерферон-чувствительного, способного к репликации клонального вируса. В частности, описано, что частицы VSV обладают токсичной активностью в отношении опухолевых клеток, но ослабляют цитотоксичность нормальных клеток под действием VSV в присутствии интерферона. В WO99/18799 также указано, что в клетках опухоли, обработанной интерфероном, наблюдалась NDV-стимулированная чувствительность, но добавление интерферона к нормальным клеткам делало эти клетки устойчивыми к NDV. Цель этого способа состоит в том, чтобы сделать клетки чувствительными к воздействию интерферона путем заражения их интерферон-чувствительными вирусами.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В одном из аспектов настоящее изобретения относится к способу ингибирования клетки с дефектным противовирусным ответом, который заключается во введении в клетку эффективного количества вируса миксомы.
В одном из аспектов изобретение относится к способу лечения заболевания, характеризующегося наличием клеток с дефектным противовирусным ответом, который заключается во введении пациенту эффективного количества вируса миксомы.
Настоящее изобретение также относится к применению эффективного количества вируса миксомы для ингибирования клеток с дефектным противовирусным ответом и для получения лекарственного средства для ингибирования клетки с дефектным противовирусным ответом.
Настоящее изобретение, кроме того, относится к применению эффективного количества вируса миксомы для лечения заболевания у пациента, где заболевание характеризуется наличием клеток с дефектным противовирусным ответом, и для получения лекарственного средства для лечения этого заболевания у пациента.
В другом аспекте настоящее изобретение относится к фармацевтической композиции, содержащей вирус миксомы и фармацевтически приемлемый носитель, для ингибирования клетки с дефектным противовирусным ответом, а также для применения в лечении заболевания, характеризующегося наличием клеток с дефектным противовирусным ответом.
В другом аспекте настоящее изобретение относится к набору, содержащему вирус миксомы и инструкции по применению для ингибирования клеток с дефектным противовирусным ответом или для лечения заболевания, характеризующегося наличием клеток с дефектным противовирусным ответом. Такие заболевания включают в себя рак и хроническую вирусную инфекцию.
Настоящее изобретение, более того, относится к способу определения клеток с дефектным противовирусным ответом у пациента, который заключается во введении пациенту вируса миксомы, модифицированного для экспрессии выявляемого маркера; инфицировании вирусом клеток с дефектным противовирусным ответом у пациента и в выявлении клеток, экспрессирующих выявленный маркер у пациента.
Настоящее изобретение также относится к способу выявления в образце клеток с дефектным противовирусным ответом, который заключается в культивировании клеток; воздействии вируса миксомы на культивированные клетки и определении инфекционности заражения клетки вирусом миксомы.
Настоящее изобретение основано на открытии, что вирус миксомы кроликов может селективно инфицировать клетки, включая опухолевые клетки человека, с дефектным противовирусным ответом, включая клетки, нечувствительные к интерферону. В данном контексте под термином «природный» понимают антиген-неспецифический иммунный ответ. Поскольку в нормальных клетках человека вирус миксомы реплицируется неэффективно, следовательно, он может быть использован для лечения различных заболеваний и болезненных состояний, которые характеризуются наличием клеток с дефектным противовирусным ответом, включая клетки, нечувствительные к интерферону, например в качестве онколитического средства для лечения рака. Также вирус может использоваться для идентификации клеток с дефектным противовирусным ответом и визуализации этих клеток in vivo.
Другие аспекты и существенные признаки настоящего изобретения станут очевидны специалисту в данной области из нижеследующего описания определенных вариантов осуществления настоящего изобретения, проиллюстрированных чертежами. Понятно, тем не менее, что подробное описание и конкретные примеры, представляющие предпочтительные варианты осуществления настоящего изобретения, приведены только для иллюстрации, так как различные изменения и модификации в рамках и объеме данного изобретения станут очевидны специалистам в данной области из подробного описания.
Краткое описание чертежей
Фигуры, иллюстрирующие варианты осуществления настоящего изобретения, приведены только в качестве примеров.
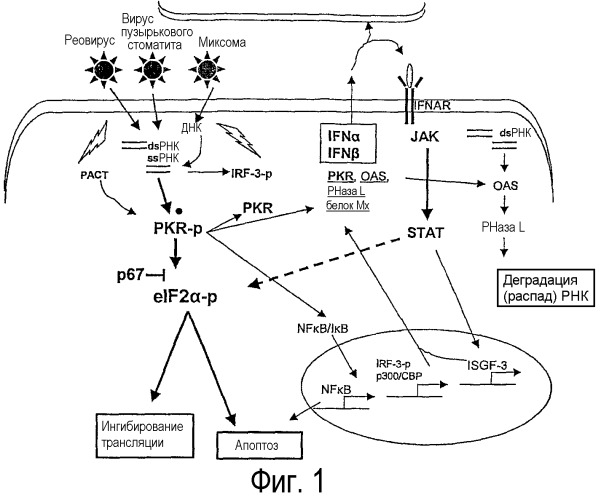
На фигуре 1 представлена схематическая диаграмма интерферон опосредованного противовирусного сигнального пути, индуцированного вирусным заражением клетки.
На фигуре 2 представлена фазово-контрастная микрофотография непермиссивных фибробластов мышиных эмбрионов дикого типа («MEF») после действия вируса миксомы, на которой видно, что MEF становятся пермиссивными после ингибирования интерферона α/β нейтрализирующим антителом.
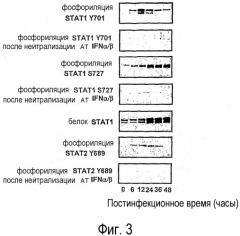
На фигуре 3 представлен Вестерн-блоттинг, на котором видны фазы фосфорилирования (активации) STAT1 и STAT2 после заражения вирусом миксомы, что обозначает, что непермиссивное инфицирование клеток MEF связано с активацией STAT 1 и STAT 2;
На фигуре 4 представлен Вестерн-блоттинг, на котором видны фазы фосфорилирования (инактивации) STAT3, STAT4, STAT5 и STAT 6 после заражения вирусом миксомы, что указывает на то, что непермиссивное инфицирование клеток MEF не активировано ни одним из этих видов.
На фигуре 5 представлена фазово-контрастная микрофотография IFNα/β R-/- MEF и STAT1 -/- MEF, IFNα/β R-/- MEF и STAT1 -/- MEF после заражения вирусом миксомы, что указывает на то, что инактивация IFN/STAT/JAK передачи сигнала делает клетки пермиссивными для миксомной инфекции.
На фигуре 6 представлен Вестерн-блоттинг, на котором видны фазы фосфорилирования PKR в непермиссивных MEF дикого типа после заражения вирусом миксомы, что указывает на то что, что PKR не активируются в результате заражения вирусом миксомы.
На фигуре 7 представлен Вестерн-блоттинг, на котором видны фазы фосфорилирования PKR в MEF дикого типа, либо ложно инфицированных, либо предварительно инфицированных вирусом миксомы, что указывает на то, что вирус миксомы блокирует активацию PKR в клетках MEF;
На фигуре 8 представлен Вестерн-блоттинг, на котором видны фазы фосфорилирования PERK в MEF дикого типа после заражения вирусом миксомы, что указывает на то, что вирус миксомы блокирует активацию PERK в клетках MEF.
На фигуре 9 представлена фазово-контрастная микрофотография тройного нокаута PKR-/-, RNase L-/- и Mx1-/- после воздействия вируса миксомы, что указывает на то, что антивирусное состояние в клетках MEF опосредовано другим путем передачи сигнала.
На фигуре 10 представлена фазово-контрастная микрофотография тройного нокаута PKR-/-, RNase L-/- и Mx1-/- после воздействия вируса миксомы.
На фигуре 11 представлена фазово-контрастная микрофотография тройного нокаута PKR-/-, RNase L-/- и Mx1-/- после обработки нейтрализующим антителом к интерферону IFNα/β и после воздействия вируса миксомы.
На фигуре 12 представлен Вестерн-блоттинг, на котором видны уровни фосфорилирования eIF2α и PKR в непермиссивных MEF после обработки нейтрализирующим антителом к IFNα/β и после действия вируса миксомы, что указывает на то, что фосфорилирование eIF2α в непермиссивных клетках катализируется PKR-независимым путем.
На фигуре 13 представлен Вестерн-блоттинг, на котором видны фазы фосфорилирования STAT1 в результате тройного нокаута PKR-/-, RNase L-/- и Mx1-/- после заражения вирусом миксомы, указывая на нормальные IFN-индуцированные реакции передачи сигнала.
На фигуре 14 представлена фазово-контрастная микрофотография, иллюстрирующая субклеточную локализацию тирозин-фосфорилированного STAT1 в непермиссивных клетках PKR-/- + RNaseL-/- + Mx1 -/- через 12 часов после заражения, что указывает на то, что активированный STAT локализуется в ядре, как и было предположено для нормальных IFN/STAT реакций передачи сигнала.
На фигуре 15 представлено флуоресцентное изображение головного мозга «nude»-мышей с внутричерепными глиомами, ложно-инфицированных или инфицированных мертвыми или живыми вирусами миксомы, экспрессирующими GFP, что указывает на то, что клетки глиомы являются мишенью вируса миксомы.
На фигуре 16 представлено флуоресцентное изображение и фотография тонкого среза глиомы мыши, зараженной вирусом миксомы, экспрессирующей GFP, что указывает на то, что вирус миксомы реплицировался только в клетках опухоли.
На фигуре 17 представлена фазово-контрастная микрофотография опухолевых клеток человека HT29, окрашенных либо X-Gal, либо кристаллическим фиолетовым, после заражения вирусом миксомы, демонстрирующая пример непермиссивной инфекции клеток человека.
На фигуре 18 представлена фазово-контрастная микрофотография опухолевых клеток человека HOP92, окрашенных либо X-Gal, либо кристаллическим фиолетовым после заражения вирусом миксомы, демонстрирующая пример пермиссивной инфекции клеток человека.
На фигуре 19 представлена фазово-контрастная микрофотография опухолевых клеток человека OVCAR4, окрашенных либо X-Gal, либо кристаллическим фиолетовым после заражения вирусом миксомы, демонстрирующая пример пермиссивной инфекции клеток человека.
На фигуре 20 представлена фазово-контрастная микрофотография опухолевых клеток человека SK-MEL3, окрашенных либо X-Gal, либо кристаллическим фиолетовым после заражения вирусом миксомы, демонстрирующая пример пермиссивной инфекции клеток человека
На фигуре 21 представлена фазово-контрастная микрография опухолевых клеток человека SK-MEL28, окрашенных либо X-Gal, или кристаллическим фиолетовым после заражения вирусом миксомы, демонстрирующая пример полупермиссивной инфекции клеток человека;
На фигуре 22 представлена фазово-контрастная микрофотография клеток BGMK, окрашенных либо X-Gal, либо кристаллическим фиолетовым после заражения вирусом миксомы, демонстрирующая характерную пермиссивную контрольную инфекцию.
На фигуре 23 представлена фазово-контрастная микрофотография клеток позитивного контроля BGMK и клеточных линий U87, A172 и U373 опухоли человека, зараженных повышенными концентрациями вируса миксомы, экспрессирующего белок LacZ, окрашенный X-Gal, что указывает на то, что все эти клетки глиомы человека были пермиссивными для репликации вируса миксомы.
На фигуре 24 представлен график, отображающий уровень выживаемости клеток BGMK, U87, A172 и U373, зараженных вирусом миксомы, через 72 часа после инфицирования повышенный концентрацией вируса, демонстрирующий способность вируса миксомы уничтожать эти клетки.
На фигуре 25 представлена фазово-контрастная микрофотография и флуоресцентная микрофотография клеток астроцитомы SF04 1585, инфицированных вирусом миксомы GFP (MV GFP), демонстрирующая инфицирование первичных клеток глиомы человека;
На фигуре 26 представлена фазово-контрастная микрофотография клеток глиомы U373, инфицированных вирусом миксомы, экспрессирующим LacZ белок, и окрашенных X-Gal, показывающая инфицирование этих опухолевых клеток человека;
На фигуре 27 представлен график, отображающий уровень выживаемости клеток SF04 1585, инфицированных вирусом миксомы GFP через 48 часов после заражения, и показывающий уничтожение этих инфицированных опухолевых клеток человека.
На фигуре 28 представлена флуоресцентная микрофотография медуллобластомы линий Daoy и D384, инфицированных вирусом миксомы, экспрессирующим GFP, показывающая инфицирование клеток этой опухоли человека.
ПОДРОБНОЕ ОПИСАНИЕ
Авторы изобретения обнаружили, что вирус миксомы, вирус, который обычно поражает кроликов, может, в том числе выборочно, поражать и уничтожать клетки человека с дефектным противовирусным ответом, например клетки, которые нечувствительны к интерферону. С другой стороны, в нормальных клетках человека вирус миксомы реплицируется неэффективно. Поскольку многие заболевания и болезненные состояния характеризуются наличием клеток с дефектным противовирусным ответом, в том числе клеток, нечувствительных к интерферону, например раковых, вирус миксомы может быть использован для лечения таких заболеваний и состояний, включая рак, с низкой токсичностью для нормальных клеток. Вирус миксомы также может быть использован для воздействия на хронически инфицированные клетки, так как такие клетки имеют дефект противовирусного ответа. Например, многие вирусы кодируют генные продукты, действие которых направлено на подавление противовирусного интерферонового ответа клеток. Вирус миксомы может выборочно инфицировать эти клетки.
Вирус миксомы («MV») является этиологическим агентом миксоматоза у кроликов. MV принадлежит к роду Leporipoxvirus семейства Poxviridae, крупнейших ДНК-вирусов. MV вызывает заболевания в легкой форме у его природного реципиента кролика Sylvilagus в Америке. Тем не менее, это вирулентный и хозяин-специфичный поксвирус, который вызывает смертельное заболевание у европейских кроликов, характеризующеееся системными поражениями и, в особенности, слизистых оболочек. (Cameron C, Hota-Mitchell S, Chen L, Barrett J, Cao JX, Macaulay C, Willer D, Evans D, McFadden G. Virology 1999, 264(2): 298-318; Kerr P & McFadden G. Viral Immunology 2002, 15(2): 229-246).
MV является крупным вирусом с геномом из двухцепочечной ДНК, состоящим из 163 т.п.н., который реплицируется в цитоплазме инфицированных клеток (B. N. Fields, D. M. Knipe, P. M. Howley, Eds., Virology Lippincott Raven Press, New York, 2nd ed., 1996). Известно, что MV кодирует различные клеточно-ассоциированные и секретируемые белки, которые были вовлечены в регуляцию по типу обратной связи иммунного и воспалительного ответов организма-хозяина, и ингибирование апоптоза зараженных вирусом клеток. MV может проникать во все соматические клетки человека. Тем не менее, в отличие от нормальных соматических клеток кролика, когда клетки имеют нормальный природный противовирусный ответ, вирус не способен продуктивно инфицировать клетку, значит, вирус не может реплицироваться и вызвать гибель клетки.
Интерфероны («IFN») представляют собой семейство цитокинов, которые секретируются в ответ на различные раздражители. Интерфероны связываются с рецепторами на поверхности клетки, активируя сигнальный каскад, который приводит к множеству клеточных ответов, включая противовирусный ответ и индукцию ингибирования роста или/и сигналов апоптоза. Интерфероны разделяют на тип I и на тип II. К IFN типа I относятся IFN-α, -β, -τ и -ω, каждый из которых является мономером, лишь только IFN-γ является IFN типа II и димером. Двенадцать различных подтипов IFN-α продуцируются 14 генами, а все другие TFN являются моногенными (Arduini et al., 1999). TFN проявляют непосредственную противоопухолевую активность путем модуляции онкогенной экспрессии. Сверхэкспрессия стимулирующих рост онкогенов, или утрата онкогенов, супрессирующих опухоль, может приводить к злокачественному преобразованию. Некоторыми онкогенами, вовлеченными в возникновение рака, являются p53, Rb, PC, NF1, WT1, DCC.
Для репликации внутри клетки вирусу миксомы, так же как и другим онколитическим вирусам, таким как реовирус и вирус пузырькового стоматита (VSV), необходимо обойти противовирусную защиту в нормальных здоровых клетках. MV и другие онколитические вирусы индуцируют продукцию интерферона и обычно чувствительны к противовирусному действию пути IFN. Соответствующие белки, индуцированные под действием противовирусного ответа IFN, и которые, главным образом, влияют на размножение вируса, включают в себя PKR, синтазу OAS и нуклеазу RnaseL. PKR активирует eIF2α, что приводит к ингибированию трансляции и индукции апоптоза. На фиг.1 представлено схематическое изображение пути ответа IFN. В нормальных клетках на MV непосредственно воздействуют PKR и eIF2α.
В раковых клетках пути противовирусного ответа часто нарушены. Например, сниженный или дефектный ответ на IFN является генетическим дефектом, который часто возникает во время процесса трансформации и развития опухоли. Более 80% опухолевых клеточных линий не реагируют, или проявляют пониженный ответ на интерферон. (Stojdl et al., Cancer Cell (2003) 4: 263-275 and references cited therein; Wong et al. J Biol Chem. (1997) 272(45):28779-85; Sun et al. Blood. (1998) 91(2):570-6; Matin et al. Cancer Res. (2001) 61(5):2261-6; Balachandran et al Cancer Cell (2004) 5(1):51-65). Авторы изобретения обнаружили, что MV может инфицировать и уничтожать раковые клетки, в том числе опухолевые клетки человека, и не ограничиваясь какой-либо конкретной теорией, полагают, что MV может инфицировать такие клетки, поскольку они имеют дефект противовирусного ответа.
Результаты исследований показывают, что ингибирование раннего природного иммунного ответа и замедление развития Th1 ответа являются очень важными факторами для эффективной онколитической терапии. Хотя вирус миксомы является вирулентным, он хозяин-специфичный и имеет очень ограниченный круг хозяев; он не поражает человека или мышей. Не ограничиваясь какой-либо конкретной теорией, вероятно, что, так как вирус миксомы не поражает человека, на него не должен влиять предшествующий иммунный ответ у человека. Более того, его потенциал как онколитического вируса будет менее подвержен риску, и вирус миксомы должен будет обеспечить более сильное инфицирование пермиссивных опухолевых клеток по сравнению с нативными вирусами человека, что, таким образом, может обеспечить эффективное онколитическое лечение рака.
Таким образом, один из вариантов осуществления изобретение относится к методу ингибирования клеток с дефектным противовирусным ответом, который заключается во введении в клетки эффективного количества вируса миксомы. В одном из воплощений клетка является нечувствительной к интерферону.
В конкретных вариантах осуществления клетка представляет собой раковую клетку млекопитающих. В одном из вариантов осуществления клетка представляет собой раковую клетку человека, в том числе клетку солидной опухоли человека.
Еще в одном варианте осуществления клетка хронически инфицирована вирусом.
Термин «клетка с дефектным противовирусным ответом», используемый здесь, относится к клетке, которая при воздействии вируса или при проникновении вируса не вызывает противовирусный защитный механизм, который включает в себя ингибирование вирусной репликации, продукцию интерферона, индуцирование пути ответа интерферона и апоптоз, опосредованный интерфероном или нет, и, таким образом, инфицируется вирусом миксомы. Термин включает в себя клетку, которая имеет пониженный или дефектный врожденный противовирусный ответ на воздействие или инфицирование вирусом по сравнению с нормальными клетками, например неинфицированными или нераковыми клетками. В том числе, этот термин относится к клетке, которая является нечувствительной к воздействию интерферона, и к клетке, имеющей пониженный или дефектный апоптотический ответ или индукцию метаболического пути. Дефицит может быть вызван различными причинами, в том числе инфекцией, внешним воздействием или может быть генетическим дефектом. Тем не менее, понятно, что когда дефицит возникает вследствие предшествующей инфекции, сферхинфицирование вирусом миксомы может быть исключено и специалист в данной области может легко идентифицировать такие случаи. Специалист в данной области может с легкостью определить, не проводя чрезмерные экспериментальные исследования, имеет ли данный тип клетки дефект противовирусного ответа и, следовательно, может ли инфицироваться вирусом миксомы. Например, VSV обычно используется для измерения противовирусного ответа клеткой.
Для оценки, имеет ли данный тип клеток, например данный вид раковых клеток, дефект противовирусного ответа, специалист в данной области может взять образец, вырастить некоторое количество клеток и оценить инфицирующую способность VSV или альтернативно, вирусом миксомы in vitro.
Термин «клетка, нечувствительная к интерферону», используемый в данном описании, обозначает клетку, которая не реагирует на активность интерферона, например на противовирусную или противоопухолевую активность интерферона, или клетку, которая имеет аномальный ответ на воздействие интерферона, например пониженный или неэффективный ответ на воздействие интерферона, или патологический путь передачи сигнала интерферона, оцениваемый, например, фосфорилированием или активацией сигнальных молекул, таких как факторы транскрипции, например STAT1. Например, без каких-либо ограничений, если клетка подвергается воздействию достаточного количества интерферона для индукции ответа в клетке, чувствительной к действию интерферона, то пролиферация клетки может не ингиброваться или клетка может быть не уничтожена. Клетка, нечувствительная к интерферону, может иметь дефект внутриклеточного сигнального пути или метаболических путей, которые в норме активированы в чувствительных к интерферону клетках. Обычно, чувствительность к инфицированию VSV определяется невосприимчивостью к действию интерферона, и специалист в данной области может с легкостью определить, является ли конкретная клетка нечувствительной к интерферону, или имеет дефект ингибирования инфекции, вызываемой VSV, в присутствии интерферона; или, используя другие маркеры активности интерферона, известные в данной области, например, уровень экспрессии IFN-стимулируемых генов, таких как PKR, STAT, OAS, MX.
Термин «способный к репликации», используемый в описании, относится к вирусу, способному инфицировать клетку организма-хозяина и реплицироваться в ней.
Термин «клетка», используемый здесь, включает в себя как единичную клетку, так и множество клеток или клеточную популяцию. Введение агента в клетку включает в себя как in vitro, так и in vivo введение.
Понятие «эффективное количество», используемое здесь, означает количество, эффективное при дозах и в период времени, необходимое для достижения желаемого результата.
Термин «животное», используемое здесь, включает в себя всех членов животного царства, в том числе и человека.
Термин «ингибирование» клетки, которая имеет дефект противовирусного ответа, включает в себя клеточную гибель в результате апоптоза или других механизмов клеточной гибели наряду с ингибированием роста и деления клетки.
Вирус миксомы может быть любым вирусом, который принадлежит к роду Leporipoxvirus поксвирусов, способным к репликации. Вирус миксомы может быть вирусом дикого типа, или генетически модифицированным.
Геном вируса миксомы может быть легко модифицирован для экспрессии одного или нескольких терапевтических трансгенов, используя стандартные методики молекулярной биологии, известные специалисту в данной области и описанные, например в Sambrook et al. ((2001) Molecular Cloning: a Laboratory Manual, 3rd ed., Cold Spring Harbour Laboratory Press). Специалист в данной области легко определит, какую часть генома вируса миксомы можно удалить, чтобы при этом вирус оставался способен к продуктивному заражению. Например, необязательные области вирусного генома, которые могут быть удалены, могут быть определены при сравнении опубликованной последовательности вирусного генома с геномами других хорошо изученных вирусов (для примера см. C. Cameron, S. Hota-Mitchell, L. Chen, J. Barrett, J.-X. Cao, C. Macaulay, D. Willer, D. Evans, и G. McFadden, Virology (1999) 264: 298-318)).
Термин «терапевтический ген» или «терапевтический трансген», используемый в настоящем изобретении, широко применяется для описания любого гена, экспрессия которого влияет на ожидаемый результат, например на противораковый эффект. Например, вирус может быть модифицирован и, таким образом нести ген, который будет усиливать противораковый эффект лечения вирусом. Таким геном может быть ген, вовлеченный в запуск апоптоза, или вовлеченный в нацеленное разрушение зараженных клеток под воздействием иммунного ответа, например ген, который восстанавливает неполный ответ на действие интерферона, или который приводит к экспрессии маркеров на поверхности клетки, которые стимулируют антительный ответ, как, например антиген на поверхности бактериальной клетки. Вирус также может быть модифицирован и экспрессировать гены, вовлеченные в ингибирование пролиферации и роста опухолевых или раковых клеток, тем самым предупреждая их деление. Так же вирус может быть модифицирован и таким образом иметь в своем составе терапевтические гены, такие как гены, вовлеченные в синтез химиотерапевтических средств, или вирус может быть модифицирован и таким образом иметь повышенный уровень репликации в клетках определенных типов, от которых происходят клетки, подлежащие ингибированию или уничтожению, например клетки человека. Конкретные примеры генов, которые могут быть введены в вирус миксомы для повышения его противоракового эффекта, включают ген человека белка TRAK или ген аденовируса, который кодирует полипептид E4 или f4, которые вовлечены в процесс уничтожения опухолевых клеток человека.
Понятно, что терапевтический эффект вируса миксомы может быть достигнут в результате лизиса клетки вирусом или в результате доставки терапевтических продуктов.
Вирус может быть получен с помощью стандартных способов, известных в данной области. Например, вирус может быть получен путем заражения клеточных культур кролика штаммом вируса миксомы, прогрессирования инфекции с тем, чтобы вирус реплицировался в клеточной культуре, и выделения стандартными способами, известными в данной области, для разрушения клеточной стенки и, таким образом, получения частиц вируса. После полученный титр вируса может быть определен путем заражения конфлюэнтного слоя клеток кролика и проведения анализа бляшкообразования (см. Mossman et al. (1996) Virology 215:17-30).
В одном из вариантов осуществления изобретение относится к способу лечения заболевания, характеризующегося наличием клеток с дефектным противовирусным ответом, у пациентов при необходимости такого лечения, который включает в себя введение пациенту эффективного количества вируса миксомы. Пациентом может быть любое животное, включая млекопитающее и, в частности, человека.
Использующая здесь фраза «заболевание, характеризующееся наличием клеток с дефектным противовирусным ответом», относится к любому заболеванию, расстройству или болезненному состоянию, связанному или характеризующемуся наличием клеток с дефектным противовирусным ответом, и заболеванию, расстройству или состоянию или симптомам, которые, таким образом, могут быть излечены путем уничтожения таких клеток. Примером такого заболевания может быть рак. Такие заболевания могут также включать в себя хронические вирусные инфекции.
Термин «лечение» заболевания относится к подходу для лечебного или желаемого эффекта, в том числе клинических результатов. Благоприятные или желательные результаты могут включать, но ими не ограничиваться, облегчение или улучшение одного или нескольких симптомов или состояний, минимизирование продолжительности заболевания, стабилизацию статуса заболевания, профилактику развития заболевания, профилактику распространения заболевания, отсрочку или замедление прогрессирования заболевания, приостановку или замедление начала заболевания, уменьшение симптомов или временное ослабление заболевания, или ремиссию заболевания (частичную или полную) либо определяемые, либо нет. «Лечение» также может означать продление времени жизни пациента по сравнению с тем временем, которое предполагалось без лечения. Также термин «лечение» может означать ингибирование прогрессирования заболевания, временное замедление прогрессирования заболевания, хотя, более предпочтительно, он обозначает полное постоянное прекращение прогрессирование заболевания. Специалисту в данной области понятно, что результаты могут быть неблагоприятными или неожидаемыми, если, несмотря на улучшение конкретного заболевания, лечение оказывает отрицательное воздействие на пациента, сводя на нет любые благоприятные или ожидаемые эффекты лечения.
В одном из вариантов осуществления заболеванием является рак. Рак может быть раком любого типа, при котором по меньшей мере некоторые клетки, хотя необязательно, все клетки имеют дефект противовирусного ответа. В одном из вариантов осуществления раком может быть рак, при котором по крайней мере некоторая часть клеток является нечувствительной к действию интерферона. Термины «опухоль», «опухолевые клетки», «рак», «раковые клетки», используемые здесь (употребляемые взаимозаменяемо), относятся к клеткам, которые демонстрируют патологический рост, характеризуются значительной потерей над клеточной пролиферацией, или к клеткам, которые были иммортализованы. Термины «рак» или «опухоль» включают в себя злокачественные новообразования или опухоли, дающие или не дающие метастазы. Термин «новообразование», используемый здесь, главным образом относится к клетке или клеткам, пролиферация которых проходит без контроля нормальных механизмов ингибирования роста и, кроме рака, включают доброкачественные опухоли, а так же ди