Способ стерилизации биологических тканей для трансплантации
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к трансплантологии, и может быть использовано при заготовке биологических тканей с высокими трансплантационными свойствами. Способ стерилизации биологических тканей для трансплантации смесью, включающей перекись водорода, осуществляют в упакованном виде без соблюдения асептики при +4°…+5°С в течение 48 часов смесью из перекиси водорода, бромоводородной и салициловой кислоты при следующем соотношении компонентов, мас.%: бромоводородная кислота - 2,0; салициловая кислота - 0,1; перекись водорода - 3,0; дистиллированная вода - остальное. Изобретение обеспечивает надежный стерилизующий эффект при заготовке трансплантатов, полученных в нестерильных условиях, не требует длительного времени и специальной техники соблюдения работ в стерильных помещениях; исключает отмывку по завершении стерилизации. 1 табл., 6 ил.
Реферат
Изобретение относится к медицине и может быть использовано при заготовке биологических трансплантатов, применяемых в травматологии - ортопедии и в других областях восстановительной хирургии.
Известен способ стерилизации биотрансплантатов антисептическим комплексом [1], который может быть включен в состав раствора №9 ЦОЛИПК, в раствор Тироде или в 11% сахарозный раствор. На каждые 100 мл этих растворов берется: 200 тысяч ЕД неомицина, 200 тыс. ЕД полимиксина, 0,005 г фуразолидона и 0,1 г пипольфена (или 0,2 г сорбиновой кислоты). Время стерилизации биотканей антисептическим комплексом при 37°С составляет 2 часа, при +2°…+4°С - одни сутки. Очевидно, что состав приведенного выше способа достаточно сложен. К настоящему времени он оставлен из-за практического отсутствия названных выше антибиотиков и пипольфена.
Известен способ стерилизации трансплантатов бета-пропиолактоном [1]. На каждые 100 мл жидкой среды берется 2,14-2,67 г фосфорно-кислого натрия или же 4-6 г бикарбоната натрия (рН соответственно 7,4-7,8-8,2). Стерилизующий агент вносится шприцем в таком количестве, чтобы получился 1% раствор, после чего посуда с тканями герметично опечатывается, встряхивается и помещается в термостат (37°С) на 2 часа. По истечении указанного времени в стерильной обстановке отработанный раствор сливается, трансплантаты перекладываются в стерильную тару, запечатываются и подвергаются консервации. Данный способ высокоэффективен и в свое время считался наиболее перспективным - по своей простоте и надежности. К сожалению, выпуск этого ценного стерилянта как у нас в, стране, так и за рубежом прекращен в связи с его якобы мутагенностью.
Известен способ стерилизации деминерализованной костной ткани [2] в закрытой системе при пониженном давлении и постоянном встряхивании в течение 4-х часов. Стерилизующая среда состоит из двух объемов надуксусной кислоты (5%), одного объема этанола и одного объема дистиллированной воды. Отношение стерилизуемой костной массы к стерилизуемому раствору составляет 1:4. По окончании стерилизации масса не менее трех раз промывается буфером Соренсена в изотоническом растворе хлорида натрия. Раскладка полученного таким образом материала осуществляется в стеклянные емкости в асептических условиях. Консервируется материал путем лиофилизации. Недостатки способа: а) работа в закрытой системе с пониженным давлением и обязательным, весьма длительным встряхиванием, что требует использования специальной техники; б) необходимость в тщательной промывке стерилизованного материала в сложном для приготовления буферном растворе хлорида натрия; в) соблюдение строгой асептики на всех этапах обработки материала; г) способ предназначен только для гранулированных (размельченных) тканей, для стерилизации монолитных трансплантатов он не рекомендован.
Известен способ (прототип) стерилизации биотканей смесью перекиси водорода с муравьиной кислотой [3]. В чистую стеклянную колбу сначала наливают 160 мл пергидроля, затем 80 мл 85% муравьиной кислоты. Смесь тщательно перемешивают и помещают в холодильник с температурой +4°…+6°С или в холодную воду на 1-1,5 часа. После чего смесь разводят дистиллированной водой комнатной температуры (18°…20°С) до 5 литров. В таком виде антисептический раствор готов для применения. Процесс стерилизации пластического материала производят в специальных стерилизаторах, имеющих на дне выпускной кран для слива отработанной жидкости. На дно стерилизатора укладывается сетка, на которую помещаются подготовленные трансплантаты. Ткани на сетке необходимо укладывать таким образом, чтобы они не соприкасались друг с другом. После этого в стерилизатор наливают свежеприготовленный антисептический раствор. По истечении 30 минут его сливают, а трансплантаты заливают физиологическим раствором комнатной температуры еще на 20-30 минут. По окончании процесса отмывки ткани раскладывают в стеклянные ампулы или пакеты и консервируют путем лиофилизации или замораживания. Важно отметить, что все манипуляции по стерилизации биологических трансплантатов осуществляют в условиях стерильного бокса.
При всей очевидной пригодности способа и доступности его рабочих ингредиентов он не лишен слабых сторон. Так, на приготовление антимикробной смеси уходит более 1,5 часов, что увеличивает время заготовки трансплантатов. Для «созревания» такой смеси необходима холодильная техника, что усложняет методику. Способ невозможен без специального приспособления - стерилизатора с выпускным клапаном. Наконец, способ не исключает вторичного инфицирования трансплантатов, например в момент их промывания или во время раскладки трансплантатов в стерильную тару. Опасность эта становится особенно реальной при одновременной заготовке большого количества трансплантатов.
Техническим результатом настоящего изобретения является упрощение методики приготовления рабочей смеси антисептиков, исключение асептики из процесса заготовки биологических тканей и отмывки последних по завершению стерилизации.
Способ осуществляется следующим образом. Подготовленные к стерилизации образцы костной, хрящевой, сухожильной и других тканей помещают в индивидуальные пластиковые пакеты и заливают без соблюдения асептики стерилизующей смесью. Для ее приготовления в колбу с дистиллированной водой последовательно вносят на каждые 95 мл объема: бромоводородную кислоту - 2,0; салициловую кислоту - 0,1; перекись водорода - 3,0. Раствор тщательно перемешивают и вливают в пакеты с трансплантатами таким образом, чтобы над раствором оставалось свободное пространство высотою 5-7 см. Пакеты герметизируют путем термоимпульсной сварки, встряхивают и переносят в бытовой холодильник с температурным режимом +4°…+5°С. Через 48 часов пакеты извлекают из холодильника и освобождают от рабочей жидкости либо путем прокола стерильной толстой иглой, либо путем отсечения небольшой части пакета в области его угла. Место прокола или обреза обрабатывают йодной настойкой и заваривают. Для контроля на стерильность 1 из 10 заготовленных трансплантатов, после отсечения от него небольших фрагментов в нескольких местах, направляют в бактериологическую лабораторию. Остальные трансплантаты подвергают консервации либо низкими температурами, либо с помощью лиофилизации.
В таблице показаны:
Результаты стерилизации биотрансплантатов предлагаемым способом.
Примечание: +рост микрофлоры
- отсутствие роста
На иллюстрациях изображены:
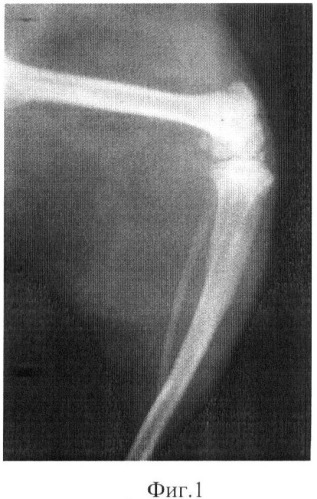
Фиг 1. Рентгенологический результат эктопической пересадки деминерализованных и стерилизованных предлагаемым способом костных аллотрансплантатов у крыс на 15 сутки после операции. Лишенный минеральной основы трансплантат не виден.
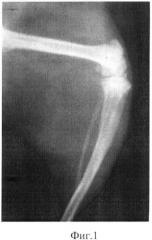
Фиг 2. Рентгенологический результат эктопической пересадки деминерализованных и стерилизованных предлагаемым способом костных аллотрансплантатов у крыс на 60 сутки после операции. На месте бывшего трансплантата сформировалась новая кость.
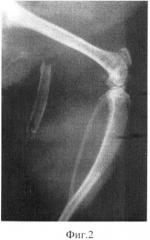
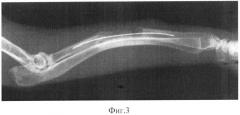
Фиг 3. Рентгенологический результат ортотопической пересадки деминерализованного и стерилизованного предлагаемым способом костного трансплантата в дефект лучевой кости кролика на 30 сутки после операции. Виден дефект лучевой кости и признаки восстановительного процесса.
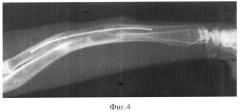
Фиг.4. Рентгенологический результат ортотопической пересадки деминерализованного и стерилизованного предлагаемым способом костного трансплантата в дефект лучевой кости кролика на 90 сутки после операции. Целостность лучевой кости восстановлена полностью.
Фиг.5. Микрофото. Гистологический результат ортотопической пересадки стерилизованного костного трансплантата в дефект лучевой кости кролика через 90 суток после операции. На снимках: новообразованная костная ткань пластинчатого строения с несколько расширенными гаверсовыми каналами. Окраска гематоксилин и эозин, X 100.
Фиг.6. Рентгенологический результат хирургического лечения больной П., 13 лет с диагнозом: многокамерная киста проксимальной трети диафиза правой плечевой кости.
а). До операции;
б). Через 3 месяца после операции;
в). Через 6 месяцев после операции;
г). Через 1,5 года после операции.
Таким образом, в отличие от прототипа:
1. Предлагаем новую стерилизующую смесь химических антисептиков, обеспечивающих в комплексе надежный стерилизующий эффект при заготовке биологических тканей, полученных в нестерильных условиях и применяемых в трансплантологии. Входящая в состав среды салициловая кислота помимо бактерицидного действия обладает, как это следует из литературы [4], мембраноуплотняющими, то есть консервирующими коллаген свойствами, а также способствует пролиферации клеток и развитию регенераторных явлений. Кроме того, она тормозит самопроизвольное разложение перекиси водорода.
2. Приготовление предлагаемой смеси антисептиков в отличие от прототипа не требует длительного времени, что важно при заготовке большого количества трансплантатов.
3. Стерилизацию трансплантатов в предлагаемом способе ведут в закрытых системах, не требующих специальной техники и соблюдения работ в стерильном помещении (боксе).
4. В предлагаемом способе отмывка трансплантатов после их стерилизации исключена, поскольку остатки среды не наносят им нежелательного ущерба.
Для подтверждения вышеизложенного приводим результаты экспериментальных исследований.
1. Стерилизующая активность способа
Для проведения экспериментов были использованы образцы тканей, наиболее инфицированные в естественных условиях: фрагменты кожных трансплантатов, полученные у трупов-доноров, хранившихся при комнатной температуре 12-18 часов, а также хвостовые фрагменты крыс, забитых после выполнения различных экспериментов. Всего было исследовано 200 биологических тест-объектов, инфицированных до стерилизации смешанной микрофлорой, в которой наиболее часто встречались: стафилококк (97,2%), споровая палочка (70,4%), плесень (60,8%), кишечная палочка (52,7%), стрептококк (20,9%), протей (19,1%), синегнойная палочка (10,9%), сарцина (2,7%), дрожжеподобные грибки (0,9%), дифтероиды (0,45%). Результаты стерилизации приведены в таблице 1.
Как видно из таблицы, предлагаемый в способе антисептический комплекс обеспечил надежные результаты стерилизации инфицированных тест-объектов через 48 часов их инкубирования в холодильнике при +5°С.Установленный факт позволил перейти к следующему этапу - исследованию биопластических свойств костных трансплантатов, заготовленных с помощью предлагаемого способа.
2. Изучение остеоиндуктивной активности костных трансплантатов, стерилизованных предлагаемым способом.
Остеоиндуктивная активность костных аллотрансплантатов, как наиболее объективный критерий их качества, была изучена в эксперименте на 12 крысах и 7 кроликах. Первым производили эктопические (в мышцы бедра), а вторым - ортотопические (в дефект лучевой кости) пересадки костных фрагментов, полученных у забитых кроликов в нестерильных условиях. Перед стерилизацией фрагменты трубчатых костей животных-доноров освобождали от мягких тканей и костного мозга. Затем их после деминерализации помещали в полиэтиленовые пакеты и заливали стерилизующим раствором, содержащим на каждые 100 мл дистиллированной воды 2,0 бромоводородной кислоты, 0,1 г салициловой кислоты, 3,0 перекиси водорода. Пакеты с препаратами и раствором герметизировали и ставили в холодильник (+5°С) на 48 часов, после чего раствор сливали через прокол толстой стерильной иглой и вновь герметизировали место прокола.
Консервацию трансплантатов до операции осуществляли при той же температуре в течение одной - двух недель. На операции трансплантаты извлекали из упаковки и помещали в стерильный физиологический раствор хлорида натрия. Проведенные до операции бактериологические исследования показали, что все трансплантаты сохраняли стерильность. Техника оперативного вмешательства у крыс и кроликов была стандартной. В послеоперационном периоде осложнений не наблюдалось, температура животных не превышала обычных величин, их поведение ничем не отличалось от поведения здоровых животных. Через 3 месяца после операции животные были выведены из эксперимента в соответствии с правилами, изложенными в приказе МЗ СССР №755 от 12.08.77 года. Взятые у них препараты исследованы рентгенологическими и гистологическими методами. Окраску гистологических препаратов производили гематоксилином и эозином.
Результаты исследований показали, что к концу наблюдений у 10 из 12 крыс рентгенологически на месте пересадки были обнаружены новообразованные костные регенераты, плотность которых еще уступала соседним участкам костей реципиента (Фиг.1 и 2).
При ортотопической пересадке у всех 7 кроликов через 3 месяца на рентгенограммах (Фиг.3 и 4) дефект лучевой кости был восполнен новообразованным костным регенератом сложного строения. На гистологических препаратах к данному сроку на месте дефекта обнаруживалась новая кость в основном пластинчатого строения. Гаверсовы каналы новой кости имели хаотичное расположение, местами были несколько расширены и содержали в основном остеогенные клеточные элементы (Фиг.5).
Таким образом, эксперимент подтвердил клиническую пригодность деминерализованных костных аллотрансплантатов, стерилизованных предлагаемым способом. Успешное их применение можно связать не только с их стерильностью, но и с тем положительным влиянием, какое оказывают на них присутствующие в среде бромоводородная и салициловая кислоты. Первая - за счет поверхностной деминерализации кости, обеспечивающей ее остеоиндуктивные свойства, вторая за счет способности повышать пролиферативную активность соединительнотканных клеток.
Клинический пример.
Больная П., 13 лет. Поступила в ЛНИДОИ им. Г.И.Турнера с диагнозом: многокамерная киста проксимальной трети диафиза правой плечевой кости (Фиг.6-а). Операция: обработка внутренних стенок кисты желобоватым долотом и окончатой фрезой. Образовавшаяся полость заполнена полосками аллогенной деминерализованной и минерализованной кости, стерилизованной предлагаемым в работе способом. Рана ушита наглухо, конечность фиксирована гипсовой лонгетой. Послеоперационный период протекал гладко. Швы удалены на 10 сутки. Выписана на амбулаторное лечение. Через три месяца после операции на рентгенограммах видна активная перестройка трансплантатов (Фиг 6-б), через 6 месяцев видны признаки формирования костномозгового канала и кортикального слоя кости (Фиг.6-в). Спустя 1,5 года после операции структура пораженного отдела кости полностью восстановлена (Фиг.6-г).
Список литературы
1. Методические основы массовой заготовки тканевых трансплантатов с помощью стерилизующих средств химической природы/Методическое письмо. - Новосибирск, 1968. - 21 с.
2. Фон Верзен Р. Подготовка деминерализованного костного матрикса к клиническому использованию/Деминерализованный костный трансплантат и его применение: Сб.науч.тр. - СПб., 1993. - С.4-11.
3. Химическая стерилизация биологических тканей с последующим замораживанием/Методические рекомендации. - Астрахань, 1978. - 26 с.
4. Сызганов А.Н. О лечении гнойных хирургических заболеваний салициловой кислотой/А.Н.Сызганов, С.Н.Левченко // Алма-Ата. - «Казахстан». - 1980. - 142 с.
| Способ стерилизации биологических тканей для трансплантации | ||||||||
| Таблица | ||||||||
| Время стерилизации | Часы | |||||||
| 12 | 24 | 48 | 72 | |||||
| Результат стерилизации | + | - | + | - | + | - | + | - |
| Количество исследований | 50 | 0 | 19 | 31 | 0 | 50 | 0 | 50 |
Способ стерилизации биологических тканей для трансплантации смесью, включающей перекись водорода, отличающийся тем, что стерилизацию тканей осуществляют в упакованном виде без соблюдения асептики при +4°…+5°С в течение 48 ч смесью из перекиси водорода, бромоводородной и салициловой кислоты при следующем соотношении компонентов, мас.%:
| бромоводородная кислота | 2,0 |
| салициловая кислота | 0,1 |
| перекись водорода | 3,0 |
| дистиллированная вода | остальное |