Применение двухфотонно-возбуждаемой флуоресценции в области клинической химии для анализов компонентов, содержащихся в клиническом образце
Иллюстрации
Показать всеИзобретение относится к области аналитической клинической химии. Анализируемый компонент подвергается химической реакции, или реакциям в одну или несколько стадий, или реакциям в последовательности реакций, приводящих к изменению количественно определяемого свойства соединения или соединений. Указанная химическая реакция, или реакции, или последовательность реакций приводит к образованию соединения с двухфотонной флуоресценцией или к изменению характеристик двухфотонной флуоресценции у реакционной системы, содержащей по крайней мере одно соединение с двухфотонной флуоресценцией, и анализируемый компонент количественно оценивают путем возбуждения указанного соединения или соединений с двухфотонной флуоресценцией, измерения интенсивности двухфотонно-возбуждаемой флуоресценции и соотнесения полученных величин измеренной флуоресценции с методом стандартизации данных, основанным на измерениях, получаемых от эталонного материала указанного анализируемого компонента. 3 н. и 14 з.п. ф-лы, 7 ил.
Реферат
Область изобретения
Настоящее изобретение относится к области клинической химии и к применению двухфотонно-возбуждаемой флуоресценции в качестве принципа детектирования данных количественного определения компонентов, анализируемых в клиническом образце.
Предыдущий уровень техники в данной области
Публикации и другие материалы, используемые в описании с целью иллюстрации предыдущего уровня техники в данной области, в частности дополнительные сведения, касающиеся практики, включены в текст посредством ссылки.
Анализы в области клинической химии
Под определяемыми в клиническом образце компонентами авторы подразумевают в данном контексте метаболиты или другие компоненты сыворотки, которые обычно измеряют на практике в области клинической химии. Примерами таких анализируемых компонентов являются следующие компоненты: глюкоза, общий холестерин, холестерин ЛВП (HDL), холестерин ЛНП (LDL), триглицериды, билирубин, креатинин, общие белки, железо, магний, мочевина, мочевая кислота, ASAT, ALAT, амилаза, ЛДГ (LDH), GT, щелочная фосфатаза, липаза и креатинкиназа. В данном контексте, определяемые компоненты, содержащиеся в клиническом образце, не включают такие компоненты, которые измеряют способами, основанными на связывании по сродству, такими как количественный иммунный анализ, анализ конкурентного связывания, анализ, основанный на образовании антигенного мостика, или агглютинационный анализ (The Immunoassay Handbook, 1994, David Wild, Editor, ISBN 0-333-51179-4).
Наиболее часто определяемые в клиническом образце компоненты анализируют способами, основанными на фотометрическом определении. Аналитические протоколы включают в себя добавление одного или нескольких реагентов к образцу (например, кровь, плазма, сыворотка, моча или другая жидкость организма, разбавленная или неразбавленная в соответствующем водном или неводном разбавителе) и инкубацию при постоянных условиях в одном или нескольких случаях после добавления реагента или в промежутках между добавлениями реагента. И, наконец, абсорбцию анализируемой смеси измеряют при одном или нескольких диапазонах длин волн, с последующим расчетом концентрации анализируемого компонента с помощью стандартных калибровочных кривых. Большая часть клинических анализов основана на реакции, катализируемой ферментом, где фермент действует либо как анализируемый компонент, либо как специфический катализатор реакции для анализируемого компонента. В результате реакции, катализируемой ферментом, происходит изменение структуры молекулы субстрата, которое приводит к изменению абсорбционных характеристик субстрата. Изменение фотометрического показания при соответствующей длине волны пропорционально концентрации анализируемого компонента в образце. В случае, когда анализируемый компонент действует как субстрат и фермент служит в качестве реагента, реакция может закончиться, при этом измерение осуществляется по конечной точке, в то время как, когда фермент действует как анализируемый компонент, реакция протекает в строго контролируемых условиях и измерение осуществляется с помощью кинетических приемов. В этом контексте, термин "кинетическое измерение" означает, что образец количественно оценивают либо при определенной заданной временной точке (или временных точках), либо, в качестве альтернативы, если кинетика реакции хорошо охарактеризована и промоделирована математически, реакцию можно оценить при любой определенной временной точке (или временных точках) с последующим расчетом конечной ферментативной активности (концентрация в единицах активности), используя кинетические уравнения, рассчитанные заблаговременно для этого отдельного случая. Программы анализа и методология, которые обычно используются в клинической практике, описаны в учебниках и в литературе (Tiez Texbook of Clinical Chemistry, Ed. C.Burtis and E.Ashwood, W.B.Saunders Company). Другой тип клинических анализов представлен таким типом, который не включает в себя ферментативный катализ, но имеет чистую химическую основу (неферментативные реакции). Такие анализируемые компоненты включают в себя, например, анализ билирубина с помощью диазореагента, анализ сывороточного белка с помощью биуретовой реакции и анализ альбумина с помощью BCG-реагента (бромкрезоловый зеленый) (Tiez Texbook of Clinical Chemistry, p.702). В результате этих реакций образуется окрашенный конечный продукт, концентрацию которого измеряют посредством фотометрии в соответствующей области длин волн. Самая типичная форма фотометрического анализатора в клинической практике включает в себя одиночный световой пучок и разовые фотометрические кюветы. Это означает, что любая вариация в оптической длине разовых кювет или в оптических свойствах стенок кювет вызывает неточность в конечном результате анализа. Из-за этих свойств фотометрии и, с другой стороны, из-за жестких требований к точности клинических анализов, требования к качеству разовых кювет являются чрезвычайно необходимыми. По этой причине, кюветы для клинических анализов являются и остаются дорогостоящими. В практике клинической химии, цена кюветы составляет основу стоимости клинических анализов, осуществленных с помощью фотометрии.
Некоторые из анализируемых компонентов клинического анализа также определяли методами, основанными на детекции флуоресценции (однофотонно-возбуждаемая флуоресценция). Указанные анализы были осуществлены путем замены хромогенного субстрата (или реагента), используемого в фотометрических методах, на флуорогенный субстрат (или реагент). В результате, сигнал флуоресценции, исходящий из анализируемой смеси, является пропорциональным концентрации компонента. Примерами таких анализов являются анализ глюкозы с помощью глюкозооксидазы, пероксидазы и Amplex Red™ (флуорогенный субстрат, торговое название молекулярных зондов, кат.No. A-12222) в качестве реагентов, и анализ креатинина с помощью креатининазы, креатиназы, саркозиноксидазы, пероксидазы и Amplex Red в качестве реагентов. Другим примером является анализ амилазы с помощью меченного флуорофором крахмала в качестве реагента (или другой аналог крахмала, такой как амилопектин или соответствующий синтетический реагент, такой как α-1,4-олигосахарид), где меченый крахмал является субстратом для фермента, причем гидролиз субстрата приводит к повышению флуоресценции по мере того, как фермент переваривает полимерный реагент (или олигомер) (Fluorescence Microplate Assays, Molecular Probes, Seventh edition, 2002, p.51). Другим примером флуорометрических методов анализа является анализ щелочной фосфатазы с помощью флуоресцеином меченного фосфата в качестве флуорогенного субстрата (Handbook of fluorescent probes and research products, 9th Ed., p.420, Molecular Probes, Eugene, OR, USA, 2002). Данный анализ основан на увеличении интенсивности флуоресценции при гидролизе флуорогенного субстрата анализируемым компонентом. Однако основанные на флуоресценции анализы используют, в основном, в исследовательских лабораториях, в то время как их использование в клинической практике является весьма ограниченным. В целом, основанные на флуоресценции методы дают порядки величин с большей чувствительностью и более широкого динамического диапазона, чем методы, основанные на фотометрии. В исследовательских лабораториях, эти качества дают явное преимущество, но в области клинической химии это преимущество не имело полезного применения, поскольку требования, предъявляемые к чувствительности или динамическому диапазону анализов в области клинической химии, часто являются скорее недостаточно высокими. Вместо этого, достоверность, точность результатов и стоимость реагента обычно рассматриваются как более важные критерии для анализов в области клинической химии. На примере указанных критериев было показано, что до настоящего времени флуорометрия не продемонстрировала явных преимуществ над фотометрией как способа детектирования в клинической практике.
Применения флуоресценции в биоаффинных анализах
Однофотонно-возбуждаемая флуоресценция нашла различные применения в области биоаналитики. Применения, такие как иммунологический анализ, анализ с помощью ДНК-гибридизации и анализ связывания рецептора, с использованием флуоресценции в качестве метода детектирования были внедрены в течение последних трех декад. В указанных анализах используют специфические биоаффинные реакции при определении анализируемого компонента в образце. Количество анализируемого компонента можно определять посредством контролирования сигнала флуоресценции, который зависит от количества связанного анализируемого компонента. Данные анализы также могут быть основаны на контролировании изменения в свойствах флуоресценции в течение реакции специфического связывания. Указанное изменение свойства флуоресценции может включать в себя либо изменение интенсивности флуоресценции, изменение длины волны испускания, изменение во времени спада импульса, либо в поляризации флуоресценции.
Иммунологические анализы были широко использованы в клинической диагностике для определения некоторых заболеваний или физиологического состояния. Иммуноанализы могут быть разделены на два разных типа анализов, конкурентный и неконкурентный анализы. В конкурентном методе, меченый антиген (второй биоспецифический реагент) конкурирует с анализируемым компонентом за связывание с ограниченным числом антител (первый биоспецифический реагент). Концентрация анализируемого компонента может быть определена из соотношения меченого антигена, связанного с антителом, или из соотношения свободной фракции меченого антигена. В неконкурентном способе (иммунометрический метод), анализируемый компонент связывается с избыточным количеством связывающего антитела (первый биоспецифический реагент). Избыток меченого антитела (второй биоспецифический реагент) связывается с другим участком анализируемого компонента. Количество анализируемого компонента можно определить на основе фракции меченого антитела, связанного с анализируемым компонентом. Физическое разделение связанных и свободных фракций является необходимым приемом до детектирования, если принцип регистрации не дает возможности отличить сигнал связанной фракции от сигнала свободной фракции. Таким образом, методы анализа подразделяются на анализы с разделением и анализы без разделения, часто также названные как гетерогенный и гомогенный анализы. [Miyai К., Principles and Ptactice of immunoassay, (ed. Price C.P. and Newman D.J.) Stockton Press, New York 1991, 246 and Hemmilä I.A., Applications of Fluorescence in Immunoassays, (ed. Winefordner J.D.) John Wiley & Sons, New York 1991]. Способ с использованием трубки с покрытием обычно применяют для анализов с разделением, и в таких случаях свободную фракцию отделяют посредством повторяемых стадий промывки.
Чувствительность и динамический диапазон флуорометрии при однофотонном возбуждении являются выше и обширнее, чем таковые при фотометрии. Однако чувствительность является достаточной только для ограниченного количества анализов. Способы флуоресценции с разрешением во времени, хемилюминесценции или электрохемилюминесценции дают улучшенную чувствительность по сравнению с обычным устойчивым состоянием (т.е. мгновенным) флуоресценции. Указанные способы известны как в области научных исследований, так и в диагностике, и их рассматривают наряду с самыми чувствительными аналитическими методами (Hemmila and Mukkala, Crit. Rev. Clin. Lab. Sci. 2001).
Двухфотонное возбуждение
В 1931 Maria Göppert-Mayer [Ann. Phys. 9 (1931) 273] показала, что молекула одновременно может поглощать два фотона. Это явление оставалось долгое время без какого-либо практического применения до тех пор, пока не стали доступными источники интенсивного лазерного излучения. Двухфотонное возбуждение создается тогда, когда при фокусировании интенсивного источника света плотность фотонов на единицу объема и в единицу времени становится достаточно высокой для того, чтобы два фотона могли быть одновременно поглощены одним и тем же хромофором. Поглощенная энергия состоит из суммы энергий двух фотонов. Возможность двухфотонного возбуждения будет зависеть от степени плотности 2-го фотона. Таким образом, поглощение двух фотонов является нелинейным процессом второго порядка. Одновременное поглощение двух фотонов одним хромофором приводит хромофор в возбужденное состояние. Затем, указанное возбужденное состояние ослабляется при спонтанной эмиссии фотона с более высокой энергией, чем фотоны освещения. В этом контексте процесс, который включает в себя двухфотонное возбуждение и последующую релаксацию, сопровождающуюся излучением, называют двухфотонно-возбуждаемой флуоресценцией (ТРЕ). ТРЕ обычно имеет характеристики излучения, подобные характеристикам однофотонно-возбуждаемой флуоресценции для такого же хромофора [Хu С.and Webb W.W., J. Opt. Soc. Am. B, 13 (1996) 481]. Спектр возбуждения, однако, иногда расширяется и/или гипсохромно смещается, если сравнивать со спектром однофотонного возбуждения. Молекулы, которые возбуждаются при одновременном поглощении двух фотонов и производят возбужденные состояния и флуоресцентное излучение, в данном контексте называют двухфотонными флуоресцентными красителями.
Одной из ключевых характеристик двухфотонного возбуждения является то, что возбуждение имеет место только в четко ограниченном 3-мерном пространстве (3D) фокусной точки. Следствием данной характеристики является высокая 3D концентрация в пространстве произведенного флуоресцентного излучения. Вследствие нелинейной природы возбуждения, минимальная фоновая флуоресценция производится вне фокусного объема, т.е., в среде, окружающей образец, и в оптических компонентах. Другой ключевой характеристикой двухфотонного возбуждения является то, что освещение и излучение имеют место в существенно различающихся областях длин волн. Результатом этой характеристики является то, что утечку рассеянного света в канале, регистрирующем флуоресцентное возбуждение, можно уменьшить с помощью фильтра низких частот (уменьшение по крайней мере на 10 порядков величин). Поскольку объем возбуждения является небольшим (в области фемтолитров, т.е., 10-15 литров), двухфотонное возбуждение является наиболее подходящим для наблюдения за небольшими объемами образцов и структур.
Биоаналитические применения флуоресценции с двухфотонным возбуждением
Одним из ранних сообщений, касающихся аналитического использования двухфотонного возбуждения, была публикация Sepaniak et al. [Anal. Chem. 49 (1977), 1554]. Авторы обсуждали возможность использования флуоресценции с двухфотонным возбуждением для регистрации ВЭЖХ. Низкий фоновый уровень и простота системы были продемонстрированы. Исследователи Lakowicz et al. [J. Biomolec. Screening 4 (1999) 355] сообщили об использовании мультифотонного возбуждения при скрининге с высокой пропускной способностью. Они показали, что двухфотонно-индуцированная флуоресценция флуоресцеина может быть измерена с большой достоверностью в многолуночных планшетах с высокой плотностью размещения.
Большая часть биоаналитического применения флуоресценции с двухфотонным возбуждением, описанного в литературе, относится к двухфотонной микроскопии [Denk W. et al. патент США 5034613, Denk W. et al., Science 248 (1990) 73]. Использование двухфотонного флуоресцентного возбуждения в лазерной сканирующей микроскопии дает 3D пространственную разрешающую способность без использования маленьких отверстий, необходимых в конфокальной микроскопии. Вместе с простой оптической моделью, микроскопия с двухфотонным возбуждением обеспечивает 3D пространственную разрешающую способность, сравнимую со способностью обычной однофотонной конфокальной микроскопии. Развитие также приводит к промышленному производству двухфотонных лазерных сканирующих микроскопических систем. Препятствием к развитию способа является требование дорогостоящего лазера, способного генерировать сильные ультракороткие импульсы с высокой частотой повторения.
Последняя разработка менее дорогостоящей лазерной технологии является весьма ободряющей в связи с применением флуоресцентной технологии с двухфотонным возбуждением в рутинных биоаналитических способах [Hänninen P. et al., Nat. Biotechnol. 18 (2000) 548; Soini J.T. et al. Single Mol. 1 (2000) 203; Soini JT (2002) Crit. Rev. Sci. Instr., международные пуоликации WO 98/25143 и WO 99/63344]. Согласно международной публикации WO 98/25143 и международной публикации WO 99/63344, вместо дорогостоящих лазеров с режимом синхронизации мод для двухфотонного возбуждения могут быть использованы микрочип-лазеры с накачкой светодиодами с пассивной модуляцией добротности. Указанные лазеры являются монолитными, небольшими, простыми и низкими по стоимости. Международные публикации WO 98/25143 и WO 99/63344 описывают использование двухфотонно-возбуждаемой флуоресценции в детектировании данных биоаффинного анализа. В этом способе биоаффинного анализа используются микрочастицы в качестве биоаффинной связывающей твердой фазы, с которой связывается первый биоспецифический реагент. В этом способе биоаффинного анализа используют биоспецифический второй реагент, который метят двухфотонным флуоресцентным красителем. Согласно способам, описанным в международных публикациях WO 98/25143 и WO 99/63344, биоаффинные комплексы образуются на поверхности микрочастиц, и количество биоаффинных комплексов количественно определяют путем измерения интенсивности двухфотонно-возбуждаемой флуоресценции, исходящей из индивидуальных микрочастиц. Таким образом, этот способ позволяет производить биоаффинный анализ без разделения в микрообъемах.
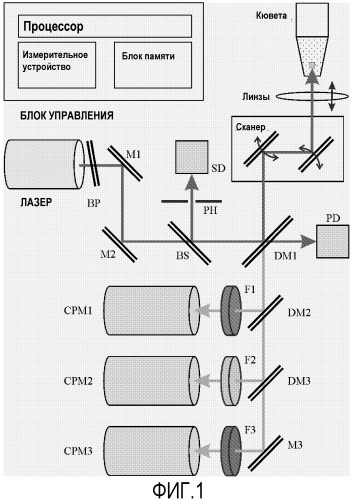
Меченый второй биоаффинный реагент связывается на поверхности микрочастиц либо через молекулу анализируемого компонента с образованием трехкомпонентных биоаффинных комплексов (неконкурентный, иммунометрический метод), либо он связывается прямо с первым биоспецифическим реагентом с образованием двухкомпонентных биоаффинных комплексов (метод конкурентного связывания). Первый и второй биоспецифические реагенты являются биологически активными молекулами, такими как гаптены, биологически активные лиганды, лекарственные средства, пептиды, полипептиды, белки, антитела или фрагменты антител, нуклеотиды, олигонуклеотиды или нуклеиновые кислоты. Согласно международным публикациям WO 98/25143 и WO 99/63344 лазер с высокой эффективностью двухфотонного возбуждения фокусирован на реакционную суспензию, и двухфотонно-возбуждаемую флуоресценцию, исходящую от единичных микрочастиц, измеряют, когда они перемещаются по всему фокусному объему лазерного пучка. В качестве альтернативы, микрочастицы могут быть «уловлены» в течение периода регистрации флуоресценции оптической ловушкой, которая вызывается лазерным лучом. Захват микрочастиц к фокусной точке лазерного пучка основан на оптическом давлении, которое производится на микрочастицу посредством луча лазера. Согласно международной публикации WO 98/25143, оптическое улавливание повышает продолжительность существования частицы в фокусном объеме лазерного пучка и увеличивает рабочий цикл регистрации флуоресценции. Схема оптического расположения типичного флуорометрического устройства с двухфотонным возбуждением показана на фигуре 1 (ArcDia™ TPX Plate Reader). Конструкция устройства может различаться в зависимости от отдельного использования и применения. Наиболее важными компонентами, которые отличают устройство, являются:
- Лазерный луч фокусирован с помощью линз объектива микроскопа с минимумом числовой апертуры от 0,4 до 0,7.
- Для улавливания микрочастиц используют двухмерный пьезоактивный сканер, который способен остановить сканирование мгновенно, когда микрочастица обнаруживается вблизи фокусного объема.
- Лазер для ближней инфракрасной области спектра представляет собой импульсный лазер с длительностью импульса короче 10 наносекунд, частотой повторения импульсов выше 10 кГц и средней мощностью луча в образце порядка 100 мВт, с ТЕМ 00 типом выхода поляризованного луча. Типичным лазером является микрочип-лазер на Nd:YAG или Nd:LBS с пассивной модуляцией добротности [Danailov M.B. & ai., Appl. Phys. В 73, 1-6 (2001)]. Альтернативным лазером может быть Yb-промотированный волоконный лазер с синхронизацией мод [Grudinin А. В. & ai., Optics Letters (2003), Vol.28 Issue 17 Page 1522].
Сигнал флуоресценции в видимой области оптического спектра определяют с помощью фотоумножителей СРМ, используя простой подсчет фотонов.
Текущее состояние вопроса в диагностическом тестировании in vitro
Основными областями диагностического тестирования in vitro (IVD) являются: клинические анализы, биоаффинные анализы, гематология и микробиология. Из указанных четырех областей диагностика чаще требуется в практике клинической химии, однако, самый высокий объем продаж и темп роста приходится на биоаффинные анализы. Другие области, микробиология и гематология, вместе составляют 1/6 от объема продаж IVD, но они являются необходимыми для полного первичного диагноза и лечения.
В обычной лабораторной практике небольших и средних больниц или поликлиник, обычно требуются три типа анализаторов: 1) устройство для подсчета клеток крови в гематологии, 2) автоматический анализатор для клинической химии и 3) анализатор для иммунологических анализов. Микробиологическое тестирование можно выполнить быстрым способом с помощью тест-полосок, путем визуализации микробных культур или с помощью иммуноанализа, таким образом, специализированных инструментов не требуется для считывания результатов проверки.
Как обсуждалось выше, сегодня в диагностической лаборатории in vitro требуются по крайней мере три основных анализатора для осуществления ряда анализов, в которых чаще всего имеется потребность. Такое большое число анализаторов требует затрат, и эти затраты окупаются только тогда, когда пропускная способность образцов в лаборатории является достаточно высокой, чтобы резервное время работы анализатора было как можно меньше. Согласно современной тенденции, наблюдающейся в промышленно развитых странах, система здравоохранения подвергается критическому анализу относительно эффективности затрат. Правительство, выплачивающее компенсацию за расходы в системе здравоохранения, находится в затруднительном положении относительно снижения затрат. Исходя из этой ситуации как клинические лаборатории, так и производители анализаторов и наборов для анализов вынуждены сокращать общую стоимость операций на анализ и осуществлять IVD обслуживание более эффективно. В результате, происходит централизация IVD механически выполняемых работ в больших лабораториях. Однако эта тенденция находится в противоречии с необходимостью интенсивной терапии, терапии в условиях чрезвычайного положения и поликлинического дежурства, где IVD результаты анализа образцов одного больного требуются без промедления. Тенденция к централизации не применима в сельских областях, где расстояния от кабинета врача до центральной больницы являются значительными. Таким образом, кроме тенденции к централизации, существует повышенная потребность в проверке здоровья на местах (РОС) и в распределении IVD анализаторов.
Тенденция к централизации IVD
Тенденция к централизации приводит к тому, что высокопроизводительные IVD-анализаторы устанавливают в центральных лабораториях. Сбор образцов у больных будет происходить либо на местах в отдаленных кабинетах врача, либо в медицинских центрах или в приемной центральной IVD-лаборатории. В первом случае, образцы, взятые у больных, должны быть собраны и транспортированы из отдаленных районов курьером в центральную IVD-лабораторию, в то время как в последнем случае требуется транспортировка самих больных. Очевидно, прямые затраты на проверку оказываются минимальными, когда анализы выполняют партиями в центральной лаборатории с помощью высокопроизводительных анализаторов. Однако структуры здравоохранения обычно фокусируют свое внимание на анализах, требующих прямых затрат и не в состоянии подсчитать косвенные затраты на IVD во всей системе здравоохранения. Часть денег направляют на транспортировку образцов или больных к центральным лабораториям и небольшую часть дают на (i) время ожидания больного, (ii) многочисленные визиты больного и (iii) свободностоящие образцы в неконтролируемых условиях. В незначительном количестве случаев, общая стоимостная структура служб IVD и материально-технического обеспечения принимается во внимание, когда методологию IVD и устройства выбирают власти. Кроме того, изменяемое время ожидания образцов индивидуального больного в неконтролируемых условиях (температура, экспозиция дневного света) неизбежно вызывает изменения в композиции образца, приводящие к ошибочным результатам анализа и ошибочному диагнозу.
Анализы, производимые в пунктах медицинского обслуживания
Платформы для медицинского обслуживания (РОС) предназначены для проверки единичных образцов и характеризуются ограниченным портфелем заказов. Обычно, при проверке единичных образцов в РОС-пунктах используют нестандартные методы анализа, получают качественные или полуколичественные результаты, работают без надзора специалистов в клинической химии и без обращения к базе данных, обычно, РОС-тесты основываются на использовании собранных разовых площадок для анализа. Некоторые из них основаны на иммунохроматографических способах, которые включают в себя хроматографическую среду и зону проверки с иммобилизованным иммунным реагентом. Определение может иметь место визуально или, например, с помощью фотометрического метода, флуорометрического метода, резонанса поверхностного плазмона или электролюминесцентного метода. РОС-тестирование является эффективным. по затратам при ограниченном использовании - 1000-10000 тестов в год. В больших количествах, превышающих 10000 тестов в год, РОС-тесты становятся менее эффективными по затратам вследствие высокой цены на разовый анализ компонента. РОС-устройства являются практичными только в случаях, где немедленно требуются качественные результаты для образцов единичного больного.
Децентрализация средств диагностического тестирования IVD
В противоположность тенденции к централизации, наблюдается явное увеличение необходимости в распределении служб IVD и анализаторов. Под децентрализацией диагностического IVD-тестирования авторы подразумевают осуществление на практике IVD-диагностики с помощью компактных комплексных анализаторов для IVD, которые распределены в помещениях, где образцы берут у больных, таких как местные кабинеты врачей или отдаленные главные медицинские учреждения района. Анализаторы связаны с базой данных центральной лаборатории посредством сети дальней связи. Анализаторы функционируют и за их работой наблюдают специалисты в области клинической химии в центральной лаборатории, таким образом, анализаторы работают подобно химическим датчикам, расположенным близко к больному.
Технология для распределения средств IVD все еще недостаточно развита. До сих пор не имеется какой-либо образцовой и подходящей методологии и коммерчески доступной аппаратуры, которые делали бы децентрализованные анализы IVD-диагностики эффективными по затратам. Это есть одна из главных причин современной тенденции к централизации IVD в промышленно развитых странах. Образцовый анализатор для децентрализованной IVD-диагностики должен выполнять все из наиболее часто требующихся анализов, включающих как клинические анализы, так и чувствительные иммуноанализы, с одним детектором. Для того, чтобы осуществлять эффективные по затратам анализы, анализатор для децентрализованной IVD-диагностики должен выполнять все анализы без разделения, другими словами, без стадий промывки. Такой свободный от разделения формат анализа должен в значительной степени упрощать обращение с жидкостной техникой, таким образом, делая аппарат меньше и менее дорогим для производства. Физический размер анализатора должен быть подходящим для настольного использования. Анализатор должен позволять осуществлять операции в небольших анализируемых объемах. Это вместе с форматом без разделения (без стадий промывки) должно сэкономить реагенты и жидкие расходные материалы, таким образом повышая эффективность по затратам на способ. Работа на анализаторе не должна требовать персонала, обладающего знаниями, необходимыми в клинической лаборатории. Стоимость анализатора не должна быть выше, чем, например, стоимость небольшого анализатора, применяемого в клинической химии, или анализатора, применяемого в иммунологии. Устройство должно включать специализированную программу обработки данных для применений в клинической химии и для количественной оценки анализов и должно осуществлять связь с сетью передачи данных для наблюдения специалистом в центральной лаборатории. Это означает, что анализаторы должны быть распространены в отдаленных местах, где берут образцы, в то время как экспертиза клинической химии, применение результатов анализа, контроль качества и содержания должны быть централизованы. В настоящее время имеется немного коммерчески доступных анализаторов и технологий, которые удовлетворяли бы указанным требованиям. Небольшие анализаторы, применяемые в клинической химии, и анализаторы, применяемые в иммунологии, обычно доступны как отдельные единицы. Некоторые из коммерческих анализаторов, применяемых в клинической химии, осуществляют также иммуноанализы в формате без разделения. Однако указанные иммуноанализы обычно основаны на принципах либо турбидиметрии, либо нефелометрии (анализ агглютинации), которые не позволяют осуществлять высокочувствительные анализы, но ограничиваются анализом компонентов с относительно высокой клинической исходной концентрацией.
Для того чтобы справиться с анализами компонентов с более низкой исходной концентрацией, некоторые производители недавно разработали анализаторы, которые комбинируют клинические анализы с иммунологическими анализами, используя принцип гетерогенного иммуноанализа. Примером такого анализатора является анализатор Adaltis (Adaltis Italia S.p.A, Bologna, Italy), который осуществляет клинический анализ посредством регистрации данных с помощью фотометрии и иммуноанализы посредством регистрации данных с помощью хемилюминесценции. Принцип, на котором основан гетерогенный иммуноанализ, не позволяет, однако, осуществлять анализы без разделения и поэтому не является образцовым для децентрализованной IVD-диагностики. В заключение, рынок сбыта IVD находится в поиске новой инструментальной технологии, которая будет удовлетворять требованиям, обсуждаемым выше.
Одной из самых важных проблем фотометрической методологии является надобность дорогостоящих кювет для испытания. Если анализатор снабжен проточными кюветами, годными к повторному использованию, стоимость кюветы на анализ не составляет проблему. Однако проточные кюветы, годные к повторному использованию, обычно не используют в настоящее время вследствие их чувствительности к анализируемому компоненту и остающемуся реагенту и загрязнению. Таким образом, для большинства коммерческих анализаторов, применяемых в клинической химии, используют разовые фотометрические кюветы. Благодаря природе фотометрической регистрации данных, результат анализа зависит от оптического качества испытуемой кюветы и от длины оптического пути. Указанные требования качества вынуждают создавать высокие промышленные технологии, что делает продукцию кювет дорогостоящей и соответствующие анализы склонными к погрешности вследствие изменений от кюветы к кювете. По этой причине, кюветы для анализов, применяемых в клинической химии, являются и остаются дорогостоящими. Действительно, кювета является главной составляющей затрат на анализы в области клинической химии, которые основаны на фотометрической регистрации данных.
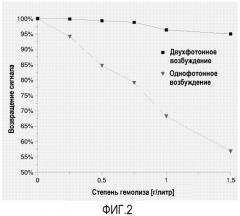
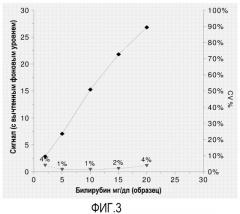
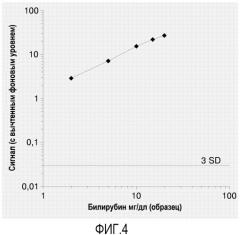
Дополнительная проблема, касающаяся точности фотометрических анализов, связана с помехами, исходящими от матрикса образца. Сыворотка и плазма крови являются типичными образцами, где анализируют метаболиты. Однако образец может содержать мешающие определению матриксные компоненты, такие как билирубин, гемоглобин из гемолизированных эритроцитов, или мутность из-за частиц, липидов. Все указанные субстанции могут сильно мешать фотометрическим измерениям, если образец не разбавлять в большой степени до анализа.
Третья проблема фотометрической регистрации данных относится к анализируемым объемам. Аналитическая чувствительность фотометрической регистрации зависит от длины оптического пути. Чем длиннее оптический путь, тем выше фактор разведения может быть использован. Это повышает диапазон допуска к помехам, создаваемым компонентами матрикса, и точность регистрации. Типичная оптическая длина у коммерческих анализаторов составляет от 5 до 8 мм. В зависимости от геометрии кюветы, эта длина приводит к анализируемому объему 100-300 микролитров. Такая кювета не является оптимальной для иммунологических анализов, поскольку стоимость реагентов для иммуноанализов обычно составляет в десять раз выше стоимости реагентов для клинической химии. Следовательно, анализаторы, применяемые в клинической химии, с фотометрической регистрацией являются относительно крупными по размеру, и для работы с ними требуются скорее большие объемы реагентов и разбавителей. Это свойство повышает затраты на иммуноанализы, и преимуществом маленьких анализируемых объемов нельзя воспользоваться.
Суммируя вышесказанное, авторы заключают, что рынок сбыта средств IVD-диагностики не является достигшим желаемых результатов относительно технологии и анализатора, которые должны способствовать осуществлению обычных клинических анализов и высокочувствительных иммунологических анализов и которые должны выполнять все наиболее часто требующиеся анализы с методологией без разделения в микрообъемах. Кроме того, методология должна сводить к минимуму или исключать необходимость жидкостной обработки, отличной от разбавления и распределения образца. Методология должна способствовать выполнению анализов с высокой точностью путем использования разовых кювет с низкой стоимостью и без необходимости предварительно изготовленных трубок с нанесенным покрытием или другого дорогостоящего компонента анализа. Таким образом, анализатор должен сочетать функции двух больших клинических анализаторов - анализатора для клинической химии и иммуноанализатора, и, таким образом, способствовать осуществлению эффективных по затратам анализов в микрообъемах.
Цель и сущность изобретения
Одной целью настоящего изобретения является разработка улучшенного способа количественной оценки компонентов в области клинической химии, содержащихся в клиническом образце.
Другой целью настоящего изобретения является применение устройства для улучшенной количественной оценки компонентов в области клинической химии, содержащихся в клиническом образце.
Также целью настоящего изобретения является создание улучшенной системы количественной оценки компонентов в области клинической химии, содержащихся в клиническом образце.
Другой целью настоящего изобретения является разработка программы для системы количественной оценки компонентов в области клинической химии, содержащихся в клиническом образце.
Таким образом, настоящее изобретение относится к in vitro диагностическому способу количественной оценки компонента в области клинической химии, содержащегося в клиническом образце, где анализируемый компонент
a) претерпевает химическую реакцию или реакции с реагентом или реагентами, протекающую в одну или нескользко стадий, или последовательность реакций, или
b) катализирует химическую реакцию или реакции, или реакцию в последовательности реакций, реагента или реагентов, в одну или несколько стадий;
в реакционной системе, причем указанная реакция, или реакции, или последовательность реакций приводит к изменению количественно определяемого свойства соединения или соединений указанной реакции, или реакций, или последовательности реакций. Характерным признаком способа является то, что
i) указанная химическая реакция, или реакции, или последовательность реакций приводит к
- образованию соединения с двухфотонной фруоресценцией или
- изменению свойств двухфотонной флуоресценции реакционной системы, включающей в себя по к