Способ коррекции метаболического синдрома у больных деформирующим остеоартрозом
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к эндокринологии, кардиологии и ревматологии, и касается коррекции метаболического синдрома у больных деформирующим остеоартрозом. Для этого в дополнение к общепринятой терапии нестероидными противовоспалительными препаратами и средствами антигипертензивной терапии вводят артрофоон по 1 таблетке 4 раза в сутки сублингвально ежедневно в сочетании с сиофором в дозировке 500 мг 2 раза в сутки на протяжении 12 месяцев. Способ обеспечивает эффективную коррекцию метаболических и суставных нарушений за счет синергетического действия артрофоона и сиофора, вводимых в заявленных дозах и режимах. 7 табл.
Реферат
Изобретение относится к медицине, а именно к эндокринологии, кардиологии и ревматологии, и может быть использовано для уменьшения проявлений метаболического синдрома и выраженности суставного синдрома у больных деформирующим остеоартрозом, а также снижает риски развития сердечно-сосудистых осложнений у этих больных.
Метаболический синдром (МС) представляет собой совокупность гормональных и метаболических нарушений, в основе которых лежит инсулинорезистентность - нарушение инсулин-опосредованной утилизации глюкозы периферическими тканями (Reaven G.V. Role of insulin resistance in human disease. Diabetes. 1988, 37, p.1595-1607).
МС определяется на основании критериев, разработанных комитетом экспертов Национальной образовательной программы по холестерину (NCEP ATPIII, 2001 г.), при наличии у пациента трех и более из следующих признаков (Third report of the National Cholesterol Education Program (NCEP) expert panel on detection, evaluation, and treatment of high blood cholesterol in adults (Adult Treatment Panel III) NIH Publication. 2005, 5, N 01-3670):
- абдоминальное ожирение (окружность талии >102 см у мужчин, >88 см у женщин);
- уровень триглицеридов ≥1.7 ммоль/л;
- уровень холестерина липопротеидов высокой плотности (ХС-ЛПВП) <1 ммоль/л у мужчин, <1,3 ммоль/л у женщин;
- артериальная гипертензия (АД≥130/85 мм рт.ст.);
- показатели глюкозы крови натощак ≥6,1 ммоль/л.
На сегодняшний день имеются различные взгляды на лечение МС. Некоторые ученые считают достаточным воздействие на отдельные компоненты МС, полагая, что при этом можно добиться заметного улучшения за счет компенсаторных изменений в других звеньях патогенеза МС (Чазова И.Е., Мычка В.Б. Профилактика, диагностика и лечении метаболического синдрома. М., 2005, с.48). Важную роль в лечении таких больных отводят немедикаментозным методам лечения: соблюдению низкокалорийной диеты и расширению объема аэробных физических нагрузок (Суркова Е.В. Эффективность применения структурированной программы лечения и обучения в комплексной терапии инсулиннезависимого сахарного диабета. Автореф. дис. канд. мед. наук, М., 1995).
Недостатком данного метода является низкая приверженность пациентов к такому лечению, и, как следствие, такое лечение не всегда оказывает существенное влияние на течение МС. Неэффективной оказывается диетотерапия и при выраженной гиперлипидемии.
Остеоартроз является самой распространенной формой суставной патологии. Кроме того, остеоартроз становится одним из наиболее распространенных заболеваний в современном обществе, поражающим не менее 20% населения земного шара (Насонова В.А., Насонов Е.Л. Рациональная фармакотерапия ревматических заболеваний. М., 2003, с.506). Поздняя диагностика и малоэффективная терапия приводят к снижению качества жизни больных, росту временной нетрудоспособности и ранней инвалидизации лиц трудоспособного возраста. В настоящее время получены данные о взаимосвязи остеоартроза с метаболическими нарушениями (Збровский А.Б., Стажаров М.Ю., Мартемьянов В.Ф. Ферменты пуринового метаболизма в диагностике и дифференциальной диагностике остеоартроза и подагрического артрита. Тер. архив, 2000, 4, с.21-24). Наличие признаков метаболического синдрома у больных остеоартрозом ассоциируется с более тяжелым поражением хряща и рецидивирующими синовитами (Курылева К.В. Остеоартроз и метаболический синдром: клинико-иммунологические взаимосвязи. Автореф. дис. канд. мед. наук. Ярославль, 2005, с.20). На сегодняшний день разработаны методы патогенетического лечения деформирующего остеоартроза, включающие применение нестероидных противовоспалительных лекарственных средств (НПВП), хондропротекторов, локальных методов лечения - местное применение препаратов на мазевой и гелевой основе, внутрисуставное введение препаратов (глюкокортикостероидов, хондропротекторов, НПВП-препаратов, протекторов синовиальной жидкости) (Насонова В.А., Насонов Е.Л. Рациональная фармакотерапия ревматических заболеваний. М., 2003, с.506). Недостатком данных методов лечения является индифферентность используемых лекарственных средств в отношении основных проявлений МС. Кроме того, НПВП-препараты способны задерживать жидкость в организме, тем самым усугубляя течение артериальной гипертензии, являющейся одним из компонентов МС. В это же время какого-либо способа лечения, направленного на коррекцию МС у больных деформирующим остеоартрозом, на сегодняшний день нет. Данные факты диктуют необходимости поиска новых, более эффективных путей коррекции МС в данной группе больных.
Применение метформина для лечения МС в последнее время привлекает все большее внимание ученых всего мира. Препарат, относящийся к бигуанидам, снижающий инсулинорезистентность, традиционно применялся для лечения сахарного диабета. Но на сегодняшний день накопленные данные позволили расширить его клиническую значимость: так, было установлено, что препарат обладает гиполипидемическим и антиатерогенным действием (Bailey C.J., Turner R.C. Metformin. N. Engl. J. Med. 1996, 334 (9), p.574-579. Daskalopoulou S.S., Mikhailidis D.P. Elisaf M. Prevention and treatment of metabolic syndrome. Angiology. 2004, 55 (6), p.589-612. Mamputu J.C., Wiernsperger N.F., Renier G.A. Antiatherogenic properties of metformin: the experimental evidence. Diabetes Metab. 2003, 29 (4 Pt 2), p.6S71-76), снижает риск образования тромбов (Bailey C.J., Turner R.C. Metformin. N. Engl. J. Med. 1996, 334 (9), p.574-579. Kirpichnicov D., McFarlane S.I., Sowers J.R. Metformin: an update. Ann. Intern. Med. 2002, 137 (1), p.25-33). На фоне терапии метформином уменьшается вазоконстрикция, увеличивается активность натриевого насоса и продукция оксида азота, что сопровождается снижением содержания внутриклеточного кальция [Збровский А.Б., Стажаров М.Ю., Мартемьянов В.Ф. Ферменты пуринового метаболизма в диагностике и дифференциальной диагностике остеоартроза и подагрического артрита. Тер. архив, 2000, 4, с.21-24. Chen X.L., Panec К., Rembold C.M. Metformin relaxes rat tail artery by repolarization and resultant decreases in Ca2+influx and intracellular
[Ca2+]. J. Hypertens. 1997, 15 (3), p.269-274. Kim Y.W., Park S.Y., Kim J.Y., Huh J.Y. Metformin restores the penile expression of nitric oxide synthase in high fad-fed obese rats. J. Androl. 2007, 26(3), p.34-38), препарат способен ингибировать высвобождение ИЛ-1 и ИЛ-6 (Isoda К., Young J.L., Zirlik A. et all. Metformin ingibits proinflavvatory responses and nuclear factor-(kappa)B in human vascular wall cells. Arteriocler. Thromb. Vasc. Biol., 2006, 26 (3), p.611-617), улучшать эндотелийзависимую дилатацию (Kim Y.W., Park S.Y., Kim J.Y., Huh J.Y. Metformin restores the penile expression of nitric oxide synthase in high fad-fed obese rats. J. Androl. 2007, 26(3), p.34-38).
Известно, что в основе патогенеза остеоартроза лежат иммунологические изменения, сопровождающиеся гиперпродукцией провоспалительных цитокинов (Коваленко В.Н., Борткевич О.Н. Остеоартроз. К., 2003, с.448), одним из которых является фактор некроза опухоли - α (ФНО-α). Кроме того, известно, что при ожирении, одном из компонентов метаболического синдрома адипоциты висцеральной жировой ткани синтезируют ряд гормонально-активных веществ, одним из которых является ФНО-α (Чазова И.Е., Мычка В.Б. Профилактика, диагностика и лечение метаболического синдрома. М., 2005, с.48), который не только усугубляет течение остеоартроза, индуцирует образование других провоспалительных цитокинов (ИЛ-1, ИЛ-6, ИЛ-8 и др.) (Коваленко В.Н., Борткевич О.Н. Остеоартроз. К., 2003, с.448), но и приводит к уменьшению мышечной массы и атрофии мышц (Арутюнов Г.П. Кахексия у больных с хронической сердечной недостаточностью. Каков масштаб проблемы? Что мы знаем и что нам делать? Сердечная недостаточность, 2001, 2(3), с.101-104). Поэтому представляется обоснованным применение в лечении больных деформирующим остеоартрозом с признаками метаболического синдрома антагонистов ФНО-α. Одним из таких препаратов является артрофоон, представляющий собой аффинно-очищенные антитела к человеческому ФНО-α: смесь гомеопатических разведений С12, С30, С200.
Известно, что для лечения остеоартроза широко применяются нестероидные противовоспалительные препараты, обладающие противовоспалительным и обезболивающим действием. Однако НПВП способны задерживать жидкость в организме, усугубляя течение артериальной гипертензии, являющейся одним из компонентов МС, тем самым усугубляя течение МС в целом. Поэтому применение антагонистов ФНО-α, также обладающих противовоспалительным эффектом, позволит снизить дозировку НПВП у таких больных.
Целью изобретения является коррекция метаболического синдрома у больных деформирующим остеоартрозом путем снижения выраженности абдоминального ожирения и веса в целом, нормализации липидного спектра крови и стабилизации уровня артериального давления.
Для достижения технического результата было проведено исследование, в которое были включены 63 пациента с деформирующим остеоартрозом. Все больные находились на стационарном лечении в ревматологическом отделении МУЗ «Центральная городская клиническая больница города Липецка» в 2006 г. Обследованные больные были подразделены на две группы. В контрольную группу, состоящую из 33 человек, вошли больные деформирующим остеоартрозом с диагностированным метаболическим синдромом (МС) - 25 женщин и 8 мужчин в возрасте от 47 до 76 лет (средний 61,1±1,66 лет), получавшие патогенетическое лечение деформирующего артроза. В основной группе оказалось 30 пациентов с деформирующим артрозом с признаками МС - 28 женщин и 2 мужчин в возрасте от 23 до 80 лет (средний 61,7±2,2 лет), получавших на фоне патогенетической терапии артроза сиофор и артрофоон.
При поступлении в стационар у всех больных, включенных в исследование, был диагностирован МС на основании критериев, разработанных комитетом экспертов Национальной образовательной программы по холестерину (NCEP АТРIII, 2001 г.).
В исследование не включались больные, имевшие противопоказания к назначению сиофора: гипоксические состояния (сердечная или дыхательная недостаточность); декомпенсация функций печени и почек; повышенная чувствительность к метформину или артрофоону. По мере необходимости пациенты получали нестероидные противовоспалительные препараты, антигипертензивную терапию и другие средства симптоматического лечения.
Антропометрические методы исследования включали измерение роста (см), веса (кг), окружностей талии (ОТ) (см) и бедер (ОБ) (см). На основании проведенных измерений подсчитывали индекс массы тела (ИМТ) (кг/м2) по формуле Кетле - отношение веса (кг) к росту (м), возведенному в квадрат, отношение окружности талии к окружности бедер (ОТ/ОБ). Полученные результаты использовались для оценки физического развития пациентов. Так, по величине ИМТ (норма 19-25 кг/м2) диагностировали избыточную массу тела (ИМТ 25,1-29,9 кг/м2) и ожирение. Первая степень - ИМТ: 30-35 кг/м2, вторая степень - ИМТ: 35,1-40 кг/м2, третья степень - ИМТ: 40,1 кг/м2 и выше. По величине ОТ и индексу ОТ/ОБ определяли абдоминальную форму ожирения (ОТ свыше 102 см у мужчин и более 88 см у женщин, индекс ОТ/ОБ свыше 1,0).
Биохимическими методами определяли уровень глюкозы, показателей липидного спектра: холестерина суммарного, холестерина липопротеидов высокой и низкой плотности, индекса атерогенности, триглицеридов; концентрацию креатинина, мочевины мочевой кислоты.
Оценка тяжести суставного синдрома проводилась путем подсчета числа пораженных суставов (суставного счета), числа припухших (дефигурированных) суставов согласно индексу Ричи, оценки интенсивности болевого синдрома в покое и при движении по визуальной аналитической шкале (ВАШ) (мм), вычисления индексов Lequesne и WOMAC.
Стратификацию по степени риска возникновения сердечно-сосудистых заболеваний больных деформирующим остеоартрозом с артериальной гипертензией проводили согласно рекомендациям, разработанным экспертами Всероссийского научного общества кардиологов (2000).
АД определяли в состоянии покоя в положении больного сидя по методу Н.С.Короткова путем трехкратного измерения с 5-минутными интервалами.
Сиофор назначался по 500 мг × 2 р/сут. Артрофоон пациенты получали по 1 таблетке 4 р/сут сублингвально. В контрольной и основной группах отслеживались антропометрические и биохимические показатели на 1-3, 7-10 день стационарного лечения, а также спустя 3, 6 и 12 месяцев. Статистическую обработку полученных данных проводили на персональном компьютере с помощью программы Microsoft Exell пакета Microsoft Office 2003. Подсчитывали величину средней, ошибки средней. Достоверность различий изученных показателей в контрольной и основной группах определяли по критерию Стьюдента.
Среди пациентов контрольной и основной групп большинство результатов биохимических и антропометрических данных до начала исследования достоверно не отличались, однако при обследовании на 1-3 день в основной группе достоверно выше оказался индекс ВАШ при движении и индекс WOMAC, что указывает на большую выраженность суставного синдрома среди пациентов основной группы (табл.1).
| Таблица 1 | |||
| Достоверность различий по выраженности суставного синдрома у пациентов контрольной и основной групп до лечения | |||
| Контрольная группа | Основная группа | р | |
| ВАШ при движении (мм) | 56,5±0,67 | 58,4±0,41 | <0,05 |
| Индекс WOMAC (мм) | 1040,7±17,7 | 1112,7±12,71 | <0,01 |
Все пациенты основной группы получали сиофор по 500 мг × 2р/сут и артрофоон по 1 таблетке 4 р/сут сублингвально ежедневно на протяжении 12 месяцев. Побочных нежелательных эффектов препарата за время исследования среди данной группы пациентов обнаружено не было.
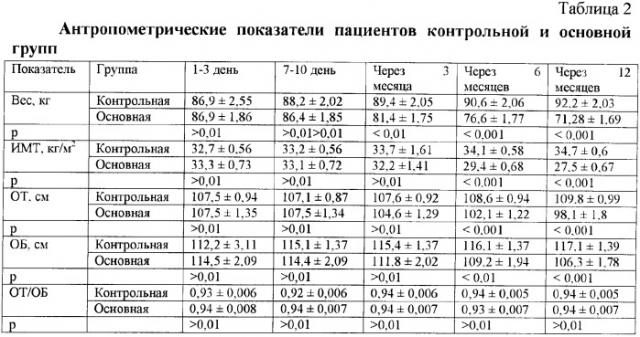
Среди пациентов контрольной группы масса тела на протяжении всего исследования достоверно не менялась, однако наблюдалась тенденция к ее увеличению, и к концу исследования вес увеличился на 6,1%. Индекс массы тела (ИМТ) достоверно вырос к концу исследования на 6,1% (р<0,05). Достоверных изменений показателей окружности талии (ОТ), окружности бедер (ОБ) и отношения ОТ/ОБ в контрольной группе обнаружено не было, хотя также отмечалась тенденция к их увеличению на 2,1%, 4,4% и 1,1% соответственно (табл.2).
В основной группе больных вес тела достоверно уменьшился уже через 3 месяца исследования (p<0,05), а к исходу 12 месяцев составил 82% от первоначального (p<0,001). ИМТ к концу исследования сократился на 17,4% (p<0,001). Достоверное снижение ОТ было обнаружено через 6 месяцев и составило 5% (p<0,01), а к исходу 12 месяцев достигло 8,7% (p<0,01). Показатель ОБ достоверно уменьшился к концу исследования на 7,2% (p<0,01).
При сравнении пациентов обеих групп в популяции больных, получавших сиофор и артрофоон, вес оказался достоверно ниже уже через 3 месяца исследования (p<0,01), а через 6 и 12 месяцев очевидно ниже оказались ИМТ, ОТ, ОБ (p<0,001). Таким образом, среди больных контрольной группы вес в течение исследования нарастал, тогда как в основной группе пациентов нормальной массы тела удалось достичь у 9 пациентов (30%), а количество больных с ожирением снизилось с 27 в начале исследования (90%) до 6 человек (20%) (табл.3).
| Таблица 3 | |||
| Динамика массы тела пациентов контрольной и основной групп в начале и в конце исследования: | |||
| 1-3 день | Через 12 месяцев | ||
| Нормальная масса тела | Контрольная | 0 чел. | 0 чел. |
| Основная | 0 чел. | 9 чел. - 30% | |
| Избыточная масса тела | Контрольная | 2 чел. - 5,7% | 2 чел. - 5,7% |
| Основная | 3 чел. - 10% | 15 чел. - 50% | |
| Ожирение 1 ст. | Контрольная | 18 чел. - 51,4% | 10 чел. - 28,6% |
| Основная | 21 чел. - 70% | 5 чел. - 16,7% | |
| Ожирение 2 ст. | Контрольная | 3 чел. - 8,6% | 8 чел. - 22,9% |
| Основная | 2 чел. - 6,7% | 1 чел. - 3,3% | |
| Ожирение 3 ст. | Контрольная | 1 чел. - 2,9% | 3 чел. - 8,6% |
| Основная | 4 чел. - 13,3% | 0 чел. |
Динамика биохимических показателей
Среди пациентов контрольной группы уровень общего холестерина и триглицеридов на протяжении всего исследования достоверно не менялся, однако отмечалась тенденция к увеличению обоих показателей (за 12 месяцев на 3,5% и 7,3% соответственно). В это же время уровень ХС-ЛПВП достоверно уменьшился на 12,5% (p<0,01), а показатели ХС-ЛПНП (p<0,05) и индекса атерогенности (p<0,001) увеличились на 10,5% и 20,4% соответственно (табл.4).
Среди больных, получавших сиофор и артрофоон, уровень холестерина достоверно уменьшился уже спустя 3 месяца от начала лечения (р<0,01) и к концу исследования достиг 82,3% от первоначального. Уровень триглицеридов оказался достоверно ниже также через 3 месяца (р<0,05), а через 12 месяцев он составил 68,4% от первоначального (р<0,001). Произошло достоверное увеличение ХС-ЛПВП через 3 месяца (р<0,001), к концу достигшее 18,6% от первоначального. Достоверно снизились ХС-ЛПНП и индекс атерогенности (р<0,01 и р<0,001 соответственно) через 3 месяца, достигнув 85,6% и 66% через 12 месяцев (р<0,001).
Достоверных различий в контрольной и основной группах по всем показателям липидного спектра удалось достичь уже через 3 месяца (табл.4), достоверность которых росла на протяжении всего исследования и достигла максимума к концу исследования (р<0,001).
Среди пациентов контрольной группы уровень глюкозы достоверно не менялся, однако к концу исследования увеличился на 9,7%, в основной же группе, напротив, отмечалось снижение данного показателя на 11,7% через 12 месяцев (табл.5). К концу исследования также были обнаружены достоверные различия в двух группах по уровню глюкозы (р<0,01), однако цифры гликемии в обеих группах были в пределах нормальных показателей.
На фоне терапии сиофором уровни креатинина и мочевины существенно не менялись на протяжении всего наблюдения, однако при сравнении показателей креатинина среди пациентов обеих групп в основной группе больных через 6 и 12 месяцев исследования он был достоверно ниже, чем в контрольной (р<0,001 и р<0,01 соответственно). Уровень мочевины в основной группе также оказался ниже через 3, 6 и 12 месяцев (табл.5). Показатель мочевой кислоты в контрольной группе достоверно не изменялся, однако он постоянно рос и к концу исследования составил 108,9% от первоначального. В основной группе концентрация мочевой кислоты падала на протяжении всего исследования и концу исследования снизилась на 29,2%. Достоверные различия в двух группах были достигнуты через 3 месяца (р<0,001) и сохранились до конца исследования.
За время нахождения больных контрольной и основной групп на стационарном лечении и тем и другим была подобрана адекватная гипотензивная терапия. При этом препаратами выбора считались метаболически нейтральные ингибиторы АПФ (Чазова И.Е., Мычка В.Б. Профилактика, диагностика и лечение метаболического синдрома. М., 2005, с.48). Адекватность гипотензивной терапии подтверждает достоверность снижения цифр систолического (САД) и диастолического (ДАД) артериального давления через 7-10 дней от начала терапии в обеих группах (р<0,001). Однако в контрольной группе достоверность снижения САД уменьшилась через 12 месяцев (р<0,05), уровень достоверности ДАД снизился через 6 месяцев (р<0,05), а к концу исследования разница по уровню ДАД до лечения и к исходу 12 месяцев стала недостоверной (табл.6). В это же время среди пациентов, получавших сиофор и артрофоон, достоверно более низкие цифры САД и ДАД сохранились (р<0,001) по отношению к первоначальным через 3, 6 и 12 месяцев, что подтверждает стабильность показателей АД в данной группе на протяжении всего наблюдения.
При сравнении пациентов контрольной и основной групп уровни САД и ДАД оказались достоверно ниже среди больных, получавших сиофор и артрофоон, уже через 3 месяца (р<0,001 и р<0,01 соответственно), и эта разница сохранялась до конца исследования (р<0,001). Через 12 месяцев у 24 пациентов контрольной группы (68,6%) АД оказалось выше заявленного 130/85 мм рт.ст., в то время как в основной группе таких больных не оказалось. Кроме того, 8 пациентов (26,7%), получавших сиофор и артрофоон, смогли снизить среднесуточную потребность в антигипертензивной терапии, а 5 пациентов (20%) вовсе отказались от нее.
Динамика суставного синдрома
Среди пациентов обеих групп чаще всего были поражены коленные суставы (30 пациентов (90,9%) контрольной группы, 27 больных (90%) основной). Дефигурация коленных суставов была выявлена у 19 пациентов (57,5%) контрольной группы и 20 больных (66,7%) основной. В обеих группах поражение суставов нижних конечностей составляло 100%, что косвенно подтверждает негативное влияние избыточной массы тела на течение суставного синдрома. В стационаре всем больным проводилось комплексное патогенетическое лечение деформирующего остеоартроза (регулярный прием нестероидных противовоспалительных препаратов и хондропротекторов, локальные методы лечения - внутрисуставные инъекции, физиотерапевтические методы лечения). В связи с этим на 7-10 день у всех пациентов удалость достичь достоверного снижения выраженности болевого синдрома по всем 4 показателям - индекс ВАШ в покое и при движении, индекс Lequesne, WOMAC (р<0,001). Пациенты, получавшие сиофор и артрофоон, смогли сохранить достоверность снижения выраженности болевого синдрома по всем 4 показателям через 3, 6 и 12 месяцев (табл.7).
В контрольной группе достоверных различий по индексу ВАШ в покое и при движении, индексу Lequesne через 3, 6, 12 месяцев и в начале лечения найдено не было, а индекс WOMAC через 12 месяцев оказался достоверно выше на 6,7% (р<0,01).
Изначально индекс ВАШ при движении и индекс WOMAC в основной группе был достоверно выше по отношению к контрольной (р<0,05 и р<0,01 соответственно), через 7-10 дней существенных различий по данному показателю в двух группах обнаружено не было, а через 3, 6 и 12 месяцев выраженность суставного синдрома по всем 4 показателям в основной группе оказалась достоверно ниже (р<0,001). Существенных различий по количеству болезненных суставов у пациентов получено не было, однако припухших суставов в основной группе на 7-10 день, через 3, 6 и 12 месяцев обнаружено не было, в то время как в контрольной группе число припухших суставов в течение наблюдения статистически достоверно не менялось. Кроме того, в основной группе 14 пациентов (46,7%) на фоне приема сиофора и артрофоона смогли сократить суточный прием НПВП на 50%, а 4 больных (13,3%) полностью отказались от приема НПВП через 3 месяца от начала наблюдения.
Таким образом, предложенный способ коррекции метаболического синдрома у пациентов с деформирующим остеоартрозом путем совместного применения сиофора и артрофоона является эффективным в отношении основных проявлений метаболического синдрома - способен снижать выраженность абдоминального ожирения и веса в целом, нормализует липидный спектр крови, снижая уровни общего холестерина, триглицеридов, холестерина ЛПНП и индекса атерогенности и повышая уровень холестерина ЛПВП, существенно уменьшает концентрацию мочевой кислоты в крови, способствует снижению уровня гликемии и стабилизации уровня артериального давления. Кроме того, на фоне комбинированного применения сиофора и артрофоона часть пациентов смогла сократить среднесуточную дозировку нестероидных противовоспалительных препаратов, часть пациентов отказалась от приема НПВП вовсе, что доказывает эффективность данного метода лечения и в отношении проявлений суставного синдрома. У пациентов на фоне лечения не было обнаружено припухших (дефигурированных) суставов, выраженность болевого синдрома была сопоставима с цифрами, полученными в стационаре. Побочных нежелательных эффектов комбинации данных препаратов за время исследования получено не было. Данные факты подтверждают клиническую эффективность и безопасность применения сиофора и артрофоона для коррекции метаболического синдрома у пациентов деформирующим остеоартрозом.
Способ коррекции метаболического синдрома у больных деформирующим остеоартрозом, включающий терапию нестероидными противовоспалительными препаратами, средствами антигипертензивной терапии, характеризующийся тем, что пациентам назначают препарат антител к человеческому фактору некроза опухоли артрофоон по 1 таблетке 4 раза в сутки сублингвально ежедневно в сочетании с сиофором в дозировке 500 мг 2 раза в сутки на протяжении 12 месяцев.