Способ и набор для лечения и профилактики злокачественных опухолей женской репродуктивной системы с применением 9-оксоакридин-10-уксусной кислоты, и/или ее соли, и/или ее сложного эфира
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к онкологии, и может быть использовано для лечения и профилактики рецидива злокачественных опухолей женской репродуктивной системы. Способы по изобретению включают введение 9-оксоакридин-10-уксусной кислоты (СМА), и/или ее фармацевтически приемлемой соли, и/или ее сложного эфира в комбинации с ингибитором ароматазы. Также изобретение касается применения СМА для получения лекарственного препарата и набора для использования в указанных способах. Изобретение обеспечивает лечение и профилактику рецидивов злокачественных опухолей женской репродуктивной системы опухолей за счет потенцирования эффекта ингибиторов ароматазы и химиотерапевтических агентов под действием СМА. 3 н. и 16 з.п. ф-лы, 9 табл.
Реферат
Изобретение предназначено для использования в медицине и относится к средствам лечения и профилактики рецидива злокачественных опухолей женской репродуктивной системы.
УРОВЕНЬ ТЕХНИКИ
Рак органов женской репродуктивной системы (молочной железы, яичников, эндометрия) является одной из самых крупных проблем в онкологии. Заболеваемость этими новообразованиями в среднем по России составляет 78 на 100 тыс. женщин (30% от общей заболеваемости женщин злокачественными опухолями). В настоящее время практически у 70% больных диагноз рака органов женской репродуктивной системы впервые устанавливается в III-IV стадиях, когда лечение оказывается неэффективным. И, как следствие, от этих опухолей ежегодно только в РФ умирают 442 из 100 тыс. женщин.
Лечение опухолей органов женской репродуктивной системы является одной из проблем современной онкологии.
Несмотря на то, что злокачественные опухоли молочной железы, матки и яичников имеют эстрогеновые рецепторы, через которые передается эстрогенный сигнал, последний (рак яичников) в клинике не поддается в какой-либо заметной степени лечению антиэстрогенами и прогестинами (Но. S.-M., Estrogen, Progesteron and Epithelial Ovarian Cancer, 2003, Reproductive Biology and Endocrinology, 2003, vol.1, p.73).
При этом, по крайней мере, для рака молочной железы, считается, что исчезновение или уменьшение рецепторов эстрогенов приводит к уходу опухоли из-под лечебного контроля и дальнейшему ее прогрессированию.
Не так давно было показано, что эстрогены осуществляют свое стимулирующее рост воздействие не только через активацию эстроген-зависимых генов, но и внегеномными механизмами, в частности, через регуляцию активации протеинкиназ (Urn, K.T., et al., Nongenomic estrogen signaling in estrogen receptor negative breast cancer cell: a role for the angiotensin II receptor AT1, Breast Cancer Research, 2006, vol.8, p R33 (doi: 10.1186/bcr1509).
Одними из средств терапевтического воздействия на эти опухоли являются вещества, ингибирующие фермент ароматазу. Этот фермент отвечает за процесс конверсии андростендиона и тестостерона в эстрогены (эстрон и эстрадиол) в некоторых периферических и опухолевых тканях, т.е. за процесс внегонадного синтеза эстрогенов, Эстрогены же оказывают стимулирующее (митотическое) действие на клетки злокачественных опухолей репродуктивной системы. Ароматаза (точнее, специфический энзимный комплекс цитохрома Р-450, называемый ароматазой) является ключевым ферментом биосинтеза эстрогенов. Ароматаза присутствует в яичниках женщин в пременопаузе, в плаценте беременных женщин, в жировой ткани женщин в постменопаузе, в тканях злокачественных опухолей женской репродуктивной системы: молочной железы, матки, яичников. Ароматаза связана с эндоплазматическим ретикуломом и состоит из двух основных белков. Один белок является цитохромом Р-450 (Р450аром). Он конвертирует C19 - стероиды (андрогены) в C18 - стероиды (эстрогены), содержащие фенольное кольцо А. Второй белок является НАДФ - зависимой цитохром Р-450 редуктазой, которая переносит восстановленные энергетические эквиваленты к цитохрому Р-450аром.
Снижение активности ароматазы приводит к уменьшению синтеза эстрогенов и, как следствие, снижению эстрогенного (стимулирующего) воздействия на клетки опухоли. Это обусловливает значительную терапевтическую эффективность веществ, ингибирующих ароматазу (Таблица А).
| Таблица А | ||
| Ингибиторы ароматазы, используемые в клинической практике | ||
| Стероидные | Нестероидные | |
| Первое поколение | Форместан (4-гидроксиандростендион) | Аминоглютетимид |
| Второе поколение | Экземестан | Роглетимид |
| Фадрозол | ||
| Третье поколение | Ворозол | |
| Летрозол | ||
| Анастрозол |
По механизму действия ингибиторы ароматазы (ИА) делятся на конкурентные, вызывающие временную блокаду фермента, и "суицидные", необратимо связывающиеся с активными участками ароматазы. Необратимые ингибиторы имеют исключительно стероидную природу (они являются химическими структурными аналогами андростендиона) и необратимо связываются с ферментом, полностью нарушая его активность как биокатализатора. Их также называют инактиваторами ароматазы. После прекращения воздействия таким ингибитором требуется определенное время для того, чтобы фермент синтезировался в тканях вновь. Конкурентные ИА могут по химической структуре как стероидными, так и нестероидными. Нестероидные ингибиторы относятся к пиперидионам (аминоглютетимид, роглетимид), имидазолам (лиарозол, фадрозол), триазолам (анастрозол, летрозол, ворозол) и др. нестероидным соединениям. Они обратимо взаимодействуют с цитохромной Р-450-частью ферментной системы. Нестероидные ингибиторы ароматазы могут обладать как селективным (действуют только на фермент ароматазу), так и неселективным действием (угнетают синтез других гормонов, в частности глюко- и минералокортикоидов). Из стероидных ИА известны, например, пломестан, форместан, экземестан.
СТЕРОИДНЫЕ ИНГИБИТОРЫ АРОМАТАЗЫ
Стероидные ингибиторы ароматазы
Из нестероидных ИА известны, например, аминоглютетимид, фадрозол, анастрозол, летрозол, ворозол.
НЕСТЕРОИДНЫЕ ИНГИБИТОРЫ АРОМАТАЗЫ
Нестероидные ингибиторы ароматазы
Указанные ИА связываются с каталитической частью фермента.
Так, например, анастрозол (2,2'-[5-(1Н-1,2,4-триазол-1-илметил)-1,3-фенилен]бис(2-метилпропионитрил) является конкурентным ингибитором ароматазы и вызывает только временную блокаду данного фермента.
Другой нестероидный ингибитор ароматазы летрозол ((4,4'-[(1Н-1,2,4-триазол-1-ил)-метилен]бис-бензонитрил)), в системе in vitro по способности ингибировать ароматазу в 200 раз активнее аминоглютетимида и в 19 раз более активен, чем аримидекс.
Ворозол, точнее, (+)-ворозол, или (+)-6-((4-хлорофенил)-1Н-1,2,4-триазол-1-илметил)-1-метил-1Н-бензотриазол, является (+)-энантиомером ингибитора ароматазы R76713.
Экземестан (6-метиленандроста-1,4-диен-3,17-дион), например, является структурным аналогом андростендиона и по механизму действия является стероидным инактиватором ароматазы "суицидного" типа, поскольку, связываясь с активным участком фермента, необратимо инактивирует его.
Применение ингибиторов ароматазы (в отличие от прогестинов и антиэстрогенов) целесообразно только у женщин с выключенной функцией яичников, поскольку снижение эстрогенов, происходящих из периферических тканей, будет автоматически вызывать компенсаторное увеличение гонадного (яичникового) синтеза эстрогенов.
В то же время все эти классы препаратов (антиэстрогены и прогестины) широко применяются в качестве адъювантного лечения, а также в случаях распространенного рака молочной железы и тела матки, не подлежащего радикальному хирургическому лечению. Как антиэстрогены, так и прогестины не оказывают влияния на внутриопухолевую продукцию эстрогенов, которую эффективно подавляют ингибиторы ароматазы. В настоящее время антиэстрогены и ингибиторы ароматазы назначаются как в качестве адъювантной терапии операбельного рака молочной железы, так и в качестве терапии неоперабельных распространенных опухолей только пациентам с эстроген-рецептор-позитивным статусом опухоли, поскольку полагается, что чувствительность к гормональному воздействию прямо связана с наличием рецепторов эстрогенов в опухоли.
У больных злокачественной опухолью эндометрия введение ингибитора ароматазы летрозола приводило к определенному терапевтическому эффекту. При этом клинический эффект (уменьшение объема опухоли) никак не коррелировал с изначальным уровнем рецепторов и их динамикой в процессе лечения (Berstein, L, et al., Neoadjuvant therapy of endometrial cancer with aromatase inhibitor letrozole: endocrine and clinical effect. European Journal of Obstetric & Ginecology and Reproductive Biology, 2002, vol. 105, pp.161-165).
Также известны неудачные попытки лечения рецидивирующего или распространенного рака эндометрия с помощью ингибитора ароматазы (летрозола): всего 9.4% ответа на терапию, несмотря на то, что у 86% пациенток опухоли были эстроген-рецептор-позитивны, и у 86% процентов прогестинрецептор-позитивны (Ма, В.В., The activity of letrozole in patient endometrial cancer and correlation with biological markers - a study of the National Cancer Institute of Canada Ckinical Trial Group, International Journal of Gynecology Cancer, 2004, vol. 14, pp.650-658). При этом, как известно, прогестины достаточно эффективны у таких больных. Напротив, попытки лечения стромальной саркомы матки ингибиторами ароматазы, такими, как амидоглютетимид (Spano, J.P., Long-term survival of patients given hormonal therapy for metastatic endometrial stromal sarcoma, Medical Oncology, 2003, vol.20, pp.87-93), или летрозол (Leunen, M. et al., Low grade endometrial stromal sarcoma treated with the aromatase inhibitor letrosole, Gynecologic Oncololgy, 2004, vol. 95, pp.769-771), имели значительный успех.
Также, для ингибиторов ароматазы показано, что развитие резистентности эстрогензависимой опухоли к одному ингибитору ароматазы не приводит автоматически к резистентности к другому ингибитору (Carlson R.W., Sequencing of endocrine therapies in breast cancer - integration of recent data, Breast Cancer Research and Treatment, 2002, vol. 75, Supplement 1, pp.S27-32). Хорошо известно, что назначение ингибиторов ароматазы эффективно, если опухоль не отвечает на антиэстрогены или прогестины.
В тканевой культуре (in vitro) рака яичника, рака эндометрия и рака молочной железы человека показано, что ингибиторы ароматазы способны уменьшать пролиферативную активность клеток вне зависимости от рецепторного статуса и/или активности ароматазы в опухолевой ткани (Sasano, H. et.al., Effect of aromatase inhibitors on the pathobiology of human breast, endometrial and ovarian carcinoma, Endocrine-related cancer, 1999, vol.6, p.197-204).
В клинике при лечении распространенных опухолей яичника не было выявлено связи между ответом на терапию ингибитором ароматазы (летрозолом) и рецепторными особенностями опухоли (Papadimitriou, C.A. et al., Hormonal therapy with letrozole for relapsed epithelial ovarian cancer. Long-term results of a phase II study. Oncology, 2004; vol.66, pp.112-117).
Также было показано, что предварительные инкубации эстроген-позитивных клеток с ингибитором ароматазы форместаном увеличивает чувствительность опухолевых клеток к антитело-зависимому клеточному ответу, что приводит к их ускоренному цитолизу (Braun D.P. et al, Aromatase inhibitors increase the sensitivity of human tumor cells to monocyte-mediated, antibody-dependent cellular cytotoxicity, The American Journal of Surgery, 2005, vol.190, pp.570-571).
Таким образом, молекулярные механизмы, обеспечивающие чувствительность злокачественной опухоли к антиэстрогенам и прогестинам, с одной стороны, и ингибиторам ароматазы, с другой, совершенно различны.
Как известно, фактор NF-kB относится к числу специфических цитоплазменных белков, активирующихся в эукариотических клетках (в том числе, и малигнизированных) в ответ на неблагоприятные воздействия, в частности, химиопрепараты и радиацию. При этом неактивная форма этого белка находится в комплексе со своим ингибитором. При активации (фосфорилировании специфическими киназами) комплекс распадается и белок NF-kB транслоцируется в ядро, запуская работу генов-мишеней. Активация этих генов ассоциирована с пролиферацией, ангиогенезом, суппрессией апоптоза, что является ключевым звеном в развитии устойчивости опухолевых клеток к химиотерапии. Вещества, ингибирующие активность фактора NF-kB, могут оказывать свое ингибирующее действие на любой ступени активации этого фактора: связывать фактор NF-kB; ингибировать транслокацию фактора NF-kB в ядро; ингибировать регуляцию фактора NF-kB транскрипции YY1; ингибировать промоцию апоптоза, ингибировать экспрессию генов, зависимых от фактора NF-kB; ингибировать образование комплекса NF-kB с другими факторами, регулирующими активность NF-kB. Поиск синтетических ингибиторов NF-kB, в том числе среди известных науке веществ ведется широким фронтом. Так, например, способностью ингибировать NF-kB обладает дигидроксиметилэпоксихиномицин (DHMEQ) (структурный аналог антибиотика эпоксихиномицина-С и его производных (заявка WO 2006/060819)), куркумин и его производные (заявка WO 03/090681), а также другие соединения.
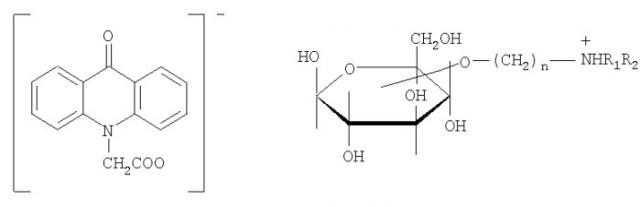
9-оксоакридин-10-уксусная кислота представляет собой вещество, имеющее структурную формулу
По другой номенклатуре она также может быть названа как 10-(карбоксиметил)-9(10H)акридон, в базе CAS имеет номер 38609-97-1, международное непатентованное название - криданимод (cridanimod).
Следует указать, что под аббревиатурой СМА в контексте данной заявки, если отдельно не указано иного, или это не следует из контекста, понимается как сама 9-оксоакридин-10-уксусная кислота, так и ее фармацевтически приемлемые соли и ее сложные эфиры.
Производные 9-оксоакридин-10-уксусной кислоты были предложены в 1971 году сотрудниками компании Хоффман Ла Рош Инк в качестве мощных противовирусных средств (патент США №3,681,360).
В настоящее время препараты на основе 9-оксоакридин-10-уксусной кислоты и ее фармацевтически приемлемых солей предлагаются для лечения и профилактики широкого круга заболеваний. В частности, известны такие ее свойства как иммуномодулирующие, интерфероногенные, антибактериальные, антипромоторные и радиопротективные.
Хотя известно, что 9-оксоакридин-10-уксусная кислота не обладает какой-либо значительной собственной цитостатической активностью, в опытах на животных установлено, что торможение роста опухоли с помощью обычной для таких случаев гормонотерапии в присутствии 9-оксоакридин-10-уксусной кислоты и/или ее солей и соединений является более эффективным, чем в ее отсутствие.
Таким образом, остается актуальной задача повышения эффективности лечения опухолей женской репродуктивной системы.
Задачей настоящего изобретения является разработка нового эффективного способа лечения опухолей органов женской репродуктивной системы, то есть опухолей, происходящих из эстроген-зависимых тканей.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение основано на неожиданном установлении того факта, что СМА, ее соли и/или ее сложные эфиры, резко увеличивают способность ингибиторов ароматазы угнетать активность фермента ароматазы, с одной стороны, а с другой стороны СМА, ее соли и/или ее сложные эфиры, способны угнетать активность фактора NF-kB, активация которого, как известно, не только защищает опухолевую клетку от неблагоприятных воздействий, но приводит, кроме прочего, к активации того же фермента ароматазы. Кроме того, неожиданно оказалось, что совместное воздействие СМА, и/или ее солей и/или ее сложных эфиров, с одной стороны, и ингибиторов ароматазы, с другой стороны, на злокачественные опухоли женской репродуктивной системы приводит подавлению пролиферации опухолевых клеток даже в том случае, когда внутриопухолевый синтез эстрогенных стероидов с участием ароматазы незначителен, отсутствует или не оказывает влияния на рост опухоли. При раздельном применении данных классов веществ (СМА отдельно, ИА отдельно) такого эффекта не наблюдалось.
Кроме того, как было выявлено авторами в процессе работы над изобретением, указанный эффект СМА продолжается длительное время даже после того, как прекращена экспозиция СМА, то есть наблюдается эффект «сенситизации» опухоли к последующему воздействию ИА.
За счет этих вновь выявленных свойств СМА, как было установлено в процессе работы над изобретением, СМА резко усиливает способность ингибиторов ароматазы снижать пролиферативную активность опухолей человека, происходящих из эстроген-зависимых тканей, в частности злокачественных опухолей органов женской репродуктивной системы.
Таким образом, авторами данного изобретения обнаружено новое свойство 9-оксоакридин-10-уксусной кислоты, которое открывает новую область для применения 9-оксоакридин-10-уксусной кислоты, ее фармацевтически приемлемых солей и/или ее сложных эфиров. А именно, при лечении злокачественных опухолей, происходящих из эстроген-зависимых тканей с помощью ингибиторов ароматазы, 9-оксоакридин-10-уксусная кислота и ее фармацевтически приемлемые соли и ее сложные эфиры позволяют резко усилить противоопухолевый эффект ингибиторов ароматазы.
Также неожиданно обнаружено, что если 9-оксоакридин-10-уксусную кислоту, и/или ее фармацевтически приемлемые соли, и/или ее сложные эфиры вводят до начала гормональной терапии, то это позволяет осуществить сенситизацию опухоли к последующему воздействию ингибиторов ароматазы, причем этот эффект сохраняется и после прекращения введения 9-оксоакридин-10-уксусной кислоты или ее производного.
Известно, что 9-оксоакридин-10-уксусная кислота обладает интерферон-индуцирующими свойствами. Однако авторами данного изобретения установлено, что в отношении торможения роста опухоли 9-оксоакридин-10-уксусная кислота продолжает проявлять дозо-зависимый эффект в дозировках, превышающих максимальную интерферон-индуцирующую дозу. Под максимальной интерферон-индуцирующей дозой в данном случае понимается порог дозы 9-оксоакридин-10-уксусной кислоты, при превышении которого дальнейшего увеличения уровня тканевых и сывороточных интерферонов не происходит. Более того, в тех ситуациях, когда система выброса интерферонов уже истощена (это происходит при повторных введениях любого индуктора интерферонов, в том числе СМА), 9-оксоакридин-10-уксусная кислота, ее фармацевтически приемлемые соли и/или ее сложные эфиры продолжают оказывать дозо-зависимое влияние на торможение роста опухоли в комбинации с ингибитором ароматазы, резко усиливая его эффективность.
Термин «фармацевтически приемлемая соль» относится к солям, которые сохраняют вышеописанные свойства 9-оксоакридин-10-уксусной кислоты, и которые не являются биологически или каким-либо иным образом неприемлемыми. Фармацевтически приемлемые соли могут быть получены воздействием неорганических или органических оснований на ту или иную неорганическую или органическую (к коим относится 9-оксоакридин-10-уксусная кислота)кислоту.
Соли с неорганическими основаниями включают в себя, например, соли натрия, калия, лития, аммония, кальция и магния.
Соли с органическими основаниями без ограничения включают: соли первичных, вторичных, третичных и четвертичных аминов, такие как амины, замещенные одним, двумя или тремя заместителями такими, как: алкил, алкенил, циклоалкил, циклоалкенил, арил, гетероарил или гетероциклил, которые в свою очередь могут быть замещенными; смешанные ди- и три-амины, где по меньшей мере один из заместителей на амине отличается от других заместителей и выбран из группы, включающей в себя алкил, замещенный алкил, алкенил, замещенный алкенил, циклоалкил, замещенный циклоалкил, циклоалкенил, замещенный циклоалкенил, арил, гетероарил, гетероциклил и т.п. Сюда также включают амины, у которых два или три заместителя вместе с атомом азота, к которому они присоединены, образуют гетероциклил или гетероарил.
Конкретные примеры подходящих аминов включают, в частности, изопропиламин, триметиламин, диэтиламин, три(изопропил)амин, три(н-пропил)амин, этаноламин, 2-диметиламиноэтанол, трометамин, лизин, аргинин, гистидин, кофеин, прокаин, холин, бетаин, этилендиамин, глюкозамин, N-алкилглюкамин, теобромин, пурины, пиперазин, пиперидин, морфолин, N-этилпиперидин и тому подобное.
Примером соли 9-оксоакридин-10-уксусной кислоты со щелочным металлом является натриевая соль:
Примером соли с аминосоединением является соль с 1-дезокси-1-(метиламино)-О-глюцитолом (меглюмином):
Другими примерами солей с различными сложными четвертичными аммониевыми основаниями являются соли с амино-замещенными углеводами, например с 2-дезокси-2-амино(или 2-алкиламино)-D-глюкозой, где R представляет собой Н или низший алкил:
с 1-дезокси-1-метиламино-D-глюкозой:
а также соли с различными сложными эфирами углеводов и алифатических аминоспиртов, например
где R1, R2 представляют собой независимо алкил, арил, гетерил.
Примерами подходящих катионов также являются, в частности катионы: 3-O-(N,N-диметиламино-н-пропил)-1,2:5,6-ди-O-изопропилиден-α,D-глюкофуранозы:
а также катионы:
1-дезокси-1-(этиламино)-D-глюцитола (то есть эглюмина),
1-дезокси-1-(пропиламино)-D-глюцитола,
1-дезокси-1-(бутиламино)-D-глюцитола,
1-дезокси-1-(метиламино)-L-глюцитола,
1-дезокси-1-(этиламино)-L-глюцитола,
1-дезокси-1-(пропиламино)-L-глюцитола и
1-дезокси-1-(бутиламино)-L-глюцитола.
Под сложными эфирами 9-оксоакридин-10-уксусной кислоты подразумевают соединения, образованные в результате замещения атома водорода в ОН-группе кислоты органической группой R.
Примерам подходящих сложных эфиров являются сложные эфиры 9-оксоакридин-10-уксусной кислоты с низшими алкилами (а именно с (C1-С12)алкилами, в частности этиловый, пропиловый, изопропиловый, бутиловый и амиловый эфиры), а также с холином и другими липофильными спиртами.
После быстрого проникновения через биологические мембраны эти соединения далее легко гидролизуются "in vivo" до свободной 9-оксоакридин-10-уксусной кислоты.
Применяемые согласно настоящему изобретению фармацевтические соли 9-оксоакридин-10-уксусной кислоты можно использовать в разовой дозе от 0.5 до 100 мг/кг веса тела (в пересчете на остаток 9-оксоакридин-10-уксусной кислоты), предпочтительно от 4 до 20 мг/кг веса тела. При этом суточная доза может варьировать от 2 до 1000 мг/кг, предпочтительно от 2 до 200 мг/кг. Конкретная доза препарата может быть рассчитана специалистом на основе описания изобретения и приведенных примеров.
Подразумевается, что используемые количества 9-оксоакридин-10-уксусной кислоты или ее фармацевтически приемлемой соли или ее сложного эфира и ингибитора ароматазы являются синергетически эффективными.
Под «эстроген-зависимыми тканями» в контексте данной заявки подразумеваются ткани, рост которых, в том числе за счет пролиферации и/или гипертрофии клеток, стимулируется целиком или в основном эстрогенами. К таким тканям, в частности, относятся ткани органов женской репродуктивной системы:
ткани молочной железы, ткани матки, ткани яичников. Соответственно, к злокачественным опухолям, происходящим из этих тканей, в контексте данной заявки относятся: рак молочной железы, злокачественные опухоли эндометрия (как эпителиальные, так и стромальные), рак яичника.
Новые обнаруженные свойства СМА позволили предложить способ лечения злокачественных опухолей органов женской репродуктивной системы путем одновременного или последовательного воздействия на опухоль СМА и ИА, что приводит к резкому усилению эффективности противоопухолевого лечения в клинике.
Вновь выявленные свойства СМА, ее солей и/или ее сложных эфиров, неизвестные авторам из доступных источников информации, позволили предложить их использование в комбинации с ингибиторами ароматазы при лечении опухолей органов женской репродуктивной системы. Авторам не известны из доступных источников информации какие-либо попытки совместного или последовательного применения ингибиторов ароматазы и препаратов СМА в клинике для лечения новообразований органов женской репродуктивной системы, в том числе и в адъювантом или в неоадъювантном режимах.
В процессе работы над изобретением авторами было выявлено, что 9-оксоакридин-10-уксусная кислота и ее фармацевтически приемлемые соли и/или ее сложные эфиры не только способны усиливать эффект ингибиторов ароматазы. Также неожиданно оказалось, что 9-оксоакридин-10-уксусная кислота и/или ее фармацевтически приемлемые соли и/или ее сложные эфиры в комбинации с ингибиторами ароматазы способны значительно усиливать эффект противоопухолевого действия известных химиотерапевтических агентов разных классов, применяемых при лечении злокачественных опухолей органов женской репродуктивной системы.
Если на различных этапах такого комбинированного лечения (СМА+ИА) дополнительно начинали проводить химиотерапию или химиотерапию применяли после такой комбинации, то она оказывала гораздо более сильное ингибирующее воздействие на рост опухоли. Такое потенцирование противоопухолевого эффекта наблюдали, в том числе, и при терапии гормонорефрактерного (гормонорезистентного) варианта злокачественной опухоли.
Такой сенситизирующий эффект при совместной экспозиции ингибиторов ароматазы и 9-оксоакридин-10-уксусной кислоты или ее производных в отношении цитостатических химиопрепаратов не достигался при экспозиции опухолевых клеток к 9-оксоакридин-10-уксусной кислоте или ингибиторам ароматазы в отдельности. Интересно, что эффект «сенситизации» сохранялся и после прекращения совместного действия 9-оксоакридин-10-уксусной кислоты (или ее фармацевтически приемлемых солей или ее сложных эфиров) и гормональных препаратов.
Соответственно, в одном своем аспекте настоящее изобретение предлагает способ лечения злокачественных опухолей органов женской репродуктивной системы, происходящих из эстроген-зависимых тканей, при котором нуждающейся в этом пациентке вводят эффективное количество соединения, выбранного из группы, включающей в себя 9-оксоакридин-10-уксусную кислоту и/или ее фармацевтически приемлемую соль и/или ее сложный эфир, и осуществляют воздействие, направленное на снижение активности фермента ароматазы, в частности, путем введения ингибитора (ингибиторов) ароматазы.
Еще в одном своем аспекте настоящее изобретение предлагает способ профилактики рецидива злокачественных опухолей органов женской репродуктивной системы, происходящих из эстроген-зависимых тканей, при котором нуждающейся в этом пациентке вводят эффективное количество соединения, выбранного из группы, включающей в себя 9-оксоакридин-10-уксусную кислоту и/или ее фармацевтически приемлемую соль и/или ее сложный эфир, и осуществляют воздействие, направленное на снижение активности фермента ароматазы, в частности, путем введения ингибитора (ингибиторов) ароматазы.
При этом снижение риска развития рецидива (то есть профилактика возникновения повторной опухоли) осуществляется согласно изобретению в отношении опухоли, регресс или элиминация которой из организма достигнуты любым путем, например в результате хирургического вмешательства или в результате химиотерапии, гормонотерапии, радиотерапии, биотерапии или с помощью любого сочетания указанных видов лечения.
Один из предпочтительных вариантов реализации настоящего изобретения представляет собой способ лечения и/или профилактики злокачественных опухолей женской репродуктивной системы и/или их рецидивов посредством введения 9-оксоакридин-10-уксусной кислоты и/или ее фармацевтически приемлемой соли и/или ее сложного эфира, отличающийся тем, что 9-оксоакридин-10-уксусную кислоту и/или ее соль и/или ее сложный эфир вводят в комбинации с ингибитором ароматазы.
В другом своем аспекте настоящее изобретение обеспечивает способ усиления чувствительности злокачественных опухолей, происходящих из эстроген-зависимых тканей, к ингибитору (ингибиторам) ароматазы, при котором вводят эффективное количество соединения, выбранного из группы, включающей в себя 9-оксоакридин-10-уксусную кислоту и/или ее фармацевтически приемлемую соль и/или ее сложный эфир.
Термин "лечить" или "лечение" в данном описании определен как применение или введение (назначение) состава субъекту (например, пациенту или человеку с риском возникновения патологии, например, страдающему злокачественной опухолью или имеющему риск ее возникновения). В целом, лечение обеспечивают субъекту, имеющему патологию (например, злокачественную опухоль, как описано в данной заявке), симптом патологии, повышенный риск развития патологии, или предрасположенность к патологии, с целью вылечить, исцелить, облегчить, уменьшить, изменить, исправить, повысить качество, чтобы улучшить течение или повлиять на патологию, признаки патологии или предрасположенность к патологии. Лечение может включать назначение или применение одного агента в комбинации со вторым агентом. Термин "в комбинации" в этом контексте означает, что различные агенты (а именно СМА и ИА) применяют одновременно, или последовательно. Если агенты применяют последовательно, в момент начала применения второго агента, в области воздействия в эффективных концентрациях предпочтительно обнаруживается первый из двух агентов или его фармакодинамическое действие (фармакологический эффект) еще сохраняется к моменту применения второго агента.
Согласно данному изобретению предпочтительные соли 9-оксоакридин-10-уксусной кислоты выбраны из группы, включающей в себя натриевую, меглюминовую, эглюминовую соли и соль с 3-O-(N,N-диметиламино-н-пропил)-1,2:5,6-ди-O-изопропилиден-α,D-глюкофуранозой.
Согласно данному изобретению предпочтительные сложные эфиры 9-оксоакридин-10-уксусной кислоты выбраны из группы, включающей в себя этиловый, пропиловый, бутиловый, изопропиловый, амиловый эфиры.
Согласно данному изобретению предпочтительно, 9-оксоакридин-10-уксусную кислоту и/или ее соли или ее сложные эфиры вводят каждый день или через день в течение от 30 дней до 180 дней в суточной дозе от 4 до 300 мг/кг веса включительно (считая на остаток 9-оксоакридин-10-уксусной кислоты).
При реализации настоящего изобретения может применяться как стероидный, так и нестероидный ингибитор ароматазы.
Предпочтительно, ингибитор ароматазы выбран из группы, включающей в себя: форместан, экземестан, аминоглютетимид, фадрозол, анастрозол, летрозол, ворозол.
Еще в одном способе реализации настоящего изобретения в организм больного дополнительно вводят одно или несколько химиотерапевтических средств. При этом, как оказалось, эффективность такого комбинированного воздействия (ИА, СМА, химиотерапевтическое средство (или средства)) не зависит от рецепторного статуса опухоли и/или активности ароматазы в ткани опухоли.
В качестве таких химиотерапевтических средств согласно настоящему изобретению можно применять, например, алкилирующие агенты, циклофосфамид, хлорамбуцил, цисплатин, карбоплатин, бусульфан, мелфалан, стрептозоцин, триэтиленмеламин, митомицин С, дакарбазин, прокарбазин, и тому подобные; антиметаболиты, например, метотрексат, этопозид, 6-меркаптопурин, 6-тиогуанин, цитарабин, 5-фторурацил, капацетабин, флюдарабин, и тому подобные; противоопухолевые антибиотики, например, актиномицин Д, доксорубицин, эпирубицин, даунорубицин, блеомицин, митрамицин и тому подобные; алкалоиды барвинка, такие как винкристин и винбластин; таксаны (таксоиды), например, паклитаксел и доцетаксел и их производные; глюкокортикоиды, например, преднизон; нитрозомочевина и ее производные, например, ломустин, кармустин, и им подобные; противоопухолевые ферменты, например аспарагиназа и ее пегилированные формы или ее формы, конъюгированные с другими небелковыми полимерами; ингибиторы топоизомеразы, например, топотекан и иринотекан, и им подобные; ингибиторы полимеризации тубулина микротрубочек, например, винорельбин.
Предпочтительными химиотерапевтическими средствами согласно изобретению являются средства, выбранные из группы, включающей: алкилирующие агенты, антиметаболиты; агенты, нарушающие сборку микротрубочек; противоопухолевые антибиотики, включая антрациклиновые антибиотики; препараты платины; ингибиторы топоизомеразы, глюкокортикоиды.
Также, в способе согласно настоящему изобретению дополнительно к совместному или последовательному введению СМА и ИА можно вводить:
- антагонисты эстрогенных рецепторов, то есть антиэстрогенов, например тамоксифен и торемифен;
- агонисты прогестиновых рецепторов, то есть прогестинов, например медроксипрогестерона ацетат, мегестрола ацетат, гидроксипрогестерона капронат:
- антагонисты ЛГРГ (антагонисты релизинг-гормона лютеинизирующего гормона, например, такие как гозерелин, бузерелин), которые можно применять для лечения злокачественных опухолей органов женской репродуктивной системы,
- терапевтические антитела против рецепторов факторов роста, например препараты трастузумаб, который представляет собой моноклональные антитела против HER2/neu рецепторов эпидермального ростового фактора человека,
или комбинацию средств указанных классов.
В качестве вариантов реализации способа лечения согласно настоящему изобретению 9-оксоакридин-10-уксусную кислоту, ее соль /или ее сложный эфир:
- вводят курсом перед назначением ИА,
- либо одновременно с введением ИА,
- либо начинают введение 9-оксоакридин-10-уксусную кислоту и/или ее соли, и/или ее сложного эфира до начала введения ИА и продолжают во время курса введения ИА.
Еще в одном своем аспекте настоящее изобретение относится к применению 9-оксоакридин-10-уксусной кислоты и/или ее соли, и/или ее сложного эфира для получения лекарственного препарата для лечения злокачественных опухолей женской репродуктивной системы в комбинации с введением ингибитора ароматазы.
Наряду с применением 9-оксоакридин-10-уксусной кислоты и/или ее соли, и/или ее сложного эфира для получения такого лекарственного препарата в качестве других компонентов можно применять различные наполнители, вспомогательные вещества, в том числе солюбилизаторы, например аминосахара (или аминоспирты) и их сложные эфиры, циклодекстраны, например гидроксипропил-β-циклодекстрин, эмульгаторы, например, твины; загустители; светофильтры; например метиленовый синий; комплексообразователи; стабилизаторы, например трилон Б; пролонгаторы, например микроцеллюлоза или поливинилпирролидон; корригенты, например сорбит; красители; консерванты, а также буферные системы на основе неорганических и органических веществ, обеспечивающие поддержание определенного рН. Такой препарат может быть приготовлен в виде раствора для парентерального введения, или таблеток, или таблеток, покрытых кишечно-растворимым покрытием, или порошка или гранулята, в капсулах или пакетах, или в виде суппозиториев, или в виде аэрозоля или раствора для ингаляций, или в виде пролонгированной формы с замедленным высвобождением активного вещества, например в виде пролонгированной формы для перорального введения или полостного введения на основе твердой или полутвердой полимерной матрицы.
Согласно настоящему изобретению предпочтительные соли 9-оксоакридин-10-уксусной кислоты для получения лекарственного препарата для лечения злокачественных опухолей женской репродуктивной системы в комбинации с введением ингибитора ароматазы выбирают из группы, включающей натриевую, меглюминовую, эглюминовую и соль с 3-O-(N,N-диметиламино-н-пропил)-1,2:5,6-ди-O-изопропилиден-α,D-глюкофуранозой.
Далее согласно изобретению предлагается набор для лечения злокачественных опухолей женской репродуктивной системы, включающий 9-оксоакридин-10-уксусную кислоту, и/или ее соль, и/или ее сложный эфир в терапевтически эффективном количестве и ингибитор ароматазы.
Далее согласно изобретению как вариант вышеуказанного набора для лечения предлагается набор, в котором соль 9-оксоакридин-10-уксусной кислоты выбрана из группы, включающей натриевую, меглюминовую, эглюминовую и соль с 3-O-(N,N-диметиламино-н-пропил)-1,2:5,6-ди-O-изопропилиден-α,D-глюкофуранозой.
В заявляемом наборе ингибитор ароматазы представляет собой стероидный ингибитор ароматазы нестероидный ингибитор ароматазы. Предпочтительным в наборе является ингибитор ароматазы, относящийся к группе, включающей: форместан, экземестан, аминоглютетимид, фадрозол, анастрозол, летрозол, ворозол.
Единичные дозированные формы в наборах могут быть представлены таблетками, капсулами или суспензиями для перорального приема; ампулами или шприц-тюбиками, содержащими стерильный раствор для инъекций; свечами для ректального или интравагинального введения; порошками для приготовления суспензий или растворов.
В общем, все средства по изобретению альтернативно могут включать в себя, состоять или по существу состоять из любых подходящих компонентов, раскрытых в данном описании, и такие средства, в том