Фармацевтическая композиция на основе пептида, регулирующего нарушения ангиогенеза, и способ ее применения
Иллюстрации
Показать всеИзобретение относится к медицине и касается фармацевтической композиции, подходящей для парентерального введения, содержащей пептид Nε-(γ-L-глутамил)-L-лизин общей формулы: H-Lys(H-Glu-OH)-OH, стимулирующий ангиогенез, которая может быть использована как лекарственное средство для коррекции нарушений ангиогенеза. Изобретение обеспечивает усиление экспрессии гена фактора роста эндотелия сосудов, стимуляцию метаболической активности, пролиферации и миграции эндотелиоцитов, нормализацию продукции цитокинов. 3 н. и 2 з.п. ф-лы, 3 ил., 6 табл.
Реферат
Изобретение относится к лекарственным средствам для коррекции нарушений ангиогенеза, и касается фармацевтической композиции, содержащей пептид, регулирующий нарушения ангиогенеза, которая может быть использована в медицине как лекарственное средство для коррекции нарушений ангиогенеза.
В описании изобретения используются следующие определения.
Под процессом ангиогенеза понимается механизм образования новых кровеносных сосудов (неоваскуляризации), возникающих из предсуществующей капиллярной сети.
Ангиогенез является многостадийным процессом, который сначала запускает миграцию, прикрепление и адгезию эндотелиальных клеток и затем их пролиферацию и организацию в сосуды для формирования сосудистой сети, необходимой для развития тканей.
Ангиогенез включает в себя пролиферацию и миграцию эндотелиальных клеток в первичных васкулярных структурах и способствует васкуляризации эктодермальных и мезенхимных органов, реконструкции капиллярной сети.
Ангиогенез необходим для процессов заживления ран, коллатерализации, стимулированной ишемией, развития плаценты, многих эмбриональных и постнатальных тканей, а также для циклических репродуктивных изменений в женском организме, связанных с формированием желтого тела, ростом эндометрия и лактацией. В норме процессы ангиогенеза в организме протекают с умеренной интенсивностью и активизируются при регенерации поврежденных тканей, рассасывании тромбов, ликвидации очагов воспаления, рубцевании и других процессах восстановления, а также при росте и развитии организма.
Нарушения ангиогенеза вовлечены в патогенез раневого процесса, диабетических микро- и макроангиопатий, эндометриоза, синдрома гиперстимуляции яичников, нарушений гестационного процесса, ишемической болезни сердца, инсульта и целого рада других заболеваний и патологических состояний.
К основным эндогенным стимуляторам ангиогенеза относятся цитокины: фактор роста эндотелия сосудов, фактор роста плаценты, фактор роста фибробластов, фактор роста тромбоцитов, трансформирующий фактор роста, фактор роста гепатоцитов, инсулиноподобный фактор роста, фактор некроза опухолей, IL-8, эритропоэтин, гранулоцитарный колониестимулирующий фактор и гранулоцитарно-макрофагальный колониестимулирующий фактор [Griffioen A.W., Molema G. Angiogenesis: Potentials for Pharmacologic Intervention in the Treatment of Cancer, Cardiovascular Diseases, and Chronic Inflammation // Pharmacological Reviews. - 2000. - Vol.52, Issue 2. - P.237-268; Carmeliet P. Angiogenesis in health and disease // Nature Medicine. - 2003. - Vol.9. - P.653-660].
Известен фактор роста фибробластов (FGF), способный стимулировать пролиферацию фибробластов и представляющий собой полипептид с молекулярной массой 50 кДа и длиной цепи 267 аминокислот; его аналоги (заявка РФ 97105853, МПК6 C61K 38/18, 1999); пептиды, которые на 60% идентичны FGF от аминокислотного остатка 28 (Glu) до аминокислотного остатка 207 (Ala) (заявка РФ 99109987, 2001), а также основной фактор роста фибробластов (bFGF), являющийся частью молекулы природного фактора роста фибробластов с 10 по 155 аминокислоту (патент РФ 2093519, 1997).
Однако использование их в качестве лекарственных препаратов затруднено в связи возможностью развития аллергических реакций, обусловленных высокой молекулярной массой препаратов.
Эти факторы представляют собой соединения полипептидной природы, стимулирующие ангиогенез, но воздействующие при этом также на другие физиологические функции организма, что ведет к появлению нежелательных побочных эффектов, вследствие чего их клиническое применение ограничено.
Известен способ применения фармацевтических композиций, подавляющих сосудистую пролиферацию (патент РФ 2288739, 2005), который обеспечивает подавление нежелательной сосудистой пролиферации при минимальном проявлении побочных эффектов за счет селективного антиангиогенного действия агониста рецептора соматостатина типа 1.
Известный способ подавления пролиферации гладкой мускулатуры, пролиферации эндотелиальных клеток и прорастания новых кровеносных сосудов включает стадию введения терапевтически эффективного количества агониста рецептора соматостатина типа 1. Примеры клинических показаний для лечения по известному способу описаны в патент РФ 2288739, при этом в ряде случаев агонист соматостатина вводят в течение всей жизни пациента.
В связи с изложенным, актуальной и необходимой становится разработка более эффективных регуляторов нарушений ангиогенеза, представляющих собой синтетические пептиды, характеризующиеся эффективностью в малых дозах и не оказывающие вредных воздействий на организм при их применении.
Из уровня техники (Squires E.J., Feltham L.A., "Isolation, characterization and seasonal variations in the concentration of N-epsilon-(gamma-glutamyl)-lysine isodipeptide in the blood plazma of the winter flounder (Pseudopleuronectes americanus)", Biochem J. 1980 Mar 1; 185(3): 761-6) известно получение вариантов дипептида Glu-Lys, в том числе Nε-(γ-L-глутамил)-L-лизин.
Настоящим изобретением поставлена и решена задача выявления неизвестной ранее биологической активности пептида Nε-(γ-L-глутамил)-L-лизин, заключающейся в регулировании нарушений ангиогенеза, а также фармацевтической композиции, содержащей в качестве действующего вещества этот пептид, использование которой регулирует нарушения ангиогенеза.
Технический результат изобретения заключается в создании фармацевтической композиции, содержащей в качестве действующего вещества пептид Nε-(γ-L-глутамил)-L-лизин, проявляющий новую биологическую активность, заключающуюся в регулировании нарушений ангиогенеза, которая может быть использована для регуляции нарушений ангиогенеза за счет усиления экспрессии гена фактора роста эндотелия сосудов, стимуляции метаболической активности, пролиферации и миграции эндотелиоцитов, нормализации продукции цитокинов.
Для решения поставленной задачи и достижения указанного технического результата предложена группа изобретений, объединенных общим изобретательским замыслом.
В одном аспекте настоящее изобретение относится к фармацевтической композиции, регулирующей нарушения ангиогенеза, содержащей в качестве действующего вещества эффективное количество пептида Nε-(γ-L-глутамил)-L-лизин общей формулы: H-Lys(H-Glu-OH)-OH и фармацевтически приемлемый носитель.
При этом фармацевтическая композиция находится в форме, подходящей для парентерального введения.
В другом аспекте настоящее изобретение относится к пептиду Nε-(γ-L-глутамил)-L-лизин общей формулы: H-Lys(H-Glu-OH)-OH, обладающему биологической активностью, заключающейся в регулировании нарушений ангиогенеза.
Следующий аспект настоящего изобретения касается способа регуляции нарушений ангиогенеза, заключающегося во введении пациенту фармацевтической композиции, содержащей в качестве действующего вещества эффективное количество пептида Nε-(γ-L-глутамил)-L-лизин общей формулы: H-Lys(H-Glu-OH)-OH в дозе от 0,01 мкг/кг до 100 мкг/кг массы тела, парентерально однократно ежедневно в течение 5-10 дней.
При этом введение осуществляют внутримышечно.
Пептид Nε-(γ-L-глутамил)-L-лизин общей формулы: H-Lys(H-Glu-OH)-OH получают классическим методом пептидного синтеза в растворе.
При экспериментальном изучении пептида Nε-(γ-L-глутамил)-L-лизин общей формулы: H-Lys(H-Glu-OH)-OH выявлено, что он проявляет новую биологическую активность, заключающуюся в регулировании нарушений ангиогенеза, а именно - в стимулировании метаболической активности, пролиферации и миграции эндотелиоцитов, усилении экспрессии гена фактора роста эндотелия сосудов, нормализации продукции цитокинов.
Изучение биологической активности пептида Nε-(γ-L-глутамил)-L-лизин общей формулы: H-Lys(H-Glu-OH)-OH проводили по его влиянию на рост эксплантатов сосудистой стенки, экспрессию гена фактора роста эндотелия сосудов, ферментативную активность в эндотелии сосудов при заживлении гнойных резано-размозженных ран мягких тканей.
Возможность объективного проявления технического результата при использовании изобретения подтверждена достоверными данными, приведенными в примерах, содержащих сведения экспериментального характера, полученные в процессе проведения исследований по методикам, принятым в данной области.
Среди факторов, регулирующих ангиогенез, наиболее важен фактор роста эндотелия сосудов (VEGF). VEGF известен как фактор проницаемости сосудов (VPF), образуется сосудистыми клетками гладких миоцитов. Фактор роста эндотелия сосудов (VEGF, ФРЭС) является митогенным белковым фактором, главным образом - для клеток эндотелия кровеносных сосудов. VEGF имеет значительное структурное сходство с фактором роста тромбоцитов, однако в отличие от факторов роста тромбоцитов, фибробластов и др. VEGF имеет высокую специфичность именно к клеткам эндотелия. VEGF может стимулировать растяжение, образование сосудистой сетки и разветвление непролиферирующих эндотелиальных клеток, лишенных кислорода и питательных веществ. В связи с тем, что эндотелиальные клетки находятся в хронических гипоксических условиях, предполагается, что VEGF приводит к образованию новых кровеносных сосудов.
Для получения фармацевтической композиции, отвечающей изобретению, эффективное количество пептида Nε-(γ-L-глутамил)-L-лизин как действующее вещество смешивают с фармацевтически приемлемым носителем согласно принятым в фармацевтике способам компаундирования.
Понятие «эффективное количество» подразумевает использование такого количества действующего вещества, которое в соответствии с его количественными показателями активности и токсичности, а также на основании знаний специалиста должно быть эффективным в данной лекарственной форме.
В качестве носителя могут использоваться различные вещества в зависимости от лекарственной формы препарата, желаемой для введения в организм. Для парентерального введения в качестве носителя обычно используют физиологический раствор или стерильную воду.
Сущность изобретения иллюстрируется фигурами, и поясняется таблицами.
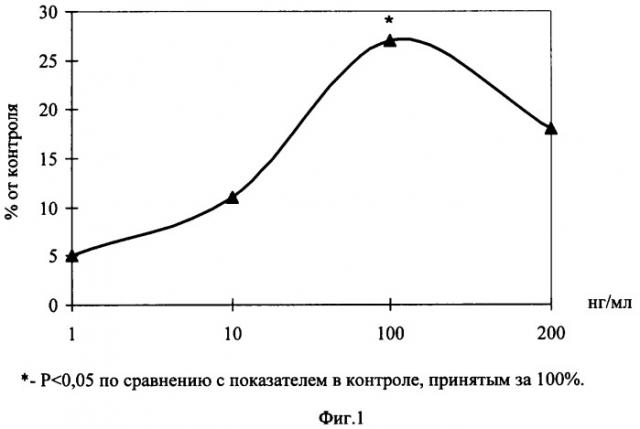
На Фиг.1 показано влияние пептида Nε-(γ-L-глутамил)-L-лизин, на рост эксплантатов сосудистой стенки.
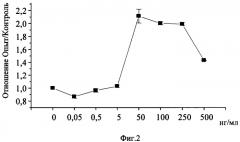
На Фиг.2 показана дозозависимая стимуляция пептидом Nε-(γ-L-глутамил)-L-лизин экспрессии гена VEGF в эндотелиальных клетках линии EA.hy926.
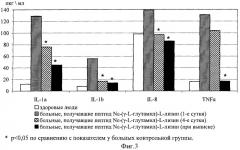
На Фиг.3 показано влияние пептида Nε-(γ-L-глутамил)-L-лизин на динамику содержания цитокинов у больных с флегмонами челюстно-лицевой области.
В Таблице 1 представлено влияние пептида Nε-(γ-L-глутамил)-L-лизин на экспрессию гена VEGF в эндотелиальных клетках линии EA.hy926.
В Таблице 2 представлено влияние фармацевтической композиции, содержащей пептид Nε-(γ-L-глутамил)-L-лизин, на активность щелочной фосфатазы в эндотелии сосудов при заживлении гнойных резано-размозженных ран мягких тканей у кроликов.
В Таблице 3 представлено влияние фармацевтической композиции, содержащей пептид Nε-(γ-L-глутамил)-L-лизин, на продолжительность течения раневого процесса у кроликов с гнойными резано-размозженными ранами мягких тканей.
В Таблице 4 представлено влияние пептида Nε-(γ-L-глутамил)-L-лизин, используемого в качестве действующего вещества в фармацевтической композиции, на морфологические и биохимические показатели периферической крови морских свинок при изучении хронической токсичности.
В Таблице 5 представлены сведения о локализации, частоте, множественности и средних размерах опухолей толстой кишки.
В Таблице 6 представлены сведения о частоте, множественности и размерах опухолей двенадцатиперстной кишки, а также тощей и подвздошной кишки.
Изобретение иллюстрируется примером синтеза пептида Nε-(γ-L-глутамил)-L-лизин (пример 1), примерами, подтверждающими проявление пептидом биологической активности, заключающейся в регулировании нарушений ангиогенеза (примеры 2, 3 и 4), примером изучения токсичности пептида Nε-(γ-L-глутамил)-L-лизин, используемого в качестве действующего вещества в фармацевтической композиции (пример 5), примером влияния пептида Nε-(γ-L-глутамил)-L-лизин, используемого в качестве действующего вещества в фармацевтической композиции на торможение канцерогенеза (пример 6), а также примером клинического применения фармацевтической композиции, содержащей этот пептид, для лечения больных с флегмонами челюстно-лицевой области (пример 7).
Пример 1. Синтез пептида Nε(γ-L-глутамил)-L-лизин
1. Название соединения: Nε-(γ-L-глутамил)-L-лизин
2. Структурная формула:
H-Lys(H-Glu-OH)-OH
3. Брутто-формула без противоиона: C11H21N3O5.
4. Молекулярный вес без противоиона: 275,30.
5. Противоион: ацетат.
6. Внешний вид: белый аморфный порошок без запаха.
7. Способ синтеза: пептид получен классическим методом синтеза в растворе по схеме:
ВОС - трет.бутилоксикарбонильная группа,
OSu - N-оксисукцинимидный эфир,
DCC - N,N'-дициклогексилкарбодиимид,
OBut - трет.бутиловый эфир,
TFA - трифторуксусная кислота.
8. Характеристики готового препарата:
- содержание основного вещества: 98,40% (по ВЭЖХ, 220 нм),
- ТСХ - индивидуален, Rf=0,80 (ацетонитрил-вода 1:3),
- содержание влаги: 6%,
- pH 0,001% раствора: 4,50,
Пример синтеза:
1) BOC-Glu(OSu)-OBut (I), трет.бутиловый эфир N-трет.бутилоксикарбонил-(γ-N-оксисукцинимидил)глутаминовой кислоты
Трет.бутиловый эфир N-трет.бутилоксикарбонилглутаминовой кислоты (2,36 г, 7 мМоль) растворяли в 150 мл тетрагидрофурана, добавляли N-оксисукцинимид (0,89 г; 7,7 мМоль) и полученный раствор охлаждали до температуры минус 15°С. Отдельно охлаждали до этой же температуры раствор N,N'-дициклогексилкарбодиимида (1,6 г; 7,7 мМоль) в 20 мл тетрагидрофурана. Оба раствора объединяли и перемешивали при охлаждении льдом в течение суток.
Далее выпавший осадок N,N'-дициклогексилмочевины отфильтровывали, фильтрат упаривали в вакууме, остаток растворяли в 100 мл этилацетата, упаривание растворителя повторяли. Кристаллизация из системы этилацетат/гексан. Продукт отфильтровывали, сушили в вакууме при комнатной температуре. Выход 2,7 г (88%), Rf=0,71 (бензол-ацетон 2:1).
2) Nα-BOC-Nε-(BOC-Glu-OBut)-Lys-OH (II), Nα-трет.бутилоксикарбонил-Nε-(α-трет.бутил-N-трет.бутилоксикарбонилглутамил)-лизин
Nα-трет.бутилоксикарбониллизин (2,00 г; 8 мМоль) суспендировали в 10 мл N,N'-диметилформамида, добавляли 1,1 мл (8 мМоль) триэтиламина и перемешивали при температуре 30-35°С в течение 3 ч. Далее к смеси добавляли BOC-Glu(OSu)-OBut (I),
трет.бутиловый эфир N-трет.бутилоксикарбонил-(γ-N-оксисукцинимидил)глутаминовой кислоты (2,60 г; 6 мМоль) в 10 мл N'-диметилформамида и перемешивали при комнатной температуре в течение 2 суток. Реакционную смесь подкисляли 0,5 н раствором серной кислоты до pH 3-4 и экстрагировали этилацетатом 4×50 мл. Органический слой объединяли и промывали 0,5 н раствором серной кислоты (3×50 мл), водой (2×50 мл), 5% раствором NaHCO3 (30 мл), водой (2×50 мл), насыщенным раствором NaCl (2×20 мл).
Органический слой сушили над Na2SO4 растворитель упаривали в вакууме. Кристаллизация в системе этилацетат/гексан, сушка над Р2O5. Получено 2,30 г продукта (68%). Rf=0,66 (бензол-ацетон 1:1).
3) H-Lys(H-Glu-OH)-OH, Nε-(γ-L-глутамил)-L-лизин
Nα-BOC-Nε-(BOC-Glu-OBut)-Lys-OH (II), Nα-трет.бутилоксикарбонил-Nε-(α-трет.бутил-N-трет.бутилоксикарбонилглутамил)-лизин 2,30 г растворяли в смеси хлороформ-трифторуксусная кислота (1:1). Через 3 ч растворитель упаривали в вакууме, остаток сушили в вакууме над КОН. Получали продукт в виде масла, 1,50 г. Rf=0,80 (ацетонитрил-вода 1:3).
Для очистки 200 мг препарата растворяли в 4 мл 0,01% раствора трифторуксусной кислоты (pH пробы 2,5) и подвергали высокоэффективной жидкостной хроматографии на колонке с обращенной фазой 50×250 мм Diasorb-130-C16T, 7µ. Хроматограф Beckman System Gold, 126 Solvent Module, 168 Diode Array Detector Module. Условия хроматографирования А: 0,1% TFA; В: 50% MeCN in 0.1% TFA; градиент В 0→5% за 80 мин. Объем пробы 5 мл, детекция при длине волны 219 нм, сканирование при длинах волн 190-600 нм, скорость потока 10 мл/мин. Отбирали фракцию 37-41 мин.
Растворитель упаривали в вакууме при температуре не выше 40°С, упаривание многократно (не менее 5 раз) повторяли с 10 мл 10% раствора уксусной кислоты.
Окончательно остаток растворяли в 20 мл деионизованной воды и лиофилизовывали. Получено 130 мг очищенного препарата в виде аморфного белого порошка без запаха.
4) Анализ готового препарата
- Содержание основного вещества определяли методом ВЭЖХ на колонке Phenomenex С 18 LUNA 4,6×150 mm. A: 0,1% TFA. В: MeCN; grad.B 0-100% in 10 min. Скорость потока 1 мл/мин. Детекция при длине волны 220 нм, сканирование при длинах волн 190-600 нм, проба 20 µl. Содержание основного вещества 98,40%.
- ТСХ: индивидуален, Rf=0,80 (ацетонитрил-вода 1:3, пластинки ПТСХ-П-В-УФ Sorbfil, силикагель СТХ-1 ВЭ 8-12 мкм, проявление хлор/бензидин).
- Содержание влаги: 6% (гравиметрически по потере массы при сушке 20 мг при температуре 100°С).
- pH 0,01% раствора: 4,50 (потенциометрически).
- Удельное оптическое вращение: [α]D 22: -26° (c=1, H2O), "Polamat A", Carl Zeiss Jena.
Пример 2. Влияние пептида Nε-(γ-L-глутамил)-L-лизин на рост эксплантатов сосудистой стенки
Эксперименты проведены на 28 фрагментах сосудистой стенки периферической артерии крыс линии «Wistar» с массой тела 170-210 г. Питательная среда для культивирования эксплантатов состояла из 35% раствора Игла, 25% фетальной сыворотки теленка, 35% раствора Хенкса, 5% куриного эмбрионального экстракта, в среду добавляли глюкозу (0,6%), инсулин (0,5 ед./мл), пенициллин (100 ед./мл), глютамин (2 мМ). Фрагменты сосудистой стенки помещали в эту среду и культивировали в чашках Петри в термостате при температуре 36,7±0,2°С в течение 2 суток. В экспериментальную среду добавляли пептид Nε-(γ-L-глутамил)-L-лизин в концентрациях 1, 10, 100 и 200 нг/мл. Критерием биологической активности служил индекс площади (ИП) - соотношение площади всего эксплантата вместе с зоной роста к исходной площади фрагмента сосудистой стенки. Значения ИП выражали в процентах, контрольное значение ИП принималось за 100%.
На Фиг.1 показано влияние пептида Nε-(γ-L-глутамил)-L-лизин на развитие эксплантатов сосудистой стенки.
Установлено, что через 1 сутки культивирования происходило распластывание эксплантатов на коллагеновой подложке, и начиналось выселение пролиферирующих и мигрирующих клеток по периферии эксплантата. На 3-и сутки культивирования при концентрации пептида Nε-(γ-L-глутамил)-L-лизин 100 нг/мл наблюдалось достоверное повышение ИП эксплантатов на 27%, по сравнению с контрольными значениями ИП. При исследовании эксплантатов сосудистой стенки на более длительных сроках культивирования (7 дней) были выявлено аналогичное стимулирующее действие пептида Nε-(γ-L-глутамил)-L-лизин в той же концентрации.
Таким образом, в отношении ткани сосудистой стенки крыс пептид Nε-(ε-L-глутамил)-L-лизин оказывал тканеспецифическое действие, проявляющееся в стимуляции роста эксплантатов.
Пример 3. Влияние пептида Nε-(γ-L-глутамил)-L-лизин на экспрессию гена фактора роста эндотелия сосудов
При изучении влияния пептида Nε-(γ-L-глутамил)-L-лизин на ангиогенез in vitro использовали эндотелиальные клетки человека линии Ea.hy926 - линия KB (карцинома ротовой полости человека). Клетки Ea.hy926 представляют собой иммортализованную клеточную гибридную линию эндотелиального происхождения, полученную путем слияния клеток эндотелия пупочной вены человека с клетками линии карциномы человека.
Для оценки влияния пептида Nε-(γ-L-глутамил)-L-лизин на экспрессию гена фактора роста эндотелия сосудов (vascular endothelial growth factor - VEGF) в эндотелиальных клетках использовали обратно-транскриптазную полимеразную цепную реакцию.
В Таблице 1 показано влияние пептида Nε-(γ-L-глутамил)-L-лизин на экспрессию гена VEGF в эндотелиальных клетках линии EA.hy926 (интенсивность флуоресценции мРНК, окрашенной иодидом пропидия, усл. ед., M±m).
В Таблице 1 представлены результаты экспериментов с культурой эндотелиальных клеток перевиваемой линии EA.hy926, которые инкубировали с пептидом Nε-(γ-L-глутамил)-L-лизин в течение 48 ч. В качестве контроля использовали физиологический раствор. Для сравнения оценивали также эффект митогена - форболмиристатацетата. Установлено, что пептид Nε-(γ-L-глутамил)-L-лизин в концентрациях 10 нг/мл и 100 нг/мл достоверно усиливает экспрессию гена VEGF в эндотелиальных клетках по сравнению с контролем. Стимулирующее действие пептида Nε-(γ-L-глутамил)-L-лизин проявлялось в абсолютном приросте содержания в клетках VEGF-специфичной мРНК и увеличении индекса стимуляции.
На Фиг.2 представлена дозозависимая стимуляция пептидом Nε-(γ-L-глутамил)-L-лизин экспрессии гена VEGF в эндотелиальных клетках линии EA.hy926.
При этом необходимо отметить, что на Фиг.2 цифрой «ноль» обозначен контроль культуры клеток, в среду которых добавляли физиологический раствор, по оси абсцисс указаны концентрации пептида Nε-(γ-L-глутамил)-L-лизин в культуральной среде, нг/мл, по оси ординат указаны индексы стимуляции (отношение интенсивности экспрессии мРНК VEGF под влиянием пептида Nε-(γ-L-глутамил)-L-лизин к интенсивности экспрессии мРНК VEGF в контроле), характеризующие степень усиления активности гена.
На Фиг.2 представлены данные, полученные путем суммирования трех подобных экспериментов с разными концентрациями пептида Nε-(γ-L-глутамил)-L-лизин. Экспрессия гена VEGF представлена в виде индексов стимуляции, т.е. отношения интенсивности экспрессии гена в культурах эндотелиальных клеток, инкубированных с пептидом Nε-(γ-L-глутамил)-L-лизин, к интенсивности экспрессии гена в контрольных культурах. Видно, что стимулирующий эффект пептида Nε-(γ-L-глутамил)-L-лизин на экспрессию гена VEGF носит дозозависимый характер.
Диапазон концентраций, в котором стимулирующий эффект пептида Nε-(γ-L-глутамил)-L-лизин наиболее выражен, соответствует 50-500 нг/мл, с пиком активности при концентрациях 50, 100 и 250 нг/мл. Это соответствует дозам пептида Nε-(γ-L-глутамил)-L-лизин in vivo 50-250 мкг на 1 кг массы тела. В этом диапазоне доз пептида наблюдается приблизительно двукратное усиление экспрессии гена VEGF.
Полученные результаты свидетельствуют о том, что пептид Nε-(γ-L-глутамил)-L-лизин в исследуемых концентрациях вызывает значительное усиление активности гена VEGF, что приближает эффект пептида к стимулирующему действию таких сильных активаторов ангиогенеза, как основной фактор роста фибробластов (bFGF), провоспалительные цитокины TNFα и IL-1β и форболовый эфир.
VEGF в физиологических и патологических условиях стимулирует рост новых сосудов, т.е. является индуктором неоваскуляризации. В этом качестве VEGF является важной мишенью для воздействия различных препаратов при лечении ран, трофических язв, диабетических микро- и макроангиопатий, ишемической болезни сердца.
Результаты изучения влияния пептида Nε-(γ-L-глутамил)-L-лизин, используемого в качестве действующего вещества в фармацевтической композиции, на экспрессию гена VEGF убедительно свидетельствуют о том, что пептид является сильным активатором процессов ангиогенеза, связанных с действием этого ростового фактора.
Пример 4. Влияние фармацевтической композиции, содержащей пептид Nε-(γ-L-глутамил)-L-лизин на ферментативную активность в эндотелии сосудов при заживлении гнойных резано-размозженных ран мягких тканей
Эффективность пептида Nε-(γ-L-глутамил)-L-лизин оценивали на модели гнойной резано-размозженной раны мягких тканей бедра у 15 кроликов породы "Шиншилла" обоего пола с массой тела от 2 до 3 кг. С этой целью у кроликов выбривали шерсть в области мягких тканей бедра под нембуталовым наркозом и проводили разрез длиной 5 см и глубиной 1,5 см. Мягкие ткани (мышцы, подкожную клетчатку) раздавливали зажимом Кохера, инфицировали смесью возбудителя: Staphylococcus aureus, штамм 186. На кожу накладывали швы. Через 72 ч непрорезавшиеся швы снимали, проводили обработку ран 3% раствором перекиси водорода.
Животным подопытной группы вводили ежедневно однократно внутримышечно пептид Nε-(γ-L-глутамил)-L-лизин в дозе 5 мкг на инъекцию в 0,5 мл физиологического раствора в течение 10 суток. Кроликам контрольной группы по аналогичной схеме вводили 0,5 мл физиологический раствор. В процессе лечения проводили обработку ран с применением наружных антисептических средств.
При оценке эффективности фармацевтической композиции, содержащей пептид Nε-(γ-L-глутамил)-L-лизин, учитывали динамику регресса воспалительного процесса, сроки очищения ран от гнойно-некротических масс, отторжения струпа, появления грануляционной ткани в ране и начала краевой эпителизации. С целью определения объективных критериев течения раневого процесса на 6, 14, 21, 28 и 40 сутки анализировали показатели, отражающие полуколичественные характеристики активности тканевых ферментов.
В Таблице 2 показано влияние фармацевтической композиции, содержащей пептид
Nε-(γ-L-глутамил)-L-лизин, на активность щелочной фосфатазы в эндотелии сосудов при заживлении гнойных резано-размозженных ран мягких тканей у кроликов.
Отличительной чертой реакции тканей на применение фармацевтической композиции, содержащей пептид Nε-(γ-L-глутамил)-L-лизин, являлась высокая активность щелочной фосфатазы в эндотелии сосудов в фазу пролиферации (14-28 сутки), которая стабилизировалась на высоком уровне в фазу рубцевания (Таблица 2).
В Таблице 3 показано влияние фармацевтической композиции, содержащей пептид
Nε-(γ-L-глутамил)-L-лизин, на продолжительность течения раневого процесса у кроликов с гнойными резано-размозженными ранами мягких тканей. Сроки начала отторжения некротизированных тканей с поверхности ран у животных подопытной группы в 1,54 раза меньше, чем у кроликов контрольной группы, а сроки полного очищения поверхности ран от некротизированных тканей - в 1,39 раз меньше.
Таким образом, наблюдаемое в процессе исследования значительное сокращение продолжительности течения раневого процесса у животных с гнойными резано-размозженными ранами мягких тканей свидетельствует об активизации процессов клеточного метаболизма в эндотелии сосудов, стимуляции неоваскуляризации, способствующей более быстрому очищению раневой поверхности от некротизированных тканей и эпителизации раны (Таблица 3).
Пример 5. Изучение токсичности фармацевтической композиции, содержащей пептид Nε-(γ-L-глутамил)-L-лизин
Общетоксическое действие фармацевтической композиции, содержащей пептид Nε-(γ-L-глутамил)-L-лизин, исследовали в соответствии с требованиями «Руководства по экспериментальному (доклиническому) изучению новых фармакологических веществ» (2005): острой токсичности при однократном введении препарата, а также подострой и хронической токсичности при длительном введении пептида.
Исследование по изучению острой токсичности проведено на 60 белых беспородных мышах-самцах с массой тела 18-20 г. Животные были рандомизированно разделены на 6 равных групп. Препарат вводили животным однократно внутримышечно в дозах 1 мг/кг, 2 мг/кг, 3 мг/кг, 4 мг/кг, 5 мг/кг в 0,25 мл стерильного 0,9% раствора NaCl. Животным контрольной группы в том же объеме вводили стерильный 0,9% раствор NaCl.
Исследования по изучению подострой токсичности проведено на 52 белых беспородных крысах-самцах с массой тела 180-220 г. Ежедневно однократно животным подопытных групп вводили препарат внутримышечно в течение 90 дней в дозах 1 мкг/кг, 0,1 мг/кг, 1 мг/кг в 0,5 мл стерильного 0,9% раствора NaCl. Животным контрольной группы вводили в том же объеме стерильный 0,9% раствор NaCl. До введения препарата, на 30, 60 и 90 сутки после начала введения препарата у животных исследовали морфологический состав и свойства периферической крови. При завершении эксперимента исследовали биохимические и коагулологические показатели крови.
Исследования по изучению хронической токсичности проводили в течении 6 месяцев, исходя из длительности рекомендуемого клинического назначения препарата, на 70 морских свинках-самцах с массой тела 290-320 г. Животные подопытных групп получали ежедневно однократно внутримышечно фармацевтическую композицию, содержащую пептид в дозах 1 мкг/кг, 0,1 мг/кг, 1 мг/кг в 0,5 мл стерильного 0,9% раствора NaCl, в течение 6 мес. В контрольной группе животным вводили по аналогичной схеме стерильный 0,9% раствор NaCl в том же объеме. У животных в периферической крови общепринятыми методами определяли: количество эритроцитов, гемоглобина, ретикулоцитов, тромбоцитов, лейкоцитов, лейкоцитарную формулу, скорость оседания эритроцитов (СОЭ), резистентность эритроцитов. Наряду с этим определяли содержание в сыворотке крови общего белка по методу Лоури, калия и натрия методом плазменной спектрофотометрии. После завершения эксперимента проводили патоморфологическое исследование головного и спинного мозга, спинномозговых ганглиев, щитовидной железы, паращитовидных желез, надпочечников, семенников, гипофиза, сердца, легких, аорты, печени, почки, мочевого пузыря, поджелудочной железы, желудка, тонкой кишки, толстой кишки, тимуса, селезенки, лимфатических узлов, костного мозга.
При изучении острой токсичности установлено, что однократное введение исследуемого пептида животным в дозе, превышающей терапевтическую, рекомендованную для клинического применения, более чем в 5000 раз, не вызывает токсических реакций, что свидетельствует о большой терапевтической широте препарата.
В Таблице 4 представлено влияние пептида Nε-(γ-L-глутамил)-L-лизин, используемого в качестве действующего вещества в фармацевтической композиции, на морфологические и биохимические показатели периферической крови морских свинок при изучении хронической токсичности.
Изучение подострой и хронической токсичности фармацевтической композиции, содержащей пептид, свидетельствует об отсутствии побочных эффектов при длительном применении препарата в дозах, превышающих терапевтическую в 100-1000 раз. При исследовании не отмечено достоверного влияния исследуемого пептида на морфологические, биохимические показатели в периферической крови, а также на СОЭ и резистентность эритроцитов (Таблица 4).
При оценке общего состояния животных, морфологических и биохимических показателей периферической крови, морфологического состояния внутренних органов, состояния сердечно-сосудистой и дыхательной систем, функции печени и почек патологические изменения в организме не обнаружены.
Отсутствие общетоксического действия позволяет рекомендовать фармацевтическую композицию, содержащую в качестве действующего вещества пептид Nε-(γ-L-глутамил)-L-лизин, для проведения клинических испытаний с целью возможности использования в медицине как лекарственного средства для коррекции нарушений ангиогенеза.
Пример 6. Влияние фармацевтической композиции, содержащей пептид Nε-(γ-L-глутамил)-L-лизин на канцерогенен кишечника, индуцированный 1,2-диметилгидразином, у крыс
Исследование проводили на 80 крысах-самцах линии «Вистар» с массой тела 200-220 г. Животные получали стандартный корм, а также воду без ограничений. Животных рандомизированно разделили на 4 группы по 20 крыс в каждой группе.
Всем животным вводили подкожно 1 раз в неделю 1,2 диметилгидразин дигидрохлорид (ДМГ) в дозе 21 мг/кг (в расчете на основание) в 0,1 мл физиологического раствора, доведенного до pH 7,0 добавлением бикарбоната натрия. Всего было произведено 5 инъекций ДМГ. Суммарная доза канцерогена составила 105 мг/кг - из литературы известно, такая суммарная доза достаточна для индукции новообразований кишечника (Anisimov V.N., Popovich I.G., Zabezhinski M.A. Melatinin and colon carcinogenesis: I. Inhibitory effect of melatonin on development of intestinal tumors induced by 1,2-dimethylhydrazine in rats // Carcinogenesis. 1997. Vol.18. P/.1549-1553)/.
Крысам 1 группы (контроль) на протяжении всего опыта дополнительно вводили подкожно в течение 5 дней в неделю по 0,1 мл физиологического раствора. Для изучения влияния фармацевтической композиции, содержащей пептид Nε-(γ-L-глутамил)-L-лизин на канцерогенез кишечника подопытным крысам 2, 3 и 4 групп помимо ДМГ вводили подкожно 5 дней в неделю пептид Nε-(γ-L-глутамил)-L-лизин в дозе 10 мкг на крысу в 0,1 мл физиологического раствора по разным схемам. Крысам 2 группы фармацевтическую композицию, содержащую пептид Nε-(γ-L-глутамил)-L-лизин, вводили в течение всего эксперимента с целью оценить его влияние как на инициацию канцерогенеза кишечника, вызываемого ДМГ (метаболизм ДМГ, связывание с ДНК, клеточную трансформацию), так и дальнейшую фазу опухолевой промоции. Крысам 3 группы введение фармацевтической композиции, содержащей пептид Nε-(γ-L-глутамил)-L-лизин, начинали со следующего дня после последней инъекции ДМГ (только в фазу промоции канцерогенеза) и до окончания эксперимента. Крысам 4 группы фармацевтическую композицию, содержащую пептид Nε-(γ-L-глутамил)-L-лизин, вводили только в период введения ДМГ (в фазу инициации канцерогенеза). Для стандартизации всех процедур, связанных с инъекциями и дополнительным стрессом, крысам 3 группы (в период введения ДМГ) и 4 группы (после окончания введения ДМГ) подкожно вводили 1 раз в неделю по 0,1 мл физиологического раствора.
За животными вели постоянное наблюдение, их регулярно взвешивали. Эксперимент проводили в течение 6 месяцев после начала введения канцерогена. Животных выводили из опыта декапитацией. Все крысы были подвергнуты вскрытию. Локализация и размеры новообразований кишечника регистрировались в специальных картах. Опухоли кишечника и других органов, а также печень, селезенку, легкие и почки фиксировали в 10% нейтральном формалине. После стандартной гистологической обработки срезы окрашивали гематоксилином и эозином. Новообразования кишечника и других органов классифицировали согласно рекомендации Международного агентств по изучению рака.
Результаты исследования показали, что введение ДМГ и фармацевтической композиции, содержащей пептид Nε-(γ-L-глутамил)-L-лизин, не оказывало действия на общее состояние животных, достоверных различий в массе тела крыс различных групп не отмечено.
Опухоли кишечника были выявлены у большинства животных. Эти новообразования макроскопически имели вид экзофитно- и эндофитнорастущих опухолей, встречались также язвенно-инфильтративные формы. При микроскопическом исследовании обнаружены различные гистологические типы новообразований, среди которых доминировали аденокарциномы, в основном, тубулярного строения. Встречались также аденокарциномы in situ, поверхностные раки, слизь-продуцирующие, в том числе, перстневидноклеточные карциномы. В целом, макро- и микроскопическая картина опухолей толстой кишки не отличалась от описанной в литературе. Опухоли разделяли на группы в зависимости от степени дифференцировки и глубины инвазии. Высокодифференцированные аденокарциномы в различных группах животных встречались в 61-78% случаев, низкодифференцированные - в 17-38% случаев (самый низкий показатель отмечен во 2 группе).
Значительную часть новообразований составили опухоли толстой кишки. Сведение об их локализации, частоте, множественности и средних размерах представлены в Таблице 5. Суммарная частота новообразрований толстой кишки в различных группах была примерно равной (90-100%). Отмечена лишь тенденция к их снижению у крыс группы 2, которые получали пептид Nε-(γ-L-глутамил)-L-лизин на протяжении всего эксперимента. Однако множественность этих опухолей (в расчете на 1 крысу в группе) у животных 2 и 3 групп, получавших пептид Nε-(γ-L-глутамил)-L-лизин в комбинации с канцерогеном, была статистически достоверно ниже, чем у животных, получавших только ДМГ (p<0,05). Во 2 группе было также снижено среднее количество опухолей на 1 крысу.
Анализ распределения крыс с различных числом опухолей толстой кишки показал, что у крыс, получавших только ДМГ, возникало по 3 и более опухолей, а при дополнительном введении фармацевтической композиции, содержащей пептид Nε-(γ-L-глутамил)-L-лизин, (2 и 3 группы) количество таких животных было статистически достоверно ниже по сравнению с контролем.
При оценке выраженности канцерогенеза различных отделов толстой кишки выявлено, что среди новообразований доминировали опухоли нисходящего отдела (Таблица 5). Их частота во 2 группе была достоверно снижена по сравнению с 1 группой. Тенденция к снижению частоты новообразований была также отмечена у животных 3 и 4 групп. При этом у крыс 2 и 4 групп множественность опухолей была значительно ниже по сравнени