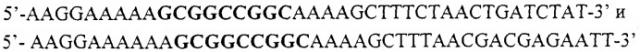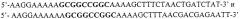Модуляция деградации мочевины в винных дрожжах
Иллюстрации
Показать всеИзобретение относится к биотехнологии, а именно к применению трансформированной клетки Saccharomyces cerevisiae, принадлежащей к штамму, применяющемуся в виноделии, способной к увеличенной по сравнению с нетрансформированной клеткой указанного штамма деградации мочевины в условиях ферментации виноградного сусла. Клетка трансформирована рекомбинантной нуклеиновой кислотой, содержащей последовательность, включающую открытую рамку считывания, гомологичную открытой рамке считывания DUR1,2 и кодирующую белок, имеющий мочевино-деградирующую ферментативную активность, и промотор, подходящий для опосредования экспрессии белка, имеющего мочевино-деградирующую ферментативную активность, в условиях ферментации виноградного сусла. Изобретение позволяет получить вино, не отличающееся по своим органолептическим свойствам от вина, полученного с помощью нетрансформированной клетки. 7 н. и 6 з.п. ф-лы, 7 ил., 1 табл.
Реферат
FОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к области биохимии микробов. В одном аспекте изобретение касается воздействия на биохимические пути, включая азотный катаболизм в организмах, способных к ферментации углеводов с получением этилового спирта. В выбранных реализациях изобретение касается культур и способов производства вина и других продуктов ферментации.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Аргинин является одной из преобладающих аминокислот, присутствующих в виноградном сусле (Henschke and Jiranek, 1993). Считают, что аргинин транспортируется в дрожжевую клетку обычной пермеазой аминокислот, кодируемой геном GAP1 (Jauniaux and Grenson, 1990) или пермеазой аргинина, кодируемой геном CAN1 (Hoffmann, 1985). Согласно имеющимся сообщениям в Saccharomyces cerevisiae аргинин расщепляется на мочевину и орнитин с помощью аргиназы, продукта гена CAR1 (Middelhoven, 1964; Sumrada and Cooper, 1982).
Ген DUR1,2 кодирует бифункциональный фермент, карбоксилазу мочевины-аллофанатгидролазу (Dur1,2; амидолиазу мочевины), который может расщеплять мочевину на аммиак и СО2. Мочевино-карбоксилазная функция кодируется отдельно в ферменте из зеленых водорослей, который катализирует реакцию: АТФ+мочевина+СО2=АДФ+фосфат+мочевина-1-карбоксилат (ЕС 6.3, 4.6; систематическое название: мочевина: СО2-лигаза (АДФ-образующая); другие названия: уреаза(АТФ-гидролизующая); карбоксилаза мочевины (гидролизующая); АТФ-амидолиаза мочевины; CAS регистрационный номер: 9058-98-4; Roon et al, 1970; Roon and Levenberg, 1972; Sumrada and Cooper, 1982). Аллофанатгидролазная функция также кодируется отдельно в ферменте из зеленых водорослей, который катализирует реакцию: мочевина-1-карбоксилат+Н2O=2СO2+2NH3 (EC 3.5.1.54; систематическое название: мочевина-1-карбоксилат амидогидролаза; другое название: аллофанатлиаза; CAS регистрационный номер: 79121-96-3; Maitz et al., 1982; Roon, et al., 1972; Sumrada and Cooper, 1982).
В S. cerevisiae ген DUR1,2 подвергается азотной катаболитной репрессии (АКР от англ. NCR - nitrogen catabolite repression) предпочтительными источниками азота, присутствующими в виноградном сусле (Genbauffe and Cooper, 1991). Мочевина, которая не расщепляется, может секретироваться дрожжевыми клетками в бродящее виноградное сусло. Секретируемая мочевина может взаимодействовать в сусле с этанолом с образованием этилкарбамата, который, как было показано, вызывает различные доброкачественные и злокачественные опухоли у множества экспериментальных животных (Mirvisch, 1968) и поэтому может рассматриваться в качестве потенциального фактора риска для здоровья людей.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном аспекте изобретения обнаружено, что концентрацией мочевины в бродящем виноградном сусле, вине или дистиллированном напитке можно управлять путем модуляции азотной катаболитной репрессии гена DUR1,2 в S. cerevisiae, кодирующего мочевино-карбоксилазную и аллофанатгидролазную активности. В одном аспекте изобретения соответственно предложены дрожжевые штаммы, трансформированные для уменьшения азотной катаболитной репрессии гена, кодирующего мочевино-деградирующую ферментативную активность, экспрессирующуюся дрожжевым штаммом при условиях ферментации. Дрожжевой штамм, например, может быть трансформирован рекомбинантной нуклеиновой кислотой, содержащей последовательность, кодирующую мочевино-деградирующую ферментативную активность, или промотором, подходящим для опосредования экспрессии мочевино-деградирующей ферментативной активности при условиях ферментации. В некоторых реализациях изобретения используют нативные или модифицированные последовательности, гомологичные промоторной и кодирующей последовательностям гена DUR1,2 из S. cerevisiae. Дрожжевые штаммы и нуклеиновые кислоты по настоящему изобретению могут быть использованы, например, для получения ферментированных алкогольных напитков, таких как вина и другие продукты ферментации.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1 представляет графическое изображение расположенного в 3'-5' направлении участка гена DUR1,2, оканчивающегося в начале кодирующей последовательности DUR.1,2. Информация, представленная на Фиг.1, получена из опубликованной полной последовательности хромосомы II Saccharomyces cerevisiae (Genbank LOCUS NC_001134, ACCESSION NC_001134, REGION: complement (635670..643177), VERSION NC_001134.2, G1:14270686; Feldmann, H., Aigle, M., Aljinovic, G., Andre, В., Baclet, M.C., Barthe, C., Baur, A, Becam, A.M., Biteau, N., Boles, E. et al. "Complete DNA sequence of yeast chromosome II" EMBO J.13 (24), 5795-5809 (1994); Goffeau, A, Barrell, B.G., Bussey, H., Davis, R.W., Dujon, В., Feldmann, H., Galibert, F., Hoheisel, J.D., Jacq, C., Johnston, M., Louis, E.J., Mewes, H.W., Murakami, Y., Philippsen, P., Tettelin, H. and Oliver, S.G. "Life with 6000 genes" Science 274 (5287), 546 (1996)).
Фиг.2 представляет часть последовательности расположенного в 3'-5' направлении участка гена DUR.1,2, оканчивающегося в стартовом кодоне ATG гена DUR.1,2. Рамкой выделены два предполагаемых АКР-элемента: GATAA(G)-боксы (один в положении от -54 до -58, а другой в положении от -320 до -324), а также предполагаемые ТАТАА-боксы.
Фиг.3 демонстрирует активацию транскрипции и трансляции DUR1,2 в дрожжах, контролируемую экспрессионной кассетой, содержащей DUR1,2. (А) Экспрессию DUR1,2 в трансформированных клетках GVY400, содержащих (дорожка 2) или не содержащих (дорожка 1) кДНК DUR1,2, сравнивали с помощью Нозерн-анализа тотальной РНК с использованием α32Р-dАТР-меченого зонда для DUR1,2. HHFI, кодирующий гистон 4, использовали в качестве стандарта нагрузки РНК. (В) Экспрессию амидолиазы мочевины в трансформированных клетках GVY400, содержащих (дорожка 3) или не содержащих (дорожка 2) кДНК DUR1,2, визуализировали с помощью вестерн-блота биотинилированных белков, присутствующих в тотальном белке, экстрагированном из трансформантов. Определение проводили с помощью хемилюминисценции на рентгеновской пленке, используя стрептавидин, конъюгированный с пероксидазой из хрена. Высокомолекулярные биотинилированные стандарты (5 мкг на дорожку) включали в качестве маркеров молекулярной массы (дорожка 1).
Фиг.4 представляет схематическое изображение стратегии клонирования гена DUR1,2 в плазмиде pHVX2 с получением PJC1 согласно способу DI/TRISEC (Dietmaler and Fabry, 1995). Геномную ДНК из S. cerevisiae TCY 1 получали согласно стандартным способам (Ausubel et al., 1995). Кодирующую последовательность гена DUR1,2 амплифицировали с помощью ПЦР, используя ДНК-полимеразу ExTaq (Takara). Использовали праймеры:
5TAAAAAAATGACAGTTAGTTCCGATACA3' для 5'-конца и 5TCGAAAAAGGTATTTCATGCCAATGTTATGAC3' для 3'-конца гена. Так называемый стартовый кодон и комплементарная последовательность для стоп-кодона представлены полужирным шрифтом. Продукт амплификации обрабатывали ДНК-полимеразой Т4 для удаления нескольких нуклеотидов на 3'-фланкирующем конце. При необходимости 3'-5'-экзонуклеазную активность фермента подавляли путем добавления адекватных нуклеотидов. Плазмиду pHVX2 (Volschenk et al., 1997) разрезали рестрикционными ферментами EcoRI и BgRlII и затем обрабатывали фрагментом Кленова ДНК-полимеразы I из Е.coli. Рестрикционные сайты были частично заполнены в присутствии dATP и dGTP, для того чтобы иметь последовательности, совместимые с клонированием вставки.
Фиг.5 представляет схему клонирования флеомицин-резистентной генной кассеты в pJCl (меченная pHVX2 или pRUR.1,2), содержащей ген DUR1,2. Для конструирования pJC2 использовали стандартные рекомбинантные методы (меченная pHVX2phleo или pDUR1,2phleo) (Ausubel et al., 1995).
Фиг.6 представляет схематическое изображение плазмиды pJC2/DUR1,2phleo (меченная pDUR1,2phleo на иллюстрации), которая является мультикопийной, эписомной челночной плазмидой S. cerevisiae - E.coli, полученной из вектора pJC2phleo, где ген DUR1,2 встроен между регуляторными последовательностями гена дрожжевой фосфоглицераткиназы (PGK1) (промоторной и терминаторной последовательностями). Маркер LEU2 облегчает селекцию трансформированных дрожжевых клеток, которые являются ауксотрофными по лейцину. Эта плазмида содержит также ген Тn5Вlе, управляемый конститутивным дрожжевым промотором TEF1, и дрожжевой терминатор CYC1. Дрожжевые клетки, несущие эту кассету, становятся устойчивыми к флеомицину. Применение этого положительного селективного маркера может быть особенно полезным для работы с трансформированными промышленными дрожжевыми штаммами, которые не несут ауксотрофных маркеров.
Фиг.7 представляет графическое изображение способности трансформированных дрожжей по настоящему изобретению уменьшать концентрацию мочевины в культуральной среде. Гаплоидный лабораторный дрожжевой штамм, разрезанный в DUR1,2 хромосомном локусе, был трансформирован плазмидой pJC2/DUR1,2phleo или плазмидой pJC2phleo без гена DUR1,2. Применение этого мутантного штамма позволяет охарактеризовать исследуемый штамм в отсутствие фона, обусловленного мочевино-амидолиазной эндогенной активностью. Трансформированные клетки выращивали в минимальной среде, содержащей 0,1% глутамина, отбирали и использовали для инокуляции свежей среды. Через 1 ч добавляли мочевину 33 мг/л. Каждые 2 ч отбирали аликвоты культуры, клетки разрушали в среде со стеклянными бусинами и клеточный дебрис удаляли центрифугированием. После того как супернатант был собран, ферменты инактивировали нагреванием и определяли количество мочевины, присутствующей в образце. Этот способ облегчает одновременное измерение внутриклеточной и внеклеточной мочевины, позволяя делать различие между мочевиной, поглощаемой клетками, и мочевиной, метаболизируемой клетками. Для контроля стадии роста каждой культуры регулярно измеряли также поглощение при 600 нм. Стандартное отклонение n=6. Данные, представленные закрашенными кружками, представляют собой концентрацию мочевины в среде, инокулированной лабораторным штаммом, трансформированным pJC2phleo. Данные, представленные закрашенными квадратиками, представляют собой концентрацию мочевины в среде, инокулированной лабораторным штаммом, трансформированным pJC2/DUR1,2phleo. Данные, представленные незакрашенными кружками, представляют собой поглощение при 600 нм для штамма pJC2phleo. Данные, представленные незакрашенными квадратиками, представляют собой поглощение при 600 нм для штамма pJC2/DUR1,2phleo. Левая ось Y означает концентрацию мочевины в мг/л. Правая ось Y означает поглощение при 600 нм. Ось Х означает часы после инокуляции.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В различных аспектах настоящее изобретение касается модификации генов и применения рекомбинантных генов. В этом контексте термин "ген" используют в соответствии с его обычным определением для обозначения группы связанных друг с другом последовательностей нуклеиновой кислоты. Модификация гена в контексте настоящего изобретения может включать модификацию любой из различных последовательностей, сцепленных в гене. Термин "сцепленный" означает, что отдельные последовательности взаимодействуют либо прямо, либо опосредованно для осуществления их предполагаемой функции, например опосредования или модуляции генной экспрессии. В качестве примера, взаимодействие сцепленных последовательностей может быть опосредовано белками, которые, в свою очередь, взаимодействуют с этими последовательностями.
Экспрессия гена обычно приводит к образованию полипептида, который кодируется частью гена. Обычно этот процесс включает в себя по меньшей мере два этапа: транскрипцию кодирующей последовательности с образованием РНК, которая сама по себе может обладать биологической активностью или которая может обеспечивать трансляцию части мРНК в полипептид. Хотя процессы транскрипции и трансляции не полностью поняты, считают, что транскрипция последовательности ДНК в мРНК контролируется несколькими участками ДНК. Каждый участок представляет собой последовательность оснований (т.е. последовательность нуклеотидных остатков, включающих аденозин (А), тимидин (Т), цитидин (С) и гуанидин (G)), которые располагаются в желательной последовательности.
Участки, которые обычно представлены в гене, включают в себя промоторную последовательность с участком, который обеспечивает связывание РНК-полимеразы и других транскрипционных факторов с промоторным сегментом ДНК. В норме РНК-полимераза движется вдоль промежуточного участка промотора до начала транскрипции в инициирующей транскрипцию последовательности, которая направляет РНК-полимеразу, для того чтобы начать синтез мРНК. Полагают, что РНК-полимераза начинает синтез мРНК на определенном расстоянии, например приблизительно от 20 до 30 оснований, выше последовательности, инициирующей транскрипцию. Вышеупомянутые последовательности обозначаются вместе как промоторный участок гена, который может включать другие элементы, которые модифицируют экспрессию гена. Такие сложные промоторы могут содержать одну или более последовательностей, которые вовлечены в индукцию или репрессию гена.
В контексте настоящего изобретения "промотор" обозначает нуклеотидную последовательность, которая способна опосредовать или модулировать транскрипцию интересующей нуклеотидной последовательности в желательной пространственной или временной системе и в желательной степени, когда транскрипционный регуляторный участок сцеплен с интересующей последовательностью. Транскрипционный регуляторный участок и интересующая последовательность являются "сцепленными", если эти последовательности функционально связаны, что позволяет опосредовать или модулировать транскрипцию интересующей последовательности транскрипционным регуляторным участком. В некоторых реализациях, будучи сцепленным, транскрипционный регуляторный участок может располагаться на той же цепи, что и интересующая последовательность. В некоторых реализациях транскрипционный регуляторный участок может располагаться на 5'-конце интересующей последовательности. В таких реализациях транскрипционный регуляторный участок может представлять собой непосредственно 5'-конец интересующей последовательности, или между этими участками могут существовать промежуточные последовательности. В некоторых реализациях транскрипционные регуляторные последовательности могут располагаться на 3'-конце интересующей последовательности. Сцепленность транскрипционного регуляторного участка и интересующей последовательности может требовать соответствующих молекул (таких как белки-активаторы транскрипции) для связывания с транскрипционным регуляторным участком, поэтому изобретение охватывает реализации, в которых предложены такие молекулы, либо in vitro, либо in vivo.
Последовательность ДНК, которая транскрибируется РНК-полимеразой в матричную РНК, обычно начинается с последовательности, которая не транслируется в белок и обозначается как 5'-нетранслируемый конец цепи мРНК, который может присоединяться к рибосоме. Эта нетранслируемая последовательность (CAP) может присоединяться после транскрипции гена. мРНК движется через рибосому до встречи со "стартовым кодоном". Стартовый кодон обычно представляет собой последовательность из трех оснований AUG; редко к инициации трансляции может приводить кодон GUG.
Следующую последовательность оснований в гене обычно называют кодирующей последовательностью или структурной последовательностью. Стартовый кодон предписывает рибосоме начать соединение последовательности аминокислот друг с другом пептидными связями с образованием полипептида, начиная с метионина, который образует аминотерминальный конец полипептида (метиониновый остаток затем может быть удален из полипептида другими ферментами). Основания, которые следуют за стартовым кодоном AUG, разделяются на группы из 3 оснований, каждая из которых представляет собой кодон. "Рамка считывания", которая устанавливает, каким образом основания распределяются в группы по 3 основания, определяется стартовым кодоном. Каждый кодон кодирует присоединение специфической аминокислоты к образующемуся полипептиду. Три кодона (UAA, UAG и UGA) обычно представляют собой "стоп"-кодоны; когда стоп-кодон достигает трансляционного механизма рибосомы, образовавшийся полипептид отделяется от рибосомы и последний предшествующий аминокислотный остаток становится карбокситерминальным концом полипептида.
Участок мРНК, который в моноцистронном гене расположен на 3'-конце от стоп-кодона, обозначают как 3'-нетранслируемый участок. Этот участок может вовлекаться в процессинг, стабильность и/или транспорт мРНК после ее транскрипции. Этот участок может включать также сигнал полиаденилирования, который распознается в клетке ферментом, добавляющим значительное количество остатков аденозина к молекуле мРНК для образования поли-А-хвоста.
Различные гены и последовательности нуклеиновой кислоты по настоящему изобретению могут представлять собой рекомбинантные последовательности. Термин "рекомбинантный" означает, что что-то рекомбинировало, так что в отношении конструкции нуклеиновой кислоты этот термин означает молекулу, которая состоит из последовательностей нуклеиновой кислоты, которые соединили вместе в некоторой точке или получили с помощью молекулярно-биологических методов. Термин "рекомбинантный", если он касается белка или полипептида, означает молекулу белка или полипептида, которую экспрессируют, используя рекомбинантную конструкцию нуклеиновой кислоты, созданную с помощью молекулярно-биологических методов. Термин "рекомбинантный", если он касается генетической комбинации, означает гамету, или потомство, или клетку, или геном с новыми комбинациями аллелей, которые не встречаются в природных родительских геномах. Рекомбинантные конструкции нуклеиновой кислоты могут включать нуклеотидную последовательность, которую лигируют или на которую воздействуют, для того чтобы ее можно было лигировать с последовательностью нуклеиновой кислоты, с которой она не лигирует в природе или с которой она лигирует в природе, но в другом положении. Поэтому ссылка на конструкцию нуклеиновой кислоты как на "рекомбинантную" указывает на то, что человек воздействует на молекулу нуклеиновой кислоты, используя методы генной инженерии.
Рекомбинантные конструкции нуклеиновой кислоты могут вводиться в хозяйскую клетку, например, путем трансформации. Такие рекомбинантные конструкции нуклеиновой кислоты могут включать последовательности, полученные из тех же видов хозяйских клеток или из других видов хозяйских клеток, которые были выделены и повторно введены в клетки хозяев.
Рекомбинантные последовательности нуклеиновой кислоты могут быть интегрированы в хозяйский клеточный геном либо в результате первичной трансформации хозяйских клеток, либо в результате последующей рекомбинации и/или этапов репарации. В качестве альтернативы, рекомбинантные последовательности могут сохраняться в виде внехромосомных элементов. Такие последовательности могут репродуцироваться, например, с помощью организма, такого как трансформированный дрожжевой штамм в качестве исходного штамма для процедур, связанных с улучшением штамма, осуществленных путем мутации, массового скрещивания или слияния протопластов. Полученные штаммы, которые сохраняют рекомбинантную последовательность по настоящему изобретению, считаются "рекомбинантными" в контексте использующегося здесь термина.
В различных аспектах изобретения, молекулы нуклеиновой кислоты могут быть химически синтезированы с помощью методов, которые раскрыты, например, у Itakura с соавт. в патенте US 4598049; Caruthers с соавт. в патенте US 4458066; и Itakura в патентах US 4401796 и 4373071. Такие синтетические нуклеиновые кислоты являются по своей природе "рекомбинантными" в соответствии с использующимся здесь термином (являясь продуктом последовательных этапов комбинирования составных частей молекулы).
Трансформация представляет собой процесс, благодаря которому генетический материал, который переносится клеткой, изменяется путем включения одной или более экзогенных нуклеиновых кислот в клетку. Например, дрожжи могут быть трансформированы с помощью множества протоколов (Gietz et al., 1995). Такая трансформация может происходить в результате включения экзогенной нуклеиновой кислоты в генетический материал клетки или благодаря изменению в эндогенном генетическом материале клетки, которое является результатом экспозиции клетки с экзогенной нуклеиновой кислотой. Трансформанты или трансформированные клетки являются клетками или потомками клеток, которые были генетически изменены вследствие поглощения экзогенной нуклеиновой кислоты. Поскольку эти термины используются здесь, они применяются и к потомкам трансформированных клеток, где желательное генетическое изменение было сохранено на протяжении последующих клеточных генераций, независимо от других мутаций или изменений, которые также могут присутствовать в клетках последующих генераций.
В альтернативных аспектах изобретение касается дрожжевых штаммов, применяющихся в ферментации для производства множества продуктов, таких как вино, пиво, тесто, этанол или уксус. В альтернативных реализациях изобретения могут применяться, например, дрожжевые штаммы S. cerevisiae, дрожжевые штаммы S. bayanus или дрожжевые штаммы Schizosaccharomyces. Трансформированные хозяйские клетки для применения в виноделии могут включать, например, штаммы S. cerevisiae или Schizosaccharomyces, такие как Bourgovin (RC 212 Saccharomyces cerevisiae), ICV D-47 Saccharamyces cerevisiae, 71B-1122 Saccharomyces cerevisiae, K.1V-1116 Saccharomyces cerevisiae, EC-1118 Saccharomyces bayanus, Vin13, Vin7, N96 и WE352. Существует множество коммерческих источников дрожжевых штаммов, таких как Lallemand Inc. из Монреаля (Квебек, Канада).
В некоторых реализациях аспектов изобретения можно использовать эндогенные или гетерологичные ферменты, обладающие мочевино-деградирующей активностью, например мочевино-карбоксилазной и аллофанатгидролазной активностью DUR.1,2. Эти ферменты, например, могут быть гомологичны DUR.1,2 или участкам DUR1,2, обладающим соответствующей активностью.
Степень гомологии между последовательностями (такими как нативный белок DUR1,2 или нативные последовательности нуклеиновой кислоты DUR1,2 и последовательность альтернативного белка или нуклеиновой кислоты для применения в изобретении) может быть выражена как процент идентичности в случае оптимального выравнивания последовательностей, которое подразумевает наличие точных пар между последовательностями. Оптимальное выравнивание последовательностей для сравнения идентичности может быть выполнено с использованием множества алгоритмов, таких как алгоритм поиска локальных гомологий Смита и Ватермана (Smith and Waterman, 1981, Adv. Appl. Math 2: 482), алгоритм выравнивания по гомологии Нидлемана и Вунша (Needleman and Wunsch, 1970, J.Mol. Biol. 48: 443), способ поиска сходства по Пирсону и Липману (Pearson and Lipman, 1988, Proc. Natl. Acad. Sci. USA 85: 2444), и компьютеризированные реализации этих алгоритмов (такие как GAP, BESTFIT, FAST и TFASTA в программном пакете Wisconsin Genetics Software Package, Genetics Computer Group, Мэдисон, Висконсин, США). Выравнивание последовательностей может осуществляться также с использованием алгоритма BLAST, описанного у Altschul с соавт. (J.Mol. Biol., 1990, 215: 403-10), использующего опубликованные параметры по умолчанию. Программное обеспечение для осуществления BLAST-анализа может быть получено из Национального Центра Биотехнологической Информации (National Center for Biotechnology Information, адрес в Интернете http://www.ncbi.nlm.nih.gov/). BLAST-алгоритм включает в себя первичную идентификацию пар последовательностей с высокой степенью сходства (HSP от англ. high scoring sequence pairs) путем идентификации коротких слов (группы символов) длиной W в запрашиваемой последовательности, которые либо образуют пары, либо удовлетворяют некоторому положительно оцениваемому пороговому показателю (score) Т при выравнивании со словом той же длины в последовательности из базы данных. Т обозначает пороговую оценку сходства родственных слов. Первоначальное "попадание" в соседнее слово является источником для инициации поисков с целью найти более длинные HSP. Поиски совпадения слов расширяются в обоих направлениях вдоль каждой последовательности, поэтому кумулятивная оценка выравнивания может увеличиваться. Расширение поиска слов в каждом направлении прекращается, когда встречаются следующие параметры: кумулятивная оценка выравнивания резко уменьшается благодаря параметру Х от ее максимально достигнутого значения; кумулятивная оценка стремится к нулю или ниже благодаря накоплению одного или более отрицатально-оцениваемых выравниваний остатков; или достижению конца одной из двух последовательностей. Параметры BLAST-алгоритма W, Т и Х определяют чувствительность и скорость выравнивания. BLAST-программы могут использовать длину слова по умолчанию (W), равную 11, выравнивание (В), равное 50, оценочной матрицы BLOSUM62 (Henikoff and Henikoff, 1992, Proc. Natl. Acad. Sci. USA 89: 10915-10919), ожидание (Е) равное 10 (которое может меняться в альтернативных реализациях до 1, или 0,1, или 0,01, или 0,001, или 0,0001; хотя значения Е, гораздо большие 0,1, могут не идентифицировать функционально сходные последовательности, полезно проверять удачные попытки с более низкой значимостью, значения Е, от 0,1 до 10, для коротких участков сходства), М=5, N=4, для нуклеиновых кислот сравнение обеих цепей. Для сравнения белков может быть использована по умолчанию программа BLASTP следующим образом: G=11 (штраф за открытие пропуска); Е=1 (штраф за расширение пропуска); Е=10 (величина ожидания, в этом параметре предполагают, что 10 "попаданий" с показателями, равными или лучшими, чем определенный показатель выравнивания S, появляются случайно в базе данных того же размера, что и искомая последовательность; величина Е может увеличиваться или уменьшаться для изменения строгости поиска); и W=3 (размер слова, по умолчанию составляет 11 для BLASTN, 3 для других blast-программ). Матрица BLOSUM определяет оценку вероятности для каждого положения при выравнивании, которое основано на частоте, с которой, как известно, замена встречается среди консенсусных блоков в пределах родственных белков. Матрицу замен BLOSUM62 (штраф за пропуск = 11; штраф за пропуск остатка = 1; соотношение лямбда = 0,85) используют по умолчанию в BLAST 2.0. Множество других матриц может быть использовано в качестве альтернативных вариантов к BLOSUM62, включая: РАМ30 (9,1,0.87); РАМ70 (10,1,0.87) BLOSUM80 (10,1,0.87); BLOSUM62 (11,1,0.82) и BLOSUM45 (14,2,0.87). Одно измерение статистического сходства между двумя последовательностями с использованием BLAST-алгоритма представляет собой наименьшую сумму вероятностей (P(N)), которая указывает на вероятность, с которой совпадение двух нуклеотидных или аминокислотных последовательностей будет происходить случайно. В альтернативных реализациях изобретения нуклеотидные или аминокислотные последовательности считаются, по существу, идентичными, если наименьшая сумма вероятностей по сравнению с тест-последовательностями составляет примерно менее 1, предпочтительно менее 0,1, более предпочтительно, менее 0,01 и наиболее предпочтительно менее 0,001.
Последовательности нуклеиновой кислоты по настоящему изобретению в некоторых реализациях могут быть, по существу, идентичными, например, белку DUR1,2 или последовательностям нуклеиновой кислоты DUR1,2. Значительная идентичность таких последовательностей может быть отражена в проценте идентичности при оптимальном выравнивании, который, например, может быть больше 50%, от 80% до 100%, по меньшей мере 80%, по меньшей мере 90% или по меньшей мере 95%, что в случае ген-определяющих субстратов может относиться к идентичности части ген-определяющего субстрата участку последовательности-мишени, где степень идентичности может облегчать гомологичное спаривание и рекомбинацию и/или репарацию. Альтернативным указанием на то, что две последовательности нуклеиновой кислоты являются, по существу, идентичными, является то, что эти две последовательности гибридизуются друг с другом в умеренно жестких или предпочтительно жестких условиях. Гибридизацию с фильтр-связанными последовательностями в умеренно жестких условиях можно осуществлять, например, в 0,5 М NaHPO4, 7%-ном додецилсульфате натрия (ДСН), 1 мМ ЭДТА при 65°С, и промывку в 0,2×SSC/0,l% ДСН при 42°С (см. Ausubel, et al. (eds), 1989, Current Protocols in Molecular Biology, Vol.1, Green Publishing Associates, Inc., and John Wiley & Sons, Inc., New York, p.2.10.3). Альтернативно, гибридизацию с фильтр-связанными последовательностями в жестких условиях можно осуществлять, например, в 0,5 М NaHPO4, 7% ДСН, 1 мМ ЭДТА при 65°С, и промывку в 0,1×SSC/0,1% ДСН при 68°С (см. Ausubel, et al. (eds), 1989, выше). Условия гибридизации могут быть модифицированы в соответствии с известными способами в зависимости от интересующей последовательности (см. Tijssen, 1993, Laboratory Techniques in Biochemistry and Molecular Biology - Hybridization - with Nucleic Acid Probes, Часть I, Глава 2 "Обзор принципов гибридизации и стратегии анализов с использованием нуклеотидных зондов", Elsevier, New York). Обычно выбирают такие жесткие условия, которые примерно на 5°С ниже, чем точка плавления специфической последовательности при определенной ионной силе и рН. Промывки для жесткой гибридизации могут длиться, например, в течение по меньшей мере 15 мин, 30 мин, 45 мин, 60 мин, 75 мин, 90 мин, 105 мин или 120 мин.
Хорошо известно в данной области, что в структуру полипептида, такого как DUR1,2, можно внести некоторые модификации и изменения без существенного изменения биологической функции этого пептида, для того чтобы получить биологически эквивалентный полипептид. В одном аспекте изобретения, белки, мочевино-карбоксилазная и/или аллофанатгидролазная активность могут включать белки, которые отличаются от нативной последовательности DUR1,2 консервативными заменами аминокислот. Использующийся здесь термин "консервативные замены аминокислот" касается замены одной аминокислоты на другую в заданном положении в белке, где замена может осуществляться без существенной потери соответствующей функции. При осуществлении таких изменений, замены похожих аминокислотных остатков могут быть произведены на основе относительного сходства боковых цепей заместителей, например их размера, заряда, гидрофобности, гидрофильности и тому подобного, и влияние таких замен на функцию белка может быть проанализировано с помощью стандартного исследования.
В некоторых реализациях могут быть выполнены консервативные замены аминокислот, где аминокислотный остаток замещен на другой аминокислотный остаток, имеющий похожую величину гидрофильности (например, в пределах значения плюс или минус 2,0), где нижеследующее может быть аминокислотой, имеющей показатель гидропатичности около -1,6, например, Туг (-1,3) или Pro (-1,6) соотносятся с аминокислотными остатками (как подробно описано в патенте US 4554101, включенном здесь посредством ссылки): Arg (+3,0); Lys (+3,0); Asp (+3,0); Glu (+3,0); Ser (+0,3); Asn (+0,2); Gin (+0,2); Gly (0); Pro (-0,5); Thr (-0,4); Ala (-0,5); His (-0,5); Cys (-1,0); Met (-1,3); Val (-1,5); Leu (-1,8); Ilе (-1,8); Тyr (-2,3); Phe (-2.5) и Тrр (-3,4).
В альтернативных реализациях могут быть выполнены консервативные замены аминокислот, где аминокислотный остаток замещен на другой аминокислотный остаток, имеющий похожую величину гидрофильности (например, в пределах значения плюс или минус 2,0). В таких реализациях каждому аминокислотному остатку может быть приписан показатель гидропатичности на основе его гидрофобности и заряда следующим образом: Ilе (+4,5); Val (+4,2); Leu (+3,8); Phe (+2,8); Cys (+2,5); Met (+1,9); Ala (+1,8); Gly (-0,4); Thr (-0,7); Ser (-0,8); Тrр (-0,9); Тyr (-1,3); Pro (-1,6); His (-3,2); Glu (-3,5); Gin (-3,5); Asp (-3,5); Asn (-3,5); Lys (-3,9) и Arg (-4,5).
В альтернативных реализациях могут быть выполнены консервативные замены аминокислот, где аминокислотный остаток замещен на другой аминокислотный остаток того же класса, где аминокислоты подразделяются на классы неполярных, кислых, основных и нейтральных аминокислот, как следует ниже: неполярные: Аlа, Val, Leu, Ile, Phe, Trp, Pro, Met; кислые: Asp, Glu; основные: Lys, Arg, His; нейтральные: Gly, Ser, Thr, Cys, Asn, Gin, Tyr.
В альтернативных реализациях консервативные замены аминокислот включают замены, основанные на представлениях о гидрофильности или гидрофобности, размере, или объеме, или заряде. Как правило, аминокислоты могут быть охарактеризованы как гидрофобные или гидрофильные главным образом в зависимости от свойств аминокислотной боковой цепи. Гидрофобная аминокислота имеет гидрофобность больше нуля, а гидрофильная аминокислота имеет гидрофильность менее нуля, исходя из нормированной шкалы гидрофобности Айзенберга с соавт. (Eisenberg et al., J.Mol. Bid. 179:125-142, 184). Генетически кодируемые гидрофобные аминокислоты включают Gly, Ala, Phe, Val, Leu, Ile, Pro, Met и Trp, и генетически кодируемые гидрофильные аминокислоты включают Thr, His, Glu, Gin, Asp, Arg, Ser и Lys. Негенетически кодируемые гидрофобные аминокислоты включают m-бутиламин, тогда как негенетически кодируемые гидрофильные аминокислоты включают цитруллин и гомоцистеин.
Гидрофобные или гидрофильные аминокислоты могут быть дополнительно разделены на основе свойств их боковых цепей. Например, ароматическая аминокислота представляет собой гидрофобную аминокислоту с боковой цепью, содержащей по меньшей мере одно ароматическое или гетероароматическое кольцо, которое может содержать один или более заместителей, таких как -ОН, -SH, -CN, -F, -Cl, -Br, -I, -NO2, -NO, -NH2, -NHR, -NRR, -C(O)R, -C(O)OH, -C(O)OR, -C(O)NH2, -C(O)NHR, -C(O)NRR и т.д., где R независимо представляет собой (С1-С6)-алкил, замещенный (С1-С6)-алкил, (С1-С6)-алкенил, замещенный (С1-С6)-алкенил, (C1-С6)-алкинил, замещенный (С1-С6)-алкинил, (С5-С20)-арил, замещенный (С5-С20)-арил, (С6-С26)-алкарил, замещенный (С6-С26)-алкарил, 5-20-членный гетероарил, замещенный 5-20-членный гетероарил, 6-26-членный алкгетероарил или замещенный 6-26-членный алкгетероарил. Генетически кодируемые ароматические аминокислоты включают Phe, Тyr и Trp.
Неполярная аминокислота представляет собой гидрофобную аминокислоту с боковой цепью, которая является незаряженной при физиологическом рН и имеет связи, в которых пара электронов, обобществленная двумя атомами, как правило, в равной степени удерживается каждым из двух атомов (т.е. боковая цепь является неполярной). Генетически кодируемые неполярные аминокислоты включают Gly, Leu, Val, Ile, Ala и Met. Неполярные аминокислоты могут быть дополнительно разделены с включением алифатических аминокислот, которые представляют собой гидрофобные аминокислоты, имеющие алифатическую углеводородную боковую цепь. Генетически кодируемые алифатические аминокислоты включают Ala, Leu, Val и Ilе.
Полярная аминокислота представляет собой гидрофильную аминокислоту с боковой цепью, которая является незаряженной при физиологическом рН, но имеет одну связь, в которой пара электронов, обобществленная двумя атомами, находится ближе к одному из атомов. Генетически кодируемые полярные аминокислоты включают Ser, Thr, Asn и Gin.
Кислая аминокислота представляет собой гидрофильную аминокислоту со значением рКа для боковой цепи менее 7. Кислые аминокислоты обычно имеют отрицательно заряженные боковые цепи при физиологическом рН благодаря потере иона водорода. Генетически кодируемые кислые аминокислоты включают Asp и Glu. Основная аминокислота представляет собой гидрофильную аминокислоту со значением рКа для боковой цепи больше 7. Основные аминокислоты обычно имеют положительно заряженные боковые цепи при физиологическом рН благодаря ассоциации с ионом гидроксония. Генетически кодируемые основные аминокислоты включают Arg, Lys и His.
Специалистам в данной области следует принять во внимание, что вышеупомянутые классификации не являются абсолютными и что аминокислоты могут быть отнесены к более чем одной категории. Кроме того, аминокислоты могут быть классифицированы на основе известного поведения и/или характерных химических, физических или биологических свойств, на основе специфических анализов или на сравнении с предварительно идентифицированными аминокислотами.
В различных аспектах изобретения мочевино-деградирующая активность хозяина может регулироваться таким образом, что она будет находиться на желательном уровне при условиях ферментации, таких как условия винной ферментации. Термин "условия ферментации" или "ферментирующие условия" означает условия, при которых организм, например, S. cerevisiae, производит энергию путем ферментации, т.е. условия культивирования, при которых происходит ферментация. В широком смысле, ферментация представляет собой совокупность анаэробных реакций, которые могут обеспечивать энергию для роста микроорганизмов при отсутствии кислорода. Энергия в процессе ферментации обеспечивается за счет фосфорилирования на уровне субстрата. В процессе ферментации органическое соединение (источник энергии) служит в качестве донора электронов, а другое органическое соединение является акцептором электронов. Для ферментации могут использоваться различные органические субстраты, например углеводы, аминокислоты, пурины и пиримидины. В одном аспекте изобретение касается таких организмов, как дрожжи, которые способны ферментировать углево