Способ определения количества микроскопических структур в тканях органа
Иллюстрации
Показать всеИзобретение относится к гистохимическим методам исследования. Сущность способа заключается в том, что проводят окрашивание и микроскопию определенного количества срезов, выбранных особым образом из полного числа срезов серии, сделанных вдоль оси объекта перпендикулярно ее плоскости. Определяют количество исследуемых микроскопических структур в каждом из выбранных срезов. Исходя из полученных экспериментальных данных, на основе математической формулы рассчитывают общее число микроскопических структур. Способ может быть использован, в частности, для определения количества нейронов среднего отдела компактной части черной субстанции головного мозга после действия нейротоксина. Использование данного способа позволяет снизить число исследуемых срезов в три и более раза при сохранении достоверности анализа в рамках 5% на различных биологических объектах с неоднородным распределением подсчитываемых структур, в частности при резком изменении числа нейронов от слоя к слою. 2 з.п. ф-лы, 1 ил., 1 табл.
Реферат
Изобретение относится к области медицины и биологии, в частности к морфологическим исследованиям, и может быть использовано в лабораторных целях.
Известен способ определения общего числа микроскопических структур в тканях по гистологической методике с помощью общепринятой формулы Конигсмарка (см., Konigsmark B.W. (1970) Methods for the counting of neurons / In W.J.H.Nauta and S.O.E.Ebbeson (eds): Contemporary research method in neuroanatomy. New York: Springer, pp.315-380). Способ позволяет использовать для подсчета количества интересующих структур часть срезов, а затем, используя сумму подсчитанных микроскопических структур, рассчитать количество микроскопических структур на всю область как пропорцию. Однако такой способ предполагает постоянство плотности нейронов на длине масштаба и оказывается в достаточной степени неточным при их неоднородном распределении.
Известно, в частности, использование данной методики для моделирования болезни Паркинсона на мышах при введении специфического токсина МРТР с последующим подсчетом нейронов (US 5844003, Tatton et al., 01.12.1998). При оценке числа нейронов черной субстанции, содержащих тирозингидроксилазу, использовался метод Конигсмарка. Однако недостатком этого метода является резкое снижение точности определения при наличии резкого изменения числа микроскопических структур на соседних обрабатываемых срезах, а также недостаточная надежность при уменьшении количества обрабатываемых срезов. При моделировании нейродегенеративных заболеваний в организм лабораторных животных вводят токсины, вызывающие гибель специфических нейронов (Erwan Bezard et a Kinetics of nigral degeneration in a chronic model of MPTP-treated mice, Neuroscience Letters 234 (1997) 47-50; ближайший аналог). При этом одним из важнейших и наиболее информативных показателей для оценки эффективности действия токсина является подсчет числа микроскопических структур - ядер нейронов. Классически подсчет ядер нейронов проводят на каждом из серийных гистологических срезов посредством микроскопии, иногда с последующей оцифровкой и переносом изображений на персональный компьютер. Подсчет количества структур - ядер нейронов проводят в заданной области каждого среза, а затем значения суммируются и вычисляется значение - общее количество ядер нейронов на всю область ткани (на мозг). Именно такой показатель позволяет оценить выраженность гибели нейронов и, следовательно, выраженность поражения, однако такой анализ, как показывают наши эксперименты, является чрезвычайно трудоемким. Так, например, в случае стандартного эксперимента при моделировании болезни Паркинсона у мышей с 1/2 мозга готовится 70-75 срезов черной субстанции, на которых выявляется в среднем около 2000 нейронов. Поскольку для одного эксперимента используется 20 животных (опытные и контрольные животные), на их обработку у исследователя уходит в среднем до 50 рабочих дней.
Задачей настоящего изобретения является определение общего количества микроскопических структур, имеющихся в локальной области ткани. Такой областью может быть орган, фрагмент ткани, в частности головной мозг животного как в норме, так и подвергшийся воздействию медикамента и пр. При этом должно обеспечиваться сохранение точности определения общего числа микроскопических структур в тканях при обработке (реагентами и микроскопии) существенно меньшего числа выбранных срезов.
Задача решена тем, что способ определения количества микроскопических структур в тканях органа состоит в выполнении гистологических срезов вдоль оси объекта, перпендикулярной плоскости среза, окрашивании, проведении микроскопии с подсчетом количества структур с заданными признаками на срезах и расчете общего числа этих структур.
Способ характеризуется тем, что окрашиванию и микроскопии подвергают срезы с порядковым номером ki, i=1, …, Ss, выбранные из условия
ki=round(i•St/(Ss+1)),
где Ss - число выбранных срезов, - полное число срезов (L - длина органа, d - толщина среза); round(…) - округление до ближайшего целого.
Общее количество N структур рассчитывают по формуле
где , , …, - количество структур с заданными признаками на выбранных срезах; α1, …, αSs - коэффициенты, определяемые в результате оптимизации данных экспериментов.
Способ может характеризоваться тем, что окрашиванию и микроскопии подвергают срезы с порядковым номером ki, i=1, …, 20, выбранные равномерно по длине органа,
при этом общее число N структур рассчитывают по формуле
где α1=0,04; α2=0,028; α3=0,87; α4=1,13; α5=1,05; α6=0,87; α7=0,87; α8=1,05; α9=1,8; α10=0,91; α11=0,79; α12=0,88; α13=1,06, α14=1,13; α15=0,90; α16=0,78; α17=0,98; α19=0,77;
α20=0,21.
Способ может характеризоваться и тем, что в качестве микроскопических структур в гистологических срезах выявляют тирозингидроксилаза-иммунореактивные нейроны в среднем отделе компактной части черной субстанции головного мозга лабораторных животных в ростро-каудальном направлении, после действия нейротоксина.
Технический результат изобретения состоит в снижении числа исследуемых срезов в 3-4 и более раз при сохранении достоверности анализа в рамках 5%, в возможности использования данного метода на различных биологических объектах с неоднородным распределением подсчитываемых структур, в частности при резком изменении числа нейронов от слоя к слою.
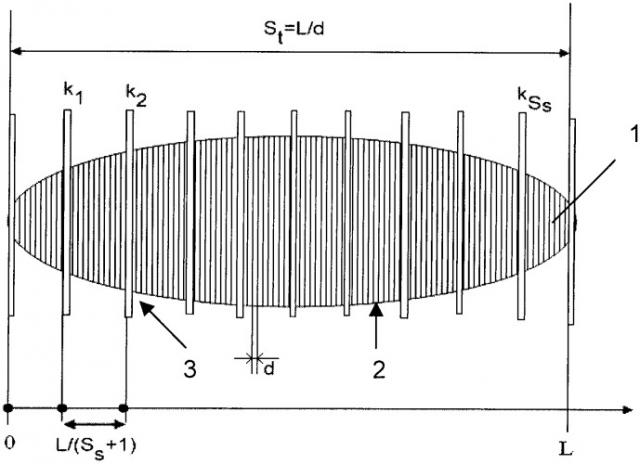
На чертеже условно показана компактная часть 1 мозга длиной L, фронтальные срезы 2, избранные срезы 3, каждый из которых по известной методике подвергается соответствующей биохимической обработке, исследованию и подсчету микроскопических структур, в частном случае - нейронов.
Изначально, для любого образца задано число подлежащих обработке срезов Ss=20. Образец длиной L нарезается на слои толщиной d, соответственно полное число срезов при этом будет .
Затем из общего числа срезов St отбирается Ss срезов для обработки реагентами и подсчета в них микроскопических структур - нейронов.
При "равномерной" сетке номера ki, i=1, …, Ss срезов для обработки выбираются из условия: ki=round(i•St/(Ss+1)). Далее по каждому из 5 избранных срезов подсчитываются , i=1, …, Ss - число структур в выбранных срезах.
Общее число нейронов (структур) N рассчитывается по полученным данным , , …, (числа структур в выбранных срезах) на основе формулы:
Ss=20,
где α1=0,04; α2=0,028; α3=0,87; α4=1,13; α5=1,05; α6=0,87; α7=0,87; α8=1,05; α9=1,8; α10=0,91; α11=0,79; α12=0,88; α13=1,06, α14=1,13; α15=0,90; α16=0,78; α17=0,98; α19=0,77;
α20=0,21.
Значения коэффициентов α - весовых констант определяются на основе регрессионного анализа данных, полученных в результате предварительных экспериментов на аналогичных объектах исследования - мышах. Для подсчета общего количества N в вышеуказанном примере для 20-ти срезов каждого образца распределение нейронов при выборе оси в ростро-каудальном направлении аппроксимируется в рамках линейной регрессии. Следует отметить, что общее число нейронов N, также как в формуле Конигсмарка, пропорционально отношению St/Ss, которое является внешним параметром аппроксимации - он, как отмечено ниже, определяется из соображений уменьшения ресурсов и затрат на получения первичных данных , , …, . Другой параметр метода - параметрическая размерность аппроксимации k - подбирается экспериментально, например, из результатов сравнения оценок N и непосредственного подсчета по всем серийным срезам St полного числа нейронов N*. Параметр k зависит от St/Ss: при малых k и больших St/Ss, также, как и формула Конигсмарка, аппроксимация дает достаточно грубые результаты. При очень больших k оценка становится очень чувствительной к ошибкам подсчетов и также дает плохие результаты. Оптимальное значение k находится между этими предельными случаями и, как отмечено выше, лучший способ его определения - экспериментальный. В частности, из проведенных экспериментов, в которых St/Ss выбиралось в районе 3~4 наилучшая параметрическая размерность аппроксимации оказалась k~8.
Пример. При проведении стандартного эксперимента подсчет числа тирозингидроксилаза-содержащих нейронов (ТГ-нейроны) проводился на серии гистологических срезов черной субстанции. Использовали самцов мышей линии C56/BL. Средний вес животных составлял 24 г., возраст - 2,5 месяца. В эксперименте участвовали 4 интактных и 4 опытных животных. После введения специфического нейротоксина животных декапитировали. Выделенный мозг фиксировали в параформальдегиде (4%), инкубировали в растворе сахарозы (20%) и замораживали при -35°С в гексане. На криостате делали серийные фронтальные срезы левой половины мозга толщиной d=20 мкм и монтировали их на стекла. Затем известным методом (см. Abramova M. et al. Dynamical study of tyrosine hydroxylase expression and its correlation with vasopressin turnover in the magnocellular neurons of the supraoptico-posthypophysial system under long-term salt loading of adult rats, Brain Research., 2002 Jan 18; 925(1): 67-75) выявляли ТГ-нейроны.
ТГ-нейроны анализировали в области компактной части черной субстанции. Каждый срез из полной серии срезов фотографировался с помощью цифровой камеры Olympus DP70, соединенной с микроскопом Olympus BX51 (объектив - X 10). Для количественного анализа использовалась программа AnalySIS 5.0. На каждом срезе в соответствии с атласом отмечали область компактной части черной субстанции, затем в ней помечали ТГ-нейроны и их число суммировали. За ТГ-нейрон принимались только клетки с видимым ядром.
У мышей с 1/2 мозга приготовлено и обработано по 20 срезов черной субстанции вместо обычных ~75 срезов. Ниже представлены результаты общего числа N нейронов, подсчитанных с серии гистологических срезов черной субстанции мозга для четырех лабораторных животных (М 1-М 4). С учетом того, что в среднем для одного эксперимента используется 20 животных (опытные и контрольные животные), на обработку с использованием патентуемой методики у исследователя уходит в среднем 10 рабочих дней. При этом погрешность в определении количества не превышает 3%.
| Параметр | M1 | M2 | M3 | M4 |
| St | 73 | 77 | 75 | 72 |
| N* (St=72-77 срезов) | 3073 | 2208 | 2296 | 2972 |
| N (Ss=20 срезов) | 3022 | 2146 | 2333 | 2955 |
| |N*-N|/N•100, % | 1,6 | 2,8 | 1,6 | 0,5 |
Таким образом, использование патентуемого способа позволяет существенно, в несколько раз, сэкономить как рабочее время исследователя, так и используемые реактивы на скрининговые морфологические исследования, что позволит гораздо быстрее и экономически эффективнее продвинуться в разработке моделей нейродегенеративных болезней Паркинсона, Альцгеймера и др. Описанная методика может быть использована для широкого класса морфологических исследований при подсчете микроскопических структур.
1. Способ определения количества микроскопических структур в тканях органа, состоящий в выполнении гистологических срезов вдоль оси объекта, перпендикулярной плоскости среза, окрашивании, проведении микроскопии с подсчетом количества структур с заданными признаками на срезах и расчете общего числа этих структур, отличающийся тем, что окрашиванию и микроскопии подвергают срезы с порядковым номером ki, i=1, …, Ss, выбранные из условияki=round(i·St/(Ss+1)),где Ss - число выбранных срезов, - полное число срезов, где L - длина органа, d - толщина среза; round(…) - округление до ближайшего целого, а общее число N структур рассчитывают по формуле ,где , , …, - количество структур с заданными признаками на выбранных срезах;α1, …, αSs - коэффициенты, определяемые в результате оптимизации данных эксперимента.
2. Способ по п.1, отличающийся тем, что окрашиванию и микроскопии подвергают срезы с порядковым номером ki, i=1, …, 20, выбранные равномерно по длине, при этом общее число N структур рассчитывают по формуле: ,где α1=0,04; α2=0,028; α3=0,87; α4=1,13; α5=1,05; α6=0,87; α7=0,87; α8=1,05; α9=1,8; α10=0,91; α11=0,79; α12=0,88; α12=1,06, α14=1,13; α15=0,90; α16=0,78; α17=0,98; α19=0,77; α20=0,21.
3. Способ по п.1 или 2, отличающийся тем, что в качестве микроскопических структур в гистологических срезах выявляют тирозингидроксилазасодержащие нейроны в среднем отделе компактной части черной субстанции головного мозга лабораторных животных в ростро-каудальном направлении, после действия нейротоксина.