Способ сохранения жизнеспособности изолированного полнослойного кожного трансплантата
Иллюстрации
Показать всеИзобретение относится к экспериментальной медицине и хирургии и может быть применимо для сохранения жизнеспособности изолированного полнослойного кожного трансплантата в эксперименте. Укрывают полупроницаемой мембраной наружную поверхность кожного трансплантата. Устанавливают на расстоянии до 4,0 см от трансплантата отражатель, на котором фиксированы монокристаллы кремния с общей площадью, составляющей 1/4 от площади кожного трансплантата. Выдерживают трансплантат в течение 4-х суток при температуре 37°C в воздушной среде при относительной влажности воздуха 100%. Способ позволяет увеличить выживаемость трансплантата. 4 ил.
Реферат
Изобретение относится к медицине, в частности к экспериментальной, для разработки операций кожной пластики в травматологии, ортопедии и камбустиологии.
Известен способ сохранения жизнеспособности изолированных кожных трансплантатов действием постоянного магнитного поля (см., например, авторы: Шилов В.Н., Рабинович Э.З., Кузнецов А.Н.: статья "Влияние постоянного магнитного поля на хемилюминесценцию кожи при ее деструкции " в журнале "Биофизика", 1983. - Т.28. - вып.5. - С.863). Сущность способа заключается в выдерживании в течение 24 часов кожного трансплантата на подложке с физиологическим раствором при температуре 5°C в непосредственной близости от намагниченного магнитофорного аппликатора.
В указанном способе смоделированные условия сохранения кожных трансплантатов имеют температурный режим, который неприемлем в ситуации пересадки трансплантата в область раневого дефекта, температура которого составляет порядка 37°C. Это является недостатком способа.
Известен также способ сохранения жизнеспособности изолированных кожных трансплантатов, взятый нами за прототип (см., например, авторы Петраш В.В., Никитюк И.Е.: статья "Использование эффектов фотонно-волновых взаимодействий биосистем с веществом в продлении жизнеспособности изолированных кожных лоскутов (экспериментальное исследование)" в журнале "Вестник Санкт-Петербургской государственной медицинской академии им. И.И.Мечникова", 2007. - №1. - в печати).
Сущность способа заключается в выдерживании завернутого в тонкий полиэтилен кожного трансплантата при температуре 37°C в воздушной среде при относительной влажности воздуха 100%, при этом его наружная поверхность контактировала либо с кристаллами кремния, либо с блестящей поверхностью алюминиевой фольги. В течение 3 суток термостатирования все изолированные трансплантаты сохранили структуру дермальных тканей, что объясняется стимулирующим влиянием излучаемых ими собственных электромагнитных полей, отраженных или преобразованных кристаллами кремния или поверхностью фольги.
В способе имеется недостаток: при удалении кристаллов кремния или поверхности алюминиевой фольги от трансплантата на расстояние, превышающее 1,0 см, наступает некроз мышечного слоя трансплантата, поэтому способ неприемлем для использования в анатомических областях с выраженной неровностью рельефа поверхности, например на лице, кистях.
Задачей изобретения является увеличение времени выживаемости изолированного полнослойного кожного трансплантата, которое сопоставимо по продолжительности с периодом восстановления питания трансплантата в случае его реимплантации, с таким расчетом, чтобы созданные условия были приемлемы для трансплантатов с неровным рельефом поверхности.
Поставленная задача достигается тем, что укрывают полупроницаемой мембраной наружную поверхность кожного трансплантата, обращенную к монокристаллам кремния, размерами, например, 5×5×1 мм, с общей площадью, составляющей 1/4 от площади кожного трансплантата, и выдерживают в термостате течение 4-х суток при температуре 37°C в воздушной среде при относительной влажности воздуха 100%, при этом монокристаллы кремния фиксированы на отражателе, например, из полированной алюминиевой фольги, размерами, превышающими размеры трансплантата, и установленным на расстоянии до 4,0 см от трансплантата.
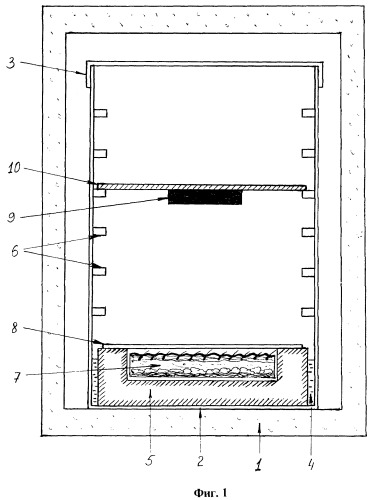
На фигуре 1 показана схема взаиморасположения в термостате кожного трансплантата, кристалла кремния и отражателя (сечение по вертикали), где:
- позиция 1 - термостат;
- позиция 2 - пластиковый контейнер;
- позиция 3 - крышка контейнера;
- позиция 4 - вода на дне контейнера;
- позиция 5 - подставка;
- позиция 6 - опорные планки;
- позиция 7 - изолированный полнослойный кожный трансплантат;
- позиция 8 - полупроницаемая мембрана;
- позиция 9 - монокристалл кремния;
- позиция 10 - отражатель.
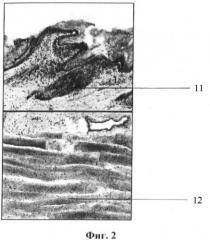
На фигуре 2 представлена гистограмма нормальной кожи, где:
- позиция 11 - волосяной фолликул, состоящий из жизнеспособных клеток с хорошо прокрашиваемыми ядрами;
- позиция 12 - мышечные волокна мышечного слоя, имеющие отчетливую поперечную исчерченность и хорошо прокрашиваемые ядра.
На фигуре 3 представлена гистограмма контрольного изолированного полнослойного кожного трансплантата через 1 сутки термостатирования без использования монокристаллов кремния на отражателе, где:
- позиция 11 - волосяной фолликул, дегенеративно измененный;
- позиция 12 - мышечные волокна мышечного слоя, дегенеративно измененные.
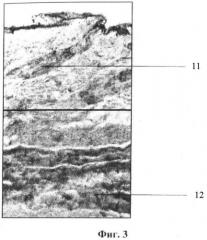
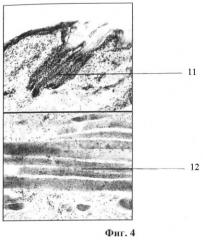
На фигуре 4 представлена гистограмма изолированного полнослойного кожного трансплантата через 4 суток термостатирования на расстоянии 4,0 см от отражателя с монокристаллами кремния, где:
- позиция 11 - волосяной фолликул, состоящий из жизнеспособных клеток с хорошо прокрашиваемыми ядрами;
- позиция 12 - мышечные волокна мышечного слоя, имеющие хорошо сохраненную структуру.
Осуществление способа базируется на следующих положениях. Хорошо известно, что клетки организма человека и животных вследствие непрерывно протекающих в них квантовых и биохимических превращений являются источниками широкого спектра электромагнитных излучений (см., например, источник: Биофизика: Учеб. для студ. высш. учеб. заведений // Под ред. проф. В.Ф.Антонова. - М.: Гуманит. изд. центр «ВЛАДОС», 2003. - 288 с.). Известно также, что и кожные покровы обладают собственными электрическими полями, которые наводятся потенциалами биологически активных точек, расположенных на поверхности кожи (См., например, авторы: Куротченко С.П., Луценко Ю.А., Новиков А.С. и др.: статья: "Регистрация и обработка электромагнитных сигналов, отраженных от биологически активных точек организма" в журнале "Вестник новых медицинских технологий". - 2006. - Т.XIII., №1. - С.161-164).
Способ осуществляем следующим образом (фигура 1). Иссекаем полнослойный кожный трансплантат 7, отделяем от организма человека или животного, например кролика, переносим на текстолитовую подставку 5, которую помещаем в пластиковый контейнер 2 с налитой на дне водой 4, тем самым в контейнере устанавливается относительная влажность воздуха 100%. Для создания микроклимата наружную поверхность трансплантата накрываем пленочной полимерной мембраной 8, например, полиэтиленом толщиной 0,03 мм, полупроницаемым для воздуха и паров воды. Над трансплантатом устанавливаем плоский отражатель 10 правильной четырехугольной формы, выполненный, например, из листа полированной алюминиевой фольги толщиной, например, 0,02 мм. Известно, что собственные электромагнитные излучения биообъектов, отраженные от зеркальных поверхностей, оказывают благоприятное воздействие на метаболические процессы в их тканях (см., например, авторы: Петраш В.В., Боровков Е.И., Довгуша В.В. и др.: статья: "Аутооптический эффект" в журнале "Доклады Академии Наук". - 2004. - Т.396, №3. - С.410-413). Размеры отражателя подбираем таким образом, чтобы контуры трансплантата проекционно не выходили за границы отражателя. Для исключения прогибания отражателя его края загибаем в противоположную от трансплантата сторону, что способствует упрочению конструкции. К поверхности отражателя, обращенной к трансплантату, клеем БФ-6 фиксируем монокристаллы кремния 9 размерами, например, 5×5×1 мм, общая площадь которых составляет 1/4 от площади трансплантата (из расчета 1 кристалл на 1 см2 поверхности кожи). Известно, что кристаллический кремний относится к полупроводникам, которые имеют обычное свойство преобразовывать падающие на них электрические сигналы (в рассматриваемой ситуации - потенциалы действия кожных покровов), усиливая их мощность, и генерировать под их действием собственные электромагнитные волны (См., например, автор: Петров К.С.: учебное пособие: "Радиоматериалы, радиокомпоненты и электроника". - СПб.: Питер, 2006. - 522 с.). Электромагнитные волны, преобразованные кристаллами кремния, оказывают благоприятное влияние на кожные ткани, так как известно, что все биоткани в процессе эволюции стали фактически моделировать свою структуру в соответствии с параметрами минеральных кристаллических решеток (см., например, автор: Голубев С.Н.: статья: "Минеральные кристаллы внутри организмов и их роль в происхождении жизни" в журнале "Журнал общей биологии". - 1987. - Т.XL VIII, №6. - С.784-805). Отражатель с установленными на нем кристаллами кремния представляет собой жесткую конструкцию плоской формы. При моделировании реальных условий применительно к трансплантатам с неровным рельефом поверхности (например, ухо), учитываем, что различные участки трансплантата могут располагаться на неодинаковых расстояниях от плоского отражателя. Поэтому определяем расстояние от поверхности трансплантата до отражателя с кристаллами кремния, на котором кожные ткани трансплантата сохраняют жизнеспособность. С учетом этого отражатель последовательно устанавливаем на опорных пластиковых планках 6 параллельно поверхности трансплантата на расстоянии от 1,0 до 6,0 см с интервалом 1,0 см. Пластиковый контейнер плотно закрываем крышкой 3 (для предотвращения испарения воды), после этого помещаем в термостат 1, например, электрический суховоздушный ТС-80М-2, в котором с помощью автоматического регулятора поддерживается постоянная температура воздуха 37°C. Оптимальное время выдерживания кожных трансплантатов в термостате, в течение которого они продолжают сохранять жизнеспособность, определяем последовательно каждый день на протяжении 6 суток.
Жизнеспособность изолированного кожного трансплантата оцениваем гистологически по критерию сохранности клеточных ядер волосяных фолликулов и структуры поперечно-полосатых мышечных волокон мышечного слоя. При термостатировании трансплантатов на удалении от 1,0 до 4,0 см от отражателя с монокристаллами кремния клеточная структура волосяных фолликулов и поперечно-полосатых мышечных волокон сохраняется в течение 4-х суток (фигура 4), такое гистологическое строение трансплантатов соответствует структуре кожи в норме (фигура 2). При увеличении расстояния между трансплантатом и отражателем с монокристаллом кремния до 5,0 см выявляются выраженные дистрофические изменения в тканях трансплантата, а на расстоянии 6,0 см наступает некроз всех его слоев. Таким образом смоделированы условия сохранения жизнеспособности кожных трансплантатов для ситуации с неровным рельефом их поверхности.
При термостатировании трансплантатов свыше 4-х суток в их тканях стремительно развиваются процессы аутолиза, что приводит к быстрому некрозу трансплантатов, независимо от того, на каком расстоянии они находились от отражателя с монокристаллом кремния.
В контрольном кожном трансплантате при аналогичных условиях, но при отсутствии на на него воздействия со стороны отражателя с монокристаллом кремния, трансплантат начинал терять жизнеспособность, начиная с первого дня, о чем свидетельствуют дегенеративно-дистрофические изменения в волосяных фолликулах и поперечно-полосатых мышечных волокнах (фигура 3).
Указанный способ может быть использован для изучения в условиях in vitro оптимизации методов кожной аутопластики и реимплантации с целью лечения полнослойных кожных ран различной этиологии на участках тела с неровным рельефом поверхности.
Способ сохранения жизнеспособности изолированного полнослойного кожного трансплантата в эксперименте, включающий укрывание полупроницаемой мембраной наружной поверхности трансплантата, обращенной к монокристаллам кремния, выдерживание в течение 4-х суток при температуре 37°C в воздушной среде при относительной влажности воздуха 100%, отличающийся тем, что на расстоянии до 4,0 см от трансплантата устанавливают отражатель, на котором фиксированы монокристаллы кремния с общей площадью, составляющей 1/4 от площади кожного трансплантата.