Способ восстановления гиалинового хряща при лечении внутрисуставных переломов
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к травматологии и ортопедии, и может быть применимо для восстановления гиалинового хряща при лечении внутрисуставных переломов. Вводят в область остеохондрального дефекта коллагеновую губку, состоящую из коллагена типа I и костной крошки в соотношении 1:1 w/w. Способ позволяет ускорить восстановление костной ткани и хряща. 7 ил.
Реферат
Изобретение относится к медицине, в частности к трансплантологии, травматологии и ортопедии, и предназначено для восстановления костно-хрящевых внутрисуставных дефектов.
В травматологической практике внутрисуставные переломы составляют приблизительно 1/3 от всех повреждений скелета. Восстановление анатомической целостности и конгруэнтности суставных поверхностей при внутрисуставных переломах является важным звеном в лечении этих повреждений и профилактике посттравматических осложнений, которые сопровождаются развитием артритов, формированием анкилозов и инвалидизацией больных. В этой связи постоянно совершенствуются способы лечения остеохондральных внутрисуставных дефектов.
Известно, что большие остехондральные дефекты самостоятельно не восстанавливаются [Jackson DW, Labor PA., Aberman HM. et al. Spontaneous Repair of Full-Thickness Defects of Articular Cartilage in a Goat Model. J Bone Joint Surg. 2001; 83: 53]. Суставная поверхность покрыта гиалиновым хрящом, обеспечивающим скольжение суставных поверхностей относительно друг друга. Гиалиновый хрящ образован хондроцитами, растущими из субхондральной зоны, расположенной на границе между костью и хрящом, и массивным коллагеновым слоем, соответствующим степени нагрузки, которая выпадает на данный участок хряща [Muir H. The chondrocyte, architect of cartilage. Biomechanics, structure, function and molecular biology of cartilage matrix macromolecules. Bioessays 1995; 17(12):1039-48]. При травме суставного хряща интенсивность восстановительных процессов зависит от глубины поражения, площади поврежденного участка, степени дезорганизации межклеточного матрикса и условий существования хряща после травмы [В.Н.Павлова, Т.Н.Копьева, Л.И.Слуцкий, Г.Г.Павлов. Хрящ. - М.: Медицина. - 1988. - с.479].
Несмотря на разнообразие стимулирующих восстановление хрящевой пластинки приемов значительные дефекты хрящевой поверхности замещаются грубой соединительной тканью или фиброзным хрящом, механические свойства которого не соответствуют суставным нагрузкам, условия скольжения нарушаются, что проявляется серьезными функциональными нарушениями.
В настоящее время устранение обширных травматических дефектов хрящевой ткани суставов осуществляется, в основном, методом оперативной коррекции. Альтернативой хирургическим приемам могут служить методы клеточной и тканевой инженерии, с которыми связывают повышение эффективности лечения [Репин B.C., Суша Г.Т. Медицинская клеточная биология. БЭБиМ, 1998. - т.126. - №10. - С.459].
Известен способ стимуляции репаративной регенерации гиалинового хряща суставов путем имплантации эмбриональных хондроцитов или стволовых клеток зародышевой соединительной ткани (патент ФРГ №341063). Недостатком известного способа является применение аллогенных тканей, что весьма часто приводит к их отторжению.
Известен способ восстановления дефекта гиалинового хряща путем введения в сустав взвеси аутологичных костномозговых стромальных клеток-предшественников, выращенных предварительно in vitro (патент RU №2142285). Однако такой способ восстановления дефекта гиалинового несет опасность, связанную с тиражированием клеток в искусственных условиях. Большое число исследователей указывает на высокую вероятность повреждения генома мезенхимальных клеток в процессе культивирования [Бочков Н.П., Воронина Е.С., Косякова Н.В. и др. Хромосомная изменчивость мультипотентных мезенхимальных клеток стромальных клеток человека. Клеточные технологии в биологии и медицине, 2007, №1. - C.11-15].
Известен способ восстановления гиалинового хряща путем введения высокой концентрации мезенхимальных клеток аутологичного костного мозга в остеохондральный дефект и их фиксацией с помощью фибринового клея [Oshima Y., Watanabe N., Matsuda K-i. et al. Behavior of Transplanted Bone Marrow-derived GFP Mesenchymal Cell in Osteochondral Defect as a Stimulation of Autologous Transplantation. J.Histochem. Cytochem. 2005; 53(2):207-216]. Однако и этому способу присущи недостатки предыдущего способа. Кроме того, мезенхимальные клетки не экспрессируют αvp3 интегрин, обеспечивающий закрепление на фибрине, поэтому фибриновый клей препятствует пролиферации и движению мезенхимальных клеток и, вероятно, гистогенезу гиалинового хряща, т.к. дефект заполняется, в основном, волокнистым хрящом [Сlark RAF. Fibrin and Wound Healing. Ann.N.Y.Acad. Sci. 2001; 936:355].
Кроме того, методы выделения и культивирования клеток дороги, исключительно трудоемки, а лаборатории, способные тиражировать клетки для каждого нуждающегося пациента, имеют только очень крупные специализированные медицинские центры.
Сегодня ни у кого не вызывает сомнения широкий потенциал мезенхимальных клеток костного мозга, способных к трансформации в клетки разных тканей, в том числе хондроциты, как in vitro, так и in vivo. Направление дифференцировки мезенхимальных клеток определяется их микроокружением. Известно, что при острой травме в месте ранения создается уникальное микроокружение (ростовые факторы, цито- и хемокины), активирующее стволовые клетки костного мозга, расположенные в близлежащих неповрежденных тканях [Howes R., Bowness JM., Grotendorst GR. et al. PDGF enhances demineralized bone matrix-induced cartilage and bone formation. Calcif. Tissue Int.; 1988; 42(1):34-38]. В связи с тем, что и хондроциты, и мезенхимальные клетки активно секретируют коллагеновые белки, можно предположить, что при наличии остехондрального суставного дефекта, когда имеется прямой контакт с мезенхимальными клетками стромы костного мозга, последние должны репопулировать хрящевую ткань прогениторами хондроцитов. Однако для осуществления своих профессиональных функций при регенерации разрушенной ткани клетки-предшественники должны продвинуться в зону повреждения, используя для этого матриксные белки межклеточного пространства (в основном коллагены), отсутствующие на ранних сроках в зоне повреждения.
Задачей изобретения является разработка способа, позволяющего улучшить восстановление костной ткани и гиалинового хряща при лечении внутрисуставных переломов.
Поставленная задача решается тем, что в остеохондральный дефект помещают коллагеновую губку, состоящую из коллагена типа I с костной крошкой в соотношении 1:1(w/w).
За основу получения коллагена типа I взят метод Abedin с соавт. [Abedin MZ., Riemschneider R. Heterogeneity collagens and them biological mean. Die Angewandte Makromolekulare Chemie 1983, 11(N1701):p.107-122]. Коллаген типа I выделяли из сухожилий хвоста крыс при температуре 4°С. Измельченные ножницами до кашеобразного состояния сухожилия помещали в раствор 1М NaCl, забуференный Tris-HCl, рН 7,2-7,5. При постоянном перемешивании в растворе 1М NaCl происходило вымывание неколлагеновых тканевых белков и нуклеиновых кислот, а нерастворимый в этих условиях коллаген сохранялся в виде белых агрегирующих волокон. Смену экстрагирующего раствора производили ежедневно в течение 2-3 дней. Затем волокна коллагена собирали, тщательно промывали дистиллированной водой для удаления NaCl и растворяли в 0,5М уксусной кислоте при постоянном помешивании в течение 2-3 суток. Образовавшийся раствор коллагена фильтровали через нейлоновую ткань для удаления нерастворившегося материала.
Для имплантата изготавливали коллагеновую губку с костной крошкой, полученной из костей скелета крысы. Для этого смешивали 50 мл 2% раствора коллагена типа I крысы с 1 г костной крошки и лиофилизировали (соотношение коллаген: костная крошка = 1:1(w/w).
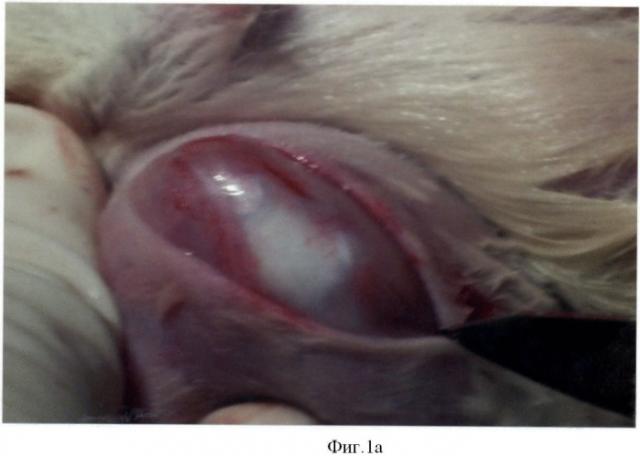
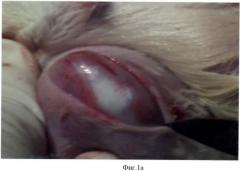
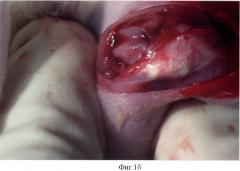
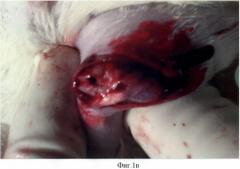
В эксперименте использовали 2 группы крыс: контрольную (№1) и экспериментальную (№2). У крыс создавали костно-хрящевой дефект на надколенниковой поверхности мыщелков бедра. Под общим обезболиванием с помощью кетамина продольным, передневнутренним парапателлярным разрезом вскрывали коленный сустав (фиг.1а), надколенник вывихивали кнаружи (фиг.1б), фрезой диметром в 2,3 мм создавали дефект на надколенниковой поверхности мыщелков глубиной 2,5-3 мм (фиг.1в).
В контрольной группе №1 дефект суставной поверхности не заполняли. В экспериментальной группе №2 дефект заполняли имплантатом из коллагеновой губки с костной крошкой. Вправляли надколенник, рану послойно зашивали. Животных содержали по одному.
Процесс восстановления костно-хрящевых дефектов оценивали морфологически. Сроки морфологического исследования составляли: 1 и 2 недели, 1 и 3 месяца после операции. Изучали по 4 животных на каждой временной точке (всего 32 животных). После операции в указанные сроки животных выводили из эксперимента введением внутрибрюшинно летальной дозы гексенала, извлекали коленные суставы и фиксировали их в растворе 10% нейтрального формалина. Морфологическому изучению подвергали оперированный участок мыщелков бедра. Образцы декальцинировали препаратом «Биодек», заливали в парафин. С помощью микротома получали срезы толщиной в 4-5 мк, которые окрашивали гематоксилином и эозином, пикрофуксином по Ван-Гизону и толуидиновым синим.
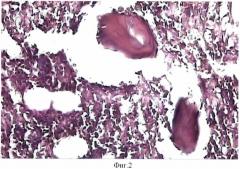
При морфологическом изучении области дефекта надколенниковой поверхности мыщелков бедренной кости крыс в контрольной группе (№1) через 1 неделю после операции у большинства животных выявлено, что костный дефект заполнен организующимся фибрином, эритроцитами, а в более глубоких участках имеются признаки формирования островков незрелой рыхлой соединительной тканью (фиг.2, ув.х400) Через 2 недели выраженность воспалительных изменений снижается, грануляционная ткань увеличивается в объеме и созревает. В глубине дефекта регенерация костной ткани только начинается, образуются незрелые остеоидные балки. Через 1 месяц после операции исчезает воспалительная инфильтрация, грануляционная ткань превращается в зрелую соединительную ткань, в глубине дефекта усиливается остеогенез. Через 3 месяца после операции дефект уменьшается в объеме и заполняется ближе к поверхности плотной фиброзной соединительной тканью без признаков регенерации хрящевой ткани, а внутри дефекта - костным регенератом, который к этому сроку созревает и занимает около 4/5 объема бывшего дефекта (фиг.3, ув.х400).
В экспериментальной группе №2 для пломбировки дефекта использовали матрикс, который состоял из коллагена типа I и костной крошки. Уже через 1 неделю новообразованная созревающая костная ткань, состоящая из остеоидных балок, занимает 4/5 объема дефекта, а наружный слой сформирован зрелой соединительной тканью, но еще без признаков хрящевой регенерации. Видны участки резорбции макрофагами фрагментов костной крошки (фиг.4, ув.х400). Через 2 недели коллагеновая пломба отсутствует вследствие резорбции имплантированного коллагена. Костная ткань созревает. В этот период образуются многочисленные очаги хрящевой регенерации. Вокруг оставшихся фрагментов имплантированного коллагена и костной крошки наблюдается окружение из столбиков дифференцированных хондроцитов, типичных для гиалинового хряща (фиг.5). Через месяц после операции отмечается образование крупных очагов волокнистого и гиалинового хряща. Через 3 месяца зона дефекта заполнена костной тканью, а снаружи участками соединительной ткани и регенерировавшего гиалинового хряща (фиг.6, ув.х200) При визуальном осмотре скользящей поверхности мыщелка бедренной кости место дефекта не выявляется (фиг.7).
Введение в остеохондральный раневой дефект коллагена типа I, универсального межклеточного матрикса, к которому все клетки-участники раневого процесса имеют специализированные интегриновые рецепторы, определяющие клеточное движение, является необходимым условием для направленного движения клеток в зону повреждения [Lynch MP., Stein JL., Stein GS., Lian JB. The influence of type I collagen on the development and maintenance of the osteopath phenotype in hoary and passage rat calvarias osteoblasts: modification of expression of genes supporting cell growth, adgesion, and extracellular matrix mineralization. Exp Cell Res; 1995; 216(1):35-45]. Кроме того, коллагеновая губка плотно пломбирует костно-хрящевую рану, предотвращая излитие крови в суставную сумку, что также благоприятно влияет на течение раннего послеоперационного периода. Роль костной крошки, вероятно, заключается в том, что она является источником костного морфогенного белка (КМБ). Известно, что семейство КМБ причастно в различным программам развития, а ее члены являются мощными индукторами остео- и хондрогенеза [Canalis E., Economides AN., Gazzerro E. Bone Morphogenetic Proteins, Their Antagonists, and the Skeleton. Endocr. Reviews, 2003; 24(2):218-235; Cook SD., Patron LP., Salkeld SL. et al. Repair Articular Cartilage Defects with Osteogenic Protein-1 (BMP-7) in Dog. J Bone Joint Surg. 2003; 85:116-123]. Таким образом, сочетание биологических свойств коллагена типа I и костной крошки в имплантате активно способствует восстановлению костной и гиалиновой хрящевой ткани во внутрисуставном дефекте.
Способ восстановления гиалинового хряща при лечении внутрисуставных переломов путем введения в область остеохондрального дефекта коллагеновой губки, отличающийся тем, что вводят коллагеновую губку, состоящую из коллагена типа I и костной крошки в соотношении 1:1w/w.