Способ повышения функциональной активности сетчатки при ее патологии различного генеза
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к офтальмологии. Используют суспензию аутологичных культивированных нейрональных клеток, выделенных из обонятельной области слизистой носа, или аутологичных культивированных мезенхимальных клеток, выделенных из костного мозга. Стволовые клетки вводят супрахориоидально в количестве 500 тыс. в 0,02 мл физиологического раствора или ретробульбарно - 1,5 млн в 0,3 мл физиологического раствора. Через 20-30 суток введение повторяют. Способ позволяет обеспечить длительное и адекватное улучшение функциональной и репаративной активности сетчатки при ее патологии различного генеза. 1 з.п. ф-лы, 6 ил.
Реферат
Изобретение относится к офтальмологии и предназначено для повышения репаративной и функциональной активности сетчатки при ее патологии различного генеза. Улучшение репаративной активности, ретинального электрогенеза и связанных с ним зрительных функций несомненно является основной задачей любых реабилитационных мероприятий при заболеваниях сетчатки различной природы (дистрофиях различного генеза, посттравматических изменениях, поражениях сетчатки при общих заболеваниях).
Несмотря на широкий выбор обычно применяемых способов лечения, восстановление структуры, функциональной активности, а следовательно, и зрительных функций остается актуальной проблемой. Многочисленные медикаментозные средства, физиотерапевтические методы, лазерные и хирургические вмешательства не обладают достаточной эффективностью, поэтому клиническое улучшение оказывается нестойким, патологический процесс продолжает прогрессировать, приводя к значительному снижению зрения. Отсюда понятна необходимость поиска новых, современных способов улучшения функциональной активности сетчатки.
В последние годы появился кардинально новый подход к лечению заболеваний сетчатки на основе клеточных технологий. Клеточные технологии позволяют, не меняя поврежденный орган, "обновлять" его клеточный состав. Такое "обновление" структурно-функциональных элементов органа позволяет решать те же задачи, что и органная трансплантация. Вместе с тем, эта технология намного расширяет возможности трансплантационного лечения, делая его доступным для широкого круга разных категорий пациентов.
Основой для развития клеточных технологий являются стволовые клетки (СК). СК способны, в зависимости от микроокружения, превращаться в клетки разных органов и тканей и обеспечивать регенерацию поврежденных участков через продукцию различных факторов роста и ключевых метаболитов. Одна такая клетка может дать множество функционально активных потомков. В настоящее время в мире активно разрабатываются подходы к наращиванию стволовых клеток, а также интенсивно исследуются возможности их генетической модификации. Список болезней, в борьбе с которыми либо трансплантация стволовых клеток уже успешно проводится, либо для которых применение клеточных технологий планируется в ближайшем будущем, быстро растет. В этот список, по-видимому, войдут все болезни, медикаментозное лечение которых малоэффективно.
В офтальмологии терапевтический потенциал стволовых и прогениторных клеток изучается на животных с наследственной ретинальной патологией, близкой к пигментному ретиниту человека [Lund et al. Subretinal transplantation of genetically modified human cell lines attenuates loss visual function in dystrophic rats 11 PNAS. - 2001. - V.98. - N.17. P.9942-9947]. Используется также моделирование механического поражения сетчатки. Большинство работ свидетельствует о том, что пересаженные во взрослую сетчатку стволовые клетки всегда достоверно дифференцируются в глиальные элементы (в астроциты и клетки Мюллера). При изучении эффектов стволовых клеток большое значение имеет определение характера их воздействия на структуры и функцию сетчатки, а также объективная оценка функциональной состоятельности регенерируемых нейронов.
Ближайшим аналогом предлагаемого изобретения является способ улучшения функциональной активности сетчатки при ее патологии различного генеза (RU 2279886, 2006), включающий однократное введение в глаз суспензии культивированных эмбриональных стволовых клеток в количестве 1-2,5 млн в 0.05 мл физиологического раствора.
Источником стволовых клеток, применяемых в данном способе, являлась фетальная или эмбриональная ткань. Данный клеточный материал является малодоступным для внедрения и широкого применения в клинике, а его использование ставит перед специалистами в самых разных областях трудноразрешимые этико-правовые проблемы. В настоящее время большое внимание уделяется клеточным технологиям, основанным на трансплантации стволовых клеток, полученных от самого больного. Развитие данного направления способно решить множество проблем [Ramon-Cueto A., Cordero М.I, Santos-Benito F.F., Avila J. Functional recovery of paraplegic rats and motor axon regeneration in their spinal cords by olfactory ensheathing glia. Neuron 2000; 25:425-435].
Во взрослом организме пул CK обеспечивает медленную смену постаревших аномальных клеток на новые здоровые популяции. Как известно, апоптоз изношенных клеток в сочетании с обновлением клеточных популяций служит одним из ведущих механизмов защиты от болезней.
Преимущества лечения стволовыми клетками, полученными от самого пациента, заключаются в доступности и свойствах неиммуногенного клеточного материала. Использование аутологичных клеток снижает риск иммунного отторжения трансплантата, исключает возможность переноса генетических дефектов, вирусных и прионных заболеваний. Наиболее изученными из постнатальных СК являются мезенхимальные стволовые клетки (МСК) и неирональные стволовые клетки, выделенные из обонятельной области слизистой носа (обкладочные обонятельные клетки ООК). По мнению многих экспертов, мультипотентность генома этих клеток достаточна для наработки ростков донорской специализированной ткани.
В связи с этим нами проявлен интерес к вопросу о целесообразности использования культивированных in vitro стволовых клеток, выделенных из организма взрослого человека, для улучшения функциональной активности сетчатки при некоторых видах ее патологии. Для этого сначала на экспериментальных моделях повреждения сетчатки были проведены исследования по трансплантации СК в супрахориоидальное и ретробульбарное пространство, с оценкой репаративных эффектов и функциональной активности сетчатки.
Отдельно проведен предварительный эксперимент по изучению переносимости тканями глаза трансплантации различного количества СК с последующим подбором оптимальной дозы клеток для экспериментального и клинического применения.
Задачей изобретения является разработка способа повышения репаративной и функциональной активности сетчатки при различных видах ее повреждения с использованием наиболее легкодоступного вида клеточного материала для трансплантации.
Техническим результатом предлагаемого изобретения является длительное и адекватное улучшение функциональной и репаративной активности сетчатки при ее патологии различного генеза.
Технический результат достигается за счет трансплантации культивированных нейрональных аутологичных стволовых клеток, выделенных из обонятельной области слизистой носа, или культивированных мезенхимальных стволовых клеток, выделенных из костного мозга, в супрахориоидальное пространство в количестве 500 тыс. в 0.02 мл физиологического раствора или ретробульбарно - 1.5 млн клеток в 0.3 мл физиологического раствора.
Нейрональные стволовые клетки выделяли из обонятельной области слизистой носа человека ферментативно-механическим методом. Диссоциированные клетки культивировали как монослой в чашках d=30 мм или в 6-луночных плашках (Costar, USA) при +37°С в СО2-инкубаторе, атмосфере с 5% СО2 и 95% влажности, в посевной концентрации 100-200 тысяч клеток в 1 мл в ростовой среде DMEM/F12 (содержащей 3% фетальной телячьей сыворотки) с добавлением фактора роста фибробластов (Sigma, USA) 20 нг/мл, эпидермального фактора роста, гепарина, ИТС и 3-5% ЭТС. Первичные культуры повторно пересевали через 10-15 суток. Пассированные культуры ООК представляли собой активно пролиферирующие прикрепленные колонии мелких эпителиальных клеток, в которых содержание нестин/виментин положительных клеток составляло не менее 60%. Другие клетки экспрессировали GFAP и b-тубулин. При переводе культур на бессывороточную среду наблюдалось образование характерных нейросфер, которые продолжали пролиферировать в суспензионной культуре. Для трансплантаций использовали клетки после 6-8 пассажей.
Костный мозг получали из трубчатых костей во время реконструктивных вмешательств на конечностях (возможно получение костного мозга путем пункции подвздошной кости). Брали 10-20 мл аспирата костного мозга по классическим методикам. Методом градиентного центрифугирования выделяли мононуклеарную фракцию клеток костного мозга. Полученную суспензию клеток рассевали в пластиковые чашки в ростовой среде DMEM/F12, содержащей 20% ЭТС, селектированной для выращивания клеток в низкой плотности, 2 мМ L-глутамина и антибиотики. Плотность посева первичной клеточной суспензии составляла в среднем 100-300 тысяч в 1 мл. Культивировали клетки в стандартных условиях: при 37°С в атмосфере 5% СО2. Через сутки неприкрепленные клетки удаляли, а прикрепленные инкубировали 5-7 дней. Стандартное пассирование ММСК из костного мозга позволяет получать гетерогенные популяции клеток, в которых доля стволовых клеток составляет небольшой процент. С целью отбора стволовых популяций мезенхимальных клеток культуры серийно клонировали в низкой плотности. Для этого полученный монослой трипсинизировали и пересевали на новые чашки с плотностью 3 клетки на 1 см2 в ростовой среде, дополнительно содержащей ИТС, основной фактор роста фибробластов (bFGF) и гепарин. Через 10-14 дней культивирования отбирали однородные плотные колонии мелких клеток с высокой степенью гомогенности клеток с негранулированной цитоплазмой. Отобранные клеточные колонии пассировали, проводя не более 6-8 пассажей, и использовали для исследований. Цитофлуориметрическое исследование полученных культур показало высокую экспрессию основных маркерных генов МСК - CD44, CD90 и CD105, процентное отношение которых составило соответственно 70%, 93% и 60%. К CD34 и CD45 были позитивны менее 1,3% клеток, что не превышало фонового значения. При направленной дифференцировке в стандартных условиях, описанных для дифференцировки МСК из костного мозга, наблюдалась хондрогенная, остеогенная и адипогенная дифференцировка, что доказывало мультипотентность используемой культуры.
Влияние МСК и ООК на функциональную активность сетчатки изучали на модели лазерного повреждения сетчатки после введения клеток в супрахориоидальное пространство. Отдельно изучено влияние ретробульбарной трансплантации ООК на модели острой ишемии сетчатки.
Повреждение сетчатки кролика осуществляли с помощью аргоновой лазерной установки. Производили секторальную лазерную коагуляцию сетчатки обоих глаз. Коагуляты локализовались в нижнем квадранте глазного дна (300 коагулятов). Мощность излучения составляла 300 мВт, длительность экспозиции 0,1 с, диаметр пятна 200 мкм.
Повреждение сетчатки при сверхпороговом лазерном воздействии характеризуется, как правило, нарушением ультраструктуры клеток ретины вплоть до изменения архитектоники хориоретинальной области и кровоизлияний в сетчатку. Повреждение сетчатки как результат прямого термического воздействия лазерного воздействия развивается в пигментном эпителии сетчатки, сопровождается некрозом ядер в наружном зернистом слое, некрозом внутренних и наружных сегментов фоторецепторов, а следовательно, и снижением функциональной активности сетчатки [Ф.Гамалея. Лазеры в эксперименте и клинике. М.: - 1972. - С.101-108].
С некрозом связывают первичное непосредственное повреждение ткани в момент приложения травматической силы. Основным морфологическим проявлением первичного повреждения является некротический очаг, который включает в себя обломки разрушенных клеток и клетки, которые участвуют в развитии воспаления. Некротический очаг впоследствии эволюционирует в глиально-соединительно-тканный рубец. Таким образом, некроз характеризуется гибелью клеток в результате внешнего чрезмерного повреждающего воздействия, что приводит к нарушению их энергообеспечения, разрушению клеточных мембран, набуханию и распаду клетки. Наряду с первичным повреждением сетчатки запускаются и развиваются механизмы вторичного повреждения клеток, к которым можно отнести воспалительную реакцию, апоптоз, глиальную реакцию, ишемические нарушения.
Воспаление является главным механизмом в санации очага повреждения. В то же время избыточный воспалительный ответ может привести к вторичному повреждению путем чрезмерного выделения медиаторов воспаления и развития гиперэргических клеточных реакций. В свою очередь, это вызывает и усиливает такие процессы, как ишемия и апоптоз.
Уже через 24 ч наблюдается максимальная инфильтрация области травмы полиморфно-ядерными лейкоцитами; через 24-48 ч происходит пик миграции макрофагов, через 48 ч - натуральных киллеров, хелперов и супрессоров. Последние участвуют в иммунной модуляции воспаления и наблюдаются до 16 сут. Лейкоциты, которые появляются в очаге травмы, выделяют множество прямых цитотоксичных факторов и медиаторов, что позволяет процессу воспаления самоподдерживаться и расширяться вне очага поражения. Макрофаги, микроглия участвуют в прогрессирующем некрозе путем освобождения свободных радикалов и воспалительных цитокинов - интерлейкина-1, интерлейкина-6, фактор некроза опухоли, факторов адгезии тромбоцитов (IL-1, IL-1b, TNFa, PAF соответственно). Медиаторы воспаления имеют множество мишеней, и как результат - развитие многоуровневого воспалительного иммунного ответа.
Гибель клетки путем апоптоза - есть включение травматическим агентом механизмов естественной клеточной смерти. Причиной развития апоптоза является непрямое влияние через нейромедиаторы, медиаторы воспаления, ишемии и пр., приводящие к прогрессированию гибели активных клеток и, как следствие, к увеличению площади повреждения сетчатки.
Перед трансплантацией животных наркотизировали внутримышечным введением смеси реланиума и кетонала. Затем в верхненаружном квадранте делали разрез конъюнктивы и в 6 мм от лимба разрез склеры длиной 2 мм, через который с помощью микрошприца "Hamilton" в супрахориоидальное пространство по направлению к заднему полюсу вводили суспензию клеток в количестве 500 тыс. клеток в 0.02 мл физиологического раствора. В парный контрольный глаз вводили такой же объем СФР (сбалансированный физиологический раствор).
Функциональную активность сетчатки оценивали по данным электрофизиологического исследования. Электроретинография позволяет документально подтверждать степень и направленность изменений функционального статуса сетчатки, исследовать механизмы влияния изучаемых факторов, локализовать наиболее чувствительные к воздействию ретинальные структуры, определяющие весь спектр дальнейших зрительных функций.
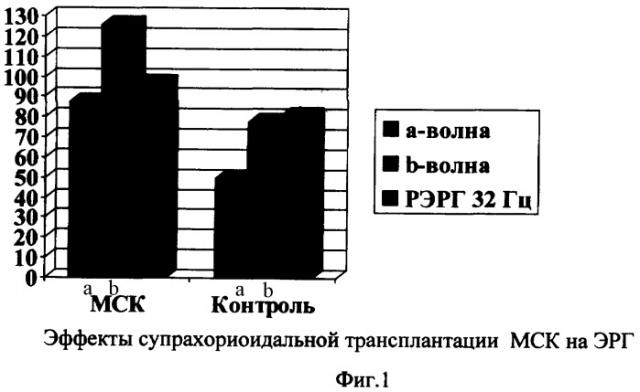
По данным ЭФИ супрахориоидальная трансплантация МСК способствовала сохранности функции фоторецепторов (волна-а), по сравнению с контролем, что свидетельствовало о наличии нейропротекторного эффекта, наиболее выраженного в ранние сроки после лазеркоагуляции. В правых опытных глазах через 10 дней после трансплантации и в течение последующего месяца отмечалась лучшая сохранность функции биполярных клеток и мюллеровской глии. Амплитуды а- и b-волн ЭРГ и РЭРГ на 12 Гц в контрольных и опытных глазах составляли в среднем 43-80, 88-115 и 82-85% нормальных значений соответственно. РЭРГ на 32 Гц соответствовала исходным показателям (фиг.1).
Для оценки воздействия трансплантации МСК на степень дегенерации сетчатки после лазеркоагуляции с помощью программы "Image Tool" проводили измерения линейных размеров участков сетчатки, на которых полностью отсутствовали фоторецепторы. Морфометрические измерения были проведены на 20-30 срезах, содержащих лазерное поражение, от каждого из 8 глаз подопытных кроликов (более 600 измерений). Средние размеры всех пораженных участков сильно варьировались, однако во всех случаях средние размеры в опытных глазах превышали таковые в контрольных (фиг.2). Различия между опытным и контрольным глазами были статистически достоверны.
С целью ослабить влияние случайных вторичных изменений большой площади на результаты морфометрии мы проводили отдельный анализ для мелких (менее 300 микрометров) первичных очагов дегенерации. После исключения из опытных и контрольных групп зон дегенерации размером более 300 микрометров средние размеры в опытных глазах также превышали таковые в контрольных.
Средние величины поражений для всех опытных глаз были также меньше, чем таковые для контрольных.
После трансплантации ООК по результатам ЭФИ через 10 дней и в течение последующего месяца отмечалась сохранность функции биполярных клеток и мюллеровской глии. Амплитуды а- и b-волн ЭРГ и РЭРГ на 12 Гц в контрольных и опытных глазах составляли в среднем 62-80% и 78-91% нормальных значений соответственно. РЭРГ на 32 Гц, в отличие от контрольных глаз, либо соответствовала исходным показателям, либо превышала их на 30-57% (фиг.3).
При морфометрическом исследовании средние величины поражений для всех опытных глаз были также меньше, чем таковые для контрольных (фиг.4).
С целью создания острой ишемии сетчатки проводилась лазерная коагуляция артерии и вен первого порядка с помощью той же аргоновой лазерной установки. Средняя мощность излучения составляла 600-800 мВт, длительность экспозиции 0.1 с, диаметр пятна 300 мкм, количество коагулятов - 100. Проводилась коагуляция всех видимых сосудов 1/2 PD от диска зрительного нерва на всем их протяжении. На следующий день после создания модели в опытный глаз вводили ООК ретробульбарно 1.5 млн клеток в 0.3 мл СФР, в контрольный - СФР.
Нарушение кровообращения в ретинальных сосудах приводит к ишемическому некрозу, повреждению гематоофтальмического барьера, развитию воспалительной реакции и запускает апоптоз. Уже через 180 мин после острой ишемии сетчатки наступают полностью необратимые изменения.
При электроретинографии через сутки после лазерной коагуляции сосудов сетчатки на обоих глазах отмечалась гиперреакция сетчатки. В среднем по группе амплитуда а-волны ЭРГ (корнео-негативного потенциала, источником генерации которого являются фоторецепторные клетки) через сутки составляла 133 и 129% исходных значений для опытных и контрольных глаз соответственно. Гиперреакция сетчатки в первые сутки после лазеркоагуляции вызвана раздражением фоторецепторов в ответ на острую ишемию.
Через 1 неделю после моделирования ретинальной ишемии амплитуды всех биопотенциалов в контрольной группе достоверно снижались, причем наибольшему угнетению подвергалась а-волна ЭРГ. В контрольных глазах амплитуды а- и b-волн ЭРГ и РЭРГ с частотой 30 Гц составляли в среднем 47, 53 и 43% от индивидуальной нормы (фиг.5).
В опытных глазах после моделирования ретинальной ишемии и введения ООК среднее значение амплитуд a-b-волн ЭРГ и РЭРГ через неделю достигали 90, 118 и 82% от индивидуальной исходной нормы. Через 14 дней амплитуды волн ЭРГ в опытных глазах умеренно превышали норму, и выраженная гиперреакция сетчатки сохранялась до конца срока наблюдения. Наиболее резко возрастала b-волна ЭРГ, значения которой достигали 153%, что может отражать активизацию глиальных клеток Мюллера, возможно, компенсаторно-приспособительного характера. Через месяц наблюдения средняя по группе амплитуда а- и b-волн ЭРГ составляла 133 и 140% от нормы. Амплитуда РЭРГ соответствовала нормальным значениям, в среднем 108% от исходных величин (фиг.6).
Следует отметить, что при моделировании ретинальной ишемии в отдаленные сроки наблюдения в обоих глазах ритмическая ЭРГ на 30 Гц практически всегда имела субнормальные значения при минимальной амплитуде через 7 суток после лазеркоагуляции. Изменения РЭРГ на мелькающий стимул были статистически достоверными, но менее выраженными, чем начальные альтерации волн ЭРГ на одиночные вспышки. Биопотенциалы сетчатки на высокочастотные мелькания имеют чисто нейральную (в большей степени фоторецепторную) природу генерации. Учитывая также данные литературы о селективной чувствительности РЭРГ с частотой 30-40 Гц к развитию в сетчатке человека изменений дистрофического характера, угнетение ритмических ответов, по-видимому, следует рассматривать как отражение очагов органических нарушений, что подтверждали данные наших офтальмоскопических наблюдений.
На фоне лечения ООК, через месяц амплитуда РЭРГ в опытных глазах соответствовала нормальным значениям (108% от исходных величин), в то время как в контрольных глазах на поздних сроках эксперимента она оставалась сниженной на 30%.
При повторной трансплантации как МСК, так и ООК, через 30 дней наблюдалось умеренное возрастание электрической активности сетчатки. Амплитуда а- и b-волн ЭРГ в опытных глазах составляла в среднем 111 и 113% с последующей нормализацией показателей в пределах субнормальных значений (до 90 и 95% от исходной нормы), что связано с уже сформированными необратимыми изменениями вследствие лазерного воздействия.
Результаты проведенного эксперимента показали, что в ранние сроки после лазерного воздействия трансплантация СК выделенных из организма взрослого человека, способствовала лучшему сохранению ретинальной функции и меньшему проявлению ишемических и дистрофических изменений на глазном дне. В более поздние сроки эффект трансплантации проявлялся в лучшей динамике восстановления ретинального электрогенеза.
Полученные данные свидетельствуют об эффективности трансплантации ООК и МСК взрослого человека при патологии сетчатки различного генеза, что дает основу для применении данного вида клеточного материала для трансплантации в клинике.
Способ осуществляют следующим образом: в глаз вводят аутологичные культивированные ООК или МСК в виде суспензии в супрахориоидальное пространство в дозе 500 тыс. клеток в 0.02 мл физиологического раствора или ретробульбарно в количестве 1.5 млн в 0.3 мл физиологического раствора.
Клинический пример: больной А., 33 лет, история болезни № 7865, поступил в отдел травматологии и реконструктивной хирургии МНИИ ГБ им. Гельмгольца с диагнозом: ОД- контузия 3 степени, офтальмогипертензия, гифема, эпиретинальное кровоизлияние в макулярной области с отеком макулы (VIS-OD=0.07 эксцентрично). Проведена консервативная противовоспалительная, антиоксидантная, трофическая, гипотензивная, рассасывающая терапия. Через 10 дней лечения: гифема и кровоизлияние в макулярной области рассосались, сохранялся макулярный отек, Тn=20 мм рт. ст., VIS-OD=0.1.
На 14-й день произведена ретробульбарная трансплантация 1,5 млн ООК в 0.3 мл физиологического растворе (ООК выделяли из обонятельной области слизистой носа, взятой на следующий день после поступления больного). Через 2 дня после трансплантации больной субъективно отметил улучшение зрения. Острота зрения сохранялась в пределах 0.1. Через 3 недели в макуле появились мелкие вкрапления пигмента, дистрофические очаги. VIS-OD=0.25. За последующее время наблюдения острота зрения сохраняла прежние значения. Развилась начальная, травматическая катаракта. Через 1 мес. произведена повторная трансплантация ООК. На 10-й день после повторной трансплантации через 14 дней острота зрения - VIS=0.4, через 1 мес. - VIS=0.5. В течение последующих 6 месяцев наблюдения острота зрения не изменялась.
Таким образом, предложенный способ введения ООК и МСК взрослого человека с целью лечения заболеваний сетчатки, позволяет добиться длительного и адекватного улучшения функциональной активности сетчатки. По данным ЭРГ трансплантация ООК, выделенных из обонятельной области слизистой носа, или МСК, из костного мозга, положительно влияет на ретинальную активность, учитывая природу генерации биопотенциалов, в большей степени на функцию фоторецепторов и, возможно, клеток Мюллера, что можно рассматривать как отражение нейропротекторных эффектов; усиливает репаративные процессы и ограничивает развитие вторичных дистрофических изменений.
Резюмируя представленные данные клинического исследования, можно сказать, что результатом использования ООК человека явилось ускорение репаративной регенерации поврежденной сетчатки с восстановлением зрительных функций, что говорит о возможности применения данного вида СК в клинике.
1. Способ повышения функциональной активности сетчатки при ее патологии различного генеза, включающий введение стволовых клеток, отличающийся тем, что используют суспензию аутологичных культивированных нейрональных клеток, выделенных из обонятельной области слизистой носа, или аутологичных культивированных мезенхимальных клеток, выделенных из костного мозга, которые вводят супрахориоидально в количестве 500 тыс. в 0,02 мл физиологического раствора или ретробульбарно - 1,5 млн. в 0,3 мл физиологического раствора.
2. Способ по п.1, отличающийся тем, что через 20-30 сут введение повторяют.