Фармацевтические композиции
Иллюстрации
Показать всеНастоящее изобретение относится к области лекарственных средств, в частности к композиции для лечения половой дисфункции у человека легочной ингаляцией в форме сухого порошка, содержащей апоморфин в дозе от 200 мкг до 1200 мкг (номинальная доза), где апоморфин находится в форме свободного основания, фармацевтически приемлемой соли или сложного эфира. Также изобретение относится к применению апоморфина в указанной композиции, устройству для ингаляции указанной композиции и блистеру для использования в указанном устройстве. Технический результат заключается в снижении побочных эффектов и быстром достижении терапевтического эффекта. 4 н. и 23 з.п. ф-лы, 29 ил., 17 табл.
Реферат
Предпосылки создания изобретения
Термин "эректильная дисфункция" Национальный институт здравоохранения (National Institutes of Health) определяет как неспособность мужчины достигать и поддерживать эрекцию полового члена, достаточную для возможности осуществления удовлетворительного полового акта (см. J. Am. Med. Assoc., 270(1):83-90 (1993)). Поскольку адекватное артериальное кровоснабжение является критическим для эрекции, любое расстройство, которое ухудшает кровоток, может быть вовлечено в этиологию эректильной недостаточности. Эректильной дисфункцией страдают миллионы мужчин, и хотя такое расстройство, как правило, рассматривается как доброкачественное, оно оказывает глубокое воздействие на качество их жизни. Однако известно, что у многих мужчин физиологическое желание, оргастическая способность и способность к эякуляции являются интактными даже при наличии эректильной дисфункции.
Этиологические факторы в случае эректильных расстройств классифицируются по происхождению как психогенные или органические.
К психогенным факторам эректильной дисфункции относятся такие процессы, как депрессия, тревога и проблемы взаимоотношений, которые могут ухудшить эректильную функцию за счет ослабления чувственной сосредоточенности или иного ослабления чуткости к чувственному восприятию. Такие обстоятельства могут привести к неспособности вызывать или поддерживать эрекцию.
Органическими факторами являются факторы нейрогенного происхождения и факторы васкулогенного происхождения. К нейрогенным факторам относятся, например, повреждения проводящих путей соматической нервной системы, которые могут ухудшать рефлексогенную эрекцию и нарушать тактильные ощущения, необходимые для поддержания эрекции, и повреждения спинного мозга, которые, в зависимости от их расположения и тяжести, могут вызывать эректильную недостаточность различной степени. Васкулогенными факторами риска являются факторы, которые воздействуют на кровоток и включают курение сигарет, сахарный диабет, гипертензию, алкоголь, сосудистое заболевание, высокое содержание холестерина в сыворотке, низкое содержание липопротеина высокой плотности (HDL) и другие хронические болезненные состояния, такие как артрит. В Massachusetts Male Aging Study (MMAS, как сообщают H.A. Feldman et al., J. Urol., 151:54-61 (1994)) обнаружено, например, что зависящая от возраста возможность полной эректильной дисфункции в три раза выше у субъектов, которые лечатся от диабета, чем у тех, у кого диабета нет. Хотя существуют некоторые разногласия в связи с тем, какой из многочисленных аспектов диабета является непосредственной причиной эректильной дисфункции, наиболее часто упоминается сосудистое заболевание.
В MMAS также найдена существенная корреляция между эректильной дисфункцией и болезнью сердца с двумя ее факторами риска - гипертензией и низким содержанием в сыворотке липопротеина высокой плотности (HDL). Сообщается, что 8-10% из всех нелечившихся больных гипертензией являются импотентами на момент, когда у них диагностирована гипертензия. Связь эректильной дисфункции с сосудистым заболеванием по литературным данным весьма значительна, с ухудшениями в гемодинамике эрекции, показанной на пациентах с инфарктом миокарда, операцией коронарного шунтирования, инсультами и болезнью периферических сосудов. Также обнаружено, что курение сигарет является независимым фактором риска в случае васкулогенной эректильной дисфункции, и обнаружено, что курение сигарет обостряет опасность эректильной дисфункции, связанной с сердечно-сосудистыми заболеваниями.
Женщины также могут страдать от половой дисфункции. Показано, что такая дисфункция усиливается с возрастом и связана с наличием васкулярных факторов риска и наступлением менопаузы. Полагают, что некоторые из сосудистых и мышечных механизмов, которые вносят вклад в эрекцию полового члена у мужчин, схожи с васкулогенными факторами реакции женских половых органов.
У женщин половая дисфункция может возникнуть от органических причин, психогенных причин или их сочетания. Женская половая дисфункция включает недостаточность в достижении или поддержании реакций смазывания-набухания влагалища полового возбуждения до завершения сексуальной активности. Известно, что органическая женская половая дисфункция связана, частично, с васкулогенным ухудшением, приводящим к неадекватному кровотоку, недостаочной гиперемии влагалища и недостаточной клиторной эрекцией.
Как описано в патентах США №№ 5770606 и 6291471, известно о лечении как психогенной, так и органической эректильной дисфункции у мужчин опиоидом апоморфином. В настоящее время в Европе для лечения мужской эректильной дисфункции используют двух- и трехмиллиграммовые подъязычные таблетки апоморфина гидрохлорида под названием Uprima™ (см., например, European Public Assesment Report (EPAR), 1945).
Апоморфин является производным морфина и сначала, в 1869, получил оценку для применения в качестве фармакологического средства как противорвотное средство. В первой половине 20-го века апоморфин применяли как седативное средство при психиатрических нарушениях и как средство, изменяющее поведение, для алкоголиков и наркоманов. В 1967 показано допаминергическое действие апоморфина, и соединение подвергают интенсивным исследованиям для лечения паркинсонизма. Следовательно, в то же время апоморфин классифицирован как селективный агонист допаминовых рецепторов, стимулирующий центральную нервную систему, вызывающий реакцию возбуждения, проявляющуюся у животных и человека в зевоте и эрекции полового члена.
В ЕР 0689438А раскрывается композиция апоморфина для применения при облегчении симптомов "отключки" ("off-period") у пациентов, страдающих от болезни Паркинсона. Композиция представляет собой сухой порошок (выбранный из-за того, что апоморфин неустойчив в водном растворе), и ее вводят интраназально для поглощения через слизистую оболочку носовой полости.
Вообще, в предшествующем уровне технике существует предубеждение против введения апоморфина ингаляцией, поскольку считается, что апоморфин, как правило, является соединением, вызывающим раздражение, и поэтому считается, что ингаляция апоморфина может быть неудобной и неприятной, и ее следует избегать. По этой причине препарат в виде сухого порошка, описанного в ЕР 0689438А, содержит частицы размером от 50 до 100 мкм, с тем, чтобы частицы не могли случайно достичь легких после описанного интраназального введения.
В WO 00/35457 предлагается способ лечения органической эректильной дисфункции путем перорального введения терапевтически эффективного количества апоморфина или его фармацевтически приемлемой соли или пролекарства. Апоморфин оказывает нежелательное побочное действие, вызывая тошноту, и оправданием его применения является то, что для достижения нужного лечебного действия можно вводить достаточное количество апоморфина, тогда как тошноты удается избегать. Предполагается, что такое возможно за счет введения количества апоморфина для получения содержания количества в плазме в интервале до 5,5 нг/мл.
В WO 01/74358 описывается способ лечения мужской эректильной дисфункции с использованием препарата апоморфина. И снова изобретение обращается к достижению желательного лечебного эффекта, не вызывая тошноты. Сообщается, что концентрации апоморфина в плазме пациента составляют до 10 нг/мл, причем рвота возникает у менее 15% пациентов. Различные способы введения предлагаются в WO 01/74358, в том числе легочная ингаляция. Однако только композиции для ингаляции, приведенные в качестве примеров в WO 01/74358, содержат раствор апоморфина и метабисульфита натрия в воде, который вводят непосредственно в легкие собаки через трахею.
В WO 99/38467 описывается способ уменьшения степени половой дисфункции у женщины, включающий введение указанной женщине апоморфина в количестве, достаточном для усиления внутриклиторного кровотока и кровотока в стенках влагалища для стимуляции указанной женщины, но меньше количества, вызывающего существенную тошноту. Для того чтобы достичь такого баланса, предполагается, что следует поддерживать концентрацию апоморфина в плазме не более примерно 5,5 нг/мл. Предлагается сублингвальное введение апоморфина.
Хотя в предшествующем уровне технике ясно показано, что апоморфин можно применять при лечении половой дисфункции, известные способы лечения все еще далеки от идеальных. Несмотря на утверждения, которые делаются в предшествующем уровне техники, лечение постоянно вызывает рвоту даже при содержании апоморфина в плазме, которое, как предполагается, не оказывает такого побочного действия. Кроме того, существующие способы лечения также часто имеют недостатком длительную задержку начала лечебного действия. Это делает необходимым составление предварительного плана, когда пациента нужно заранее предупредить, когда желательно лечебное действие, и затем необходимо вводить дозу апоморфина за какое-то время до этого.
Хотя в предшествующем уровне техники делались попытки поддерживать дозу столь низкой, насколько возможно, для того чтобы уменьшить сопутствующее побочное действие, было трудно найти необходимый баланс между эффективностью и побочным действием. Однако теперь обнаружено, что небольшие дозы апоморфина можно вводить легочной ингаляцией для получения желательного терапевтического действия, причем в то же время удается избежать или свести к минимуму побочное действие, обычно связанное с терапевтически эффективной дозой апоморфина.
Сущность изобретения
Целью настоящего изобретения является лечение половой дисфункции, которое обеспечивает быстрое начало лечебного действия, при котором побочные действия, обычно связанные с введением апоморфина, а именно тошнота и сонливость, ослабляются или даже их удается избежать, и введение является легким.
Теперь обнаружено, что возможно вводить апоморфин легочной ингаляцией, не вызывая раздражения. Проводились токсикологические исследования на собаках и обнаружено, что апоморфин, введенный ингаляцией, безопасен при введении на протяжении 28 дней в количествах, по меньшей мере, 12-кратных относительно дозировки, предусмотренной для достижения желательного лечебного действия. Исследования не показали признаков раздражения или других гистопатологических изменений.
Также обнаружено, что мелкие частицы апоморфина быстро всасываются из легких и обеспечивают чрезвычайно быстрое начало лечебного действия апоморфина. Действительно, начало лечебного действия происходит существенно быстрее, чем его наблюдают после введения апоморфина в доступных сублингвальных таблетках Uprima®.
Кроме того, обнаружено, что количество апоморфина, требуемое для лечения половой дисфункции, когда указанную дозу вводят легочной ингаляцией, существенно меньше, чем дозы, обеспечиваемые доступными в настоящее время формами апоморфина для лечения половой дисфункции, такими как сублингвальные таблетки Uprima® и интраназальные композиции с апоморфином, разрабатываемые Nastech.
Более того, также обнаружено, что введение апоморфина легочной ингаляцией приводит к крайне благоприятному фармакокинетическому профилю, который обеспечивает исключительно быстрое начало лечебного действия при благоприятной длительности и быстром удалении лекарственного средства из плазмы. Это является противоположностью фармакокинетике таблеток Uprima®, которые показывают задержку начала лечебного действия и длительное присутствие лекарственного средства в плазме, возможно, из-за постепенного всасывания лекарственного средства через щечную мембрану, и даже небольшая часть лекарственного средства проглатывается.
К счастью, также обнаружено, что небольшая доза апоморфина, введенного легочной ингаляцией, и/или наблюдаемый в результате профиль концентрации в плазме приводят в пониженной частоте случаев побочного действия, обычно связанного с введением апоморфина, включая синкопе, рвоту и сонливость.
Наконец, также обнаружено, что апоморфин, который является неустойчивым по природе и быстро окисляется, можно ввести в препаративные формы для легочной ингаляции, которые показывают превосходную устойчивость во времени и которые поэтому подходят для организации серийного производства.
Согласно одному из аспектов настоящее изобретение относится к новым фармацевтическим композициям, содержащим апоморфин, для лечения половой дисфункции путем легочной ингаляции для того, чтобы избежать или минимизировать, в то же время, вредное побочное действие, обычно связанное с введением апоморфина.
Согласно другому аспекту настоящее изобретение относится к новым способам лечения половой дисфункции с использованием новых фармацевтических композиций, содержащих апоморфин, которые вводят легочной ингаляцией. Вновь, такие способы позволяют достичь желательного лечебного действия, не вызывая побочного действия, связанного с введением апоморфина.
Композиции и способы настоящего изобретения также обеспечивают быстрое начало желательного лечебного действия. Кроме того, композиции и способы настоящего изобретения также подходят для лечения как мужчин, так и женщин.
Настоящее изобретение относится к высокоэффективной доставке апоморфина методом ингаляции, которая имеет ряд существенных и неожиданных преимуществ перед используемыми ранее способами введения. Способ введения и композиции настоящего изобретения делают возможным такой превосходный эффект.
Апоморфин может существовать в форме свободного основания или соли присоединения кислоты. Для целей настоящего изобретения предпочтительны формы апоморфина как гидрохлорида и свободного основания, но также можно использовать и другие фармакологически приемлемые формы апоморфина. Термин "апоморфин", используемый в данном описании, включает форму свободного основания этого соединения, а также его фармакологически приемлемые соли или сложные эфиры.
Кроме гидрохлорида, другими приемлемыми солями присоединения кислот являются гидробромид, гидроиодид, бисульфат, фосфат, кислый фосфат, лактат, цитрат, тартрат, салицилат, сукцинат, малеат, глюконат и т.п.
Используемый в данном описании термин "фармацевтически приемлемые сложные эфиры" апоморфина относится к эфирам, образованным по одной или двум гидроксильным функциональным группам в положениях 10 и 11, которые гидролизуются in vivo, и включают эфиры, быстро распадающиеся в организме человека с образованием исходного соединения или его соли. Подходящими сложноэфирными группами являются, например, группы, образованные от фармацевтически приемлемых алифатических карбоновых кислот, в частности алкановых, алкеновых, циклоалкановых и алкандионовых кислот, в которых каждая алкильная или алкенильная группа, преимущественно, содержит не более 6 атомов углерода. Примерами конкретных эфиров являются формиаты, ацетаты, пропионаты, бутираты, акрилаты и этилсукцинаты.
Свободное основание апоморфина является особенно привлекательным в контексте настоящего изобретения, так как оно очень быстро проходит через легочный барьер, и, таким образом, ожидается, что его введение легочной ингаляцией будет показывать исключительно быстрое начало лечебного действия. Таким образом, любая композиция, раскрываемая в данном описании, может быть получена с использованием свободного основания апоморфина.
Согласно одному воплощению настоящего изобретения, фармацевтическая композиция находится в форме сухого порошка. Предпочтительно, сухой порошок дозируют с помощью ингалятора для порошков (DPI).
В одном из воплощений настоящего изобретения композиция содержит активные частицы, содержащие апоморфин, причем активные частицы имеют средневесовой аэродинамический диаметр (MMAD) не более примерно 10 мкм.
В другом воплощении настоящего изобретения композиция содержит активные частицы апоморфина и добавку, которая является антиадгезивом и снижает когезию между частицами в композиции.
В еще одном воплощении настоящего изобретения композиция содержит активные частицы, содержащие апоморфин, и частицы носителя - инертного эксципиента, такого как лактоза. Частицы носителя могут иметь средний размер от примерно 5 до примерно 1000 мкм.
В другом воплощении композиция представляет собой раствор или суспензию, которую дозируют с использованием ингалятора, подающего при нажатии отмеренную дозу (pMDI). Композиция согласно такому воплощению может содержать сухую порошковую композицию, описанную выше, смешанную с или растворенную в жидком пропелленте, таком как HFA134a или HFA227.
В одном воплощении настоящего изобретения композиция, используемая для лечения половой дисфункции через ингаляцию, содержит дозу от примерно 100 мкг до примерно 2400 мкг апоморфина (иными словами, апоморфина - апоморфина свободного основания, его фармацевтически приемлемой(ых) соли(ей) или фармацевтически приемлемого(ых) эфира(ов), в расчете на соль гидрохлорида). Доза может содержать от примерно 200 мкг до примерно 1800 мкг указанного апоморфина, или от примерно 300 мкг до примерно 1600 мкг указанного апоморфина, или от примерно 400 мкг до примерно 1200 мкг указанного апоморфина. В другом воплощении дозы обеспечивают ступенчато от примерно 400 мкг до примерно 1200 мкг указанного апоморфина, в зависимости от потребностей и переносимости отдельных пациентов. Например, дозы могут обеспечивать примерно 400, примерно 500, примерно 600, примерно 700, примерно 800, примерно 900, примерно 1000, примерно 1100 и/или примерно 1200 мкг указанного апоморфина.
Когда для достижения лечебного действия достаточны меньшие дозы, например при лечении женской половой дисфункции, могут обеспечиваться дозы в примерно 100, примерно 200, примерно 300, примерно 400, примерно 500 и/или примерно 600 мкг указанного апоморфина.
В другом воплощении настоящего изобретения доза порошковой композиции доставляет, in vitro, дозу тонкодисперсных частиц с от примерно 100 мкг до примерно 1800 мкг апоморфина (в расчете на массу соли гидрохлорида), при измерении многоступенчатым жидкостным импрингером (Multistage Liquid Impringer), United States Pharmacopoeia 26, глава 601, прибор 4 (2003), каскадным импактором Андерсена (Andersen Cascade Impactor) или импактором New Generation. Предпочтительно, доза доставляет, in vitro, дозу тонкодисперсных частиц от примерно 200 мкг до примерно 1200 мкг указанного апоморфина, от примерно 400 мкг до примерно 1000 мкг указанного апоморфина, от примерно 400 мкг до примерно 900 мкг указанного апоморфина или от примерно 600 мкг до примерно 800 мкг указанного апоморфина. С другой стороны, когда для достижения лечебного действия требуется меньше апоморфина, например когда нужно лечить от женской половой дисфункции, доза, предпочтительно, доставляет, in vitro, дозу тонкодисперсных частиц от примерно 100 мкг до примерно 900 мкг указанного апоморфина, от примерно 200 мкг до примерно 600 мкг указанного апоморфина, от примерно 200 мкг до примерно 400 мкг указанного апоморфина.
Обнаружено, что доставка апоморфина легочной ингаляцией более эффективна, чем доставка другими путями, испытанными на известном уровне техники, такими как пероральная доставка и интраназальная доставка. Исследования, обсуждаемые ниже, показывают, что доза в 1200 мкг, вводимая легочной ингаляцией, связана с незначительным (нетяжелым) побочным действием, таким как легкая головная боль, но не вызывает тяжелых вредных побочных действий, таких как синкопе и рвота. Хотя и не тяжелое, а слабое побочное действие, связанное с 1200 мкг апоморфина, ограничивает применение такой дозы вне клиники, и, таким образом, большие дозы не исследовались. В противоположность таким результатам предыдущие исследования не показали, что введение апоморфина ингаляцией не имеет недостатком серьезного побочного действия, такого как рвота. Кроме того, исследования по интраназальной доставке апоморфина, проводимые Nastech Pharmaceutical Company Inc., показали, что таким способом в условиях клиники можно вводить более 2 мг апомофина, не вызывая неприемлемое побочное действие.
Эффективность подачи дозы также демонстрирует тот факт, что клиническое действие наблюдают после введения ингаляцией такого небольшого количества апоморфина как 400 мкг. Напротив, оказывается, что в случае сублингвальных таблеток Uprima® необходимо минимум 2 мг апоморфина для достижения нужного эффекта.
В некоторых воплощениях настоящего изобретения апоморфин составляет от примерно 3% до примерно 80%, от примерно 5% до примерно 50%, от примерно 15% до примерно 40% порошковой композиции.
В одном воплощении настоящего изобретения доза включает примерно 600 мкг гидрохлорида апоморфина, и такая доза обеспечивает, in vivo, среднюю Cmax от примерно 3,5 нг/мл до примерно 4,9 нг/мл. В другом воплощении доза включает примерно 900 мкг гидрохлорида апоморфина, и такая доза обеспечивает, in vivo, среднюю Cmax от примерно 7,4 нг/мл до примерно 8,8 нг/мл. В еще одном воплощении доза включает примерно 1200 мкг гидрохлорида апоморфина, и такая доза обеспечивает, in vivo, среднюю Cmax от примерно 9,2 нг/мл до примерно 16,2 нг/мл. Cmax при любой дозе апоморфина регистрируется между 1 и 30 минутами после введения легочной ингаляцией, и предпочтительно - между 1 и 5 минутами. Окончательное удаление лекарственного средства происходит приблизительно через один час при любой дозе.
Таким образом, согласно одному воплощению настоящее изобретение относится к композиции, содержащей апоморфин, где введение композиции легочной ингаляцией обеспечивает Cmax в пределах 1-5 минут после введения.
В одном воплощении, предпочтительно, для лечения женской половой дисфункции Cmax составляет, по меньшей мере, 2 нг/мл. В другом воплощении Cmax составляет, по меньшей мере, 7 нг/мл.
В другом воплощении изобретения введение композиции легочной ингаляцией обеспечивает окончательное удаление лекарственного средства (период полувыведения) между 50 и 70 минутами.
В еще одном воплощении введение композиции легочной ингаляцией обеспечивает AUC0-∞ в зависимости от дозы.
В одном воплощении введение композиции легочной ингаляцией обеспечивает
AUC0-t в зависимости от дозы.
В еще одном воплощении введение композиции легочной ингаляцией обеспечивает
Cmax, зависящую от дозы.
Согласно другому воплощению настоящего изобретения дозу апоморфина подают легочной ингаляцией, и указанная доза является достаточной для обеспечения лечебного действия через примерно 10 минут или ранее.
В другом аспекте настоящее изобретение относится к стандартным дозам апоморфина для лечения половой дисфункции. Стандартные дозы содержат фармацевтические композиции, содержащие апоморфин, описанный выше.
В одном воплощении предлагаются блистеры, содержащие композиции с апоморфином по настоящему изобретению. Блистеры, предпочтительно, из фольги и имеют основание с полостью, сформированной в нем, причем полость содержит порошковую композицию, и ее открытая часть герметично закрывается покрытием, которое можно разорвать.
Дозы и/или блистеры, загруженные лекарственным средством, содержат от 1 до 5 мг порошковой композиции, где апоморфин составляет от примерно 3% до примерно 80%, от примерно 5% до примерно 50% или от примерно 15% до примерно 40% порошковой композиции. Когда требуются меньшие лечебные дозы, например, для лечения женской половой дисфункции, апоморфин может составлять от примерно 3% до примерно 40%, от примерно 4% до примерно 25% или от примерно 5%
до примерно 20% порошковой композиции.
Согласно другому воплощению настоящее изобретение относится к устройству для ингаляции сухого порошка, содержащему композицию согласно настоящему изобретению.
В другом воплощении ингалятор является активным ингалятором. В еще одном воплощении ингалятор представляет собой устройство для ингаляции, приводимое в действие дыханием.
В одном воплощении композиция по настоящему изобретению содержится в блистере, содержимое которого можно подавать с использованием одного из вышеуказанных устройств. Предпочтительно блистер является блистером из фольги.
В другом воплощении в блистере в контакте с композицией находятся поливинилхлорид или полипропилен.
В другом аспекте настоящее изобретение относится к способам получения вдыхаемого аэрозоля порошкообразной композиции с апоморфином.
В еще одном аспекте настоящее изобретение относится к применению апоморфина при получении лечебного средства для лечения половой дисфункции легочной ингаляцией.
Хотя некоторые композиции, способы лечения, ингаляторы, блистеры, способы ингаляции и дозы описываются выше как включающие носитель с частицами, предпочтительный средний размер которых составляет от примерно 40 мкм до примерно 70 мкм, следует иметь в виду, что, согласно другим воплощениям, носитель в таких композициях, способах лечения, ингаляторах, блистерах, способах ингаляции и дозах может иметь частицы другого среднего размера, в интервалах, например, от примерно 5 мкм до примерно 1000 мкм, от примерно 10 мкм до примерно 70 мкм или от примерно 20 мкм до примерно 30 мкм.
Таким образом, из описанного выше ясно, что настоящее изобретение имеет ряд преимуществ перед известным уровнем техники. В частности, настоящее изобретение обеспечивает высокоэффективную доставку апоморфина в легкие. Такая высокая эффективность создает возможность для быстрого достижения максимального содержания в крови и быстрого клинического начала лечебного действия. Действие введения апоморфина в легкие по настоящему изобретению является постоянным и воспроизводимым, и такое постоянство высокоэффективного введения ведет к снижению побочного действия, обычно связанного с введением апоморфина. При постоянной высокой эффективности также требуется меньшая общая доза по сравнению с дозой, которая может потребоваться, если использовать другие способы введения.
Существенным аспектом настоящего изобретения является то, что оно позволяет вводить значительно меньшие количества апоморфина, чем используемые на известном уровне техники, причем в то же время достигаются большие концентрации апоморфина в крови, но с меньшим побочным действием по сравнению со способами лечения апоморфином на известном уровне техники. Действительно, как будет показано ниже, при дозе апоморфина в 900 мкг, введенной по настоящему изобретению, достигается содержание апоморфина в крови, которое в 6 раз выше, чем содержание, достигаемое с помощью 4-мг сублингвальной таблетки Uprima® (фирменное наименование), но без каких-либо существенных побочных действий, в отличие от 4-мг таблетки, которую не продают из-за неприемлемого профиля побочного действия.
Краткое описание чертежей
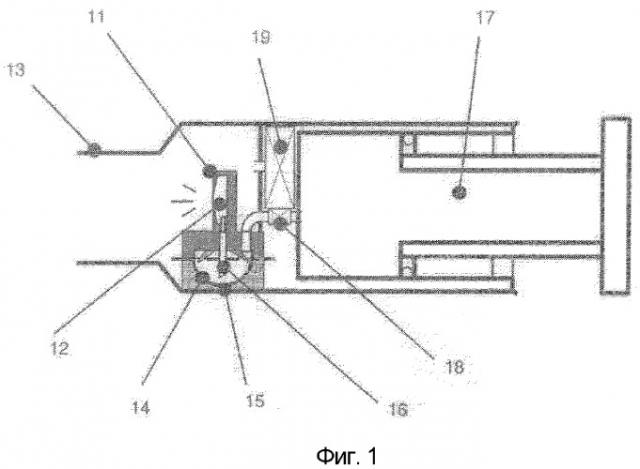
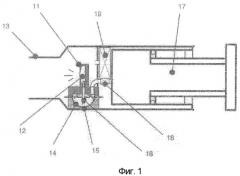
Фигура 1 показывает схематически предпочтительный ингалятор, который можно использовать для доставки порошков по настоящему изобретению.
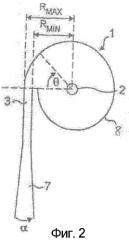
Фигура 2 показывает асимметричную вихревую камеру, которую можно использовать в устройстве для ингаляции, используемом для дозирования порошков по настоящему изобретению.
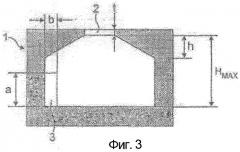
Фигура 3 показывает в разрезе другую форму вихревой камеры асимметричного ингалятора.
Фигуры 4А и 4В иллюстрируют гранулометрический состав лактозы в примере 1.
Фигуры 5А и 5В иллюстрируют гранулометрический состав тонкоизмельченного апоморфина в примере 2.
Фигуры 6А, 6В и 6С представляют данные по устойчивости для композиции 200 мкг апоморфина - лактоза примеров 2(а) и 3.
Фигуры 7А и 7В иллюстрируют результаты испытаний, осуществленных с композицией апоморфин - лактоза примеров 2 и 3.
Фигура 8 иллюстрирует гранулометрический состав тонкоизмельченного лейцина в примере 10.
Фигура 9 иллюстрирует качество эрекции в группе пациентов, получавших лечение, в примере 14.
Фигура 10 иллюстрирует степень реакции в группе пациентов, получавших лечение, в примере 14.
Фигура 11 иллюстрирует начало и длительность действия в группе пациентов, получавших плацебо, в примере 14.
Фигура 12 иллюстрирует начало и длительность действия в группе пациентов, получавших лечение 200 мкг апоморфина, в примере 14.
Фигура 13 иллюстрирует начало и длительность действия в группе пациентов, получавших лечение 400 мкг апоморфина, в примере 14.
Фигура 14 иллюстрирует начало и длительность действия в группе пациентов, получавших лечение 800 мкг апоморфина, в примере 14.
Фигура 15 показывает сравнение содержания в крови апоморфина через 70 минут после получения дозы (Т70) для каждого пациента в случае дозы 400 мкг и 800 мкг и также показывает известные средние Сmax в случае 2-мг, 4-мг и 5-мг сублингвальных таблеток Uprima®.
Фигуры 16-19 представляют результаты по фармакокинетике, накопленные во время фазы I исследования, описанного в примере 15.
Фигура 20 иллюстрирует количество (в микрограммах) лекарственного средства, доставленного к каждому из 11 компонентов ACI, в примере 18.
Фигура 21 иллюстрирует количество (в микрограммах) лекарственного средства, доставленного к каждому из 11 компонентов ACI, в примере 19.
Фигура 22 показывает результаты по однородности на протяжении срока действия дозы композиции 12А в примере 20.
Фигуры 23А и 23В показывают однородность доставляемой дозы композиции по настоящему изобретению из различно наполненных блистеров, описанных в примере 4.
Подробное описание предпочтительных воплощений
Воплощения настоящего изобретения относятся к композициям для ингаляции с апоморфином или его фармацевтически приемлемыми солями или эфирами для применения при лечении половой дисфункции. Воплощения настоящего изобретения также относятся к способам получения композиций с апоморфином, а также к способам лечения половой дисфункции с применением указанных композиций и ингаляторов, содержащих указанные композиции. Воплощения настоящего изобретения также относятся к применению апоморфина при получении лечебного средства для лечения половой дисфункции.
Композиции для ингаляции по настоящему изобретению вводят, предпочтительно, ингалятором для сухих порошков (DPI), но их также можно вводить ингалятором, отмеряющим дозу при нажатии (pMDI), или даже распылителем.
В контексте настоящего изобретения доза (например, в микрограммах) апоморфина или его фармацевтически приемлемых солей или сложных эфиров будет описываться в расчете на массу соли гидрохлорида (гидрохлорида апоморфина). Как таковая, доза в 100 мкг "апоморфина или его фармацевтически приемлемых солей или эфиров" означает 100 мкг гидрохлорида апоморфина или эквивалентное количество другой соли, эфира или основания.
Композиции для ингалятора для сухих порошков
Известно введение фармацевтически активных средств пациенту методом введения в легкие лечебной композиции в виде твердых частиц, содержащих активное вещество в форме тонкодисперсных сухих частиц (активных частиц). Размер активных частиц имеет большое значение при определении места поглощения активного вещества в легком. Для того чтобы частицы глубоко проникали в легкие, они должны быть очень мелкими, например иметь средневзвешенный аэродинамический диаметр (MMAD) менее 10 мкм. Частицы, имеющие аэродинамический диаметр более 10 мкм, вероятно, входят в контакт со стенками горла и, как правило, не достигают легких. Частицы, имеющие аэродинамический диаметр в интервале от примерно 5 мкм до примерно 2 мкм, будут, как правило, оседать в бронхиолах дыхательных путей, в то время как более мелкие частицы, имеющие аэродинамический диаметр в интервале от примерно 3 мкм до примерно 0,05 мкм, оседают, вероятно, в альвеолах.
В одном воплощении настоящего изобретения композиция содержит активные частицы, содержащие апоморфин, причем активные частицы имеют MMAD не более примерно 10 мкм. В другом воплощении активные частицы имеют MMAD от примерно 5 мкм до примерно 2 мкм. В еще одном воплощении активные частицы имеют аэродинамические диаметры в интервале от примерно 3 мкм до примерно 0,05 мкм. В одном воплощении изобретения, по меньшей мере, 90% частиц апоморфина имеют размер 5 мкм или менее.
Однако частицы, имеющие диаметр менее примерно 10 мкм, термодинамически неустойчивы из-за высокого отношения площади их поверхности к объему, что создает избыточную поверхностную свободную энергию и приводит частицы к агломерации. В ингаляторе агломерация мелких частиц и прилипание к стенкам ингалятора являются проблемами, которые приводят к тому, что активные частицы выходят из ингалятора в виде крупных агломератов или не способны покинуть ингалятор и остаются прилипшими к внутренним поверхностям устройства, или даже забивают или засоряют ингалятор.
Неопределенность, такая как степень образования устойчивых агломератов частиц при каждом срабатывании ингалятора, а также в различных ингаляторах и от партии частиц к партии, приводит к плохой воспроизводимости дозы. Кроме того, образование агломератов означает, что MMAD активных частиц может существенно возрасти, причем агломераты активных частиц не достигают требуемой части легкого. Поэтому целью настоящего изобретения является порошковая композиция, обеспечивающая хорошую воспроизводимость и, следовательно, точное и предсказуемое дозирование.
Отмеренная доза (MD) сухой порошковой композиции представляет собой общую массу активного вещества, присутствующего в отмеренной форме, предоставляемой устройством для ингаляции, представляющим интерес. Например, MD может представлять собой массу активного вещества, находящегося в капсуле для Cyclohaler (фирменное наименование) или в фольговом блистере в устройстве Aspirair (фирменное наименование).
Испускаемая доза (ED) представляет собой общую массу активного вещества, выходящего из устройства после его срабатывания. В нее не входит вещество, остающееся внутри или на поверхностях устройства. ED измеряют, собирая всю массу, выпущенную из устройства, в приборе, часто называемом прибором для отбора образцов на однородность дозы (DUSA), и извлекая и определяя указанную массу методом, принятым в количественном мокром химическом анализе.
Доза тонкодисперсных частиц (FPD) представляет собой общую массу активного вещества, выпускаемого из устройства после его срабатывания, которая присутствует в виде частиц, имеющих аэродинамический размер меньше установленного предела. Когда в данном описании используется термин "доза тонкодисперсных частиц" или "FPD", имеются в виду частицы аэродинамического размера менее 5 мкм. FPD измеряют с использованием импактора или импрингера (impringer), такого как двухступенчатый импрингер (TSI), многоступенчатый жидкостной импрингер (MSLI), каскадный импактор Андерсена (Andersen Cascade Impactor) или импактор Next Generation (NGI). Каждый импактор или импрингер имеет предварительно установленный набор аэродинамических размеров, ограниченный для каждой ступени. Величину FPD получают интерпретацией поступенчатого извлечения активного вещества, определяемого количественно установленным количественным мокрым химическим анализом, где для определения FPD используют или простое отсечение ступени или более сложную математическую интерполяцию поступенчатого осаждения.
Фракцию тонкодисперсных частиц (FPF) обычно определяют как FPD, деленную на ED, и выражают в процентах. В данном случае термин "доза тонкодисперсных частиц, в процентах" (FPD, %) используют для обозначения процента частиц от всей отмеренной дозы с диаметром не более примерно 5 мкм, которые доставляются (т.е. FPD, % = 100 · FPD/(вся отмеренная доза)).
Термин "доза ультрадисперсных частиц" (UFPD) используется в данном описании для обозначения всей массы активного вещества, доставляемой устройством, частицы которой имеют диаметр не более 3 мкм. Термин "фракция ультрадисперсных частиц" используется в данном описании для обозначения процента частиц с диаметром не более примерно 3 мкм от общего количества активного вещества, доставляемого устройством. Термин "доза ультрадисперсных частиц, в процентах" (UFPD, %) в данном описании используется для обозначения процента частиц с диаметром не более примерно 3 мкм от всей отмеренной дозы, которые доставляются (т.е. UFPD, % =
100 · UFPD/(вся отмеренная доза)).
Термины "доставляемая доза" и "выпускаемая доза" или "ED" в данном описании используются как взаимозаменяемые. Способы измерения указанных величин устанавливаются в существующей монографии ЕР для продуктов, доставляемых ингаляцией.
Выражение "срабатывани