Композиции, содержащие катионные микрочастицы и днк hcv е1е2, и способы их применения
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, вирусологии и медицины. Композиция включает полинуклеотид, кодирующий иммуноген HCV, представляющий собой комплекс E1E2 с определенной аминокислотной последовательностью, адсорбированный на катионной микрочастице и фармацевтически приемлемый наполнитель. Так же раскрыт способ получения такой композиции и ее применение для стимуляции иммунного ответа у субъекта-позвоночного. Изобретение может быть использовано для иммунизации против гепатита С. 6 н. и 23 з.п. ф-лы, 7 ил., 6 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение в целом относится к иммуногенным композициям, содержащим ДНК, кодирующую иммуногены HCV. В частности, изобретение относится к композициям, содержащим ДНК, кодирующую полипептиды HCV E1E2, адсорбированную на катионных микрочастицах, и к способам ее применения.
УРОВЕНЬ ТЕХНИКИ
Вирус гепатита С (HCV) был идентифицирован в течение последнего десятилетия и известен как главная причина вирусного гепатита не-A и не-B (Choo et al., Science (1989) 244:359-362; Armstrong et al., Hepatology (2000) 31:777). HCV инфицировано приблизительно 3% населения мира, что составляет приблизительно 200 миллионов человек (Cohen, J., Science (1999) 285:26). В Соединенных Штатах ежегодно заново появляется приблизительно 30000 инфицированных HCV. Кроме того, в развивающихся странах существует большое количество случаев инфицирования HCV. Хотя иммунный ответ способен победить инфекцию HCV, большинство случаев инфекции становится хроническими. Большинство острых инфекций остаются бессимптомными, и заболевание печени обычно проявляется только после ряда лет хронической инфекции.
Известна геномная последовательность вируса HCV, так же как и способы получения последовательности. См., например, международные публикации № WO 89/04669; WO 90/11089 и WO 90/14436. HCV имеет геном, представленный однонитевой молекулой РНК положительной полярности из 9,5 тысяч нуклеотидов, и является членом семейства вирусов Flaviridae. С помощью филогенетического анализа идентифицировано, по меньшей мере, шесть отдельных, но родственных генотипов HCV (Simmonds et al., J. Gen. Virol. (1993) 74:2391-2399). Вирус кодирует единственный полипротеин, имеющий более 3000 аминокислотных остатков (Choo et al., Science (1989) 244:359-362; Choo et al., Proc. Natl. Acad. Sci. USA (1991) 88:2451-2455; Han et al., Proc. Natl. Acad. Sci. USA (1991) 88:1711-1715). Полипротеин подвергается процессингу котрансляционно и посттрансляционно с превращением как в структурные, так и в не структурные (NS) белки. Два структурных белка являются гликопротеинами оболочки, известными как E1 и E2. Гликопротеины E1 и E2 HCV, как показано, являются защитными против вирусного заражения при исследовании на приматах (Choo et al., Proc. Natl. Acad. Sci. USA (1994) 91:1294-1298).
В настоящее время единственным доступным лечением HCV является IFN-α и рибавирин. К сожалению данные агенты эффективны менее чем у половины больных, проходящих лечение (Poynard et al., Lancet (1998) 352:1426; McHutchison et al., Engl. J. Med. (1998) 339:1485). Следовательно, существует срочная потребность в разработке эффективных вакцин для предотвращения инфицирования HCV, а также для иммунотерапии, применяемой в качестве альтернативы, или в сочетании с существующим лечением.
Т-клеточный иммунитет в отношении HCV может определить исход инфицирования и заболевания HCV (Missale et al., J. Clin. Invest. (1996) 98:706; Cooper et al., Immunity (1999) 10:439; and Lechner et al., J. Exp. Med. (2000) 191:1499). В одном исследовании установлено, что индивидуумы, у которых проявляются преобладающие Th0/Th1 CD4+ T-хелперные ответы, справляются со своими инфекциями HCV, в то время как у имеющих ответы типа Th2, наблюдается тенденция к переходу в хроническую форму (Tsai et al., Hepatology (1997) 25:449-458). Кроме того, было продемонстрировано, что существует обратная корреляция между частотой специфичных для HCV цитотоксических Т-лимфоцитов (CTLs) и вирусным заражением (Nelson, et al., J. Immunol. (1997) 158:1473). Недавно было показано, что контролирование HCV у шимпанзе связано с Th1 Т-клеточным ответом (Major et al., J. Virol. (2002) 76:6586-6595). Следовательно, HCV-специфические Т-клеточные ответы, очевидно, играют важную роль в контроле инфекции HCV. Роль антител в защите также предполагалась на основе редких случаев спонтанного прекращения хронической инфекции у больных (Abrignani et al., J. Hepatol. (1999) 31Suppll:259-263). Кроме того, защита у приматов прямо связана с титром антител против E1E2, что свидетельствует о возможной роли антител в защите (Choo et al., Proc. Natl. Acad. Sci. USA (1994) 91:1294-1298).
ДНК-вакцины, как показано, индуцируют сильные и длительные клеточные ответы CTL и Th1 в различных животных моделях (Gurunathan et al., Ann. Rev. Immunol. (2000) 18:927-974). Хотя ДНК-вакцины вводили людям-добровольцам в ряде клинических испытаний, и они оказались безопасными, их эффективность была низкой по сравнению с ответами, достигаемыми на более мелких животных моделях (Gurunathan et al., Ann. Rev. Immunol. (2000) 18:927-974). Например, хотя определяемые ответы CTL индуцировались у людей-добровольцев, даже высокие дозы ДНК (2,5 мг) иногда были не способны индуцировать определяемые ответы антител (Wang et al., Science (1998) 282:476-480). Ответы антител не определялись у людей-добровольцев даже тогда, когда в попытке улучшить эффективность для доставки ДНК использовали устройство для безыгольного струйного введения (Epstein et al., Hum. Gen. Ther. (2002) 13:1551-1560). Следовательно, существует очевидная потребность в усовершенствовании силы и эффективности ДНК-вакцин, особенно для гуморальных ответов.
Частицы-носители с адсорбированными или захваченными антигенами применяли при попытках вызвать адекватные иммунные ответы. Примеры частиц-носителей включают те, которые происходят из полиметилметакрилатных полимеров, а также микрочастицы, происходящие из поли(лактидов) (см., например, патент США № 3773919), поли(лактид-со-гликолидов), известные как PLG (см., например, патент США № 4767628) и полиэтиленгликоля, известного как ПЭГ (см., например, патент США № 5648095). Полиметилметакрилатные полимеры являются не деградируемыми, в то время как частицы PLG биодеградируют путем случайного неферментативного гидролиза эфирных связей с молочной и гликолевой кислотами, которые экскретируются по нормальным метаболическим путям.
Такие носители презентируют иммунной системе множественные копии выбранной макромолекулы и стимулируют захват и задержку молекул в местных лимфоузлах. Частицы могут фагоцитироваться макрофагами и могут увеличивать презентацию антиген путем секреции цитокинов. В международной заявке № WO 00/050006 описывается получение катионных микрочастиц с адсорбирующими поверхностями. Применение катионных микрочастиц в качестве системы доставки ДНК-вакцин, как показано, существенно улучшает эффективность (Singh et al., Proc. Natl. Acad. Sci. USA (2000) 97:811-816). Например, микрочастицы, как показано, увеличивают как гуморальный, так и Т-клеточный ответы в различных животных моделях при доставке в сочетании с плазмидами, кодирующими антигены HIV (Singh et al., Proc. Natl. Acad. Sci. USA (2000) 97:811-816; Briones et al., Pharm. Res. (2001) 18:709-712; O'Hagan et al., J. Virol. (2001) 75:9037-9043).
Проведен ряд исследований для определения механизма действия катионных микрочастиц PLG для индукции усиленных ответов на адсорбированную ДНК. Предварительные исследования показали, что PLG/ДНК, но не плазмидная ДНК, способна опосредовать трансфекцию дендритных клеток in vitro (Denis-Mize et al, Gene Ther. (2000) 7:2105-2112). Кроме того, PLG/ДНК защищает ДНК от деградации и увеличивает экспрессию генов в мышце и местных лимфатических узлах (Singh et al., Proc. Natl. Acad. Sci. USA (2000) 97:811-816; Briones et al., Pharm. Res. (2001) 18:709-712; Denis-Mize et al, Gene Ther. (2000) 7:2105-2112).
Несмотря на применение таких систем доставки в виде частиц, традиционные вакцины часто не способны обеспечить адекватную защиту против патогена-мишени. Соответственно, продолжает существовать потребность в эффективных иммуногенных композициях против HCV, которые включают безопасные и нетоксичные агенты для доставки.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение основано частично на неожиданном открытии того, что применение ДНК E1E2 HCV, адсорбированной на катионных микрочастицах, дает значительно более высокий титр антител по сравнению с наблюдаемым для ДНК E1E2 в отдельности. Катионные микрочастицы существенно адсорбируют ДНК, дают возможность для более высокой эффективности нагрузки, защищают адсорбированную ДНК от деградации и увеличивают экспрессию генов в мышце и в местных лимфатических узлах. Более того, доставка ДНК с применением микрочастиц в противоположность доставке ДНК в отдельности способна также после иммунизации привлекать в место введения значительное число активированных APC. Таким образом, применение таких сочетаний обеспечивает безопасный и эффективный подход к усилению иммуногенности антигенов E1E2 HCV.
Соответственно, в одном варианте осуществления изобретение направлено на композицию, состоящую по существу из фармацевтически приемлемого наполнителя и полинуклеотида, адсорбированного на катионной микрочастице. Полинуклеотид содержит кодирующую последовательность, которая кодирует иммуноген вируса гепатита С (HCV), оперативно связанную с контролирующими элементами, которые направляют транскрипцию и трансляцию кодирующей последовательности in vivo. Иммуноген HCV представляет собой иммуногенный комплекс E1E2 HCV с непрерывной последовательностью аминокислот, имеющей, по меньшей мере, 80% идентичности последовательности с непрерывной последовательностью аминокислот, изображенной в положениях 192-809 фиг.2A-2C, при условии, что полинуклеотид не кодирует иммуноген HCV, отличающийся от комплекса E1E2 HCV.
В определенных вариантах осуществления комплекс E1E2 HCV состоит из последовательности аминокислот, изображенной в положениях 192-809 фиг.2A-2C.
В дополнительных вариантах осуществления катионная микрочастица образуется из полимера, выбранного из группы, состоящей из поли(α-гидроксикислоты), полигидроксимасляной кислоты, поликапролактона, полиортоэфира и полиангидрида, такого как поли(α-гидроксикислота), выбранная из группы, состоящей из поли(L-лактида), поли(D,L-лактида) и поли(D,L-лактид-со-гликолида).
В дополнительных вариантах осуществления изобретение направлено на композицию, состоящую по существу из: (a) фармацевтически приемлемого наполнителя и (b) полинуклеотида, адсорбированного на катионной микрочастице, образованной из поли(D,L-лактид-со-гликолида). Полинуклеотид включает кодирующую последовательность, которая кодирует иммуноген вируса гепатита С (HCV), оперативно связанную с контролирующими элементами, которые направляют транскрипцию и трансляцию кодирующей последовательности in vivo, и иммуноген HCV представляет собой комплекс E1E2 HCV, состоящий из последовательности аминокислот, изображенной в положениях 192-809 фиг.2A-2C, при условии, что полинуклеотид не кодирует иммуноген HCV, отличающийся от комплекса E1E2 HCV.
В других дополнительных вариантах осуществления изобретение направлено на способ стимуляции иммунного ответа у субъекта-позвоночного, который включает введение субъекту терапевтически эффективного количества первой композиции, состоящей по существу из фармацевтически приемлемого наполнителя и полинуклеотида, адсорбированного на катионной микрочастице. Полинуклеотид включает кодирующую последовательность, которая кодирует иммуноген вируса гепатита С (HCV), оперативно связанную с контролирующими элементами, которые направляют транскрипцию и трансляцию кодирующей последовательности in vivo. Иммуноген HCV представляет собой иммуногенный комплекс E1E2 HCV с непрерывной последовательностью аминокислот, имеющей, по меньшей мере, 80% идентичности последовательности с непрерывной последовательностью аминокислот, изображенной в положениях 192-809 фиг.2A-2C, при условии, что полинуклеотид не кодирует иммуноген HCV, отличающийся от комплекса E1E2 HCV, где комплекс E1E2 HCV экспрессируется in vivo для выработки иммунного ответа.
В определенных вариантах осуществления комплекс E1E2 HCV состоит из последовательности аминокислот, изображенной в положениях 192-809 фиг.2A-2C.
В дополнительных вариантах осуществления катионная микрочастица образована из полимера, выбранного из группы, состоящей из поли(α-гидроксикислоты), полигидроксимасляной кислоты, поликапролактона, полиортоэфира и полиангидрида, такого как поли(α-гидроксикислота), выбранная из группы, состоящей из поли(L-лактида), поли(D,L-лактида) и поли(D,L-лактид-со-гликолида).
В дополнительных вариантах осуществления способ дополнительно включает введение субъекту терапевтически эффективного количества второй композиции, где вторая композиция включает иммуногенный полипептид HCV и фармацевтически приемлемый наполнитель.
В определенных вариантах осуществления вторую композицию вводят после первой композиции. Кроме того, иммуногенный полипептид HCV во второй композиции может представлять собой иммуногенный комплекс E1E2 HCV с непрерывной последовательностью аминокислот, имеющей, по меньшей мере, 80% идентичности последовательности с непрерывной последовательностью аминокислот, изображенной в положениях 192-809 фиг.2A-2C. В дополнительном варианте осуществления комплекс E1E2 HCV состоит из последовательности аминокислот, изображенной в положениях 192-809 фиг.2A-2C.
В дополнительном варианте осуществления вторая композиция дополнительно содержит адъювант, такой как субмикронная эмульсия масла в воде, способный увеличить иммунный ответ на иммуногенный полипептид HCV. Субмикронная эмульсия масла в воде включает (i) метаболизируемое масло, где масло присутствует в количестве от 1% до 12% от суммарного объема, и (ii) эмульгирующий агент, где эмульгирующий агент присутствует в количестве от 0,01% до 1% по массе (масс./об.) и включает моно-, ди- или триэфир полиоксиэтиленсорбитана и/или моно-, ди- или триэфир сорбитана, где масло и эмульгирующий агент присутствуют в форме эмульсии масла в воде, имеющей капли масла, по существу все из которых составляют в диаметре от приблизительно 100 нм до менее чем 1 мкм.
В определенных вариантах осуществления субмикронная эмульсия масла в воде включает 4-5% масс./об. сквалена, 0,25-1,0% масс./об. моноолеата полиоксиэтиленсорбитана и/или 0,25-1,0% триолеата сорбитана и, необязательно, N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)-этиламин (MTP-PE).
В дополнительных вариантах осуществления субмикронная эмульсия масла в воде состоит по существу из приблизительно 5% по объему сквалена и одного или более эмульгирующих агентов, выбранных из группы, состоящей из моноолеата полиоксиэтиленсорбитана и триолеата сорбитана, где суммарное количество присутствующего(их) эмульгирующего(их) агента(ов) составляет приблизительно 1% по массе (масс./об.).
В дополнительных вариантах осуществления один или более эмульгирующих агентов представляют собой моноолеат полиоксиэтиленсорбитана и триолеат сорбитана, и суммарное количество присутствующих моноолеата полиоксиэтиленсорбитана и триолеата сорбитана составляет приблизительно 1% по массе (масс./об.).
В других дополнительных вариантах осуществления вторая композиция дополнительно содержит олигонуклеотид CpG.
В другом варианте осуществления изобретение направлено на способ стимуляции иммунного ответа у субъекта-позвоночного, который включает:
(a) введение субъекту терапевтически эффективного количества первой композиции, состоящей по существу из полинуклеотида, адсорбированного на катионной микрочастице, образованной из поли(D,L-лактид-со-гликолида), где полинуклеотид включает кодирующую последовательность, которая кодирует иммуноген вируса гепатита С (HCV), оперативно связанную с контролирующими элементами, которые направляют транскрипцию и трансляцию кодирующей последовательности in vivo, и дополнительно, где иммуноген HCV представляет собой комплекс E1E2 HCV, состоящий из последовательности аминокислот, представленной в положениях 192-809 фиг.2A-2C, при условии, что полинуклеотид не кодирует иммуноген HCV, отличающийся от комплекса E1E2 HCV, и где комплекс E1E2 HCV экспрессируется in vivo; и
(b) введение субъекту терапевтически эффективного количества второй композиции, где вторая композиция включает (i) иммуногенный комплекс E1E2 HCV, состоящий из последовательности аминокислот, изображенной в положениях 192-809 фиг.2A-2C, (ii) адъювант, и (iii) фармацевтически приемлемый наполнитель, для выработки иммунного ответа у субъекта.
В определенных вариантах осуществления адъювант представляет собой субмикронную эмульсию масла в воде, способную увеличить иммунный ответ на иммуногенный комплекс E1E2 HCV во второй композиции. Субмикронная эмульсия масла в воде включает (i) метаболизируемое масло, где масло присутствует в количестве от 1% до 12% от суммарного объема, и (ii) эмульгирующий агент, где эмульгирующий агент присутствует в количестве от 0,01% до 1% по массе (масс./об.) и включает моно-, ди- или триэфир полиоксиэтиленсорбитана и/или моно-, ди- или триэфир сорбитана, где масло и эмульгирующий агент присутствуют в форме эмульсии масла в воде, имеющей капли масла, по существу все из которых составляют в диаметре от приблизительно 100 нм до менее чем 1 мкм. В дополнительном варианте осуществления вторая композиция дополнительно включает адъювант, такой как субмикронная эмульсия масла в воде, способный увеличить иммунный ответ на иммуногенный полипептид HCV.
В дополнительных вариантах осуществления субмикронная эмульсия масла в воде включает 4-5% масс./об. сквалена, 0,25-1,0% масс./об. моноолеата полиоксиэтиленсорбитана и/или 0,25-1,0% триолеата сорбитана и, необязательно, N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)-этиламин (MTP-PE).
В дополнительных вариантах осуществления субмикронная эмульсия масла в воде состоит по существу из приблизительно 5% по объему сквалена и одного или более эмульгирующих агентов, выбранных из группы, состоящей из моноолеата полиоксиэтиленсорбитана и триолеата сорбитана, где суммарное количество присутствующего(их) эмульгирующего(их) агента(ов) составляет приблизительно 1% по массе (масс./об.).
В дополнительных вариантах осуществления один или более эмульгирующих агентов представляют собой моноолеат полиоксиэтиленсорбитана и триолеат сорбитана, и суммарное количество присутствующих моноолеата полиоксиэтиленсорбитана и триолеата сорбитана составляет приблизительно 1% по массе (масс./об.).
В определенных вариантах осуществления вторая композиция дополнительно включает олигонуклеотид CpG.
В еще одном варианте осуществления изобретение направлено на способ создания композиции, включающей сочетание фармацевтически приемлемого наполнителя с полинуклеотидом, адсорбированным на катионной микрочастице. Полинуклеотид включает кодирующую последовательность, которая кодирует иммуноген вируса гепатита С (HCV), оперативно связанную с контролирующими элементами, которые направляют транскрипцию и трансляцию кодирующей последовательности in vivo. Иммуноген HCV представляет собой иммуногенный комплекс E1E2 HCV с непрерывной последовательностью аминокислот, имеющей, по меньшей мере, 80% идентичности последовательности с непрерывной последовательностью аминокислот, представленной в положениях 192-809 фиг.2A-2C, при условии, что указанный полинуклеотид не кодирует иммуноген HCV, отличающийся от комплекса E1E2 HCV.
Данные и другие варианты настоящего изобретения должны быть легко осуществлены специалистами в данной области техники в свете представленного здесь раскрытия.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1 представляет собой диаграммное представление генома HCV, изображающее различные области полипротеина HCV.
Фиг.2A-2C (SEQ ID NOS:1 и 2) представляют нуклеотидную и соответствующую аминокислотную последовательности области E1/E2/p7 HCV-1. Номера, представленные на фигуре, относятся к полноразмерному полипротеину HCV-1. Представлены области E1, E2 и p7.
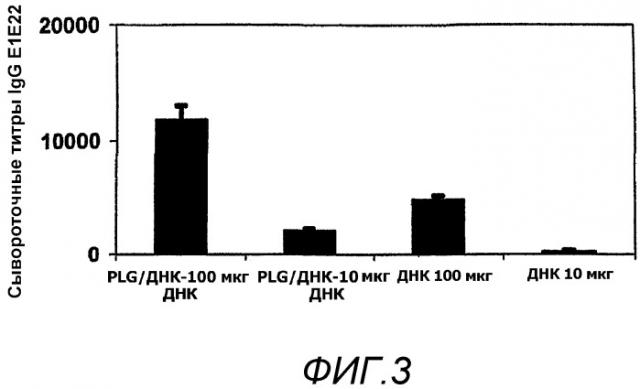
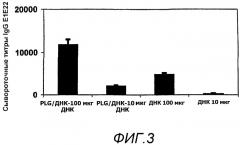
На фиг.3 представлены титры IgG в сыворотке после иммунизации мышей на 0 и 4 неделю плазмидной ДНК E1E2809, в отдельности или в виде PLG/CTAB/E1E2809ДНК (на фигурах указано как PLG/ДНК), в количестве 10 мкг и 100 мкг (N=10, +/- ст. ош. ср.).
На фиг.4 представлены титры IgG в сыворотке после иммунизации мышей на 0 и 4 неделю плазмидной ДНК E1E2809 в количестве 10 мкг, PLG/CTAB/E1E2809ДНК в количестве 1 мкг и 10 мкг, или рекомбинантным белком E1E2 E1E2809 в адъюванте MF59 в количестве 2 мкг (N=10, +/- ст. ош. ср.).
На фиг.5 представлены титры IgG в сыворотке после иммунизации мышей на 0, 4 и 8 недели плазмидной ДНК E1E2809 или PLG/CTAB/E1E2809ДНК в количестве 10 мкг, или рекомбинантным белком E1E2809 в адъюванте MF59 в количестве 5 мкг. Кроме того, 2 группы мышей дважды иммунизировали плазмидной ДНК E1E2809 или PLG/CTAB/E1E2809ДНК в количестве 10 мкг на 0 и 4 неделю и усиливали 5 мкг рекомбинантного белка E1E2809 в MF59 на 8 неделе (N=10, +/- ст. ош. ср.). D = ДНК E1E2809, 10 мкг; P = 5 мкг белка E1E2809 в MF59.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
При осуществлении настоящего изобретения будут применяться, если не указано иначе, общепринятые в данной области техники методы химии, биохимии, технологии рекомбинантной ДНК и методы иммунологии. Такие способы полностью объяснены в литературе. См., например, Fundamental Virology, 2nd Edition, vol. I & II (B.N. Fields and D.M. Knipe, eds.); Handbook of Experimental Immunology, Vols. I-IV (D.M. Weir and C.C. Blackwell eds., Blackwell Scientific Publications); T.E. Creighton, Proteins: Structures and Molecular Properties (W.H. Freeman and Company, 1993); A.L. Lehninger, Biochemistry (Worth Publishers, Inc., текущее дополнение); Sambrook, et al., Molecular Cloning: A Laboratory Manual (2nd Edition, 1989); Methods In Enzymology (S. Colowick and N. Kaplan eds., Academic Press, Inc.).
В тесте применяются следующие сокращения аминокислот:
| Аланин: Ala (A) | Аргинин: Arg (R) |
| Аспарагин: Asn (N) | Аспарагиновая кислота: Asp (D) |
| Цистеин: Cys (C) | Глутамин: Gln (Q) |
| Глутаминовая кислота: Glu (E) | Глицин: Gly (G) |
| Гистидин: His (H) | Изолейцин: Ile (I) |
| Лейцин: Leu (L) | Лизин: Lys (K) |
| Метионин: Met (M) | Фенилаланин: Phe (F) |
| Пролин: Pro (P) | Серин: Ser (S) |
| Треонин: Thr (T) | Триптофан: Trp (W) |
| Тирозин: Tyr (Y) | Валин: Val (V) |
1. Определения
В описании настоящего изобретения будут применяться следующие термины, и они предназначены для определения указанного ниже.
Следует отметить, что применяемые в данном описании и прилагаемой формуле изобретения формы единственного числа "a", "an" и "the" включают множественные значения, если в контексте ясно не указано иначе. Таким образом, например, ссылка на «полипептид E1E2» включает смесь двух или более таких полипептидов и тому подобное.
Термины «полипептид» и «белок» относятся к полимеру из аминокислотных остатков и не ограничиваются минимальной длиной продукта. Таким образом, пептиды, олигопептиды, димеры, мультимеры и тому подобное включаются в определение. Определением охватываются как полноразмерные белки, так и их фрагменты. Термины также включают постэкспрессионные модификации полипептида, например, гликозилированные, ацетилированные, фосфорилированные и тому подобное. Более того, в целях настоящего изобретения «полипептид» относится к белку, который включает модификации, такие как делеции, добавления и замены (обычно консервативные по природе), по отношению к нативной последовательности, то тех пор, пока белок сохраняет желаемую активность. Данные модификации могут быть преднамеренными, как в случае сайт-направленного мутагенеза, или они могут быть случайными, такими как мутации хозяев, которые продуцируют белки, или ошибки при ПЦР амплификации.
Под «полипептидом E1» подразумевается молекула, происходящая из области E1 HCV. Зрелая область E1 HCV-1 начинается от аминокислоты приблизительно 192 полипротеина и продолжается до аминокислоты приблизительно 383, пронумерованных относительно полноразмерного полипротеина HCV-1. (См. фиг.1 и 2A-2C. Аминокислоты 192-383 фиг.2A-2C соответствуют положениям аминокислот 20-211 SEQ ID NO:2). Аминокислоты от около 173 до приблизительно 191 (аминокислоты 1-19 SEQ ID NO:2) служат в качестве сигнальной последовательности для E1. Таким образом, под «полипептидом E1» подразумевается либо предшественник белка E1, включающий сигнальную последовательность, либо зрелый полипептид E1, у которого данная последовательность отсутствует, или даже полипептид E1 с гетерологичной сигнальной последовательностью. Полипептид E1 включает С-концевую мембранную якорную последовательность, которая расположена приблизительно в положениях аминокислот 360-383 (см. международную публикацию № WO 96/04301, опубликованную 15 февраля 1996 г.). Полипептид E1, как здесь определяется, может включать или не включать С-концевую якорную последовательность или ее части.
Под «полипептидом E2» подразумевается молекула, происходящая из области E2 HCV. Зрелая область E2 HCV-1 начинается от аминокислот приблизительно 383-385, пронумерованных относительно полноразмерного полипротеина HCV-1. (См. фиг.1 и 2A-2C. Аминокислоты 383-385 фиг.2A-2C соответствуют положениям аминокислот 211-213 SEQ ID NO:2). Сигнальный пептид начинается от аминокислоты приблизительно 364 полипротеина. Таким образом, под «полипептидом E2» подразумевается либо предшественник белка E2, включающий сигнальную последовательность, либо зрелый полипептид E2, у которого данная последовательность отсутствует, или даже полипептид E2 с гетерологичной сигнальной последовательностью. Полипептид E2 включает С-концевую мембранную якорную последовательность, которая расположена приблизительно в положениях аминокислот 715-730 и может простираться до аминокислотного остатка приблизительно 746 (см. Lin et al., J. Virol. (1994) 68:5063-5073). Полипептид E2, как здесь определяется, может включать или не включать С-концевую якорную последовательность или ее части. Более того, полипептид E2 может также включать всю или часть области p7, которая расположена в непосредственном соседстве с С-концом E2. Как показано на фиг.1 и 2A-2C, область p7 обнаруживается в положениях 747-809, пронумерованных относительно полноразмерного полипротеина HCV-1 (положения аминокислот 575-637 SEQ ID NO:2). Кроме того, известно, что существуют множественные виды E2 HCV (Spaete et al., Virol. (1992) 188:819-830; Selby et al., J. Virol. (1996) 70:5177-5182; Grakoui et al., J. Virol. (1993) 67:1385-1395; Tomei et al., J. Virol. (1993) 67:4017-4026). Соответственно, в целях настоящего изобретения термин "E2" охватывает любой из данных видов E2, включая без ограничения виды, которые имеют делеции 1-20 или более аминокислот с N-конца E2, такие как, например, делеции 1, 2, 3, 4, 5…10…15, 16, 17, 18, 19… и т.д. аминокислот. Такие виды E2 включают те, которые начинаются с аминокислоты 387, аминокислоты 402, аминокислоты 403 и т.д.
Примеры областей E1 и E2 HCV-1 представлены на фиг.2A-2C и SEQ ID NO:2. В целях настоящего изобретения области E1 и E2 определяются по отношению к номеру аминокислоты полипротеина, кодируемого геномом HCV-1, с инициаторным метионином, обозначаемым как положение 1. См., например, Choo et al., Proc. Natl. Acad. Sci. USA (1991) 88:2451-2455. Однако следует отметить, что применяемый здесь термин «полипептид E1» или «полипептид E2» не ограничивается последовательностью HCV-1. В данном отношении соответствующие области E1 или E2 других изолятов HCV могут быть легко определены путем выравнивания последовательностей из изолятов таким способом, который придает последовательностям максимальное выравнивание. Это может быть осуществлено с помощью любого из ряда пакетов компьютерных программ, такой как ALIGN 1.0, доступной от University of Virginia, Department of Biochemistry (Attn: Dr. William R. Pearson). См. Pearson et al., Proc. Natl. Acad Sci. USA (1988) 85:2444-2448.
Более того, как определяется здесь, «полипептид E1» или «полипептид E2» не ограничивается полипептидом, имеющим точную последовательность, изображенную на фигурах. Действительно, геном HCV находится в состоянии постоянного потока in vivo и содержит несколько вариабельных доменов, которые проявляют относительно высокие степени вариабельности между изолятами. Ряд консервативных и вариабельных областей известны между штаммами и, в целом, аминокислотные последовательности эпитопов, происходящих из данных областей, должны иметь высокую степень гомологии последовательностей, например, гомологию аминокислотных последовательностей более 30%, предпочтительно более 40%, более 60% и даже более 80-90% гомологии при выравнивании двух последовательностей. Совершенно очевидно, что термины охватывают полипептиды E1 и E2 из различных штаммов и изолятов HCV, включая изоляты, имеющие любой из 6 генотипов HCV, описанных в Simmonds et al., J. Gen. Virol. (1993) 74:2391-2399, (например, штаммы 1, 2, 3, 4 и т.д.), а также вновь идентифицированные изоляты и подтипы данных изолятов, такие как HCV1a, HCV1b и т.д.
Таким образом, например, термин полипептид "E1" или "E2" относится к нативным последовательностям E1 или E2 из любого из различных штаммов HCV, а также к аналогам, мутеинам и иммуногенным фрагментам, как определено далее ниже. Полные генотипы многих из данных штаммов известны. См., например, патент США № 6150087 и GenBank, № поступления AJ238800 и AJ238799.
Кроме того, термины «полипептид E1» и «полипептид E2» охватывают белки, которые включают модификации нативной последовательности, такие как внутренние делеции, добавки и замены (обычно консервативные по природе), такие белки по существу гомологичны родительской последовательности. Данные модификации могут быть преднамеренными, как в случае сайт-направленного мутагенеза, или они могут быть случайными, такими как возникающие в природе случаи мутаций. Все данные модификации охватываются настоящим изобретением до тех пор, пока модифицированные полипептиды E1 и E2 функционируют в предназначенных для них целях. Таким образом, например, если полипептиды E1 и/или E2 предполагается использовать в композициях вакцин, модификации должны быть такими, чтобы иммунологическая активность (т.е. способность вызывать гуморальный или клеточный иммунный ответ на полипептид) не терялась.
Под комплексом "E1E2" подразумевается белок, содержащий, по меньшей мере, один полипептид E1 и, по меньшей мере, один полипептид E2, как описано выше. Такой комплекс может также включать всю или часть области p7, которая расположена в непосредственном соседстве с С-концом E2. Как показано на фиг.1 и 2A-2C, область p7 обнаруживается в положениях 747-809, пронумерованных относительно полноразмерного полипротеина HCV-1 (положения аминокислот 575-637 SEQ ID NO:2). Представителя комплекса E1E2, который включает белок p7, обозначают здесь "E1E2809".
Способ ассоциации E1 и E2 в комплекс E1E2 является несущественным. Полипептиды E1 и E2 могут быть связаны с помощью нековалентных взаимодействий, таких как электростатические силы, или с помощью ковалентных связей. Например, полипептиды E1E2 по настоящему изобретению могут быть в форме гибридного белка, который включает иммуногенный полипептид E1 и иммуногенный полипептид E2, как определено выше. Гибрид может экспрессироваться с полинуклеотида, кодирующего гибрид E1E2. Альтернативно, комплексы E1E2 могут быть образованы спонтанно просто путем смешивания белков E1 и E2, которые получены индивидуально. Сходно, при коэкспрессии и секреции в среды белки E1 и E2 могут образовывать комплекс спонтанно. Таким образом, термин охватывает комплексы E1E2 (также называемые агрегатами), которые образуются спонтанно при очистке E1 и/или E2. Такие агрегаты могут включать один или более мономеров E1 в связи с одним или более мономерами E2. Не требуется, чтобы количество присутствующих мономеров E1 и E2 было равным до тех пор, пока присутствует, по меньшей мере, один мономер E1 и один мономер E2. Определение присутствия комплекса E1E2 легко осуществляется с помощью стандартных способов определения белка, таких как электрофорез в полиакриламидном геле и иммунологические способы, такие как иммунопреципитация.
Термины «аналог» и «мутеин» относятся к биологически активным производным референтной молекулы, таким как E1E2809, или к фрагментам таких производных, которые сохраняют желаемую активность, такую как иммунореактивность в описанных здесь тестах. В целом, термин «аналог» относится к соединениям, обладающим нативной полипептидной последовательностью и структурой с одной или более аминокислотных добавок, замен (обычно консервативных по природе) и/или делеций по отношению к нативной молекуле, то тех пор, пока модификации не уничтожают иммуногенную активность. Термин «мутеин» относится к пептидам, имеющим один или более пептидомиметиков («пептоидов»), таких как описанные в международной публикации № WO 91/04282. Предпочтительно, чтобы аналог или мутеин имели, по меньшей мере, такую же иммунореактивность, что и нативная молекула. Способы создания полипептидных аналогов и мутеинов известны в данной области техники и описаны далее ниже.
Особенно предпочтительные аналоги включают замены, консервативные по природе, т.е. такие замены, которые имеют место внутри семейства аминокислот, которые сходны по своим боковым цепям. Конкретно, аминокислоты обычно разделяют на четыре семейства: (1) кислые - аспартат и глутамат; (2) основные - лизин, аргинин, гистидин; (3) неполярные - аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан и (4) не заряженные полярные - глицин, аспарагин, глутамин, цистеин, серин, треонин, тирозин. Фенилаланин, триптофан и тирозин иногда классифицируются как ароматические аминокислоты. Например, реально предположить, что изолированная замена лейцина изолейцином или валином, аспартата глутаматом, треонина серином, или сходная консервативная замена аминокислоты структурно сходной аминокислотой не должна иметь существенного влияния на биологическую активность. Например, интересующий полипептид, такой как полипептид E1E2, может включать до приблизительно 5-10 консервативных или не консервативных замен аминокислот, или даже до приблизительно 15-25 или 50 консервативных или не консервативных замен аминокислот, или любое целое число между 5-50, до тех пор, пока желаемая функция молекулы остается интактной. Специалист в данной области техники легко может определить области интересующей молекулы, которые могут допускать замену при ссылке на графики Hopp/Woods и Kyte-Doolittle, хорошо известные в данной области техники. Под «фрагментом» подразумевается полипептид, состоящий только из части интактной полноразмерной полипептидной последовательности и структуры. Фрагмент может включать делецию С-конца, делецию N-конца и/или внутреннюю делецию нативного полипептида. «Иммуногенный фрагмент» конкретного белка HCV должен обычно включать, по меньшей мере, приблизительно 5-10 смежных аминокислотных остатков полноразмерной молекулы, предпочтительно, по меньшей мере, приблизительно 15-25 смежных аминокислотных остатков полноразмерной молекулы, и наиболее предпочтительно, по меньшей мере, приблизительно 20-50 или более смежных аминокислотных остатков полноразмерной молекулы, что определяет эпитоп, или любое целое число между 5 аминокислотами и полноразмерной последовательностью, предлагаемых так, чтобы исследуемый фрагмент сохранял способность вызывать иммунный ответ, как определено здесь. Для описания известных иммуногенных фрагментов E1 и E2 HCV см., например, Chien et al., международная публикация № WO 93/00365.
Применяемый здесь термин «эпитоп» относится к последовательности из, по меньшей мере, приблизительно от 3 до 5, предпочтительно приблизительно от 5 до 10 или 15, и не более приблизительно 500 аминокислот (или любое целое число между ними), которая определяет последовательность, которая сама по себе или как часть более длинной последовательности, вызывает иммунный ответ у субъекта, которому она вводится. Часто эпитоп должен связаться с антителом, выработанным в ответ на такую последовательность. Не существует верхнего критического ограничения на длину фрагмента, который может включать последовательность белка приблизительно полной длины, или даже гибридного белка, включающего два или более эпитопов полипротеина HCV. Эпитоп для применения у субъекта, согласно изобретению, не ограничивается полипептидом, имеющим точную последовательность части родительского белка, из которого он происходит. Действительно, геномы вирусов находятся в состоянии постоянного потока и содержат несколько вариабельных доменов, которые проявляют относительно высокие степени вариабельности между изолятами. Таким образом, термин «эпитоп» охватывает последовательности, идентичные нативной последовательности, а также модификации нативной последовательности, такие как делеции, добавки и замены (обычно консервативные по природе).
Области данного полипептида, которые включают эпитоп, могут быть идентифицированы с применением ряда способов картирования эпитопов, хорошо известных в данной области техники. См., например, Epitope Mapping Protocols in Methods in Molecular Biology, Vol. 66 (Glenn E. Morris, Ed., 1996) Humana Press, Totowa, New Jersey. Например, линейные эпитопы могут быть определены, например, с помощью одновременного синтеза большого количества пептидов на твердых подложках, пептидов, соответствующих частям белковой молекулы, и взаимодействия пептидов с антителами в то время, когда пептиды еще присоединены к подложкам. Такие способы известны в данной области техники и описаны, например, в патенте США № 4708871; Geysen et al. (1984) Proc. Natl. Acad. Sci. USA 81:3998-4002; Geysen et al. (1985) Proc. Natl. Acad. Sci. USA 82:178-182; Geysen et al. (1986) Molec. Immuno