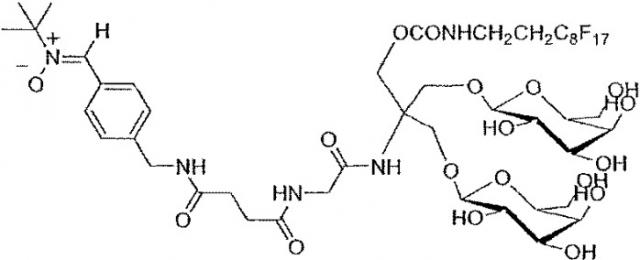
Новые амфифильные производные aльфа-c-фенил-n-трет-бутилнитрона
Иллюстрации
Показать всеНастоящее изобретение относится к производным α-C-фенил-N-трет-бутилнитрона общей формулы (I), где Х означает лактобионамидную группу, группу четвертичного аммония или группу ; m означает 1, 2 или 3; у означает 0 или 1; Y обозначает группу -CH2-; m' означает 1; X' означает алкильную цепь C4-C14, при необходимости замещенную одним или несколькими атомами фтора; Y' означает группу, выбранную из функциональной группы амида (-NHC(O)-), уретановой группы
(-OC(O)NH-) или тиоэфирного мостика (-S-). Изобретение относится также к применению заявленных соединений для получения лекарственного средства для лечения патологий, связанных с оксидативным стрессом и с образованием соединений со свободными радикалами кислорода. Кроме того, изобретение относится и к применению соединений формулы (I) для получения косметической композиции для предупреждения или лечения эффектов старения. 5 н. и 4 з.п. ф-лы, 4 табл., 11 ил.
Реферат
Объектом изобретения являются новые соединения, являющиеся производными α-C-фенил-N-трет-бутилнитрона, способ их получения и их применение для получения лекарственных средств, предназначенных для профилактики или лечения заболеваний, связанных с оксидативным стрессом.
Патологии, связанные с оксидативным стрессом и с образованием соединений со свободными радикалами кислорода, описаны в работах Croos C.E., Arch. Intern. Med. (1987) 107, 526-545 и Anderson K.M., Ells G., Bonomi P., Harris J.E., Medical Hypotheses (1999) 52, 53-57.
Они многочисленны: более 70 патологий этого типа указано в этом списке, который включает, в частности, иммунные и воспалительные заболевания, синдром ишемии-реперфузии, атеросклероз, болезни Альцгеймера и Паркинсона, повреждения, вызванные ионизирующим и УФ-излучением, определенные формы химического онкогенеза, а также старение клеток.
Реакционно-способные формы кислорода и азота (ROS и RNS) образуются в организме естественным путем, и их регулирование обеспечивается определенными специфическими ферментами, такими как растворимая супероксиддисмутаза (СОД). Улавливание этих чрезвычайно реакционно-способных радикальных соединений жизненно необходимо, так как они вызывают необратимые повреждения в клетках. Если нормальное производство этих радикальных соединений легко регулируется клеткой, перепроизводство свободных радикалов, связанное с внешним оксидативным стрессом (воспалительный шок, синдром ишемии-реперфузии и т.д.) или генетическим недостатком (в частности, аномалией митохондрий), приводит к быстрой деградации клеток. Из-за этого становится невозможной переработка этого значительного количества радикалов организмом человека или животного.
Существует множество механизмов защиты от оксидативного стресса клетки, способных осуществляться на разных уровнях окислительного каскада. Они инициируются обычно перепроизводством пероксидных радикалов, связанным с частичным восстановлением молекулярного кислорода в митохондрии (типичный синдром при ишемии-реперфузии). Этот пероксидный радикал может дисмутировать в перекись водорода. Эти два соединения посредством реакции Фентона в присутствии двухвалентного железа могут дать гидроксильные радикалы, которые имеют особенность очень быстро и неспецифическим образом реагировать с любым составляющим клетки, таким как липиды, ДНК или белки, вызывая в них необратимые повреждения, как это описано в работах Stadtman H. R., Berlett B.S. J. Biol.Chem. (1991) 266, 17201-17211; Floyd R. A. Carcinogenesis (1990) 11, 1447-1450; Gille J.J., Van Berkel C.G., Joenge H. Carcinogenesis (1994) 15, 2695-2699; Halliwell B. Mutat. Res. (1999) 443, 37-52.
Эти радикальные соединения, активируя определенные суицидные гены (гены Bel или p53) посредством фактора NF-kB, также являются следствием клеточного апоптоза, которое описано в работе Siebenlist U., Franzoso G., Brown K. Annu. Rev. Cell. Biol. (1994) 10, 405-455.
Задачей СОД является превращение пероксидных радикалов в перекись водорода, которая затем расщепляется каталазами или глутатион-зависимыми пероксидазами.
Существуют другие уровни клеточной защиты от оксидантов, в частности, на уровне мембраны, которые позволяют ограничить окисление ненасыщенных мембранных фосфолипидов. α-Токоферол и β-каротин являются главными примерами липидных антиоксидантов.
Наиболее многообещающая стратегия в поиске терапии, направленной на предупреждение или лечение заболеваний, связанных с оксидативным стрессом, состоит в том, чтобы как можно раньше вмешаться в этот окислительный каскад, чтобы очень быстро предотвратить повреждения, связанные с очень высокой реакционно-способностью радикальных соединений.
Для этого пытались улавливать эти чрезвычайно реакционно-способные свободные радикалы с помощью молекул, называемых spin trap или спиновыми ловушками, из которых самыми эффективными оказались нитроны.
Терапевтический эффект нитронов в снижении и предотвращении повреждений, вызванных свободными радикалами в биологических системах, был доказан в 1990 в работе Oliver C., Starke-Read P., Stadman E., Liu G., Carney J., Floyd R. Proc. Natl. Acad. Sci. USA (1990) 87, 5144-5147.
Эти авторы смогли показать уменьшение повреждений, вызванных церебральной ишемией, после инъекций α-C-фенил-N-трет-бутилнитрона (PBN) мышам-песчанкам. Церебральные ишемии сопровождаются сильным увеличением продукции свободных радикалов, которые захватываются PBN, чтобы образовать аддукторы спина, намного более стабильные и, следовательно, намного менее активные и токсичные спиновые аддукты. PBN является спиновой ловушкой, что делает его объектом большого числа биологических исследований.
Можно сослаться, например, на работу Hensley K., Carney J. M., Stewart C.A., Tabatabaie T., Pye Q.N., Floyd R. A. Int. Rev. Neurobiol. (1997) 40, 229-317.
Он обладает большой специфичностью церебрального действия, возможно, по причине его сильной гидрофобности, что позволяет ему преодолевать гематоэнцефалический барьер, как это показано в работе Cheng H.Y., Liu T., Feuerstein G., Barone F.C. Free Radic. Biol. Med. (1993) 14, 243-250.
Самыми известными и самыми эффективными из нитронов являются α-C-фенил-N-трет-бутилнитрон (PBN), 5,5-диметилпирролидин-N-оксид (DMPO) и молекулы, открытые позднее: N-бензилиден-1-диэтоксифосфорил-1-метилэтиламин-N-оксид (PBNP) и 5-диэтилфосфоно-5-метилпирролин-N-оксид (DEPMPO).
Можно назвать также дисульфонатное производное PBN, NXY-059
(динатрий-4-[(трет-бутилимино)-метилбензол-1,3-дисульфонат-N-оксид), обладающее более высокой нейрозащитной активностью, чем у PBN, с которым проводятся фармакологические и клинические исследования:
Kuroda S., Tsuchidate R., Smith M.L., Maples K.R., Siesjo B.K. J. Cereb. Blood Flow Metab. (1999) 19, 778-787;
Lees K.R., Sharma A.K., Barer D., Ford G.A., Kostulas V., Cheng Y.F., Odergren T. Stroke (2001) 32, 675-680.
Однако ни одна из названных молекул не обладает эффективностью in vivo или ex vivo, достаточной в малых дозах, даже если их цитотоксическая концентрация повышена: Almli L.M., Hamrick S.E.G., Koshy A.A., Tauber M.G., Ferriero D.M. Dev. Brain Res. (2001) 132, 121-129; Nakao N., Grasbon-Frodl E.M., Widner H., Brundin P. Neuroscience (1996) 73, 185-200. Этот недостаток эффективности связан, возможно, с плохой биологической эффективностью лекарства и проблемой проникновения в клетку.
Таким образом, продолжает существовать потребность в молекуле типа spin trap, или спиновой ловушки, способной захватывать свободные радикалы, которая также способна доставляться организмом человека или животного до ее цели на внутриклеточном уровне.
В частности, в молекуле, способной проходить через клеточную мембрану и, что является еще более трудной и важной задачей, митохондриальную мембрану, чтобы войти в компартмент, где продуцируются пероксидные радикалы.
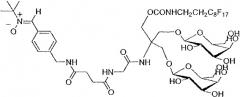
С этой целью в работах Ouari O., Polidori A., Pucci B., Tordo P., Chalier F. J. Org. Chem. (1999) 64, 3554-3556 и Geromel V., Kadhom N., Cebalos-Picot I., Ouari O., Polidori A., Munnich A., Rötig A., Rustin P. Hum. Моl. Genet. (2001) 10, 1221-1228, было предложено амфифильное перфторуглеродное производное PBN, а именно TA1PBN.
TA1PBN
Эту молекулу проверяли на клеточных линиях фибробластов, страдающих от сильного дефицита активности комплекса V дыхательной цепи (АТФазы), и она дала обнадеживающие результаты.
Однако синтез TA1PBN представляет трудности, которые делают его производство на промышленном уровне трудно представимым.
Таким образом, заявитель определяет целью разработку и производство новых молекул, обладающих активностью spin trap, или спиновой ловушки, имеющих повышенную биологическую эффективность по сравнению с молекулами предшествующего уровня техники и которые получаются просто, что позволяет планировать производство на промышленном уровне.
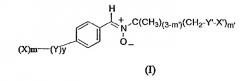
Объектом изобретения являются новые молекулы, отличающиеся тем, что они отвечают приведенной ниже формуле (I):
в которой:
X означает гидрофильную группу, выбранную из моно- или полисахарида, а также аминопроизводных моно- или полисахаридов, полиэтиленоксидную цепь, пептидную цепь, ионную полярную группу, выбранную из четвертичного аммония, аминоксида, карнитиновой группы;
m означает целое число, равное 1, 2 или 3;
Y означает связующее звено, предназначенное для соединения ароматического кольца и гидрофильных заместителей X;
Y выбран из функциональных групп сложного эфира, амида, мочевины, уретана, простого эфира, тиоэфира, амина, углеводородных цепей C1-C6, в случае необходимости прерванных одной или несколькими группами сложного эфира, амида, мочевины, уретана и одним или несколькими мостиками простого эфира, амина или тиоэфира;
y означает целое число, равное 0 или 1;
Y' означает группу, выбранную из функциональной группы сложного эфира амидной группы карбамидной группы уретановой группы эфирного мостика -O-, тиоэфирного мостика -S-;
m' является целым числом, выбранным из 1 и 2;
X' означает атом водорода или алкильную цепь C4-C14, при необходимости замещенную одним или несколькими атомами фтора.
Из моносахаридов, которые могут использоваться в настоящем изобретении, можно назвать глюкозу, лактозу, фруктозу, маннозу, галактозу, рибозу, мальтозу. Из аминопроизводных сахаров можно назвать, в частности, глюкозамин. Из полисахаридов, которые могут использоваться в настоящем изобретении, можно назвать цепи, состоящие из нескольких моносахаридных звеньев, как, например, сахароза и лактобионамид.
Если гидрофильная часть X молекулы формулы (I) является цепью полиэтиленоксида, она содержит предпочтительно от 30 до 100 звеньев этиленоксида, более предпочтительно от 50 до 60 звеньев.
Предпочтительно пептидная цепь составлена из натуральных аминокислот, таких как аланин, аргинин, аспарагин, аспарагиновая кислота, цистеин, глутамин, глутаминовая кислота, глицин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, пролин, серин, треонин, триптофан, тирозин, валин.
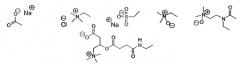
Ионные или неионные гидрофильные группы, которые могут использоваться в настоящем изобретении, показаны ниже на схеме 1.
Полярные ионные головки
Полярные неионные головки
Схема 1: Общая структура полярных головок
В зависимости от моно- или полифункциональности связующего звена Y, оно может быть одно- или двукратно замещено группой X.
Группа X' может, например, быть выбрана из следующих радикалов:
- углеводородные радикалы: н-бутил, трет-бутил, изобутил, н-пентил, изопентил, н-гексил, н-гептил, н-октил, н-нонил, н-децил, н-ундецил, н-додецил, н-тридецил, н-тетрадецил и т.д.;
- фторированные углеводородные радикалы: можно назвать радикалы, отвечающие формуле -(CH2)t-(CF2)rF, в которой r и t означают два целых числа, причем 14 ≥ r+t ≥ 4, такие, например, как:
-(CF2)4F; -(CF2)5F; -(CF2)6F; -(CF2)7F; -(CF2)8F; -(CF2)9F; -(CF2)10F; -(CF2)11F; -(CF2)12F; -(CF2)13F; -(CF2)14F; -CH2-(CF2)3F; -CH2-(CF2)4F; -CH2-(CF2)5F; -CH2-(CF2)6F; -CH2-(CF2)7F; -CH2-(CF2)8F; -CH2-(CF2)9F; -CH2-(CF2)10F; -CH2-(CF2)11F; -CH2-(CF2)12F; -CH2-(CF2)13F; -(CH2)2-(CF2)2F; -(CH2)2-(CF2)3F; -(CH2)2-(CF2)4F; -(CH2)2-(CF2)5F; -(CH2)2-(CF2)6F; -(CH2)2-(CF2)7F; -(CH2)2-(CF2)8F; -(CH2)2-(CF2)9F; -(CH2)2-(CF2)10F; -(CH2)2-(CF2)11F; -(CH2)2-(CF2)12F; -(CH2)3-(CF2)1F;… -(CH2)13-(CF2)F.
Предпочтительно удовлетворяется по меньшей мере одно из приведенных ниже условий:
X означает лактобионамидную, карнитиновую группу или цепь полиэтиленоксида;
m означает 1;
m' означает 1 или 2;
X' выбран из октила, децила, додецила, CF3(CF2)rCH2CH2-
8 ≥ r ≥ 6
Соединения по изобретению обладают тем преимуществом по сравнению с соединениями предшествующего уровня техники, что имеют улучшенную биологическую эффективность. Это улучшение биологической эффективности по крайней мере частично связано с амфифильным характером молекул по изобретению.
Объектом изобретения является также способ получения соединений, соответствующих формуле (I), причем этот способ отличается тем, что приводят в реакцию альдегид, отвечающий формуле (II), с гидроксиламином, отвечающим формуле (III), согласно схеме 2 ниже:
Схема 2
в которой X, y, Y, m, X', m' и Y' имеют то же значение, что и определенные выше.
Соединения формулы (III) получают способом, описываемым в схеме 3 ниже:
Схема 3
В зависимости от природы липофильной группы схема 3 осуществляется в условиях, которые будут изложены ниже.
a- Гидрофобная одноцепочечная углеводородная или перфторуглеродная часть (фигура 1):
На фигуре 1 показано получение соединений формулы (III), в которой:
m' = 1;
X' = (CH2)2-R с R = C6F13, C8F17, CH3(CH2)n
4 < n <14;
Y' = (соединение 5), (соединение 6), (соединение 2), (соединение 1), -S- (соединение 7).
Гидрофобная одноцепочечная часть синтезирована из 2-метил-2-нитропропанола. Спиртовая группа синтона позволяет привить углеводородные и перфторуглеродные цепи непосредственно с помощью связывания сложного эфира реакцией спирта и кислоты в присутствии связующего агента, дициклогексилкарбодиимида и диметиламинопиридина (1).
Спирт может также реагировать с алкилизоцианатом с получением связывания по типу уретана (2).
Спиртовая группа может быть превращена в аминогруппу реакцией с тозилом с последующим замещением нитридом натрия. Реакцией Штаудингера алкилазид преобразуют в амин в присутствии трифенилфосфина и соды.
Этот амин может реагировать с жирной кислотой с получением связывания по амидному типу (5) или с алкилизоцианатом с образованием мочевины (6).
Наконец, тозилат может быть замещен в основной среде тиолом с образованием тиоэфирной связи (7).
Затем нитрогруппу разных гидрофобных синтонов (1-7) восстанавливают в гидроксиламин с помощью 4 эквивалентов реактива Кагана (SmI2) в смеси ТГФ/MeOH или в уксусной кислоте.
Эта реакция описана в работах Girard P., Namy J.L., Kagan H.B. J. Am. Chem. Soc. (1980) 102, 2693-2698 и Namy J.L., Girard P, Kagan H.B. Nouv. J. Chem. (1977) 1, 5.
Эта очень быстрая (3 мин) реакция проводится с переменным выходом от 50 до 100% в зависимости от природы восстанавливаемого нитроалкила.
b- Двухцепочечная гидрофобная углеводородная или перфторуглеродная часть (фигура 2):
На фигуре 2 показано получение соединения формулы (III), в которой:
m'= 2;
X' = (CH2)2-R с R= C6F13, C8F17, CH3(CH2)n
4<n<14
Y' = (соединение 8), (соединение 9), -S- (соединение 12), (соединение 14), (соединение 13).
Гидрофобные двухцепочечные части синтезированы из 2-нитро-2-метил-1,3-пропандиола. Жирные цепи фиксируются на спиртовых функциональных группах уретановыми (9) или сложноэфирными связями (8). Спиртовые функциональные группы преобразуют в тозилат реакцией с хлоридом тозила. Дитозилат может быть замещен алкилмеркаптаном, чтобы получить тиоэфир (12). Этот дитозилат может быть преобразован в диамин замещением тозилата нитридом натрия и реакцией с трифенилфосфином и основным гидролизом. Этот диамин может реагировать с изоцианатом с получением карбамидной связи (14) или с кислотой с получением амидной связи (13).
Функциональную нитрогруппу "двухантенных" синтонов затем восстанавливают реактивом Кагана с выходом, который может варьировать от 60 до 80% в зависимости от рассматриваемой молекулы.
c- Гидрофильная неионная часть (фигура 3):
На фигуре 3 показано получение соединения формулы (II), в которой:
X означает полярную неионную группу:
Y означает -NH-CH2- (соединение 20), (соединения 21, 22, 23),
(соединение 24),
(соединение 25)
y=1;
m = 1 (соединения с 20 по 24);
m = 3 (соединение 25).
Гидрофильные неионные головки состоят из сахаров (лактобионамид, галактоза, глюкоза, манноза и т.п.), многоатомных спиртов, гликозилированных или нет (таких, например, как Tris и т.д.), или полиэтиленгликоля. Производные лактобионамида 20 синтезированы из 4-цианобензальдегида и лактобионлактона. После защиты альдегидной функциональной группы ацеталированием (15), а затем восстановлением нитрогруппы полученный амин конденсируют с лактобионлактоном. Ацетилирование спиртовых функциональных групп и удаление защиты у альдегидной функциональной группы избытком ацетальдегида в кислой среде дает полярный синтон 20.
Другие полярные головки синтезированы из 4-карбоксибензальдегида. Глюкозиловые (21), маннозиловые (22), галактозиловые (23) производные получены конденсацией Boc этаноламина с соответствующими ацетобромоглюкозидами (17, 18, 19) в условиях реакции Хельфериха. После удаления защиты у функциональной аминогруппы и конденсации с кислотной группой в присутствии пептидного связующего агента получают 3 полярные гликозилированные головки 21-23.
Пегилированное производное 24 получают в результате конденсации полиэтиленгликоля, функционализованного амином, с кислотной группой 4-карбоксибензальдегида, защищенного ацеталем. Удаление защиты у ацеталя позволяет получить это производное. Наконец, можно получить тригалактозиловое производное 25 конденсацией амина, уже описанного в литературе: Pucci B., Zarif L., Lacombe J-M., Riess J-G., Pavia A.A., Chem. Phys. Lipids (1995) 77, 225-251, с кислотной группой 4-карбоксибензальдегида.
d- Гидрофильная ионная часть (фигура 4):
На фигуре 4 показано получение соединения формулы (II), в которой:
X означает полярную ионную группу,
Y означает -CH2- (соединения 26, 27), (соединение 28), (соединение 29);
y = 1;
m = 1.
Полярные ионные головки состоят из групп четвертичного аммония, оксида амина или карнитина. Аммонийная группа синтезирована из нитрила после восстановления с помощью AlLiH4 и предварительной защиты альдегидной функциональной группы этиленгликоля. Полученный амин перметилируют йодистым метилом в присутствии трибутиламина в ДМФ по способу, описанному в работе Sommer H.Z., Lipp H.I, Jackson L.L. J. Org. Chem. (1971) 36, 824-828.
Кристаллизованный продукт гидролизуют в водном растворе уксусной кислоты, чтобы извлечь производное 26.
Оксид амина 27 получен из того же амина после образования третичного амина в присутствии 2 эквивалентов йодистого метила. Азот окисляют перекисью водорода, 10 объемов в метаноле. После удаления защиты у ацеталя получают соединение 27.
Оксид амина 29 синтезируют по методу McQuade и др. из 4-карбоксибензальдегида, защищенного на его альдегидной функциональной группе ацеталевой группой, и N-этил-N',N'-диметилэтилендиамина. Этот метод был описан в работе McQuade D.T., Quinn M.A., YU S.M., Polans A.S., Krebs M.P., Gellman S.H. Angew. Chem. Int. Ed. (2000) 39, 758-761.
Связывание проводят в присутствии пептидного связующего агента DCC. После окисления функциональной аминогруппы перекисью водорода, 10 объемов, и удаления защиты у ацеталя выделяют соединение 29.
Наконец, производное 28 карнитина получено конденсацией амина 15 с янтарным ангидридом, а затем связыванием с кислотной группой на спиртовой группе карнитина в ДМФ в присутствии DCC. После удаления защиты у функциональной кетальной группы получают продукт 28.
e- Получение одно- (фигура 5) и двухцепочечных (фигура 6) амфифильных нитронов:
Различные амфифильные нитроны получены соединением альдегидной функциональной группы разных полярных синтонов с гидроксиламиногруппой гидрофобных частей. В зависимости от более или менее полярной природы гидрофильных головок, ионные (очень полярные), обозначены I, или неионные гликозилированные (аполярные, так как ацетилированные), обозначены NI, используют полярный протонный (этанол) или апротонный (ТГФ) растворитель. Однако реакция в полярных протонных растворителях более быстрая (2 дня вместо 10 в ТГФ).
Прямоугольник с указанием CH показывает на этих фигурах углеводородную цепь X', в случае необходимости фторированную.
ТГФ применяется с полярными гликозилированными головками, так как он является растворителем, который не вызывает реакцию деацетилирования спиртовых функциональных групп. Все амфифильные гликозилированные нитроны были очищены с помощью ВЭЖХ в обращенной фазе (колонка C18, элюент метанол-вода). Ионные соединения были выделены кристаллизацией. Амфифильные пегилированные нитроны очищены c помощью гель-проникающей хроматографии (сефадекс LH20).
Кроме того, объектом изобретения является использование соединения по формуле (I), такого как определенное выше, в качестве агента против свободных радикалов.
Действительно, было показано, что соединениям согласно настоящему изобретению была придана способность захватывать свободные радикалы, эквивалентная соединениям предшествующего уровня техники.
Это свойство позволяет предусмотреть использование молекул изобретения в различных областях.
- В области терапии продукты по изобретению могут использоваться для профилактики и/или лечения патологий, связанных с оксидативным стрессом и образованием реакционно-способных форм кислорода.
Таким образом, объектом изобретения являются фармацевтические композиции, содержащие соединение согласно изобретению в фармацевтически приемлемом носителе. Его объектом является применение соединения согласно изобретению для получения лекарственного средства, предназначенного для профилактики и/или лечения эффектов, вызванных свободными радикалами.
Объектом изобретения является также применение соединения по изобретению для получения фармацевтической композиции, предназначенной для профилактики и/или лечения патологий, связанных с оксидативным стрессом и с образованием реакционно-способных форм кислорода, в частности иммунных и воспалительных заболеваний, синдрома ишемии-реперфузии, атеросклероза, болезни Альцгеймера, болезни Паркинсона, болезни Гентингтона, поражений, вызванных ионизацирующим или УФ-излучением, раковых заболеваний, старения клеток.
Продукты по изобретению могут быть введены любым путем, известным специалисту, в частности путем внутривенных или внутримышечных инъекций, пероральным или кожным введением. Они могут использоваться индивидуально или в сочетании с другими активными веществами. Их дозировку и суточную дозу устанавливают в зависимости от активности, измеренной для конкретной молекулы, и в зависимости от массы тела пациента.
- В области косметики соединения по изобретению могут использоваться для профилактики и/или лечения эффектов старения, а также эффектов, вызванных солнечным излучением.
Таким образом, объектом изобретения является также косметическая композиция, содержащая соединение по изобретению в косметически приемлемом носителе.
Указанная композиция может быть предназначена для нанесения на кожу или на запретные покровы (ногти, волосы).
Она может быть представлена в виде водного или масляного раствора, эмульсии "вода в масле" или "масло в воде", тройной эмульсии, мази.
Соединения по изобретению могут быть введены в любую косметическую композицию, для которой желательна активность против радикалов: крем для кожи, продукт для защиты от солнца, средство для снятия макияжа, маска для кожи или волос, шампунь, средство для макияжа, такое как губная помада, румяна, основа для краски, лак для ногтей и т.д.
- В области органического синтеза соединения по изобретению могут применяться как ловушки свободных радикалов в радикальных реакциях.
Благодаря своей растворимости в различных средах соединения по изобретению легко использовать и они могут быть использованы в самых разных условиях.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
I- Биологическая оценка:
Соединение A 1 использовали для проведения экспериментов по захвату свободных радикалов. Несколько соединений согласно изобретению были протестированы in vitro на их биологическую антиоксидантную и антирадикальную активность.
1- Измерение способности улавливать радикальные соединения
Эксперименты по улавливанию свободных радикалов с центром на углероде (радикалы CH3 и CО2) и на кислороде (радикал OH), проведенные на соединении A 1, показали, что функционализация PBN не влияет на способность этих молекул улавливать радикальные соединения. В случае свободных радикалов с центром на углероде можно было наблюдать ЭПР-сигналы, характерные для этих радикальных соединений, как это показано на фигуре 7.
Зато при образовании в системе гидроксильных радикалов регистрировались сигналы ЭПР, характерные для захвата радикалов с центром на углероде. Это вызвано захватом нитроном углеродсодержащих радикалов, полученных на полярных головках реакцией радикалов OH с водородами сахаров.
2- Измерение in vitro антиоксидантной и антирадикальной биологической активности
a- Оценка антиапоптозной активности на нейронах коры головного мозга крыс путем анализа энзиматической активности каспазы III.
Эти предварительные тесты были проведены на амфифильном гликозилированном углеводородном производном нитрона (нитрон A 2). Его активность против апоптоза сравнивали с двумя имеющимися в продаже нитронами, PBN и DMPO.
Нейронные клетки крыс подвергали интоксикации в течение 20 мин перекисью водорода в концентрации 100 мкМ на 8-дневной культуре. Эта добавка перекиси водорода вызывает явление апоптоза, как это было описано в работе Whittemore E.R., Loo D.T., Cotman C.W. Neuroreport (1994) 5, 1485-1488 (проверено положительным контролем апоптоза добавлением стауроспорина), оцениваемого колориметрическим анализом при 405 нм специфического фермента его метаболизма - каспазы III, по сравнению с максимальной интоксикацией контроля (описано ранее в работе Nicholson D.W., Ali A., Thombury N.A., Vaillancourt J.P., Ding C.H., Gallant M., Griffin P.R., Labelle M., Lazebnik Y.A., Munday N.A., Raju S.M., Smulson M.E., Yannin T., Yu V.I., Miller D.K. Nature (1995) 376, 37-43).
Различные тестируемые молекулы инкубировали в течение 20 часов при различных нетоксичных концентрациях (10, 100, 200 мкM) перед интоксикацией перекисью водорода. После промывки и сушки в сушильном шкафу клетки лизировали перед колориметрическим анализом. Амфифильный нитрон A 2 обладает значительной цитотоксичностью, начиная с 400 мкМ.
Полученные результаты (показанные на фигуре 8) ясно продемонстрировали очень отчетливое снижение активности каспазы III после интоксикации перекисью водорода концентрацией 100 мкМ в присутствии амфифильного нитрона A 1. Эта активность проявляется гораздо слабее, чем нормальная активность каспазы III на нейронных клетках, не подвергавшихся интоксикации.
Результаты ясно указывают на повышенный уровень защиты по сравнению с измеренным для имеющихся в продаже нитронов PBN и DMPO.
b- Оценка нейропротективной эффективности на совместных культурах нерв-мышца
Протективная оценка этих амфифильных нитронов была измерена на совместных культурах нервы-мышцы после интоксикации перекисью водорода в течение 30 мин.
Мышечные клетки человека, взятые из здоровых поперечно-полосатых мышц, выделяли миграцией сателлитных клеток в подходящую культуральную среду. Эти клетки соединялись в не способные к сокращению миофибры в культуральной среде. Эксплантаты спинного мозга крысиных эмбрионов наносились на мышечные клетки.
Через три недели все мышечные волокна, близкие к эксплантатам, не сокращались и обладали зрелыми нейромышечными связями. После созревания эти культуры отбирали и снимали на видеокамеру, соединенную с микроскопом. Молекулы типа
A (A 1 , A 2 , A 3 , A 4 ) и B (B 1 ) инкубировали в течение 20ч00 при концентрациях 100 и 200 мкМ. Затем клетки подвергали интоксикации в течение 30 мин H2О2 концентрацией 800 мМ, а затем промывали. Через 24ч00 и 48ч00 после того, как возник этот оксидативный стресс, клетки обследовали и снимали на камеру.
Через 20ч00 инкубации оказалось, что ионное соединение B 1 карбоксилатного типа является цитотоксичным и вызывает быструю деградацию мышечных клеток. Другие соединения нетоксичны, но вызывают задержку или ослабление мышечного сокращения, какой бы ни была используемая концентрация (100 и 200 мкМ). Зато для перфторированных соединений A 3 и A 4 при концентрации 100 мкМ и углеводородных соединений A 1 и A 2 при 100 и 200 мкМ наблюдается полное или частичное восстановление сокращений через 48ч00 после интоксикации перекисью водорода (таблица 1). Другие соединения защищают клетки от деградации, но не позволяют восстановление сокращений.
Затем было осуществлено количественное охарактеризование состояния апоптоза после лизиса клеток и центрифугирования при добавлении некоторого количества фрагментов ДНК с помощью устройства "cell death detection ELISA" в супернатанте. После ферментативного проявления были измерены оптические плотности при 405 нм с помощью устройства для считывания планшетов (фигура 9).
Результаты ясно показывают, что все исследованные молекулы, за исключением ионного производного B 1, защищают клетки от апоптоза, вызванного добавлением перекиси водорода. При концентрации 200 мМ карбоксилатное производное B 1 имеет очень слабый ложный сигнал апоптоза, который вызван до клеточного лизиса выделением фрагментов ДНК в культурную среду после смертью клеток в культуре, обработанной этим нитроном.
| Таблица 1 Измерение сократительной активности клеточных культур нерв-мышца через 48ч00 после интоксикации H2О2 в концентрации 800 мкM | |||||||
| Нитроны | R | [C]мкМ | Сократительная активность мышечных волокон (число лунок) | % сократительной неактивности | |||
| 0 | + | ++ | +++ | ||||
| A1 | C7H15CONH | 100 | 2 | 0 | |||
| 200 | 3 | 0 | |||||
| A2 | C8H17S | 100 | 3 | 100 | |||
| 200 | 2 | 100 | |||||
| A3 | C6F13CH2CH2S | 100 | 3 | 0 | |||
| 200 | 1 | 1 | 1 | 33,3 | |||
| A4 | C6F13CH2CH2CONH | 100 | 1 | 2 | 33,3 | ||
| 200 | 3 | 100 | |||||
| B1 | C8H17S | 100 | кс1 | 100 | |||
| 200 | кс | 100 | |||||
| PBN | 200 | кс | 100 | ||||
| DMPO | 200 | Кс | 100 | ||||
| Контроль | 1 | 1 | 0 | ||||
| Контроль H2О2 | 3 | 1 | 75 | ||||
| 1Гибель клеток |
| Таблица 2 Критерий обнаружения сократительной активности мышечных волокон | |
| 0 | Нет мышечных волокон, имеющих сократительную активность, в лунке с культурой |
| 0/+ | Одно мышечное волокно, имеющее слабую и нерегулярную сократительную активность |
| + | Одно мышечное волокно, имеющее регулярную сократительную активность |
| ++ | От 2 до 4 мышечных волокон, имеющих сократительную активность |
| +++ | Более 4 мышечных волокон, имеющих сократительную активность |
c. Оценка антиоксидантной активности на клеточных линиях фибробластов, страдающих сильным дефицитом комплекса V дыхательной цепи: определение клеточной жизнестойкости по тесту MTT
Опыты проводились на клеточных линиях фибробластов, отличающихся мутацией гена NARP, кодирующего белок (субъединица 6) комплекса V митохондриальной цепи. Эти клетки характеризуются аномальной сверхпродукцией фермента супероксиддисмутазы, что позволяет предположить, что генетический дефицит вызывает рост производства пероксидного радикала. Эта сверхпродукция пероксидных радикалов вызывает ускоренный процесс апоптоза клеток (Geromel V., Kadhom N., Cebalos-Picot I., Ouari O., Polidori A., Munnich A., Rötig A., Rustin P. Hum. Mol. Genet. (2001) 10, 1221-1228).
Культуры фибробластов были приготовлены из биопсии кожи двух индивидуумов (контроль) и одного пациента - носителя мутации NARP. Клетки культивировали в среде RPMi 1640 (выпускаемой компанией Life technologies SARL, Cergy Pontoise, Франция), в которую добавили глутамакс (446 мг/л): 10% эмбриональной сыворотки теленка не диализованной, 100 мкг/мл стрептомицина, 100 IU/мл пенициллина, 200 мкМ уридина, 2,5 мМ пирувата натрия. Для тестов на цитотоксичность клетки были засеяны до плотности 3000 клеток на лунку в микрочашке Петри при 37°C и
при 5% CО2. Чтобы вызвать оксидативный стресс, клетки после 24 часов подвергают гипогликемии путем замены глюкозы галактозой в концентрации 10 мМ (селективная среда, обозначенная "ms" на фигурах с 10a по 10f). Через 24 часа клетки были подвергнуты действию в течение 48 часов и 72 часов возрастающих концентраций различных тестируемых соединений в селективной среде, предназначенной для дыхательных клеток (среда RPMi 1640 без глюкозы). В конце сравнения все исследования были проделаны на клетках, собранных после удвоения популяции.
Антиоксидантная активность амфифильных нитронов оценивалась по измерению их способности защищать клетки от апоптоза по тесту MTT.
Тест MTT является колориметрическим методом, позволяющим определить число жизнеспособных клеток в опытах на пролиферативность и цитотоксичность. Лунки оставляли для инкубации с 20 мкл раствора MTT (5 мг/мл в PBS) в течение 1 часа при 37°C. Затем было добавлено 200 мкл изопропанола для экстрагирования формазана MTT, и был измерен коэффициент поглощения каждой лунки при 540 нм с помощью аппарата с автоматическим считывающим устройством.
Результаты, полученные при колориметрическом анализе MTT, показаны на фигурах с 10a по 10f. На этих фигурах соединение A 5 является нитроном типа A, в котором R=OCONH(CH2)5CH3, а соединение H отвечает нижеследующей формуле:
Соединение H
Тест показывает способность TA1PBN в концентрации 50 мкМ защищать клетки NARP от клеточной смерти через апоптоз. Эти результаты хорошо подтверждают, таким образом, анализ, проведенный ранее на TA1PBN (Geromel V., Kadhom N., Cebalos-Picot I., Ouari O., Polidori A., Munnich A., Rötig A., Rustin P. Hum. Mol. Genet. (2001) 10, 1221-1228). Перфторуглеродное соединение B 1 оказывается также эффективным, начиная с концентрации 100 мкМ. Следует отметить, что перфторуглеродное соединение A 4 и углеводородные соединения A 1 , A 2 и A 5 не эффективны на этой клеточной модели. Это отсутствие эффективности можно отнести за счет малой гидрофобности жирных углеводородных цепей. Перфторированное соединение A 4 имеет длину цепи меньше, чем у соединения A 3. Наконец, следует отметить, что TA1PBN имеет более длинную перфторированную цепь C8F17, чем у соединения A 3 (цепь C