Стабилизация белка в растворе
Иллюстрации
Показать всеМатериал, выбранный из группы, состоящей из стекла, покрытого диоксидом кремния, стекла, покрытого силиконом, используют в качестве материала внутренней стенки контейнера, который включает (i) стеночный участок и (ii) одну или более закрывающих перегородок, не составляющих часть названного стеночного участка, и который содержит композицию белка, имеющего домен с аминоконцевой γ-карбоксиглутаминовой кислотой (Gla), с 9-12 остатками Gla, где указанный материал снижает склонность указанного белка подвергаться ди-, олиго- и/или полимеризации. Технический результат - улучшение стабильности водных композиций - стабильности фактора VIIa (FVIIa) в водных растворах, что важно для содержания и временного хранения жидкой композиции белка, особенно водной композиции белка. 4 н. и 34 з.п. ф-лы, 3 табл.
Реферат
Область техники изобретения
Данное изобретение, помимо прочего, относится к применению в качестве материала внутренней стенки в контейнере для содержания и хранения фармацевтической композиции белка, в частности, витамин К-зависимого белка системы свертывания крови, такого как фактор VIIa, материала, который снижает или минимизирует тенденцию рассматриваемого белка к димер-, олиго- и/или полимеризации и/или, возможно, подвергаться другим процессам, которые способствуют потере активности рассматриваемого белка. В частности, изобретение важно для содержания и временного хранения жидкой композиции белка, особенно водной композиции белка.
Уровень техники изобретения
Группа белков, известных как витамин К-зависимые зимогенные белки системы свертывания крови, примером которых является фактор VII (FVII), представляет особый интерес в контексте данного изобретения. Рассматриваемые белки, которые имеют сходную белковую доменную структуру и содержат домен с аминоконцевой γ-карбоксиглутаминовой кислотой (Gla), с 9-12 Gla-остатками, составляют важный класс факторов свертывания, который вовлечен в естественно происходящий физиологический процесс, известный как гемостаз. Процесс гемостаза, который осуществляется в ответ на кровотечение, возникающее как результат вызванного повреждения стенки кровеносного сосуда, например, при травме или хирургических вмешательствах, инициируется образованием комплекса между тканевым фактором (TF), который становится доступным циркулирующей крови после повреждения стенки кровеносного сосуда, и активированной формой FVII (FVIIa), которая присутствует в циркуляции в количестве, соответствующем приблизительно 1% общей массы белка FVII. Образованный комплекс прикрепляется к TF-несущей клетке, и он активирует фактор X (FX) и фактор IX (FIX) с образованием их активированных форм (FXa и FIXa, соответственно) на клеточной поверхности. FIXa активирует протромбин в тромбин, который, в свою очередь, активирует фактор VIII (FVIII), фактор V (FV), фактор XI (FXI) и фактор XIII (FXIII) с образованием их активированных форм (FVIIIa, FVa, FXIa и FXIIIa, соответственно).
Кроме того, ограниченное количество тромбина, образованного на упомянутой исходной стадии гемостаза, также активирует тромбоциты крови, заставляя их изменить форму и представлять заряженные фосфолипиды на их поверхности. Названная поверхность активированных тромбоцитов образует матрицу для последующей дальнейшей активации FX и полного образования тромбина. Дальнейшая активация FX на поверхности активированных тромбоцитов происходит через комплекс FIXa-FVIIIa, образованный на поверхности активированного тромбоцита, а FXa затем превращает протромбин в тромбин пока еще на поверхности. Тромбин затем превращает фибриноген в фибрин, который является нерастворимым и который стабилизирует исходную тромбоцитарную закупоривающую массу. Описанный процесс компартментализован, то есть локализован в участке экспрессии TF или выделения, минимизируя вследствие этого риск системной активации системы свертывания. Нерастворимый фибрин, образующий сгусток, дополнительно стабилизируется в результате FXIII-катализируемого сшивания волокон фибрина.
Среди белков фактор VII (FVII) представляет особый интерес в контексте изобретения; белки FVII встречаются у млекопитающих (включая человека) и у других многочисленных видов животных (например, некоторых рыб). В плазме FVII существует, главным образом, в виде одноцепочечного зимогена, который расщепляется за счет FXa до его двухцепочечной активированной формы, обозначаемой FVIIa. Рекомбинантный активированный фактор VIIa (rFVIIa) был разработан как прогемостатический агент. Исследования показали, что введение rFVIIa приводит к быстрому и высокоэффективному прогемостатическому ответу у субъектов с гемофилией, у которых возникают кровотечения, которые невозможно лечить продуктами факторов свертывания, таких как FVIII или FIX, вследствие образования антител. Кроме того, кровотечения у субъектов с недостаточностью фактора VII, а также у субъектов, имеющих нормальную систему свертывания, но испытывающих сильное кровотечение (например, как последствие тяжелой травмы), можно успешно лечить FVIIa. В проведенных исследованиях никакие вредные побочные действия rFVIIa (в частности, появление тромбоэмболии) не были отмечены.
Введение дополнительного экзогенного FVIIa увеличивает образование тромбина на поверхности активированных тромбоцитов; этот факт был показан на пациентах с гемофилией с недостаточностью FIX или FVIII и, поэтому, с недостаточностью большинства возможных путей полного образования тромбина. Аналогично, у пациентов со сниженным количеством тромбоцитов или нарушенной функцией тромбоцитов введение дополнительного FVIIa увеличивает образование тромбоцитов.
Коммерческие препараты рекомбинантного FVIIa (rhFVIIa) человека продают как NovoSeven™ (Novo Nordisk A/S, Denmark), который поставляют в виде сублимированного препарата в ампулах, содержащих, например, 1,2 мг rhFVIIa,
5,84 мг NaCl, 2,94 мг CaCl2·2H2O, 2,64 мг глицилглицина, 0,14 мг полисорбата™ 80, 60,00 мг маннита, и который восстанавливают перед применением, используя 2,0 мл воды для инъекций (WFI). Полученный раствор после восстановления можно использовать в течение 24 часов, если хранят максимум при 25°С. В настоящее время никакие жидкие или высококонцентрированные композиции FVIIa коммерчески не поставляются, однако ясно, что жидкая композиция FVIIa с адекватной активностью и стабильностью является крайне желательной.
Вообще, на стабильность белка в растворе, помимо прочего, могут оказывать влияние такие факторы, как ионная сила, рН, температура, повторные циклы замораживания/оттаивания или воздействие разрушающих сил сдвига. Активный белок может быть утрачен в результате различных видов физической или физико-химической нестабильности, включая тенденцию к денатурации и/или агрегации (образование растворимых или нерастворимых агрегатов), а также химической нестабильности, включая, например, тенденцию к гидролизу, деамидированию и/или окислению, упомянутые среди прочих. Для общего ознакомления со стабильностью белковых фармацевтических препаратов смотри, например, Manning et al., Pharmaceutical Research 6: 903-918 (1989).
Тогда как возможные проявления белковой нестабильности достаточно установлены, в значительной степени невозможно сделать надежными предсказания, касающиеся типов нестабильности, которые следует ожидать для определенного белка. Многочисленные виды нестабильности могут привести к образованию белковых побочных продуктов или белковых производных, проявляющих, например, сниженную активность, повышенную токсичность и/или повышенную иммуногенность. Таким образом, например, в случае FVIIa, который является сериновой протеиназой, фрагментация белка вследствие автопротеолиза представляет собой деградацию, которую следует учитывать.
Преципитация белка из раствора, в лучшем случае, может приводить к неоднородности лекарственной формы и количества, а также к засорению шприцев или, в самом худшем случае, к тромбозу у субъекта, которого лечат. Кроме того, посттрансляционные модификации, например, такие как гамма-карбоксилирование определенных остатков глутаминовой кислоты на N-конце белка или введение углеводородных боковых цепей, могут создавать участки, которые потенциально являются чувствительными к химической модификации при хранении.
Таким образом, безопасность и эффективность любой фармацевтической композиции белка непосредственно связаны с его стабильностью. В этом отношении сохранение стабильности жидкой лекарственной формы вообще является более необходимым, чем в случае твердого препарата, например лиофилизированного препарата, который предназначен для растворения или восстановления в соответствующем жидком наполнителе незадолго перед введением, из-за значительно повышенного потенциала молекулярного движения в жидкой фазе и, вследствие этого, повышенной вероятности молекулярных взаимодействий. Кроме того, сохранение стабильности концентрированной жидкой композиции белка вообще является более необходимым, чем в случае более разбавленных жидких композиций, вследствие большей склонности к образованию агрегатов при более высоких белковых концентрациях.
Данное изобретение, явившееся результатом наблюдений, что жидкие водные препараты/композиции FVII (в данном случае как FVIIa), которые хранили в определенных типах контейнеров, проявляют неудовлетворительно высокую скорость и/или степень образования агрегатов. На основании указанных наблюдений проводили исследования, позволившие разработать критерии, в соответствии с которыми можно значительно улучшить стабильность жидкой фазы не только FVII, но также родственных типов белков.
Краткое описание изобретения
В данном изобретении установлено, что на стабильность фактора VIIa (FVIIa) в водных растворах (то есть в водных композициях) в отношении образования агрегатов (димеров, олигомеров или полимеров) оказывает значительное влияние природа материала, являющегося материалом внутренней стенки контейнера, в котором хранят водную композицию, и идентифицирован целый ряд типов материалов, которые, как оказалось, являются желательными материалами в отношении минимизации образования агрегатов (и возможно других форм деградации) и в связи с этим для минимизации потери активности белка.
Как уже упоминалось выше, FVII является одним из целого ряда белков (примерами которых являются так называемые витамин К-зависимые зимогенные белки свертывания, также упоминавшиеся выше), которые имеют сходную белковую доменную структуру и которые включают в себя домен с γ-карбоксиглутаминовой кислотой (Gla), содержащий от 9 до 12 остатков Gla на аминоконце; белок описанного типа для удобства иногда называют «Gla-доменный белок». Оказалось, что образование физиологически активных форм не только FVII (дающий FVIIa), но также других белков этого типа связано со сродством, в частности, Gla-домена упомянутых белков к связыванию иона кальция (Ca2+). Имеются указания, основанные на результатах, полученных для FVII (в виде FVIIa) (смотри рабочие примеры, представленные в описании), что минимизация образования белковых агрегатов, которые наблюдают при использовании некоторых типов материалов как материалов внутренней стенки в контейнерах, в контексте данного изобретения, может быть связана, вполне обратимым способом, со степенью, с которой материал внутренней стенки способен высвобождать определенные ионы металлов, особенно ионы определенных трехвалентных металлов и, возможно, ионы двухвалентных металлов, в раствор и что, как полагают, этот вывод можно экстраполировать на Gla-доменные белки в большей степени, чем на FVII.
Не ограничиваясь какой-либо определенной теорией, один аспект изобретения имеет отношение к применению материала, выбранного из следующего:
стекла, покрытого диоксидом кремния;
стекла, покрытого силиконом;
полимеров нециклических олефинов;
циклоолефиновых полимеров;
сополимеров циклоолефин/линейный олефин,
в виде материала внутренней стенки контейнера, который содержит (i) стеночный участок и (ii) одну или более закрывающих перегородок, не составляющих часть стеночного участка, и который содержит композицию белка, имеющего домен с аминоконцевой γ-карбоксимасляной кислотой (Gla), с 9-12 Gla-остатками.
В других родственных аспектах изобретения представляют, по крайней мере, частично заполненный контейнер, имеющий в качестве материала внутренней стенки контейнера материал, выбранный из материалов, упомянутых непосредственно выше, где контейнер включает в себя (i) стеночный участок и (ii) одну или более закрывающих перегородок, не составляющих часть стеночного участка, и содержит композицию белка, имеющего домен с аминоконцевой γ-карбоксимасляной кислотой (Gla), с 9-12 Gla-остатками.
Другие подробности, касающиеся аспектов и воплощений изобретения, описываются ниже.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ПРИМЕРЫ
Пример 1. Образование димеров/олигомеров в контейнерах, сделанных из различных материалов
Порции свежеприготовленной водной композиции rFVIIa (смотри ниже), имеющей рН 5,0 (корректировали добавлением небольших количеств 0,1 М, или 1 М HCl, или NaOH), хранили при 30°С в течение 12 недель в ампулах (контейнерах), сделанных из различных материалов, которые указаны в таблице 1, ниже. Композиция rFVIIa имела следующий состав:
| rFVIIa | 1 мг/мл |
| хлорид кальция | 1,47 мг/мл |
| хлорид натрия | 2,92 мг/мл |
| глицилглицин | 1,32 мг/мл |
| гистидин | 1,55 мг/мл |
| ацетат натрия | 0,82 мг/мл |
Процентное содержание димер + олигомеры (выраженное как процент от исходного количества FVIIa в композиции) в нулевое время и через 2, 4, 8 и 12 недель, соответственно, определяли гельпроникающей высокоэффективной жидкостной хроматографией (ГП-ВЭЖХ), проводимой на колонке Waters Protein Pak™ 300 SW, 7,5Ч300 мм, используя 0,2 М сульфат аммония, рН 7,0, как подвижную фазу; скорость потока 0,5 мл/мин. Определение проводили по спектрофотометрическому поглощению при 215 нм. Результаты суммированы в таблице 1.
Из результатов очевидно, что образование димер + олигомеры rFVIIa в контейнерах из стекла типа I быстро снижалось, если контейнеры были промыты и прогреты (стерилизованы), но что наилучшие результаты были получены с ампулами из стекла типа I, покрытого диоксидом кремния, и ампулами из CZ™-смолы, что составило приблизительно в равной степени хорошие результаты в отношении минимизации образования димер/олигомер.
| Таблица 1 | |||||
| Контейнер | Т=0% димер+олигомер | Т=2 неделям30°С% димер+олигомер | Т=4 неделям30°С% димер+олигомер | Т=8 неделям30°С% димер+олигомер | Т=12 неделям30°С% димер+олигомер |
| А | 0,5 | 5,9 | 9,1 | 15,1 | 19,3 |
| В | 0,9 | 4,9 | 4,3 | 4,4 | - |
| С | 0,5 | 1,9 | 2,3 | 2,7 | 2,7 |
| D | 1,1 | 1,9 | 2,4 | 2,7 | 2,8 |
| А: необработанная стеклянная ампула, стекло типа I (боросиликатное стекло), Ph. Eur.В: ампула из стекла типа I (Ph. Eur.), которое было промыто водой при 90°С, а затем нагрето до 300°С.С: ампула из покрытого диоксидом кремния стекла типа I (Ph. Eur.), (Schott, тип I Plus™).D: Пластмассовая ампула из смолы CZ™ (daikyo Seiko). |
Пример 2. Образование димеров/олигомеров в картриджах
Порции свежеприготовленной водной композиции rFVIIa, имеющей такой же состав, как описано выше в примере 1, и аналогично приведенной к рН 5,0, хранили при 30°С в течение 12 недель в картриджах (контейнерах), сделанных из необработанного стекла типа I (боросиликатное стекло), Ph. Eur., и промытого, обработанного силиконом и термообработанного стекла типа I (боросиликатное стекло), Ph. Eur., соответственно. Процентное содержание димер + олигомеры определяли (как описано выше в примере 1) в нулевое время и через 2, 4 и 12 недель, соответственно. Результаты суммированы в таблице 2.
Результаты показывают, что обработанные силиконом и термообработанные картриджи оказались значительно лучше, чем необработанные картриджи в отношении минимизации образования димер/олигомер.
| Таблица 2 | ||||
| Контейнер | Димер + олигомеры (%) | |||
| T=0 | T=2 неделям | T=4 неделям | T=12 неделям | |
| A | * | 2,7 | 5,0 | 7,0 |
| B | 0,6 | 2,1 | 2,5 | 2,8 |
| А: 1,5 мл картридж для шприц-ручек, сделанный из необработанного стекла типа I (боросиликатное стекло), Ph. Eur., и снабженный галоген-каучуковым поршнем, диаметр 7,2 мм (West Pharmaceutical Services, cat. No. 4002, который подвергали обработке силиконом Dow Corning Medical Fluid 369 и автоклавировали) и пластинчатой крышкой, которая пенетрируется иглой.В: картридж, как в А, но промытый, обработанный 1% эмульсией силиконового масла, приготовленной из эмульсии силиконового масла Wacker E2 (приблизительно 35% силиконовое масло), а затем нагретый максимум при 330°С в течение максимум 5 часов; поршень и крышка такие, как в А.* Достоверное значение не получено. |
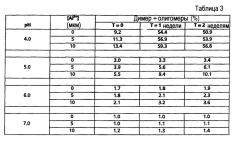
Пример 3. Образование димеров/олигомеров rFVIIa в присутствии добавленных ионов алюминия (Al3+)
Ион алюминия (в виде 100 мкМ водного раствора AlCl3·6H2O в деионизованной воде) добавляли (в двух различных конечных концентрациях) к порциям свежеприготовленной водной композиции rFVIIa, имеющей такой же состав, как описан в примере 1, выше, помещенным в ампулы, сделанные из смолы CZ™, и имеющим разные значения рН - от 4,0 до 6,0, скорректированные добавлением небольших аликвот раствора 0,1 М, или 1 М HCl, или NaOH. Ампулы хранили при 30°С.
Процентное содержание агрегатов димер + олигомер FVII определяли (как описано выше в примере 1) в нулевое время и через 1 и 2 недели, соответственно. Результаты суммированы в таблице 3, ниже, из которых очевидно, что процентное содержание димер + олигомеры rFVIIa увеличивалось со временем при увеличении добавленной конечной концентрации Al3+ при всех четырех тестируемых значениях рН.
Подробное описание изобретения
Как уже указано выше, первый аспект изобретения имеет отношение к применению материала, выбранного из следующего:
стекла, покрытого диоксидом кремния;
стекла, покрытого силиконом;
полимеров нециклических олефинов;
циклоолефиновых полимеров;
сополимеров циклоолефин/линейный олефин,
в качестве материала внутренней стенки в контейнере, который включает в себя (i) стеночный участок и (ii) одну или более закрывающих перегородок, не являющихся частью стеночного участка, и который содержит композицию белка, имеющего домен с аминоконцевой γ-карбоксиглутаминовой кислотой (Gla), с 9-12 Gla-остатками.
В тесной связи с последним аспектом изобретения в следующем аспекте изобретения представляют, по крайней мере, частично заполненный контейнер, имеющий в качестве материала внутренней стенки контейнера материал, выбранный из упомянутых непосредственно выше материалов, контейнер, который включает в себя (i) стеночный участок и (ii) одну или более закрывающих перегородок, не являющихся частью стеночного участка, и который содержит композицию белка, имеющего домен с аминоконцевой γ-карбоксиглутаминовой кислотой (Gla), с 9-12 Gla-остатками.
Как отмечено выше, предпочтительные материалы для внутренней стенки контейнера в контексте данного изобретения включают в себя различные сорта/типы стекла, на которое наносят покрытие из диоксида кремния (диоксид кремния, SiO2); одним таким материалом, который очень хорошо подходит, является стекло «типа I» (которое описывают в Европейской фармакопее, Ph. Eur.), покрытое диоксидом кремния. Что касается описания и идентификационных тестов для стекла типа I и других типов фармацевтически подходящего стекла (типы I, II, III и IV), смотри, например, раздел 3.2.1. Ph.Eur. (4th Edition).
Контейнеры из стекла типа I описывают в разделе 3.2.1. Ph.Eur. (4th Edition).
Контейнеры из стекла типа I описывают в разделе 3.2.1. Ph.Eur. (4th Edition, on line) следующим образом:
«Они представляют собой нейтральное стекло и имеют высокую гидролитическую резистентность вследствие химического состава самого стекла»,
нейтральное стекло описывают следующим образом:
«Нейтральное стекло является боросиликатным стеклом, содержащим значительные количества оксида бора, оксидов алюминия или щелочноземельных металлов. Благодаря его составу нейтральное стекло имеет высокую термостойкость и очень высокую гидролитическую устойчивость».
Покрытие из диоксида кремния на внутренней стенке контейнера данного типа имеет, по существу, однородную толщину, по крайней мере, приблизительно 0,05 мкм, хотя, как полагают, обычно более желательной является, по существу, однородная толщина в диапазоне приблизительно от 0,1 мкм до 0,2 мкм. Оказалось, что химическое осаждение с испарением (CVD) является способом, который очень хорошо подходит для нанесения такого достаточно однородного плотного покрытия из диоксида кремния на стеклянные поверхности, а контейнеры из стекла типа I (например, ампулы), имеющие покрытие из диоксида кремния, которое наносят по способу CVD на внутреннюю поверхность контейнера и которое очень подходит для применения в контексте изобретения, поставляются коммерчески, например контейнеры Schott Type I plus™ фирмы Schott Glaskontor, Mullheim/Baden, Germany.
Можно сделать ссылку, например, на следующую статью на WorldWideWed в отношении описания способов CVD: http://www.azom.com/details.asp?ArticleD=1552.
Как уже отмечено выше, другие предпочтительные материалы для внутренней стенки контейнера в контексте изобретения включают в себя различные сорта/типы стекла, которое покрывают силиконом, обычно после первоначального промывания или погружения в воду или другие водные среды, чтобы удалить выщелачиваемые водой вещества или разновидности. Как отмечалось ранее, предпочтительным типом стекла в этой связи является стекло типа I (Ph.Eur.).
Термин «силикон» широко используют в описании, чтобы указать не только на силиконы сами по себе, которые обычно представляют собой полимерные диалкилированные или моноалкилированные + моноарилированные силоксаны, но также на сополимеры, обычно блоксополимеры и привитые сополимеры, содержащие силиконовые сегменты и сегменты из других полимерных материалов, таких как полистиролы, полиолефины, полиамиды или полиуретаны.
Покрывающий материал соответственно может представлять собой масло поли(диалкилсилоксана) или сополимер, а подходящие типы поли(диалкилсилоксана) в этой связи включают в себя поли(диметилсилоксан) (PDMS), поли(дипропилсилоксан) и поли(дигексилсилоксан).
Вязкость масла, когда наносят на компоненты, может иметь важное значение, особенно для устранения феномена "скольжение-прилипание", который может возникать, например, если рассматриваемый контейнер представляет собой картридж или подобное устройство, содержащее перемещаемый поршень, используемый для удаления жидкости (белковая композиция) из контейнера. Большая вязкость уменьшает риск появления феномена "скольжение-прилипание", который препятствует ровному перемещению поршня. В одном воплощении изобретения покрытие содержит гидрофилизированное масло линейного или разветвленного поли(диалкилсилоксана). Вязкость масла при нанесении на компонент предпочтительно составляет свыше 200000 сантистокс, такая как свыше 500000 сантистокс.
В предпочтительных воплощениях силиконовое покрытие содержит поперечно-сшитое или гелеобразное силиконовое масло, такое как гидрофилизированное масло поли(диалкилсилоксана), или смесь поперечно-сшитого и несшитого масла. При использовании поперечно-сшитого или гелеобразного масла миграционная способность масла значительно снижается, а покрытие можно рассматривать как твердый материал.
Поперечно-сшитое или отвержденное силиконовое масло обычно получают, применяя масло силикона с линейной или разветвленной цепью с реакционно-способными функционализированными группами, которые используют для сшивания с покрытием на последующей стадии. Существует целый ряд различных подходящих способов сшивки, например отверждение облучением УФ-излучением, отверждение нагреванием при повышенной температуре и отверждение в присутствии воды. Сшитое силиконовое масло также можно получать, сначала используя масло силикона с прямой или разветвленной цепью, а затем облучая масло высокоэнергетическим источником излучения, например электронным источником, или источником рентгеновского излучения. Поперечно-сшитое силиконовое масло соответственно может быть маслом с чистотой, соответствующей медицинским целям, например MDX™, поставляемое Dow Corning (MDX4-4159 Fluid); другие подходящие типы масла включают в себя силиконовое масло Wacker E2, поставляемое в виде приблизительно 35% водной эмульсии.
В другом воплощении силиконовое покрытие содержит гидрофилизированные блок-сополимер и привитой сополимер поли(диалкилсилоксана). Сополимер может представлять собой любой блок-сополимер и привитой сополимер, который содержит полимерные сегменты поли(диалкилсилоксана), такие как PDMS. Полимерные сегменты, например, можно комбинировать с полимерными сегментами полистирола, полиолефинов, поламидов или полиуретана с образованием требуемого сополимера. Сополимер можно получать по любому подходящему известному способу, например последовательной анионной полимеризацией или различными способами привитой сополимеризации.
Гидрофильность силиконового покрытия может быть достигнута любым подходящим способом, например, подвергая покрытие окислительной обработке, такой как плазменная обработка или обработка коронным разрядом, после нанесения на стеклянную поверхность.
Гидрофильность также может быть достигнута посредством блокирования концевой группы сополимера гидрофильными группами или сегментами цепи. Гидрофильная группа, например, может быть отрицательно заряженной химической группой или группой фосфорилхолина (PC), а сегмент цепи, например, может представлять собой поли(оксид этилена) (PEO) или поли(2-гидроксиэтилметакрилат) (pHEMA).
Обработанные плазмой поверхности можно модифицировать, чтобы уменьшить белковую абсорбцию связыванием гидрофильных полимерных сегментов или функциональных групп. Эти полимерные сегменты или функциональные группы могут быть одного и того же вида, который описан выше, и, кроме того, могут быть связаны с функциональными группами, образованными во время плазменной обработки.
Толщина силиконового покрытия зависит от определенного покрытия и предпочтительно составляет от 0,005 до 10 мкм, более предпочтительно от 0,01 до 1 мкм. Оптимальная толщина зависит от размера, формы и типа контейнера и легко может быть установлена любым специалистом в данной области. В случае, например, картриджа с перемещаемым поршнем или частью плунжера, если покрытие оказывается слишком тонким, оно может отрываться при использовании, вследствие этого увеличивая трение между поршнем и стеночной частью. Когда толщина покрытия достигает определенного значения плато, сила трения становится приблизительно постоянной, даже если толщина еще увеличивается. Что касается состава любого покрытия, покрытие предпочтительно должно быть настолько тонким, насколько возможно, чтобы снизить стоимость. Такое тонкое покрытие соответственно может иметь толщину от 0,005 до 0,4 мкм, такую как от 0,015 до 0,25 мкм, более предпочтительно приблизительно 0,2 мкм.
В зависимости от миграционной способности силиконового покрытия гидрофильные группы при покрытии будут иметь тенденцию к поиску в покрытии уходящих поверхностных гидрофобных групп, обусловленных гидрофобностью окружающего воздуха. В случае контейнера, который должен быть заполнен жидкой водной композицией белка, содержащего Gla-домен, чтобы минимизировать любую тенденцию белка в его жидкой водной композиции абсорбировать во внутреннею поверхность контейнера, желательно, чтобы покрытие оставалось гидрофильным во время хранения до тех пор, пока жидкая белковая композиция не будет внесена в контейнер. Это довольно просто достигают заполнением контейнера белковой композицией вскоре после осуществления процесса покрытия.
Как показано выше, другие предпочтительные материалы для внутренней стенки контейнера в контексте данного изобретения включают в себя полимеры нециклических (то есть, с прямой или разветвленной цепью) олефинов, то есть, полиалкены. Из числа таких материалов подходящие полимеры, полученные из одиночного мономера, включают в себя полиэтилены и полипропилены, многочисленные виды которых являются частично кристаллическими по структуре. Сополимеры нециклических олефинов [например, сополимеры этилена (этена) и пропилена (пропена)] также представляют интерес как материалы для внутренней стенки в контексте изобретения.
Как также отмечено выше, другие предпочтительные материалы для внутренней стенки контейнера в контексте данного изобретения включают в себя полимеры циклоолефина, а их подходящие типы включают в себя полимеры, состоящие, по существу, на 100% из 5-7-членных алифатических циклических углеводородных колец. Подходящие коммерчески поставляемые контейнеры, сделанные из циклоолефинового полимерного материала, включают в себя контейнеры, приготовленные из смолы CZ™, поставляемые фирмой Daikyo Seiko Ltd., Tokyo, Japan. Другие подходящие полимерные материалы описанного типа включают в себя Zeonor™ и Zeonex™, оба от фирмы Nippon Zeon Co. Ltd., Tokyo, Japan.
Подходящие типы сополимеров циклоолефин/линейный олефин включают в себя материалы с аморфной структурой, такие как высокопрозрачные сополимеры типа Topas™ (поставляемые фирмой Ticona GmbH, Frankfurt am Main, Germany), которые доступны в виде целого ряда разновидностей (например, Topas™ 8007, Topas™ 5013, Topas™ 6013, Topas™ 6015, Topas™ 6017).
Другой аспект изобретения имеет отношение к применению твердофазного материала, который при инкубации, по крайней мере, в течение 24 часов при температуре, не превышающей 40°С, в контакте в водой или водным раствором, имеющим рН приблизительно от 3 до 8, высвобождает, в лучшем случае, приблизительно 3 мкМ иона трехвалентного металла в раствор; контейнер заключает в себе (i) стеночный участок и (ii) одну или более закрывающих перегородок, не составляющих часть стеночного участка, и который содержит препарат белка, имеющего домен с аминоконцевой γ-карбоксиглутаминовой кислотой (Gla) с 9-12 остатками Gla.
В тесной связи с описанным последним аспектом изобретения в еще одном аспекте изобретения представляют, по крайней мере, частично заполненный контейнер, имеющий в качестве материала внутренней стенки контейнера твердофазный материал, который при инкубации, по крайней мере, в течение 24 часов при температуре, не превышающей 40°С, в контакте с водой или водным раствором, имеющим рН приблизительно от 3 до 8, высвобождает, в лучшем случае, приблизительно 3 мкМ иона трехвалентного металла в раствор; контейнер заключает в себе (i) стеночный участок и (ii) одну или более перегородок, не составляющих часть стеночного участка, и содержит композицию белка, имеющего домен с аминоконцевой γ-карбоксиглутаминовой кислотой (Gla), содержащий 9-12 остатков Gla.
Хотя полагают (как показано выше), что приемлемый верхний предел для высвобождаемого уровня/концентрации ионов трехвалентных металлов составляет приблизительно 3 мкМ (то есть, высвобождаемый уровень приблизительно ≤3 мкМ), высвобождаемый уровень, в лучшем случае, приблизительно 2,5 мкМ (то есть, приблизительно ≤2,5 мкМ), более желательно, самое большое приблизительно 1 мкМ (то есть, приблизительно ≤1 мкМ), такой уровень как, самое большое, приблизительно 0,5 мкМ (то есть приблизительно ≤0,5 мкМ), как оказалось, является благоприятным.
Относительно ионов трехвалентных металлов в контексте двух последних аспектов данного изобретения, оказалось, что высвобождение Al3+ является особенно нежелательным, Fe3+ представляет следующий пример иона трехвалентного металла, высвобождения которого в раствор следует избегать.
Кроме устранения высвобождения в раствор ионов трехвалентных металлов еще считают желательным избегать высвобождения в раствор некоторых ионов двухвалентных металлов, особенно Zn2+. В этой связи высвобождаемые уровни, вероятно, не должны превышать приблизительно 3 мкМ (то есть, высвобождаемый уровень приблизительно ≤3 мкМ), более предпочтительно, самое большое, приблизительно 1 мкМ (то есть, высвобождаемый уровень приблизительно ≤1 мкМ), такой как, самое большое, приблизительно 0,5 мкМ (то есть, приблизительно ≤0,5 мкМ).
С этой точки зрения следует упомянуть, что хотя покрытые стеклянные материалы, особенно стекло, покрытое диоксидом кремния (особенно покрытое диоксидом кремния стекло типа I), и покрытое силиконом стекло (особенно покрытое силиконом стекло типа I) рассматривают среди предпочтительных материалов для внутренней стенки в контексте различных аспектов изобретения, для того чтобы соответствовать изложенным выше критериям относительно высвобождения в раствор ионов трехвалентных или двухвалентных металлов, в некоторых воплощениях может оказаться достаточным применять стекло, особенно стекло типа I (Ph. Eur.), которое подвергали промыванию или экстракции, что снижает уровень экстрагируемых ионов трехвалентных и двухвалентных металлов, присутствующих в/на поверхности стекла. Такие обработки включают в себя погружение (экстракцию) в горячую (предпочтительно, по крайней мере, 90°С) воду или другие водные среды, например, раствор сульфата аммония, или обработку диоксидом серы.
Как уже отмечалось, белки, особенно подходящие в контексте данного изобретения, являются белками, содержащими домен с аминоконцевыми γ-карбоксиглутаминовыми кислотами (Gla), с 9-12 остатками Gla. Такие белки включают в себя так называемые «витамин К-зависимые зимогенные белки системы свертывания», примерами которых являются протромбин, фактор VII (FVII), фактор IX, фактор X и белок С. Оказалось, что Gla-домен таких белков вовлечен в связывание ионов кальция такими белками, и, как полагают, кальций-связанная форма является ответственной за опосредующую ассоциацию с фосфолипидными мембранами; относительно дальнейшей информации и подробного описания структуры, касающихся таких Gla-доменных белков, можно упомянуть, например, H.R. Roberts et al., “Molecular Biology and Biochemistry of the Coagulation Factors and Pathways of Hemostasis”, pp. 1409 et seq., Chapter 112, in Williams Hematology, 6th edition (editors E. Beutler et al.), McGraw-Hill, 2001.
Gla-доменные белки рассматриваемого типа проявляют очень высокую степень гомологии аминокислотной последовательности из первых 42 остатков. В соответствии с H.R. Roberts (loc. cit) в настоящее время вообще полагают, что связывание Gla-содержащих белков - факторов свертывания, с липидными поверхностями опосредуется мембранной вставкой из гидрофобных остатков в первые десять аминокислот Gla-домена, и что ионы кальция являются существенными в этой связи, так как связывание Ca2+ остатками Gla индуцирует драматическое конформационное изменение, которое выставляет гидрофобные аминокислотные остатки в «бляшку» на поверхности белка; эта «бляшка» позволяет вставить белок в фосфолипидную мембрану.
К числу воплощений, касающихся применений и, по крайней мере, частично заполненных контейнеров согласно изобретению, относятся воплощения, в которых рассматриваемая белковая композиция содержит фактор VII (FVII) или его активированную форму (FVIIa). В важных воплощениях полипептид фактора VII, применяемый в соответствии с изобретением, представляет собой фактор VII человека, однако в других воплощениях фактор VII может быть фактором VII, например, крупного рогатого скота, свиньи, собаки, лошади, мыши и лосося. Рассматриваемый полипептид фактора VII можно получать из плазмы или рекомбинантным способом. Для применения для лечения человека используемый полипептид фактора VII предпочтительно представляет собой рекомбинантно полученный FVII человека (rhFVII) (смотри, например, патент США 4784950).
Следует понимать, что белки, содержащие Gla-домен, упоминаемые в контексте данного изобретения, включают в себя не только белки, имеющие (нативную) аминокислотную последовательность дикого типа (то есть, имеющие аминокислотную последовательность белка, содержащего Gla-домен, как она встречается естественным образом у человека или у других видов животных), но также включают в себя, например, варианты последовательностей таких белков, в которых один или более аминокислотных остатков замещены (заменены), утрачены или вставлены по сравнению с последовательностью дикого типа, но которые сохраняют Gla-домен из 9-12 остатков Gla.
В контексте данного изобретения термины «фактор VII», «полипептид фактора VII» и «полипептид, родственный фактору VII», которые применяют относительно человека, охватывает человеческий фактор VII дикого типа (то есть, полипептид, имеющий аминокислотную последовательность, описанную в патенте США № 4784950), а также варианты фактора VII человека, которые в активированной форме проявляют, по существу, такую же или улучшенную биологическую активность по сравнению с фактором VII дикого типа. Термин «фактор VII» предназначен для широкого охвата полипептидов фактора VII в их нерасщепленной (зимогенной) форме, а также тех полипептидов фактора VII, которые подверглись протеолитическому процессингу с образованием их соответствующих биоактивных форм, которые можно обозначать как фактор VIIa. Обычно фактор VII расще