Генерирование дендритных клеток из моноцитарных предшественников дендритных клеток с помощью gm-csf в отсутствие дополнительных цитокинов
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, медицины и клеточной биологии. Предложен способ дифференцировки моноцитарных предшественников дендритных клеток в незрелые дендритные клетки, а также способ продуцирования зрелых дендритных клеток с использованием колониестимулирующего фактора гранулоцитов - макрофагов GM-CSF без других цитокинов при условиях, которые предотвращают адгезию клеток к сосуду. Изобретение может быть применено в иммунотерапии на основе дендритных клеток, например, для использования в лечении заболеваний, в том числе рака. 7 н. и 15 з.п. ф-лы, 15 ил., 1 табл.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка претендует на приоритет предварительной Заявки на Патент Соединенных Штатов с номером 60/451015, поданной 27 февраля 2003 года, описание которой включено здесь полностью.
УРОВЕНЬ ТЕХНИКИ
Антигенпрезентирующие клетки (АПК) являются важными в индукции эффективного иммунного ответа. АПК не только презентируют антигены Т-клеткам с антигенспецифическими рецепторами, но также обеспечивают сигналы, необходимые для активации Т-клеток. Такие сигналы остаются не полностью определенными, но известно, что они включают различные молекулы клеточной поверхности, а также цитокины или факторы роста. Факторы, необходимые для активации «наивных» или непраймированных Т-клеток, могут отличаться от факторов, требуемых для реактивации ранее праймированных Т-клеток памяти. Хотя было показано, что моноциты и В-клетки являются компетентными АПК, их антигенпрезентирующие способности, являются, по-видимому, ограниченными повторной активацией ранее сенсибилизированных Т-клеток. Таким образом, они неспособны непосредственно активировать функционально наивные или непраймированные Т-клеточные популяции. С другой стороны, дендритные клетки способны активировать как наивные, так и ранее праймированные Т-клетки.
Дендритные клетки являются гетерогенной клеточной популяцией с характерной морфологией и широко распространенным распределением в тканях, в том числе в крови (см., например, Steinman, Ann. Rev. Immunol. 9:271-96 (1996)). Клеточная поверхность дендритных клеток является необычной, с характерными вуалеподобными выступами. Зрелые дендритные клетки обычно идентифицируют как CD3-, CD11c+, CD19-, CD83+, CD86+ и HLA-DR+.
Дендритные клетки процессируют и презентируют антигены и стимулируют реакции из "наивных" или непраймированных Т-клеток и Т-клеток памяти. В частности, дендритные клетки имеют высокую способность сенсибилизации МНС-рестриктированных Т-клеток и являются очень эффективными в презентации антигенов Т-клеткам, как аутоантигенов во время развития Т-клеток и Т-клеточной толерантности, так и чужеродных антигенов во время иммунной реакции. Кроме их роли в презентации антигенов, дендритные клетки также непосредственно сообщаются с нелимфатической тканью и осуществляют надзор за нелимфатической тканью в отношении сигнала повреждения (например, ишемии, инфекции или воспаления) или опухолевого роста. После передачи сигнала дендритные клетки инициируют иммунный ответ высвобождением цитокинов, которые стимулируют активность лимфоцитов и моноцитов.
Вследствие их эффективности в презентации антигенов существует растущий интерес к использованию дендритных клеток в качестве иммуностимуляторного агента как in vivo, так и in vitro. Однако применение выделенных дендритных клеток в качестве иммуностимуляторных агентов было ограниченным вследствие низкой частоты встречаемости дендритных клеток в периферической крови и низкой чистоты дендритных клеток, выделяемых прежними способами. В частности, частота встречаемости дендритных клеток в периферической крови человека была оценена при приблизительно 0,1% лейкоцитов. Подобным образом, существует ограниченная доступность дендритных клеток из других тканей, таких как лимфоидные органы. Эта низкая частота встречаемости дендритных клеток увеличивала интерес к выделению клеточной популяции, обогащенной предшественниками дендритных клеток, и культивированию этих предшественников ех vivo или in vitro для получения обогащенных популяций незрелых или зрелых дендритных клеток. Поскольку характеристики предшественников дендритных клеток остаются не полностью определенными, способы, обычно используемые для выделения предшественников дендритных клеток, не приводят к очищенным фракциям желаемых предшественников, а вместо этого обычно продуцируют смешанные популяции лейкоцитов, обогащенные предшественниками дендритных клеток. Были идентифицированы несколько типов клеток как имеющих потенциал функционирования в качестве предшественников дендритных клеток. Полученные из крови CD14+ моноциты, в частности, CD14+ моноциты, которые экспрессируют на своей поверхности рецептор для фактора роста, а именно колониестимулирующего фактора гранулоцитов-моноцитов (GM-CSF), являются известными предшественниками дендритных клеток. Другие происходящие из крови предшественники дендритных клеток могут быть выделены сначала удалением моноцитов и других "недендритных клеток-предшественников" (см., например, Патенты США с номерами 5994126 и 5851756). Другие известные предшественники дендритных клеток включают происходящие из костного мозга клетки, которые экспрессируют маркер клеточной поверхности CD34.
Клеточные популяции, обогащенные предшественниками дендритных клеток, получали различными способами, такими как, например, разделение в градиенте плотности, клеточный сортинг с активацией флуоресценции, иммунологические способы разделения клеток, например пэннинг, лизис комплемента, метод розеткообразования, магнитные способы разделения клеток, разделение с использованием найлоновой ваты и комбинации таких способов (см., например, O'Doherty et al., J. Exp. Med. 178:1067-76 (1993); Young and Steinman, J. Exp. Med. 171:1315-32 (1990); Freudenthal and Steinman, Proc. Natl. Acad. Sci. USA 87:7698-702 (1990); Macatonia et ai., Immunol. 67:285-89 (1989); Markowicz and Engleman, J. Clin. Invest. 85:955-61 (1990), все из которых полностью включены здесь в качестве ссылки). Способы для иммуноселекции дендритных клеток включают в себя, например, использование антител к маркерам клеточной поверхности, ассоциированным с предшественниками дендритных клеток, таких как анти-CD34-и/или анти-CD14-антитела, связанные с субстратом (см., например, Bernhard et al., Cancer Res. 55:1099-104 (1995); Caux et ai., Nature 360:258-61 (1992)).
В одном типичном способе-примере лейкоциты выделяют процедурой лейкафереза. Дополнительные способы обычно используют для дополнительной очистки для обогащения в отношении фракций клеток, которые, как предполагается, содержат дендритные клетки и/или предшественники дендритных клеток. Подобным образом, такие способы, как дифференциальное центрифугирование (например, выделение лейкоцитарной пленки), пэннинг с моноклональными антителами, специфическими в отношении определенных белков клеточной поверхности (например, положительный и отрицательный отбор), и фильтрование также дают неочищенную смесь лейкоцитов, содержащую предшественников дендритных клеток.
Другим сообщенным способом для выделения пролиферирующих предшественников дендритных клеток является использование коммерчески обработанного пластикового субстрата (например, гранул или магнитных гранул) для селективного удаления прикрепленных моноцитов и других «недендритных клеток-предшественников» (см., например, Патенты США с номерами 5994126 и 5851756). Прикрепленные моноциты и недендритные клетки-предшественники выбрасывают, тогда как неприкрепленные клетки сохраняют для культивирования и созревания ex vivo. В другом способе клетки афереза культивировали в пластиковых культуральных мешках, к которым были добавлены пластиковые, т.е. полистироловые или стироловые, гранулы-микроносители для увеличения площади поверхности этого мешка. Эти клетки культивировали в течение достаточного периода времени для прикрепления к этим гранулам и неприкрепленные клетки вымывали из этого мешка (Maffei, et al., Transfusion 40:1419-1420 (2000); WO 02/44338, включенные здесь в качестве ссылки).
После по существу всех сообщенных способов получения популяции клеток, обогащенной предшественниками дендритных клеток, эти популяции клеток обычно культивируют ех vivo или in vitro для дифференцировки предшественников дендритных клеток или поддержания и/или размножения этих дендритных клеток. Вкратце, дифференцировка ex vivo моноцитарных предшественников дендритных клеток включала культивирование популяции смешанных клеток, обогащенных предшественниками дендритных клеток, в присутствии комбинаций клеточных факторов роста, таких как цитокины. Например, моноцитарные предшественники дендритных клеток требуют колониестимулирующего фактора гранулоцитов/моноцитов (GM-CSF) в комбинации по меньшей мере с одним другим цитокином, например, выбранным из интерлейкина 4 (IL-4), интерлейкина 15 (IL-15), интерлейкина 13 (IL-13), интерферона α (IFN-α) и т.п., для дифференцировки этих клеток в оптимальное состояние для поглощения, процессинга и/или презентации антигена. Количества дендритных клеток из немоноцитарных предшественников дендритных клеток, таких как клетки, полученные удалением моноцитов и других предшественников недендритных клеток (адсобцией на пластиковой поверхности) или отбором на CD34+ клетки, также размножали культивированием в присутствии определенных цитокинов. Либо только GM-CSF, либо комбинацию GM-CSF и IL-4 использовали в способах получения популяций дендритных клеток из таких пролиферирующих предшественников дендритных клеток для терапевтического применения.
Однако эффективность таких дифференцировки, поддержания и/или размножения ех vivo была ограничена качеством исходной популяции, обогащенной дендритными клетками и предшественниками дендритных клеток. При некоторых условиях культивирования популяции дендритных клеток и предшественников дендритных клеток, которые в сильной степени загрязнены нейтрофилами, макрофагами и лимфоцитами или их комбинациями, могут быть уменьшены этими последними клетками, что приводит к низкому выходу дендритных клеток. Культуры дендритных клеток, содержащие большие количества нейтрофилов, макрофагов и лимфоцитов или их комбинации, являются менее пригодными для применения в качестве иммуностимуляторных препаратов.
Незрелые или зрелые дендритные клетки после получения обычно подвергали действию антигена-мишени (антигенов-мишеней) и агентов созревания для обеспечения активированных зрелых дендритных клеток. Обычно этот антиген добавляли в популяцию клеток, обогащенную незрелыми или зрелыми дендритными клетками, при подходящих условиях культивирования. В случае незрелых дендритных клеток этим клеткам затем позволяли в течение достаточного времени поглощать и процессировать антиген и экспрессировать антигенные пептиды на клеточной поверхности в ассоциации с маркерами либо МНС класса I, либо МНС класса II. Антиген может презентироваться незрелым дендритным клеткам на поверхности клеток в очищенной форме, в полуочищенной форме, такой как выделенный белок или слитый белок (например, слитый белок GM-CSF-антиген), в виде лизата мембран, в виде комплекса липосома-белок и другими способами. Кроме того, поскольку зрелые дендритные клетки не способны поглощать и процессировать антиген, к зрелым дендритным клеткам для презентации могут быть добавлены антигенные пептиды, которые связываются с молекулами МНС класса I или МНС класса II.
После получения активированных дендритных клеток их вводили пациенту для стимуляции иммунного ответа. Активированные дендритные клетки могут вводиться пациенту болюсной инъекцией, непрерывной инфузией, пролонгированным высвобождением из имплантатов или другими подходящими способами, известными в данной области. Активированные дендритные клетки могут также вводиться совместно с физиологически приемлемыми носителями, наполнителями, буферами и/или разбавителями. Кроме того, активированные дендритные клетки могут быть использованы для активации Т-клеток, например цитотоксических Т-клеток, ex vivo с использованием способов, хорошо известных квалифицированному специалисту. Затем антигенспецифические цитотоксические Т-клетки могут быть введены пациенту, например, для лечения растущей опухоли или бактериальной или вирусной инфекции. Эти композиции могут быть использованы сами по себе или в качестве адъюванта для других терапий, таких как, например, хирургическая резекция, химиотерапия, лучевая терапия и их комбинации, а также другие терапевтические способы воздействия, подходящие для подлежащего лечению состояния.
В данном изобретении обнаружено, что в противоположность предыдущим способам моноцитарные предшественники дендритных клеток могут быть дифференцированы в незрелые дендритные клетки и поддержаны в подходящем состоянии, которое является полностью компетентным для процессинга и презентации антигена, в присутствии только GM-CSF без дополнительных цитокинов. Эти способы предусматривают обеспечение популяции клеток, содержащих предшественники дендритных клеток, которые не были активированы, и культивирование этих клеток in vitro или ex vivo в среде для культивирования дендритных клеток, дополненной GM-CSF, без каких-либо дополнительных цитокинов. Способы, обычно используемые для обогащения клеточных популяций предшественниками дендритных клеток, могут активировать эти клетки-предшественники, инициируя конечную дифференцировку этих клеток, например, в макрофаг. Добавление других цитокинов, например IL-4, IL-13, IL-15 или TNF-α, противодействовало эффектам выделения, связанным с активацией этих клеток. Использование на практике способов данного изобретения обеспечивает простой и более экономичный способ получения и поддержания незрелых дендритных клеток с состоянии, оптимизированном для поглощения, процессинга и презентации выбранного антигена.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение обеспечивает способ дифференцировки и поддержания незрелых дендритных клеток ех vivo или in vitro в состоянии, оптимизированном для поглощения, процессинга и презентации выбранного антигена. Этот способ предусматривает обеспечение клеточной популяции, содержащей неактивированные моноцитарные предшественники дендритных клеток, т.е. моноциты, которые экспрессируют рецептор GM-CSF на своей поверхности, и другие такие предшественники дендритных клеток, и контактирование этих неактивированных предшественников дендритных клеток с культуральной средой для дендритных клеток, дополненной колониестимулирующим фактором гранулоцитов/макрофагов, в отсутствие дополнительных цитокинов. В противоположность предыдущим способам, эти дополнительные цитокины не требуются для генерирования дендритных клеток из выделенных неактивированных моноцитарных предшественников дендритных клеток.
Активация моноцитарных предшественников дендритных клеток может быть предотвращена, например, ингибированием или блокированием адгезии клеток-предшественников к твердой поверхности, с которой эти клетки контактируют во время обычного выделения и/или процесса обогащения или во время культивирования клеток. Твердой поверхностью может быть культуральный сосуд, такой как колба, бутыль или мешок для культуры клеток, используемый для получения или поддержания клеток ex vivo или in vitro. Этой твердой поверхностью может быть также любая поверхность сосуда или устройства, используемого в получении клеточной популяции, обогащенной предшественниками дендритных клеток, например, поверхность фильтра; гранула, используемая в очистке, такая как магнитная, стеклянная или пластиковая гранула; трубка, культуральный сосуд и т.п. Ингибирование адгезии неактивированных моноцитарных предшественников дендритных клеток может осуществляться добавлением высокой концентрации белка животного или человека к клеточной культуре или к среде для выделения. Высокая концентрация белка животного или человека, в данном контексте, включает приблизительно 1-10% мас./об. белка. Белок животного может включать альбумин, сыворотку, плазму, желатин, полиаминокислоту и т.п., пока они сами не активируют эти клетки. Активация моноцитарных предшественников дендритных клеток может быть также блокирована или ингибирована добавлением хелатора металла к клеточной культуре и/или среде для выделения. Хелатор металла может включать ЭДТА, ЭГТА и т.п. Считается, что добавление этих агентов дендритных клеток минимизирует активацию клеток-предшественников уменьшением концентрации двухвалентных катионных металлов в культуральной среде.
Активация моноцитарных предшественников дендритных клеток может быть также предотвращена или ингибирована выделением или обогащением и культивированием предшественников дендритных клеток в сосуде для культуры с низкой клеточной авидностью. Сосуды для культуры с низкой клеточной авидностью обычно содержат такие материалы, как полипропилен, Тефлон®, PFTE и т.п. Как и при добавлении белка животного или человека, уменьшение или блокирование адгезии предшественников дендритных клеток к твердой поверхности предотвращает активацию этих клеток и делает возможными дифференцировку и поддержание этих клеток в незрелые дендритные клетки в присутствии среды для культивирования дендритных клеток, дополненной GM-CSF, без каких-либо дополнительных цитокинов. Выполнение выделения клеток-предшественников при температурах ниже приблизительно 37°С, таких как комнатная температура, дополнительно уменьшает долю моноцитарных предшественников дендритных клеток, которая подвергается активации в клеточной популяции. Способы данного изобретения могут предусматривать комбинацию любых или всех этих агентов, материалов и/или условий. В одном конкретном варианте осуществления культуральной средой для дендритных клеток является бессывороточная среда, и белок животного, например сывороточный альбумин, добавляют для уменьшения авидности предшественников дендритных клеток в отношении поверхности культурального сосуда для предотвращения и/или уменьшения активации моноцитарных предшественников дендритных клеток.
Обычно клеточные популяции, которые содержат моноцитарные предшественники дендритных клеток, получают из периферической крови, продукта лейкафереза, продукта афереза, пуповинной крови, селезенки, лимфатического узла, тимуса или костного мозга. Эти клеточные популяции могут быть криоконсервированы до и после применения на практике данного изобретения. Далее эта клеточная популяция может быть дополнительно обогащена моноцитарными клетками-предшественниками фильтрацией с тангенциальным потоком, пэннигом антител, дифференциальным центрифугированием и т.п. При дополнительном обогащении этой клеточной популяции фильтрацией с тангенциальным потоком фильтр обычно содержит поры размером 5,5 мкм, скорость рециркуляции равна приблизительно 1400 мл/мин, скорость фильтрации равна приблизительно 15-21 мл/мин, обычно 17 мл/мин, и время фильтрации составляет приблизительно 60-90 мин (см., например, заявку WO 2004/000444, опубликованную 31 декабря 2003 года, включенную здесь в качестве ссылки).
Незрелые дендритные клетки, которые получали способами данного изобретения, могут быть проконтактированы с выбранным представляющим интерес антигеном в течение периода времени, достаточного для поглощения и процессинга этого антигена. После процессинга антиген презентируется на поверхности дендритных клеток. Далее незрелые дендритные клетки могут быть проконтактированы с агентом созревания дендритных клеток до контактирования с представляющим интерес антгеном, одновременно с контактированием или после контактирования с представляющим интерес антигеном. Агент созревания дендритных клеток может включать Bacillus Calmette-Guerin (BCG), липополисахарид (LPS), фактор некроза опухоли α (TNF-α), интерферон гамма (IFNγ) или их комбинации. В конкретных вариантах данного изобретения агент созревания дендритных клеток является комбинацией инактивированного BCG и IFNγ. Выбранные антигены, применимые в способах данного изобретения, включают, но не ограничиваются ими, опухолеспецифический антиген, опухоль-ассоциированный антиген, вирусный антиген, бактериальный антиген, опухолевые клетки, нуклеиновую кислоту, полученную из опухолевых клеток, бактериальные клетки, вирусные частицы, рекомбинантные клетки, экспрессирующие антиген, клеточный лизат, препарат мембран, рекомбинантно полученный антиген, пептид, произведенный из представляющего интерес антигена, или выделенный представляющей интерес антиген. На любой стадии, в том числе после контакта с выбранным антигеном, поглощения, процессинга и созревания дендритных клеток, эти клетки могут быть криоконсервированы для более позднего использования.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
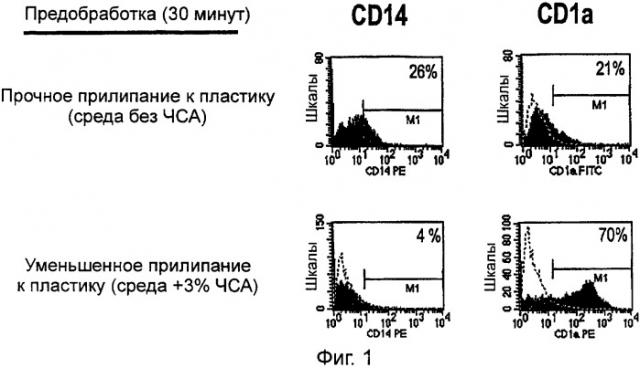
Фигура 1 изображает гистограммы экспрессии CD14 и CD1a на поверхности дендритных клеток для оценки дифференцировки in vitro моноцитарных предшественников дендритных клеток в CD1а+-дендритные клетки в присутствии только GM-CSF без дополнительных цитокинов и в присутствии блокирующего агента (3% сывороточного альбумина человека; САЧ), который предотвращает прочное связывание с поверхностью контейнера клеточной культуры.
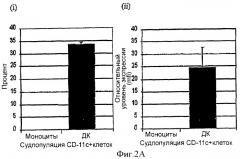
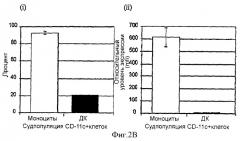
Фигура 2 изображает измерение экспрессии CD1a и CD14 при дифференцировке моноцитов в дендритные клетки (ДК) после культивирования in vitro в отсутствие IL-4. Дифференцировка показана реципрокной экспрессией маркеров CD1a и CD14 на "живых" CD11с+ клетках. Фигура 2А демонстрирует повышение экспрессии CD1a на ДК в день 5 относительно его экспрессии на поверхности моноцитов-предшественников. Фигура 2В демонстрирует понижение экспрессии CD14 на ДК относительно его уровня на моноцитах-предшественниках. Данные показывают соответствующие культуры после электронной установки дискриминационного окна на клетках моноцитарной линии дифференцировки (CD11c+) для (i) субпопуляций и (ii) относительной экспрессии, измеряемой по средней интенсивности флуоресценции (mfi). Фоновое окрашивание, наблюдаемое с контрольными антителами релевантного типа, вычитали. Эти данные представляют средние величины из моноцитов, выделенных и культивируемых из двух независимых доноров.
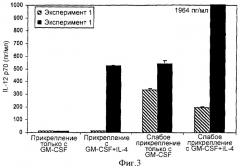
Фигура 3 изображает количественное определение секреции IL-12 р70 из моноритарных предшественников дендритных клеток, которым давали плотно прикрепляться или рыхло прикрепляться к субстрату перед культивированием либо в GM-CSF и IL-4, либо только GM-CSF.
Фигура 4 изображает экспрессию типичных маркеров дендритных клеток для моноцитарных предшественников дендритных клеток, культивируемых только в GM-CSF.
Фигура 5 изображает кинетику in vitro дифференцировки в дендритные клетки неактивированных моноцитов в клеточной культуральной среде, дополненной только GM-CSF, определяемую экспрессией CD1a и CD14.
Фигуры 6А-6Е изображают сравнение фенотипа неактивированных моноцитов относительно дендритных клеток, культивируемых в мешках из Тефлона® или пластиковых колбах для культуры ткани в клеточной культуральной среде, дополненной только GM-CSF или GM-CSF плюс IL-4, в присутствии или в отсутствие фактора созревания дендритных клеток. Фигура 6А изображает процент клеток, которые были CD1a-положительными. Фигура 6В изображает процент клеток, которые были CD83-положительными. Фигура 6С изображает относительный уровень экспрессии (mfi) CD80. Фигура 6D изображает относительный уровень экспрессии (mfi) CD86. Фигура 6Е изображает относительный уровень экспрессии (mfi) HLA-DR.
Фигуры 7А и 7В изображают генерируемую прикреплением к покрытым стеклом гранулам-микроносителям антигенспецифическую Т-клеточную реакцию дендритных клеток, культивируемых в присутствии либо только GM-CSF, либо GM-CSF и IL-4, и затем контактированных либо с контрольным антигеном гемоцианина фиссуреллы, либо с 40-мерным пептидом М1-А4 вируса гриппа А и агентом созревания дендритных клеток. Фигура 7А изображает анализ антигенспецифических цитотоксических Т-клеток для клеток, выделенных из донора Р016, и фигура 7В-подобный анализ для донора Р052.
Фигуры 8А и 8В изображают фенотипические профили на клетках моноцитарной линии дифференцировки, которые дифференцировались в дендритные клетки (ДК) после культивирования in vitro в отсутствие IL-4. Маркеры на всех субпопуляциях и их соответствующие уровни экспрессии (mfi) показаны на «живых» CD11c+ клетках. Фигура 8А изображает процент CD11c+ клеток, которые коэкспрессируют специфические маркеры на моноцитах и ДК дня 5. Фигура 8В изображает относительную экспрессию фенотипических маркеров. Показаны результаты для независимых культур из двух различных доноров, обозначенных 63665 и 63666, после электронной установки дискриминационного окна на клетках моноцитарной линии дифференцировки (CD11с+) для (i) субпопуляций и (ii) относительной экспрессии, измеряемой по средней интенсивности флуоресценции (mfi). Фоновое окрашивание, наблюдаемое с контрольными антителами релевантного типа, вычитали.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение обеспечивает способы дифференцировки моноцитарных предшественников дендритных клеток в незрелые дендритные клетки (ДК). Моноцитарные предшественники дендритных клеток, которые не были активированы, могут быть проконтактированы с культуральной средой для дендритных клеток, дополненной GM-CSF, в качестве единственного цитокина для индукции дифференцировки и поддержания этих клеток в виде незрелых дендритных клеток. Способы, которые требуют только добавления единственного цитокина, являются менее дорогими и являются более эффективными, чем способы, используемые ранее, которые требуют добавления других цитокинов для предотвращения дифференцировки моноцитарных предшественников дендритных клеток в другие типы клеток, в том числе, например, макрофаг и т.п.
Незрелые дендритные клетки, получаемые способами данного изобретения, являются фенотипически и функционально сходными с клетками, получаемыми предыдущими способами, которые используют более сложные условия культивирования, и могут быть затем проконтактированы с фактором созревания дендритных клеток, таким как BCG и IFNγ, и необязательно с заранее определенным антигеном в подходящих условиях созревания. Антиген может быть проконтактирован с незрелыми дендритными клетками данного изобретения либо во время, либо до созревания.
Моноцитарные предшественники дендритных клеток и незрелые дендритные клетки
Моноцитарные предшественники дендритных клеток, в данном контексте, включают моноциты, которые имеют GM-CSF-рецептор на их поверхности, и другие миелоидные клетки-предшественники, которые отвечают на GM-CSF. Эти клетки могут быть получены из любой ткани, в которой они находятся, в частности из лимфоидных тканей, таких как селезенка, костный мозг, лимфатические узлы и тимус. Моноцитарные предшественники дендритных клеток могут быть также выделены из системы кровотока. Периферическая кровь является легкодоступным источником моноцитарных предшественников дендритных клеток. Кровь пупочного канатика является другим источником моноцитарных предшественников дендритных клеток. Моноцитарные предшественники дендритных клеток могут быть выделены из различных организмов, в которых может быть вызван иммунный ответ. Такие организмы включают, например, людей и животных, таких как приматы, млекопитающие (в том числе собаки, кошки, мыши и крысы), птицы (в том числе куры), а также их трансгенные виды.
В некоторых вариантах осуществления моноцитарные предшественники дендритных клеток и/или незрелые дендритные клетки могут быть выделены из здорового субъекта или из субъекта, нуждающегося в иммуностимуляции, такого как пациент с раком или другой субъект, для которого клеточная иммуностимуляция может быть полезной или желательной (т.е. субъект, имеющий бактериальную, вирусную или паразитарную инфекцию и т.п.). Моноцитарные предшественники дендритных клеток и/или незрелые дендритные клетки могут быть также получены из HLA-соответствующего здорового индивидуума для превращения в незрелые дендритные клетки, созревания, активации и введения HLA-соответствующему субъекту, нуждающемуся в иммуностимуляции.
Способы выделения неактивированных моноцитарных предшественников дендритных клеток и незрелых дендритных клеток из различных источников, описанных выше, в том числе из крови и костного мозга, могут выполняться рядом способов. Обычно клеточную популяцию собирают из индивидуума и обогащают неактивированными моноцитарными предшественниками дендритных клеток. Например, смешанная популяция клеток, содержащая неактивированные моноцитарные предшественники дендритных клеток, может быть получена из периферической крови лейкаферезом, аферезом, центрифугированием в градиенте плотности, дифференциальным лизисом, фильтрацией, пэннингом антител или получением лейкоцитарной пленки. Выбранный способ не должен активировать моноцитарные предшественники дендритных клеток. Например, если для обогащения клеточной популяции в отношении предшественников выбран пэннинг антител, выбранные антитела не должны активировать эти клетки, например, индукцией вхождения ионов кальция, которая может возникать как следствие сшивания этих молекул на поверхности, с которой связываются антитела. Обычно при пэннинге антител используют антитела, которые элиминируют макрофаги, В-клетки, природные клетки-киллеры, Т-клетки и т.п. Антитела могут быть также использованы для положительного отбора на моноцитподобные клетки, экспрессирующие CD14.
В одном варианте осуществления данного изобретения неактивированные моноцитарные предшественники дендритных клеток получают предотвращением прочного прикрепления популяции клеток, содержащей моноцитарные предшественники дендритных клеток, к сосуду для культуры клеток. Прочное прикрепление может предотвращаться, например, добавлением блокирующего агента к культуральной среде, используемой для поддержания предшественников дендритных клеток in vitro или ex vivo. Такие блокирующие агенты могут включать высокие концентрации белка, в том числе, например, и не в качестве ограничения, белка животного или белка человека, такого как альбумины, сыворотка, плазма, желатин, полиаминокислоты и т.п. В частности, используют альбумины из бычьего или человеческого источника. Обычно используют концентрацию блокирующего агента приблизительно 1-10% мас./об. В частности, альбумин сыворотки человека (САЧ) может быть использован при концентрации приблизительно 1%, 2% или до приблизительно 5% или более. Следует отметить, что должны выбираться блокирующие агенты, которые сами не активируют эти клетки. Культуральными средами могут быть любые среды, обычно используемые для культуры моноцитарных предшественников дендритных клеток, в том числе среды, которые не требуют сыворотки.
В другом варианте осуществления данного изобретения к культуральной среде может быть добавлен хелатор металла для дополнительного предотвращения или уменьшения активации моноцитарных предшественников дендритных клеток посредством хелатирования двухвалентных катионов, в том числе, но без ограничения, ионов кальция. Применение культуральных сосудов с низкой прикрепляемостью или с низким связыванием может также уменьшать авидность прикрепления или связывания предшественников дендритных клеток для предупреждения активации этих клеток. Особенно предпочтительные материалы низкого связывания включают, например, но не только, полипропилен, Тефлон®, PFTE и т.п. Хелатор металлов может быть использован в комбинации с вышеописанными блокирующими агентами.
Моноцитарные предшественники дендритных клеток и незрелые дендритные клетки могут быть также получены в замкнутой, асептической системе. В данном контексте термины «замкнутая, асептическая система» или «замкнутая система» относятся к системе, в которой подвергание действию нестерильного, окружающего или циркулирующего воздуха или других нестерильных условий является минимизированным или элиминированным. Замкнутые системы для изоляции предшественников дендритных клеток и незрелых дендритных клеток обычно исключают центрифугирование в градиенте плотности в открытых сверху пробирках, открытый перенос клеток, культивирование клеток в чашках для культуры ткани или негерметизированных колбах и т.п. В типичном варианте осуществления замкнутая система делает возможным асептический перенос предшественников дендритных клеток и незрелых дендритных клеток из исходного сосуда для сбора в герметизированный сосуд для культуры ткани без экспонирования нестерильного воздуха.
В некоторых вариантах неактивированные моноцитарные предшественники дендритных клеток выделяют частичным прикреплением к моноцитсвязывающему субстрату, как описано в заявке WO 03/010292, описание которой включено здесь в качестве ссылки. Например, популяция лейкоцитов (например, выделенная лейкаферезом) может быть проконтактирована с субстратом, приклеивающим моноцитарный предшественник дендритной клетки, например, покрытой стеклом микроносителем-гранулой, в присутствии блокирующего агента, который предотвращает неспецифическое связывание, а также уменьшает авидность связывания моноцитарных предшественников дендритных клеток. При контактировании этой популяции лейкоцитов с субстратом эти моноцитарные предшественники дендритных клеток в данной популяции лейкоцитов предпочтительно неплотно прикрепляются к субстрату. Другие лейкоциты (в том числе другие потенциальные предшественники дендритных клеток), например пролиферирующие предшественники дендритных клеток и т.п., обнаруживают уменьшенную аффинность связывания с субстратом, позволяя таким образом субпопуляции этих моноцитарных предшественников дендритных клеток преимущественно обогащаться на поверхности этого субстрата. Неплотная адгезия не активирует моноцитарные предшественники дендритных клеток. После связывания клеток и элюции неприкрепленных клеток субпопуляцию моноцитарных предшественников дендритных клеток элюируют из субстрата забуференным солевым раствором, который может быть дополнен нетоксичным хелатообразующим агентом. «Нетоксичный хелатообразующий агент» обозначает хелатообразующие агенты, которые по существу не уменьшают жизнеспособность моноцитарных предшественников дендритных клеток, например, но без ограничения, ЭДТА, ЭГТА и т.п.
Подходящие субстраты включают, например, субстраты, имеющие большую площадь поверхности относительно объемной доли, такие как стеклянные гранулы или покрытый стеклом микроноситель. Такой субстрат может быть, например, состоящим из частиц или волокнистым субстратом. Подходящие состоящие из частиц субстраты включают, например, стеклянные частицы, покрытые стеклом пластиковые частицы, покрытые стеклом полистироловые частицы и другие гранулы, подходящие для адсорбции белка. Подходящие волокнистые субстраты включают стеклянные или покрытые стеклом микрокапиллярные трубки и микроворсинчатую мембрану. Состоящий из частиц или волокнистый субстрат обычно позволяет элюировать прикрепленные моноцитарные предшественники дендритных клеток по существу без уменьшения жизнеспособности прикрепленных клеток. Состоящий из частиц или волокнистый субстрат может быть по существу непористым для облегчения элюции моноцитарных предшественников дендритных клеток или дендритных клеток из этого субстрата. «По существу непористый» субстрат обозначает субстрат, в котором по меньшей мере большинство пор, присутствующих в данном субстрате, являются меньшими, чем клетки, для мимнимизации улавливания клеток в этом субстрате.
Прикрепление моноцитарных предшественников дендритных клеток к субстрату без активации может быть необязательно модулировано добавлением связывающих сред. Подходящие связывающие среды включают культуральные среды для моноцитарных предшественников дендритных клеток (например, AIM-V®, RPMI 1640, DMEM, X-VIVO 15® и т.п.), дополненные, индивидуально или в любой комбинации, например, цитокинами (например, колониестимулирующим фактором гранулоцитов/макрофагов (GM-CSF), плазмой крови, сывороткой (например, сывороткой человека, такой как аутологичные или аллогенные сыворотки), очищенными белками, такими как сывороточный альбумин, двухвалентными катионами (например, ионами кальция и/или магния) и другими молекулами, которые способствуют специфическому прикреплению моноцитарных предшественников дендритных клеток к субстрату или которые предотвращают прикрепление немоноцитарных предшественников дендритных клеток к этому субстрату. В некоторых вариантах осуществления плазма или сыворотка крови может быть инактивирована нагреванием. Инактивированная нагреванием плазма может быть аутологичной или гетерологичной относительно лейкоцитов.
В другом способе обогащения клеточной популяции моноцитарными предшественниками дендритных клеток из пробы компонен