Противовоспалительные средства
Иллюстрации
Показать всеИзобретение относится к производным 3-аминокапролактама формулы (I):
где Х представляет собой -CO-R1 или
-SO2-R2, R1 представляет собой алкильный (за исключением 5-метилгептанила и 6-метилгептанила, где радикал R1 присоединен к карбонилу в положении 1), галогеналкильный, алкокси (за исключением трет-бутилокси), алкенильный, алкинильный или алкиламино радикал из 4-20 атомов углерода (например, из 5-20 атомов углерода, 8-20 атомов углерода, 9-20 атомов углерода, 10-18 атомов углерода, 12-18 атомов углерода, 13-18 атомов углерода, 14-18 атомов углерода, 13-17 атомов углерода) и R2 представляет собой алкильный радикал из 4-20 атомов углерода (например, из 5-20 атомов углерода, 8-20 атомов углерода, 9-20 атомов углерода, 10-18 атомов углерода, 12-18 атомов углерода, 13-18 атомов углерода, 14-18 атомов углерода, 13-17 атомов углерода); или к его фармацевтически приемлемой соли. Изобретение также относится к применению и фармацевтической композиции, обладающей противовоспалительной активностью, на основе этих соединений. Технический результат - получение новых соединений и фармацевтической композиции на их основе, которые могут быть использованы для получения лекарственных средств для лечения, облегчения или профилактики симптомов воспалительного заболевания. 8 н. и 49 з.п. ф-лы, 1 ил.
Реферат
Изобретение относится к применению производных 3-аминокапролактама для изготовления лекарственного средства, предназначенного для предотвращения или лечения воспалительных расстройств.
Воспаление представляет собой важный компонент физиологической защиты организма. Однако становится все яснее, что нежелательные по времени и распространению воспалительные реакции играют роль при широком диапазоне заболеваний, включая заболевания с очевидным лейкоцитарным компонентом (такие как аутоиммунные заболевания, астма или атеросклероз), но также при заболеваниях, которые традиционно не считались связанными с лейкоцитами (таких как остеопороз или болезнь Альцгеймера).
Хемокины представляют собой большое семейство сигнальных молекул, гомологичных интерлейкину-8, который участвует в регуляции передвижения лейкоцитов и в физиологических, и в патологических условиях. При более чем 50 лигандах и 20 рецепторах, участвующих в передаче хемокиновых сигналов, система имеет необходимую плотность информации для обращения к лейкоцитам через сложные иммунные регуляторные процессы из костного мозга к периферии, затем назад через вторичные лимфоидные органы. Однако эта сложность хемокиновой системы сначала затрудняла поиск фармакологических подходов к модулированию воспалительных реакций посредством блокады хемокиновых рецепторов. Оказалось трудным определить, какой хемокиновый рецептор(ы) следует ингибировать для получения терапевтического эффекта при данном воспалительном заболевании.
Позднее было описано семейство средств, которые блокируют передачу сигналов одновременно широким диапазоном хемокинов (Reckless et al., Biochem J. (1999) 340:803-811). Было обнаружено, что первое такое средство, пептид, называемый «пептидом 3», ингибирует миграцию лейкоцитов, вызванную 5 различными хемокинами, в то же самое время оставляя неизменной миграцию в ответ на другие хемоаттрактанты (такие как fMLP или TGF-бета). Этот пептид и его аналоги, такие как NR58-3.14.3 (т.е. Последовательность ID No.1 совместно называются «Ингибиторами хемокинов широкого спектра» (BSCI). Впоследствии Grainger et al., Biochem. Pharm. 65 (2003) 1027-1034, показали, что BSCI обладают потенциально полезной противовоспалительной активностью для ряда заболеваний на моделях животных. Интересно, что одновременная блокада множества хемокинов не очевидно связана с острой или хронической токсичностью, свидетельствуя о том, что этот подход может представлять собой полезную стратегию для разработки новых противовоспалительных лекарственных средств с преимуществами, подобными стероидам, но со сниженным количеством побочных эффектов.
Однако пептиды и пептидные производные, такие как NR58-3.14.3, могут не быть оптимальными для использования in vivo. Их синтез достаточно дорог, и они имеют относительно неблагоприятные фармакокинетические и фармакодинамические свойства. Например, NR58-3.14.3 биологически недоступен при пероральном введении и после внутривенной инъекции выводится из плазмы крови при периоде полувыведения менее чем 30 мин.
Две параллельные стратегии были приняты для идентификации новых препаратов, которые сохраняют противовоспалительные свойства пептида 3 и NR58-3.14.3, но имеют улучшенные характеристики для их применения в качестве фармацевтических средств. Во-первых, был разработан ряд пептидных аналогов, некоторые из которых имеют более длительные периоды полувыведения, чем NR58-3.14.3, и синтез которых значительно дешевле. Во-вторых, был проведен детальный анализ структуры: активности пептидов для идентификации ключевых фармакофоров и конструирования небольших не пептидных структур, которые сохраняют полезные свойства исходного пептида.
Этот второй подход выявил несколько структурно отличающихся серий соединений, которые сохраняли противовоспалительные свойства пептидов, включая 16-амино и 16-аминоалкильные производные алкалоида йохимбина, а также ряд N-замещенных 3-аминоглутаримидов (Ссылка: Fox et al., J Med Chem 45(2002) 360-370: WO 99/12968 и WO 00/42071). Все эти соединения представляют собой ингибиторы хемокинов широкого спектра, которые сохраняют селективность перед не хемокиновыми хемоаттрактантами, и было показано, что ряд из них блокирует острое воспаление in vivo.
Самым активным и селективным из этих соединений был (S)-3-(ундец-10-еноил)аминоглутаримид (NR58,4), который ингибировал вызванную хемокином миграцию in vitro при ED50 5 нМ. Однако дальнейшие исследования выявили, что аминоглутаримидное кольцо было восприимчиво к ферментативному раскрытию кольца в сыворотке. Следовательно, для некоторых видов применения (например, подвергаемое лечению воспаление является хроническим, например, при аутоиммунных заболеваниях) эти соединения могут иметь неоптимальные свойства, и более устойчивое соединение с аналогичными противовоспалительными свойствами может иметь преимущества.
С целью к идентификации таких устойчивых аналогов были испытаны различные производные (S)-3-(ундец-10-еноил)аминоглутаримида на их устойчивость в сыворотке. Одно такое соединение, 6-деоксо аналог (S)-3-(ундец-10-еноил)тетрагидропиридин-2-он, полностью устойчиво в сыворотке человека в течение, по меньшей мере, 7 дней при 37°С, но имеет значительно сниженную активность по сравнению с исходной молекулой.
Амидные производные 3-аминокапролактама уже были раскрыты в данной области. Например:
- В заявке на патент Японии № 09087331 описаны амидные производные 3-аминокапролактама, где амидалкильная боковая цепь может содержать от 2 до 30 атомов углерода. Эти соединения были представлены в виде желатинирующих масло агентов.
- В патенте США № 6395282 описываются иммуногенные конъюгаты, включающие молекулу-носитель, соединенную с аутоиндуктором грамотрицательных бактерий, где указанный аутоиндуктор может представлять собой амидное производное 3-аминокапролактама, причем амидалкильная боковая цепь может содержать до 34 атомов углерода. Однако терапевтическое применение раскрыто только для конъюгатов, а не для изолированного амидного производного.
- В статье Weiss et al. (Research Communications in Physiology, Psychiatry and Behavior (1992), 17(3-4), 153-159) раскрыт ряд амидных производных 3-аминокапролактама и среди других 3-гексанамидо-DL-ε-капролактам и 3-додеканамидо-DL-ε-капролактам. Эти соединения представлены как имеющие только активность in vitro, но без значимого эффекта in vivo.
Другими словами, хотя некоторые алкиламидные производные 3-аминокапролактама определенно были известны в данной области, для алкиламидных производных 3-аминокапролактама не было описано действительное фармацевтическое применение.
Изобретение предоставляет применение соединения общей формулы (I) или его фармацевтически приемлемой соли для получения лекарственного средства для лечения воспалительного расстройства:
где
Х представляет собой -CO-R1 или -SO2-R2,
R1 представляет собой алкильный, галогеналкильный, алкокси, галогеналкокси, алкенильный, алкинильный или алкиламино радикал из 4-20 атомов углерода (например, из 5-20 атомов углерода, 8-20 атомов углерода, 9-20 атомов углерода, 10-18 атомов углерода, 12-18 атомов углерода, 13-18 атомов углерода, 14-18 атомов углерода, 13-17 атомов углерода) и
R2 представляет собой алкильный радикал из 4-20 атомов углерода (например, из 5-20 атомов углерода, 8-20 атомов углерода, 9-20 атомов углерода, 10-18 атомов углерода, 12-18 атомов углерода, 13-18 атомов углерода, 14-18 атомов углерода, 13-17 атомов углерода).
Альтернативно, R1 и R2 может быть выбран независимо из пептидного радикала, содержащего от 1 до 4 пептидных фрагментов, соединенных пептидными связями (например, пептидного радикала из 1-4 аминокислотных остатков).
Атом углерода в положении 3 капролактамового кольца является асимметричным, и, следовательно, соединения в соответствии с настоящим изобретением имеют две возможные энантиомерные формы, то есть “R” и “S” конфигурации. Настоящее изобретение охватывает эти две энантиомерные формы и все комбинации этих форм, включая рацемические смеси “RS”. С целью простоты, когда в структурных формулах не показана определенная конфигурация, следует понимать, что представлены обе энантиомерные формы и их смеси.
В приоритетных заявках GB 0327775.3 и 0417436.3 одного и того же заявителя правильно указано, что соединения конфигурации “S” предпочтительны - в этих заявках ошибочно иллюстрируется общая формула (I'), демонстрирующая конфигурацию “R”.
Предпочтительно соединения общей формулы (I) или его фармацевтически приемлемые соли, применяемые в соответствии с этим аспектом изобретения, должны представлять собой соединения формулы (I')
где Х имеет такое же значение, как указано выше.
Атомы углерода в R1 и R2 могут быть линейными или разветвленными.
Соединения общей формулы (I) или (I') или их фармацевтически приемлемые соли могут быть такими, что алкильная, галогеналкильная, алкокси, галогеналкокси, алкенильная, алкинильная или алкиламино часть радикала R1 является или линейной, или разветвленной, но содержит линейную цепь из, по меньшей мере, 8 или из, по меньшей мере, 10 атомов углерода.
Изобретение также предоставляет фармацевтические композиции, включающие в качестве активного ингредиента соединение общей формулы (I) или его фармацевтически приемлемую соль и, по меньшей мере, один фармацевтически приемлемый эксципиент (наполнитель) и/или носитель:
где
Х представляет собой -CO-R1 или -CO2-R2,
R1 представляет собой алкильный, галогеналкильный, алкокси, галогеналкокси, алкенильный, алкинильный или алкиламино радикал из 4-20 атомов углерода (например, из 5-20 атомов углерода, 8-20 атомов углерода, 9-20 атомов углерода, 10-18 атомов углерода, 12-18 атомов углерода, 13-18 атомов углерода, 14-18 атомов углерода, 13-17 атомов углерода) и
R2 представляет собой алкильный радикал из 4-20 атомов углерода (например, из 5-20 атомов углерода, 8-20 атомов углерода, 9-20 атомов углерода, 10-18 атомов углерода, 12-18 атомов углерода, 13-18 атомов углерода. 14-18 атомов углерода, 13-17 атомов углерода).
Альтернативно, R1 и R2 может быть выбран независимо из пептидного радикала, содержащего от 1 до 4 пептидных фрагментов, соединенных пептидными связями (например, пептидного радикала из 1-4 аминокислотных остатков).
Предпочтительно соединение общей формулы (I) или его фармацевтически приемлемая соль, применяемые в соответствии с этим аспектом изобретения, должны представлять собой соединения формулы (I')
где Х имеет такое же значение, как указано выше.
Под фармацевтически приемлемой солью подразумеваются, в частности, соли неорганических кислот, такие как гидрохлорид, гидробромид, гидройодид, сульфат, фосфат, дифосфат и нитрат, или органических кислот, такие как ацетат, малеат, фумарат, тартрат, сукцинат, цитрат, лактат, метансульфонат, п-толуолсульфанат, пальмоат и стеарат. Также в пределах объема настоящего изобретения, когда они могут применяться, находятся соли, образованные из оснований, таких как гидроксид натрия или калия. Для других примеров фармацевтически приемлемых солей можно сослаться на “Salt selection for basic drugs”, Int. J. Pharm. (1986), 33, 201-217.
Фармацевтическая композиция может быть представлена в форме твердого вещества, например порошков, гранул, таблеток, желатиновых капсул, липосом или суппозиториев. Соответствующие твердые основы могут представлять собой, например, фосфат кальция, стеарат магния, тальк, сахара, лактозу, децстрин, крахмал, желатин, целлюлозу, метилцеллюлозу, карбоксиметилцеллюлозу натрия, поливинилпирролидин и воск. Другие соответствующие фармацевтически приемлемые эксципиенты и/или носители известны специалистам в данной области.
Фармацевтические композиции в соответствии с изобретением могут быть также представлены в жидкой форме, например растворов, эмульсий, суспензий или сиропов. Соответствующие жидкие основы могут представлять собой, например, органические растворители, такие как глицерин или гликоли, а также их смеси в различных пропорциях в воде.
Изобретение также предоставляет соединения и его соли общей формулы (I)
где
Х представляет собой -CO-R1 или -SO2-R2,
R1 представляет собой алкильный, галогеналкильный, алкокси, галогеналкокси, алкенильный, алкинильный или алкиламино радикал из 4-20 атомов углерода (например, из 5-20 атомов углерода, 8-20 атомов углерода, 9-20 атомов углерода, 10-18 атомов углерода, 12-18 атомов углерода, 13-18 атомов углерода, 14-18 атомов углерода, 13-17 атомов углерода) и
R2 представляет собой алкильный радикал из 4-20 атомов углерода (например, из 5-20 атомов углерода, 8-20 атомов углерода, 9-20 атомов углерода, 10-18 атомов углерода, 12-18 атомов углерода, 13-18 атомов углерода, 14-18 атомов углерода, 13-17 атомов углерода).
Альтернативно, R1 и R2 может быть выбран независимо из пептидного радикала, содержащего от 1 до 4 пептидных фрагментов, соединенных пептидными связями (например, пептидного радикала из 1-4 аминокислотных остатков).
Предпочтительно соединение общей формулы (I) или его фармацевтически приемлемая соль, применяемые в соответствии с этим аспектом изобретения, должны представлять собой соединения формулы (I')
где Х имеет такое же значение, как указано выше.
Предпочтительно соединения общей формулы (I) или (I') при использовании в изобретении или их соли должны быть такими, чтобы алкильная, галогеналкильная, алкокси, галогеналкокси, алкенильная, алкинильная или алкиламино часть радикала
R1 являлась или линейной, или разветвленной, но содержала линейную цепь из, по меньшей мере, 8-10 атомов углерода.
В частности, предпочтительные соединения общей формулы (I) или (I') и их соли в соответствии с любым аспектом настоящего изобретения выбраны из группы, состоящей из:
-(S)-3-гексадеканоиламинокапролактама;
-(S)-3-ундеканоиламинокапролактама;
-(S)-3-(ундец-10-еноил)аминокапролактама;
-(S)-3-(ундец-10-иноил)аминокапролактама;
-(S)-3-тетрадеканоиламинокапролактама;
-(R)-3-гексадеканоиламинокапролактама;
-(S)-3-окстадеканоиламинокапролактама;
-(S)-(Z)-3-(гексадец-9-еноил)аминокапролактама;
-(S)-(Z)-3-(октадец-9-еноил)аминокапролактама;
-(R)-(Z)-3-(октадец-9-еноил)аминокапролактама;
-(S)-3-(2',2'-диметилдодеканоил)аминокапролактама;
-(S)-3-(децилоксикарбонил)аминокапролактама;
-(S)-(Е)-3-(додец-2-еноил)аминокапролактама;
-(S)-3-(дец-9-ениламинокарбонил)аминокапролактама;
-(S)-3-(дециламинокарбонил)аминокапролактама
и их солей.
Наиболее предпочтительные соединения должны быть выбраны из группы, состоящей из:
-(S)-3-гексадеканоиламинокапролактама (т.е. соединения формулы (I'), где R1 представляет собой гексадеканил), -(S)-3-(2',2'-диметилдодеканоил)аминокапролактама, -(S)-3-(2',2'-диметилпропионил)аминокапролактама и их солей.
Как указано выше в обсуждении предшествующего уровня техники, определенные алкиламидные производные 3-аминокапролактама могут быть известны как соединения сами по себе (хотя в настоящее время неизвестно, что какое-либо из них было описано как таковое в качестве фармацевтических композиций или для медицинского применения в противовоспалительном контексте). В предшествующем уровне техники может быть описание линейных алкиламидных производных 3-аминокапролактама. Несмотря на то что любое соединение известно как таковое, это соединение не предназначено представлять собой соединение, заявленное само по себе в этом изобретении, и заявители настоящим изобретением отказываются от прав на него. Следовательно, заявитель в настоящем описании четко различает линейные алкильные производные, охватываемые определением представленных здесь формул (I) и (I'), и разветвленные алкильные производные представленных здесь формул (I) и (I'). Используемое здесь определение R1 в связи с самими соединениями может включать все алкильные производные; альтернативно R1 может включать все алкильные производные, за исключением определенных указанных линейных алкильных производных; альтернативно R1 может включать все разветвленные алкильные производные; и в качестве еще одной альтернативы определение R1 может исключать все алкиламидные производные 3-аминокапролактама.
Изобретение включает определенные соединения, композиции и виды их применения, где соединение представлено в гидратированной или сольватированной форме.
Как указано во «Введении», определенные алкиламинокапролактамные соединения сами по себе и композиции/конъюгаты, содержащие их, могут уже быть известны из предшествующего уровня техники. Любые такие известные соединения или композиции должны быть исключены из притязаний настоящего изобретения путем исключения конкретного или обобщенного класса соединений/композиций.
Описанные здесь амидные производные 3-аминокапролактама представляют собой функциональные BSCI. Их синтез относительно недорогой при использовании предоставленных здесь легких путей синтеза; они устойчивы в сыворотке человека и, следовательно, имеют превосходные фармакокинетические свойства; они биологически доступны при пероральном введении; они представляют собой высоко активные in vitro ингибиторы хемокинов широкого спектра с отличной селективностью, по сравнению с не хемокиновыми хемоаттрактантами; они представляют собой высоко активные и эффективные противовоспалительные средства in vivo на моделях воспаления у грызунов; их введение не связано с какой-либо значительной токсичностью в дозах, необходимых для достижения максимального терапевтического эффекта. Эти свойства, взятые вместе, свидетельствуют о том, что амидные производные 3-аминокапролактама представляют противовоспалительные лекарственные средства, имеющие преимущества перед ранее описанными соединениями.
При сравнении с предшествующим уровнем техники усовершенствование в настоящем изобретении заключается во введении фрагмента аминокапролактама. Однако химическая структура боковой цепи (или алкиламидной, алкилсульфонамидной или пептидной) может также значимо воздействовать на свойства молекулы, так что алкильные заместители с замещением в положении 2 (относительно амидкарбонила) или положении 1 (относительно сульфонамидсульфонильной группы) значительно превосходят соединения с линейными алкильными цепями (или алкиламиды, или алкилсульфонамиды).
Пептиды предшествующего уровня техники (такие как NR58-3.14.3) имеют недостатки, заключающиеся в том, что: (а) они дорогостоящие и требуют твердофазного синтеза (по меньшей мере, для более длинных соединений) и (b) они очень быстро выводятся через почки и (с) они в целом менее активны.
Аминоглутарамиды предшествующего уровня техники дешевы, не выводятся быстро через почки и более активны, но они не обладают метаболической стабильностью.
Описанное здесь усовершенствование, аминокапролактамы, являются дешевыми, не выводятся почками и даже более активны, а также являются метаболически устойчивыми.
В соответствии с этим изобретением воспалительные расстройства, предназначенные для предотвращения или лечения соединениями общей формулы (I) или (I'), или их фармацевтически приемлемые соли, или фармацевтические композиции, или лекарственные средства, содержащие их в качестве активных ингредиентов, включают, в частности:
- аутоиммунные заболевания, например, такие как рассеянный склероз;
- сосудистые расстройства, включая инсульт, поражения коронарных артерий, инфаркт миокарда, нестабильную стенокардию, атеросклероз или васкулит, например синдром Бехчета, гигантоклеточный артрит, ревматическую полимиалгию, грануломатоз Вегенера, васкулит синдрома Чарга-Штрауса, пурпуру Геноха-Шонлейна и болезнь Кавасаки;
- вирусную инфекцию или репликацию, например инфекции вследствие вирусов или репликации вирусов, включая вирус оспы, вирус герпеса (например, Herpesvirus samiri), цитомегаловирус (СМВ) или лентивирус;
- астму;
- остеопороз (низкая минеральная плотность костей);
- рост опухоли;
- ревматоидный артрит;
- отторжение трансплантата органа и/или отсроченную функцию трансплантата или органа, например, у пациентов с почечным трансплантатом;
- расстройство, характеризуемое повышенным уровнем TNF-α;
- псориаз;
- кожные раны;
- расстройства, вызванные внутриклеточными паразитами, такие как малярия или туберкулез;
- аллергии; или
- болезнь Альцгеймера.
В соответствии с этим изобретением другие воспалительные расстройства включают:
- боковой амиотрофический склероз;
- фиброз (в частности, легочный фиброз, но не ограничивающийся фиброзом легкого);
- образование спаек (в частности, в брюшной полости и тазовой области);
- вызванная антигеном анамнестическая реакция;
- подавление иммунного ответа.
Эти клинические показания подпадают под общее определение воспалительных расстройств или расстройств, характеризуемых повышенными уровнями TNF-α.
При наличии легальной возможности изобретение также предоставляет способ лечения, облегчения или профилактики симптомов воспалительных заболеваний (включая побочную воспалительную реакцию на вещество) введением пациенту противовоспалительного количества соединения, композиции или лекарственного средства, как заявлено в настоящем документе.
Введение лекарственного средства в соответствии с изобретением можно проводить местным, пероральным, парентеральным путем, внутримышечной инъекцией и т.д.
Вводимая доза, предусмотренная для лекарственного средства в соответствии с изобретением, составляет от 0,1 мг до 10 г, в зависимости от типа используемого активного соединения.
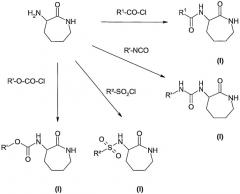
В соответствии с изобретением соединения общей формулы (I) или (I') можно получить, используя описанные ниже способы.
Получение соединений общей формулы (I) или (I')
Все соединения общей формулы (I) или (I') можно легко получить в соответствии с общими способами, известными специалисту в данной области.
Тем не менее предлагаются следующие предпочтительные пути синтеза:
Диаграмма 1
В соответствии с путями, показанными на диаграмме 1:
- 3-аминокапролактам обрабатывают хлорангидридом кислоты общей формулы R1-CO-Cl, где R1 представляет собой алкильный, галогеналкильный, алкенильный или алкинильный радикал, для получения соединений общей формулы (I), где Х представляет собой -CO-R1, а R1 представляет собой алкильный, галогеналкильный, алкенильный или алкинильный радикал; или
- 3-аминокапролактам обрабатывают изоцианатом общей формулы R'-NCO, где R' представляет собой алкил, для получения соединений общей формулы (I), где Х представляет собой -CO-R1, а R1 представляет собой алкиламино радикал;
- 3-аминокапролактам обрабатывают сульфохлоридом общей формулы R2-SO2Cl, где R2 представляет собой алкил, для получения соединений общей формулы (I), где Х представляет собой -SO2-R2, а R2 представляет собой алкильный радикал; или
- 3-аминокапролактам обрабатывают хлорформиатом общей формулы R'-O-CO-Cl, где R' представляет собой алкил, для получения соединений общей формулы (I), где Х представляет собой -CO-R1, а R1 представляет собой алкокси радикал.
Реакции, показанные на диаграмме 1, можно проводить, например, в хлороформе или дихлорметане. Наиболее предпочтительным реакционным растворителем является дихлорметан. Указанные выше реакции предпочтительно проводят в присутствии основания, например Na2CO3.
Все указанные выше реакции можно проводить при температуре окружающей среды (примерно 25°С) или в общем случае при температуре от 20 до 50°С.
Определения
Термин «примерно» относится к интервалу около рассматриваемой величины. Используемый в настоящей патентной заявке термин «примерно Х» означает интервал от Х минус 10% от Х до Х плюс 10% от Х, а предпочтительно интервал от Х минус 5% от Х до Х плюс 5% от Х.
Использование числового диапазона в настоящем описании предназначено для однозначного включения в пределы объема изобретения всех отдельных целых чисел в пределах диапазона и всех комбинаций величин верхнего и нижнего предела в пределах самого широкого объема данного диапазона. Следовательно, например, диапазон от 4 до 20 атомов углерода, определенный в отношении (наряду с другими) формулы I, предназначен для включения всех целых чисел от 4 до 20 и всех субдиапазонов каждой комбинации верхних и нижних величин, проиллюстрированных определенно или неопределенно.
Используемый здесь термин «включающий» следует воспринимать как означающий и «включающий», и «состоящий из». Следовательно, когда изобретение относится к «фармацевтической композиции, включающей в качестве активного ингредиента» соединение, эта терминология предназначена для охвата и композиций, в которых могут присутствовать другие активные ингредиенты, и также композиций, которые состоят только из одного определенного активного ингредиента.
Используемый здесь термин «пептидные фрагменты» предназначен для включения следующих 20 природных протеогенных аминокислотных остатков:
| ОБОЗНАЧЕНИЕ | ЗНАЧЕНИЕ |
| Ala | Аланин |
| Сys | Цистеин |
| Asp | Аспарагиновая кислота |
| Glu | Глутаминовая кислота |
| Phe | Фенилаланин |
| Gly | Глицин |
| His | Гистидин |
| Ile | Изолейцин |
| Lys | Лизин |
| Leu | Лейцин |
| Met | Метионин |
| Asn | Аспарагин |
| Pro | Пролин |
| Gln | Глутамин |
| Arg | Аргинин |
| Ser | Серин |
| Thr | Треонин |
| Val | Валин |
| Trp | Триптофан |
| Tyr | Тирозин |
Модифицированные и необычные аминокислотные остатки, а также пептидо-миметики также предназначены для охвата определением «пептидные фрагменты».
При отсутствии других определений все технические и научные термины, используемые здесь, имеют такое же значение, как значение, обычно понимаемое средним специалистом в области, к которой относится настоящее изобретение. Аналогичным образом, все публикации, патентные заявки, все патенты и все другие ссылки, упомянутые здесь, включены в качестве ссылки (когда это разрешено законом).
Следующие примеры представлены для иллюстрации описанных выше процедур, и их ни в коей мере не следует рассматривать как ограничивающие объем изобретения.
Чертежи
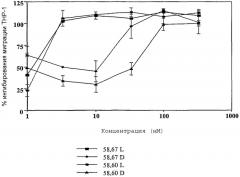
Фиг.1 предоставляет сравнение (R)- и (S)-энантиомеров амидных производных аминокапролактама в качестве ингибиторов миграции, вызванной МСР-1.
Примеры
Общая процедура синтеза исходных соединений
Гидрохлориды (R)- и (S)-3-аминокапролактама и гидропирролидин-5-карбоксилаты (R,R)- и (S,S)-3-аминокапролактама синтезировали в соответствии с литературными данными (cf. Boyle et al., J. Org. Chem., (1979), 44, 4841-4847; Rezler et al., J. Med. Chem. (1997), 40, 3508-3515).
Пример 1: (S)-3-гексадеканоиламинокапролактам:
Гидрохлорид (S)-3-аминокапролактама (5 ммоль) и Na2CO3 (15 ммоль) в воде (25 мл) добавляют к раствору гексадеканоилхлорида (5 ммоль) в дихлорметане (25 мл) при температуре окружающей среды и реакционную смесь перемешивают в течение 2 ч. Органический слой затем отделяют и водную фазу дополнительно экстрагируют дихлорметаном (2 х 25 мл). Объединенные органические слои сушат над Na2CO3 и упаривают в вакууме. Остаток очищают перекристаллизацией из EtOAc для получения указанного в заголовке соединения (1,41 г; 77%).
Точка плавления: 99-100°С.
(c = 1, CHCl3) = +32,0.
ИК: νmax (см-1): 3325, 3272 (NH), 1666, 1655, 1631 (CO), 1524 (NH).
1H ЯМР (δH, 500 МГц, CDCl3): 6,88 (1H, д, J 5,5, CHNH), 6,72 (1H, шир. с, CH2NH), 4,49 (1H, ддд, J 11, 6, 1, CHNH), 3,29-3,16 (2H, м, CH2NH), 2,17 (2H, т, J 7,5, CH2CONH), 2,03 (1H, шир. д, J 13,5, кольцо CH), 1,98-1,89 (1H, м, кольцо CH), 1,85-1,73 (2H, м, кольцо CH), 1,58 (2H, шир. кн J 7,0, CH2CH2CONH), 1,43 (1H, шир. кд, J 14, 3, кольцо CH), 1,38-1,29 (1H, шир. м, кольцо CH), 1,29-1,14 (24H, м, (CH2)12) и 0,83 (3H, т, J 6,5, CH3).
13C ЯМР (δC, 125 МГц, CDCl3): 175,9, 172,3 (CO), 52,0 (NHCHCO), 42,1 (NCH2), 36,6, 31,9, 31,7, 29,6 (×6), 29,4, 29,3 (×2), 29,2, 28,8, 27,9, 25,6, 22,6 (CH2) и 14,1 (CH3).
m/z (C22H42N2O2Na): 389,31450 (рассчитано: 389,3144).
Пример 2: (S)-3-ундеканоиламинокапролактам:
Гидрохлорид (S)-3-аминокапролактама (2 ммоль) и Na2CO3 (6 ммоль) в воде (25 мл) добавляют к раствору ундеканоилхлорида (2 ммоль) в дихлорметане (25 мл) при температуре окружающей среды и реакционную смесь перемешивают в течение 2 ч. Органический слой затем отделяют и водную фазу экстрагируют дополнительно дихлорметаном (2 х 25 мл). Объединенные органические слои сушат над Na2CO3 и упаривают в вакууме. Остаток очищают перекристаллизацией из EtOAc для получения указанного в заголовке соединения (397 мг; 67%).
Точка плавления: 91-92°С.
(c = 1, CHCl3) = +30,2.
ИК: nmax (см-1): 3342, 3313 (NH), 1676, 1638 (CO), 1519 (NH); 3342, 3292 (NH), 1671, 1639 (CO), 1513 (NH).
1H ЯМР (dH, 500 МГц, d6-ДМСО): 7,76 (1H, т, J 6, CH2NH), 7,68 (1H, д, J 7, CHNH), 4,38 (1H, дд, J 10, 7, CHNH), 3,15 (1H, ддд, J 15,5, 11, 5, CHHNH), 3,04 (1H, дт, J 13, 6, CHHNH), 2,19-2,06 (2H, м, CH 2CONH), 1,85 (1H, дт, J 10,5, 3, C-5 H), 1,77-1,68 (2H, м, C-4 H, C-6 H), 1,60 (1H, кт, J 12, 3,5, C-5 H), 1,46 (2H, шир. кн J 6,5, CH 2CH2CONH), 1,35 (1H, кд, J 12,5, 3, C-4 H), 1,31-1,13 (15H, м, (CH2)7 + C-6 H) и 0,85 (3H, т, J 7,0, CH3).
13C ЯМР (dC, 125 МГц, d6-ДМСО): 174,4 (CO-кольцо), 171,3 (CO-цепь), 51,3 (NHCHCO), 40,7 (NCH2), 35,2, 31,4, 31,3, 29,1, 29,0 (×2), 28,9, 28,8, 28,7, 27,8, 25,4, 22,2
(CH2) и 14,0 (CH3).
m/z (C17H32N2O2Na): 319,23540 (рассчитано: 319,2361).
Пример 3: (S)-3-(ундец-10-еноил)аминокапролактам:
Гидрохлорид (S)-3-аминокапролактама (2 ммоль) и Na2CO3 (6 ммоль) в воде (25 мл) добавляют к раствору ундец-10-еноилхлорида (2 ммоль) в дихлорметане (25 мл) при температуре окружающей среды и реакционную смесь перемешивают в течение 2 ч. Органический слой затем отделяют и водную фазу экстрагируют дополнительно дихлорметаном (2 х 25 мл). Объединенные органические слои сушат над Na2CO3 и упаривают в вакууме. Остаток очищают перекристаллизацией из EtOAc для получения указанного в заголовке соединения (423 мг; 72%).
Точка плавления: 83-84°С.
(c = 1, CHCl3) = +40,1.
ИК: nmax (см-1): 3327, 3273 (NH), 1655, 1630 (CO), 1521 (NH).
1H ЯМР (dH, 500 МГц, d6-ДМСО): 7,75 (1H, т, J 6, CH2NH), 7,66 (1H, д, J 7, CHNH), 5,76 (1H, ддт, J 17, 10, 6,5 CH2=CH), 4,96 (1H, дк, J 17, 2, CHH=CH), 4,96 (1H, ддт, J 17, 2, 1, CHH=CH), 4,36 (1H, дд, J 10, 7, CHNH), 3,14 (1H, ддд, J 15,5, 11,5, 5, CHHNH), 3,03 (1H, шир.дт, J 13, 5,5, CHHNH), 2,16-2,06 (2H, м, CH 2CONH), 1,98 (2H, шир.к, J 7, CH2=CHCH 2), 1,85 (1H, дт, J 10,5, 3, C-5 H), 1,75-1,67 (2H, м, C-4 H, C-6 H), 1,60 (1H, кт, J 13, 3,5, C-5 H), 1,44 (2H, шир. кн, J 7, CH 2CH2CONH), 1,39-1,27 (3H, м, CH2=CHCH2CH 2 + C-4 H) и 1,31-1,13 (9H, м, (CH2)4 + C-6 H).
13C ЯМР (dC, 125 МГц, d6-ДМСО): 174.4 (CO-кольцо), 171,3 (CO-цепь), 138,9 (CH2=CH), 114,7 (CH2=CH), 51,3 (NHCHCO), 40,7 (NCH2), 35,3, 33,3, 31,3, 29,0, 28,9 (×2) 28,7, 28,6, 28,4, 27,8 и 25,4 (CH2).
m/z (C17H30N2O2Na): 317,21970 (рассчитано: 317,2205).
Пример 4: (S)-3-(ундец-10-иноил)аминокапролактам:
Гидрохлорид (S)-3-аминокапролактама (2 ммоль) и Na2CO3 (6 ммоль) в воде (25 мл) добавляют к раствору ундец-10-иноилхлорида (2 ммоль) в дихлорметане (25 мл) при температуре окружающей среды и реакционную смесь перемешивают в течение 2 ч. Органический слой затем отделяют и водную фазу экстрагируют дополнительно дихлорметаном (2 х 25 мл). Объединенные органические слои сушат над Na2CO3 и упаривают в вакууме. Остаток очищают перекристаллизацией из EtOAc для получения указанного в заголовке соединения (362 мг; 62%).
Точка плавления: 73-75°С.
(c = 1, CHCl3) = +42,1.
ИК: nmax (см-1): 3332, 3295 (NH), 1667, 1633 (CO), 1523 (NH).
1H ЯМР (dH, 500 МГц, d6-ДМСО): 7,76 (1H, т, J 5,5, CH2NH), 7,68 (1H, д, J 7, CHNH), 4,36 (1H, дд, J 11, 7, CHNH), 3,16 (1H, ддд, J 15,5, 11,5, 5, CHHNH), 3,03 (1H, шир.дт, J 14, 7, CHHNH), 2,17-2,07 (4H, м, CH 2CONH + CH 2CCH), 1,85 (1H, м, C-5 H), 1,77-1,67 (2H, м, C-4 H, C-6 H), 1,62 (1H, шир.кт, J 13, 3,0, C-5 H), 1,50-1,28 (5H, м, CH 2CH2CONH +
HCCCH2CH 2 + C-4 H) и 1,28-1,13 (9H, м, (CH2)4 + C-6 H).
13C ЯМР (dC, 125 МГц, d6-ДМСО): 174,4 (CO-кольцо), 171,3 (CO-цепь), 84,6 (CH2 CCH), 71,1 (CH2CCH), 51,3 (NHCHCO), 40,7 (NCH2), 35,2, 31,3, 29,0, 28,8, 28,7, 28,5, 28,2, 28,0, 27,8, 25,4 и 17,8 (CH2).
m/z (C17H28N2O2Na): 317,20470 (рассчитано: 315,2048).
Пример 5: (S)-3-додеканоиламинокапролактам:
Гидрохлорид (S)-3-аминокапролактама (2 ммоль) и Na2CO3 (6 ммоль) в воде (25 мл) добавляют к раствору додеканоилхлорида (2 ммоль) в дихлорметане (25 мл) при температуре окружающей среды и реакционную смесь перемешивают в течение 2 ч. Органический слой затем отделяют и водную фазу экстрагируют дополнительно дихлорметаном (2 х 25 мл). Объединенные органические слои сушат над Na2CO3 и упаривают в вакууме. Остаток очищают перекристаллизацией из EtOAc для получения указанного в заголовке соединения (439 мг; 71%).
Точка плавления: 93-94°С.
(c = 1, CHCl3) = +35,5.
ИК: nmax (см-1): 3324, 3267 (NH), 1666, 1630 (CO), 1521 (NH).
1H ЯМР (dH, 500 МГц, d6-ДМСО): 7,76 (1H, шир.с, CH2NH), 7,67 (1H, д, J 7, CHNH), 4,38 (1H, дд, J 10,5, 7,5, CHNH), 3,15 (1H, ддд, J 15,5, 11,5, 5, CHHNH), 3,05 (1H, дт, J 14,5, 5,5, CHHNH), 2,17-2,07 (2H, м, CH 2CONH), 1,90-1,80 (1H, м, C-5 H), 1,77-1,68 (2H, м, C-4 H, C-6 H), 1,62 (1H, шир.кт, J 12, 3,5, C-5 H), 1,46 (2H, шир.кн J 6,0, CH 2CH2CONH), 1,36 (1H, кд, J 12,5, 2,5, C-4 H), 1,31-1,13 (17H, м, (CH2)8 + C-6 H) и 0,85 (3H, т, J 6,5, CH3).
13C ЯМР (dC, 125 МГц, d6-ДМСО): 174,4 (CO-кольцо), 171,2 (CO-цепь), 51,3 (NHCHCO), 40,7 (NCH2), 35,3, 31,4, 31,3, 29,1 (×3), 29,0 (×2), 28,8, 28,7, 27,8, 25,4, 22,2
(CH2) и 14,0 (CH3).
m/z (C18H34N2O2Na): 333,25150 (рассчитано: 333,2518).
Пример 6: (S)-3-тетрадеканоиламинокапролактам:
Гидрохлорид (S)-3-аминокапролактама (2 ммоль) и Na2CO3 (6 ммоль) в воде (25 мл) добавляют к раствору тетрадеканоилхлорида (2 ммоль) в дихлорметане (25 мл) при температуре окружающей среды и реакционную смесь перемешивают в течение 2 ч. Органический слой затем отделяют и водную фазу экстрагируют дополнительно дихлорметаном (2 х 25 мл). Объединенные органические слои сушат над Na2CO3 и упаривают в вакууме. Остаток очищают перекристаллизацией из EtOAc для получения указанного в заголовке соединения (412 мг; 61%).
Точка плавления: 97-98°С.
(c = 1, CHCl3) = +33,2.
ИК: nmax (см-1): 3326, 3273 (NH), 1666, 1655, 1631 (CO), 1523 (NH).
1H ЯМР (dH, 500 МГц, CDCl3): 6,87 (1H, д, J 5,5, CHNH), 6,66-6,48 (1H, шир.м, CH2NH), 4,50 (1H, дд, J 11, 6, CHNH), 3,30-3,16 (2H, м, CH 2NH), 2,18 (2H, т, J 7,5, CH 2CONH), 2,04 (1H, шир.д, J 13,5, кольцо CH), 2,00-1,92 (1H, м, кольцо CH), 1,86-1,74 (2H, м, кольцо CH), 1,59 (2H, шир.кн J 7,0, CH 2CH2CONH), 1,43 (1H, шир.к, J 12,5, кольцо CH), 1,31 (1H, шир.к, J 13, кольцо CH), 1,31-1,13 (20H, м, (CH2)10) и 0,85 (3H, т, J 6,5, CH3).
13C ЯМР (dC, 125 МГц, CDCl3): 175,9, 172,3 (CO), 52,0 (NHCHCO), 42,1 (NCH2), 36,6, 31,9, 31,7, 29,6 (×4), 29,4, 29,3 (×2), 29,2, 28,8, 27,9, 25,6, 22,6 (CH2) и 14,1 (CH3).
m/z (C20H38N2O2Na): 361,28270 (рассчитано: 361,2831).
Пример 7: (R)-3-гексадеканоиламинокапролактам:
Гидропирролидин-5-карбоксилат (R,R)-3-аминокапролактама (5 ммоль) и Na2CO3 (15 ммоль) в воде (25 мл) добавляют к раствору гексадеканоилхлорида (5 ммоль) в дихлорметане (25 мл) при температуре окружающей среды и реакционную смесь перемешивают в течение 2 ч. Органический слой затем отделяют и водную фазу экстрагируют дополнительно дихлорметаном (2 х 25 мл). Объединенные органические слои сушат над Na2CO3 и упаривают в вакууме. Остаток очищают перекристаллизацией из EtOAc для получения указанного в заголовке соединения (1,23 г; 67%).
Точка плавления: 99-100°С.
(c = 1, CHCl3) = -32,0.
Пример 8: (S)-3-октадеканоиламинокапролактам:
Гид