Дигидротетрабеназины и содержащие их фармацевтические композиции
Иллюстрации
Показать всеИзобретение относится к новому 3,11b-цис-дигидротетрабеназину общей формулы (I) или к его антиподу
.
Изобретение также относится к композиции, к фармацевтической композиции, к применению 3,11b-цис-дигидротетрабеназина, к способу получения 3,11b-цис-дигидротетрабеназина по п.1, к соединениям формулы (II), (III), а также к сложному эфиру кислоты Мошера и 3,11b-цис-дигидротетрабеназина.
Технический результат - получение новых биологически активных соединений, обладающих активностью в качестве ингибитора везикулярного транспортера моноаминов VMAT2. 9 н. и 14 з.п. ф-лы, 8 табл.
Реферат
Данное изобретение относится к новым изомерам дигидротетрабеназина, содержащим их фармацевтическим композициям, способам их получения и их терапевтическому применению.
Уровень техники
Тетрабеназин (химическое название: 1,3,4,6,7,11b-гексагидро-9,10-диметокси-3-(2-метилпропил)-2H-бензо(a)хинолизин-2-он) использовался в качестве фармацевтического лекарственного средства с конца 1950-х. Сначала используемый в качестве антипсихотического средства, в настоящее время тетрабеназин используется для лечения гиперкинетических двигательных расстройств, таких как болезнь Хантингтона, гемибаллизм, сенильная хорея, тик, поздняя дискинезия и синдром Туретта, см., например, Jankovic et al., Аm. J. Psychiatry. (1999) Aug; 156(8): 1279-81 и Jankovic et al., Neurology (1997) Feb; 48 (2): 358-62.
Первичным фармакологическим действием тетрабеназина является снижение поступления моноаминов (например дофамина, серотонина и норэпинефрина) в центральную нервную систему путем ингибирования везикулярного транспортера моноаминов человека изоформы 2 (hVMAT2). Данное лекарственное средство также блокирует постсинаптические дофаминовые рецепторы.
Тетрабеназин представляет собой эффективное и безопасное лекарственное средство для лечения различных гиперкинетических двигательных расстройств и в отличие от типичных нейролептиков не вызывает поздней дискинезии. Тем не менее тетрабеназин проявляет ряд дозозависимых побочных эффектов, в том числе вызывающих депрессию, паркинсонизм, сонливость, нервозность или тревогу, бессонницу и, в редких случаях, злокачественный нейролептический синдром.
Центральные эффекты тетрабеназина сильно напоминают эффекты резерпина, но он отличается от резерпина тем, что проявляет недостаточную активность в отношении VMAT1 транспортера. Недостаточная активность в отношении VMAT1 транспортера означает, что тетрабеназин обладает меньшей периферической активностью, чем резерпин, и следовательно, не дает побочных эффектов, связанных с VMAT1, таких как гипотензия.
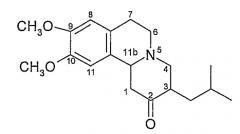
Химическая структура тетрабеназина представляет собой структуру, показанную на Фигуре 1, приведенной ниже.
Фигура 1 - структура тетрабеназина
Данное соединение имеет хиральные центры при 3 и 11b атомах углерода и, следовательно, может, теоретически, существовать всего в четырех изомерных формах, как показано на Фигуре 2.
Фигура 2 - Возможные изомеры тетрабеназина
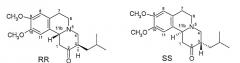
На Фигуре 2, стереохимию каждого изомера определяют, используя «R и S» номенклатуру, разработанную Cahn, Ingold и Prelog, см. Advanced Organic Chemistry by Jerry March, 4th Edition, John Wiley & Sons, New York, 1992, страницы 109-114. На Фигуре 2 и в других местах в этой патентной заявке, обозначения «R» или «S» даны в порядке номеров позиций атомов углерода. Таким образом, например, RS представляет собой сокращенное обозначение для 3R,11bS. Подобным образом, когда присутствуют три хиральных центра, как у дигидротетрабеназинов, описанных ниже, обозначения «R» или «S» перечислены в порядке атомов углерода 2, 3 и 11b. Таким образом, 2S,3R,11bR изомер в кратком виде обозначается SRR и так далее.
Коммерчески доступный тетрабеназин представляет собой рацемическую смесь RR и SS изомеров и получается, что RR и SS изомеры (здесь и далее называемые по отдельности или в совокупности транс-тетрабензином, поскольку атомы водорода в положениях 3 и 11b имеют транс взаимную ориентацию) представляют собой наиболее термодинамически стабильные изомеры.
Тетрабеназин имеет довольно низкую и изменчивую биодоступность. Он интенсивно метаболизируется посредством пресистемного метаболизма, и небольшое количество или неизмененный тетрабеназин обычно определяется в моче. Основным метаболитом является дигидротетрабеназин (химическое название 2-гидрокси-3-(2-метилпропил)-1,3,4,6,7,11b-гексагидро-9,10-диметокси-бензо(a)хинолизин), который образуется восстановлением 2-кетогруппы в тетрабеназине, и считается, что он в первую очередь отвечает за активность лекарственного средства (см. Mehvar et al., Drug Metab. Disp, 15, 250-255 (1987) и J. Pharm. Sci., 76, No. 6, 461-465 (1987)).
Ранее были идентифицированы и охарактеризованы четыре изомера дигидротетрабеназина, все они являются производными более стабильных изомеров RR и SS исходного тетрабеназина и имеют транс взаимную ориентацию между атомами водорода в положениях 3 и 11b) (см. Kilbourn et al., Chirality, 9: 59-62 (1997) и Brossi et al., Helv. Chim. Acta., vol. XLI, No. 193, pp l793-1806 (1958).
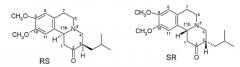
Этими четырьмя изомерами являются (+)-α-дигидротетрабеназин, (-)-α-дигидротетрабеназин, (+)-β-дигидротетрабеназин и (-)-β-дигидротетрабеназин. Рассматриваемые структуры четырех известных изомеров дигидротетрабеназина показаны на Фигуре 3.
Фигура 3 - Структуры известных изомеров дигидротетрабеназина
Kilbourn et al. (см. Eur. J. Pharmacol., 278: 249-252 (1995) и Med. Chem. Res., 5: 113-126 (1994)) изучали специфическое связывание отдельных радиоактивно-меченных изомеров дигидротетрабеназина, в головном мозге крыс, находящихся в сознании. Они обнаружили, что (2R,3R,11bR)изомер (+)-α-[11C]дигидротетрабеназина накапливался в участках головного мозга, связанных с более высокими концентрациями нейронального мембранного транспортера дофамина (DAT) и везикулярного транспортера моноаминов (VMAT2). Однако по существу неактивный изомер (-)-α-[11C]дигидротетрабеназина был почти равномерно распределен в головном мозге, давая возможность предположить, что специфического связывания с DAT и VMAT2 не происходило. Исследования in vivo коррелировали с исследованиями in vitro, которые демонстрировали, что изомер (+)-α-[11C]дигидротетрабеназина показывает Ki для [3H]метокситетрабеназина >2000 раз выше, чем Ki для изомера (-)-α-[11C]дигидротетрабеназина.
К настоящему времени, насколько осведомлены заявители, изомеры дигидротетрабеназина, полученные из нестабильных RS и SR изомеров (здесь и далее названные по отдельности или в совокупности цис-тетрабеназином, поскольку атомы водорода в положениях 3 и 11b имеют цис-взаимную ориентацию) тетрабеназина ранее не были выделены и охарактеризованы, и данные о биологической активности этих соединений до настоящего времени не были опубликованы.
Сущность изобретения
В настоящее время было обнаружено, что изомеры дигидротетрабеназина, полученные из нестабильных RS и SR изомеров (««цис» изомеров») тетрабеназина являются не только стабильными, но, неожиданно, обладают хорошими биологическими свойствами. В частности, некоторые изомеры имеют профили рецепторной активности, которые предполагают ряд преимуществ по сравнению с используемым в настоящее время RR/SS тетрабеназином. Например, некоторые изомеры, хотя и имеют высокую аффинность к VMAT2, демонстрируют значительно сниженное или незначительное связывание с дофаминовыми рецепторами, следовательно, они едва ли вызывают дофаминергические побочные эффекты, встречающиеся у тетрабеназина. Ни один из этих изомеров не показывал ингибирования переносчика дофамина (DAT). Кроме того, исследования некоторых изомеров на крысах показали, что они не имеют нежелательных седативных побочных эффектов, ассоциированных с тетрабеназином. Отсутствие седативной активности связано с очень низкой аффинностью некоторых изомеров к адренергическим рецепторам. Более того, принимая во внимание, что одним из побочных эффектов тетрабеназина является депрессия, некоторые изомеры дигидротетрабеназина демонстрируют аффинность к белку-переносчику серотонина (SERT), следовательно, они могут обладать антидепрессантным действием.
В связи с этим, в первом аспекте, данное изобретение относится к 3,11b-цис-дигидротетрабеназину.
В другом аспекте, данное изобретение относится к фармацевтической композиции, содержащей 3,11b-цис-дигидротетрабеназин и фармацевтически приемлемый носитель.
Данное изобретение также относится к 3,11b-цис-дигидротетрабеназину по существу в чистом виде, например, с изомерной чистотой более 90%, обычно более 95% и более, предпочтительно более 98%.
Термин «изомерная чистота» в контексте настоящего изобретения относится к количеству присутствующего 3,11b-цис-дигидротетрабеназина относительно общего количества или концентрации дигидротетрабеназина всех изомерных форм. Например, если 90% общего содержания дигидротетрабеназина, присутствующего в композиции, представляет собой 3,11b-цис-дигидротетрабеназин, то изомерная чистота составляет 90%.
Данное изобретение дополнительно относится к композиции, содержащей 3,11b-цис-дигидротетрабеназин, по существу свободный от 3,11b-транс-дигидротетрабеназина, предпочтительно содержащей менее 5% 3,11b-транс-дигидротетрабеназина, более предпочтительно менее 3% 3,11b-транс-дигидротетрабеназина и, наиболее предпочтительно менее 1% 3,11b-транс-дигидротетрабеназина.
В другом аспекте данное изобретение относится к 3,11b-цис-дигидротетрабеназину для применения в медицине или лечении, например, при лечении гиперкинетических двигательных расстройств, таких как болезнь Хантингтона, гемибаллизм, сенильная хорея, тик, поздняя дискинезия и синдром Туретта, или при лечении депрессии.
Еще в одном аспекте, данное изобретение относится к применению 3,11b-цис-дигидротетрабеназина для получения лекарственного средства для лечения гиперкинетических двигательных расстройств, таких как болезнь Хантингтона, гемибаллизм, сенильная хорея, тик, поздняя дискинезия и синдром Туретта, или лечения депрессии.
Еще в одном дополнительном аспекте, данное изобретение относится к способу профилактики или лечения гиперкинетических двигательных расстройств, таких как болезнь Хантингтона, гемибаллизм, сенильная хорея, тик, поздняя дискинезия и синдром Туретта или лечения депрессии у пациента, нуждающегося в такой профилактике или лечении, который включает введение профилактически или терапевтически эффективного количества 3,11b-цис-дигидротетрабеназина.
Термин «3,11b-цис-», используемый здесь, означает, что атомы водорода в 3- и 11b-положениях структуры дигидротетрабеназина находятся в цис-взаимной ориентации. Изомеры по данному изобретению, следовательно, представляют собой соединения формулы (I) и их антиподы (зеркальные отображения).
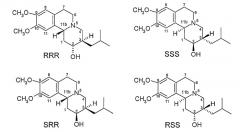
Существует четыре возможных изомера дигидротетрабеназина, имеющих 3,11b-цис конфигурацию, и они представляют собой 2S,3S,11bR изомер, 2R,3R,11bS изомер, 2R,3S,11bR изомер, и 2S,3R,11bS изомер. Эти четыре изомера были выделены и охарактеризованы и, в другом аспекте, данное изобретение относится к индивидуальным изомерам 3,11b-цис-дигидротетрабеназина. В частности, данное изобретение относится к: (a) 2S,3S,11bR изомеру 3,11b-цис-дигидротетрабеназина, имеющего формулу (Ia):
(b) 2R,3R,11bS изомеру 3,11b-цис-дигидротетрабеназина, имеющего формулу (Ib):
(c) 2R,3S,11bR изомеру 3,11b-цис-дигидротетрабеназина, имеющего формулу (Ic):
и
(d) 2S,3R,11bS изомеру 3,11b-цис-дигидротетрабеназина, имеющего формулу (Id):
Индивидуальные новые изомеры по данному изобретению могут быть охарактеризованы по их спектроскопическим, оптическим и хроматографическим свойствам.
Предпочтительными изомерами являются правовращающие (+)изомеры.
Не предполагая конкретной абсолютной конфигурации или стереохимии, четыре новых изомера могут быть охарактеризованы следующим образом:
Изомер A
Оптическая активность, измеренная с помощью дисперсии оптического вращения (ORD) (метанол, 21°C): левовращающий (-) ИК-спектр (твердый KBr), 1H-ЯМР-спектр (CDCl3) и 13C-ЯМР-спектр (CDCl3) по существу такие, как описано в Таблице 1.
Изомер B
Оптическая активность, измеренная с помощью дисперсии оптического вращения (ORD) (метанол, 21°C): правовращающий (+)ИК-спектр (твердый KBr), 1H-ЯМР-спектр (CDCl3) и 13C-ЯМР-спектр (CDCl3) по существу такие, как описано в Таблице 1.
Изомер C
Оптическая активность, измеренная с помощью дисперсии оптического вращения (ORD) (метанол, 21°C): ИК-спектр (твердый KBr), 1H-ЯМР-спектр (CDCl3) и 13C-ЯМР-спектр (CDCl3) по существу такие, как описано в Таблице 2.
Изомер D
Оптическая активность, измеренная с помощью дисперсии оптического вращения (ORD) (метанол, 21°C): левовращающий (-) ИК спектр (твердый KBr), 1H-ЯМР спектр (CDCl3) и 13C-ЯМР спектр (CDCl3) по существу такие, как описано в Таблице 2.
Значения ORD для каждого изомера даны в примерах, приведенных ниже, но следует отметить, что такие значения даны в качестве примера и могут варьировать в зависимости от степени чистоты изомера и влияния других переменных, таких как колебания температур и действие остаточных молекул растворителя.
Каждый из энантиомеров A, B, C и D может присутствовать по существу в энантиомерно чистой форме или в виде смесей с другими энантиомерами данного изобретения.
Термины «энантиомерная чистота» и «энантиомерно чистый» в контексте настоящего изобретения относится к количеству данного энантиомера 3,11b-цис-дигидротетрабеназина, присутствующему относительно общего количества или концентрации дигидротетрабеназина всех энантиомерных и изомерных форм. Например, если 90% общего дигидротетрабеназина, присутствующего в данной композиции, находится в виде единственного энантиомера, то энантиомерная чистота составляет 90%.
В качестве примера, в каждом аспекте и варианте осуществления данного изобретения, каждый индивидуальный энантиомер, выбранный из изомеров A, B, C и D, может иметь энантиомерную чистоту по меньшей мере 55% (например, по меньшей мере 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 97%, 98%, 99%, 99,5% или 100%).
Изомеры по данному изобретению также могут находиться в форме смесей одного или нескольких изомеров A, B, C и D. Такие смеси могут быть рацемическими смесями или нерацемическими смесями. Примеры рацемических смесей включают в себя рацемическую смесь изомера А и изомера В, и рацемическую смесь изомера С и изомера D.
Фармацевтически приемлемые соли
Если только иное не требуется по контексту, ссылка в этой заявке на дигидротетрабеназин и его изомеры включает в своем объеме не только свободное основание дигидротетрабеназина, а также его соли и, в частности, кислотно-аддитивные соли.
Конкретные кислоты, из которых образуются кислотно-аддитивные соли, включают в себя кислоты, имеющие значение pKa менее 3,5 и, чаще, менее 3. Например, кислотно-аддитивные соли могут образовываться из кислоты с pKa в диапазоне от +3,5 до - 3,5.
Предпочтительные кислотно-аддитивные соли включают в себя соли, образованные с сульфоновыми кислотами, такими как метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, толуолсульфоновая кислота, камфорсульфоновая кислота и нафталинсульфоновая кислота.
Кислотой, заслуживающей особого внимания, из которой могут быть образованы кислотно-аддитивные соли, является метансульфоновая кислота.
Кислотно-аддитивные соли могут быть получены описанными здесь способами или обычными химическими методами, такими, которые описаны в публикации Pharmaceutical Salts: Properties, Selection, and Use, P. Heinrich Stahl (Editor), Camille G. Wermuth (Editor), ISBN: 3-90639-026-8, Hardcover, 388 страниц, август 2002. В основном такие соли могут быть получены путем взаимодействия соединения в форме свободного основания с соответствующим основанием или кислотой в воде или в органическом растворителе, или в смеси двух; главным образом используют безводную среду, такую как простой эфир, этилацетат, этанол, изопропанол или ацетонитрил.
Соли обычно представляют собой фармацевтически приемлемые соли. Однако соли, не являющиеся фармацевтически приемлемыми, также могут быть получены в виде промежутоных форм, которые затем можно преобразовать в фармацевтически приемлемые соли. Такие не-фармацевтически приемлемые солевые формы также составляют часть данного изобретения.
Способы получения изомеров дигидротетрабеназина
В дополнительном аспекте предлагается способ (Способ А) получения дигидротетрабеназина по данному изобретению, который включает в себя взаимодействие соединения формулы (II):
с реагентом или реагентами, подходящими для гидрирования 2,3-двойной связи в соединении формулы (II) и, в последствии, где требуется, отделение и выделение желаемой изомерной форы дигидротетрабеназина.
Гидрирование 2,3-двойной связи можно провести гидроборированием с использованием боранового реагента, такого как диборан или боран-эфир (например, боран-тетрагидрофуран (ТГФ)) с получением промежуточного алкил-боранового продукта присоединения с последующим окислением алкил-боранового продукта присоединения и гидролизом в присутствии основания. Гидроборирование обычно проводят в сухом полярном апротонном растворителе, таком как простой эфир (например, ТГФ), обычно при неповышенной температуре, например, при комнатной температуре. Боран-алкеновый продукт присоединения обычно окисляют окисляющим агентом, таким как перекись водорода, в присутствии основания, обеспечивающего источник гидроксид-ионов, как, например, гидроксид аммония или гидроксид щелочного металла, например, гидроксид калия или гидроксид натрия. Последовательность реакций Способа А гидроборирование-окисление-гидролиз обычно дает изомеры дигидротетрабеназина, в которых атомы водорода в положениях 2- и 3-транс взаимную ориентацию.
Соединения формулы (II) могут быть получены путем восстановления тетрабеназина с получением дигидротетрабеназина с последующим дегидрированием дигидротетрабеназина. Восстановление тетрабеназина можно осуществить с использованием алюмогидридного реагента, или боргидридного реагента, такого как боргидрид натрия, боргидрид калия или боргидридное производное, например, алкилборгидрид, такой как три-втор-бутилборгидрид. Альтернативно, стадию восстановления можно проводить с использованием каталитического гидрирования, например, на скелетном никелевом катализаторе гидрирования или оксидоплатиновом катализаторе. Подходящие условия для проведения стадии восстановления описаны более подробно ниже или их можно найти в US 2843591 (Hoffmann-La Roche) и Brossi et al., Helv. Chim. Acta., vol. XLI, No. 193, pp l793-1806 (1958).
Поскольку тетрабеназин, используемый как исходное вещество для реакции восстановления, обычно представляет собой смесь RR и SS изомеров (т.е. транс-тетрабеназин), дигидротетрабеназин, образованный на стадии восстановления, будет иметь такую же транс-конфигурацию в 3- и 11b-положениях и примет форму одного или нескольких известных изомеров дигидротетрабеназина, показанных на Фигуре 3, указанной выше. Таким образом, Способ А может включать в себя взятие известных изомеров дигидротетрабеназина, дегидрирование их до формы алкена (II), а затем «регидрирование» алкена (II) с использованием условий, которые дают желаемые новые цис-изомеры дигидротетрабеназина по данному изобретению.
Дегидрирование дигидротетрабеназина в алкен (II) можно проводить с использованием целого ряда стандартных условий для дегидрирования спиртов до образования алкенов, см., например, J. March (idem) страницы 389-390 и приведенные ссылки. Примеры таких условий включают в себя применение дегидрирующих агентов на основе фосфора, таких как галогениды фосфора или оксигалогениды фосфора, например POCl3 и PCl5. В качестве альтернативы для прямого дегидрирования, гидроксильная группа дигидротетрабеназина может быть преобразована в уходящую группу L, такую как галоген (например, хлорин или бромин), а затем подвергнута воздействию условий (например, присутствие основания) для удаления H-L. Преобразование гидроксильной группы в галогенид может достигаться использованием способов, хорошо известных опытному химику, например реакцией с тетрахлоридом углерода или тетрабромидом углерода в присутствии триалкил- или триарилфосфина, такого как трифенилфосфин или трибутилфосфин.
Тетрабеназин, используемый в качестве исходного вещества для восстановления, для получения дигидротетрабеназина может быть получен коммерчески или может быть синтезирован способом, описанным в US 2830993 (Hoffmann-La Roche).
Данное изобретение также относится к способу (Способ В) получения дигидротетрабеназина по данному изобретению, который включает в себя воздействие на соединение формулы (III):
условий для раскрытия цикла 2,3-эпоксидной группы в соединении формулы (III), а в дальнейшем, где требуется, отделение и выделение желаемой изомерной формы дигидротетрабеназина.
Раскрытие цикла можно осуществить в соответствии с известными способами раскрытия эпоксидного цикла. Однако предпочтительным способом раскрытия эпоксидного цикла в настоящее время является восстановительное раскрытие цикла, которое может достигаться с использованием восстанавливающего агента, такого как боран-ТГФ. Реакцию с боран-ТГФ можно проводить в полярном апротонном растворителе, таком как простой эфир (например, тетрагидрофуран) обычно при температуре окружающей среды, образованный таким образом борановый комплекс впоследствии гидролизуется нагреванием в присутствии воды и основания при температуре кипения растворителя. В Способе B обычно образуются изомеры дигидротетрабеназина, в которых атомы водорода в положениях 2- и 3- имеют цис-взаимную ориентацию.
Эпоксидные соединения формулы (III) могут быть получены эпоксидированием алкена формулы (II), указанной выше. Реакцию эпоксидирования проводят с использованием условий и реагентов, хорошо известных опытному химику, см., например, J. March (idem), страницы 826-829 и ссылки. Обычно перкислота, такая как мета-хлорпербензойная кислота (MCPBA), или смесь перкислоты и дополнительного окисляющего агента, такого как перхлорная кислота, могут быть использованы для осуществления эпоксидирования.
В тех случаях, когда исходные вещества для способов А и В, указанных выше, представляют собой смеси энантиомеров, тогда продукты этих способов обычно будут представлять собой пары энантиомеров, например, рацемические смеси, возможно вместе с диастереоизомерными примесями. Нежелательные диастереоизомеры могут быть удалены такими способами, как хроматография (например, ВЭЖХ) и индивидуальные энантиомеры могут быть разделены рядом способов, известных опытному химику. Например, их можно разделить посредством:
(i) хиральной хроматографии (хроматография на хиральном носителе); или
(ii) образования соли с оптически чистой хиральной кислотой, отделение данных солей двух диастереоизомеров фракционной кристаллизацией, а затем выделение дигидротетрабеназина из данной соли; или
(iii) образование производного (такого как сложный эфир) с оптически чистым хиральным агентом, образующим производные (например, этерифицирующим агентом), отделение полученных в результате эпимеров (например, хроматографией), а затем превращение данного производного в дигидротетрабеназин.
Один способом разделения пар энантиомеров, полученных в результате каждого из Способов А и В, и который был признан особенно эффективным, является этерификация гидроксильной группы дигидротетрабеназина оптически активной формой кислоты Мошера, такой как R (+) изомер, показанный ниже, или его активной формой:
Полученные в результате сложные эфиры двух энантиомеров дигидротетрабеназина затем могут быть разделены с помощью хроматографии (например, ВЭЖХ) и разделенные сложные эфиры подвергали гидролизу с получением индивидуальных изомеров дигидробеназина, используя основание, такое как гидроксид щелочного металла (например, NaOH) в полярном растворителе, таком как метанол.
В качестве альтернативы использованию смесей энантиомеров, в качестве исходных веществ в способах А, а затем последующему проведению разделения энантиомеров, способы А и В каждый можно проводить на взятых в отдельности энантиомерах исходных веществ, что в результате приводит к продуктам, в которых преобладает отдельно взятый энантиомер. Отдельные энантиомеры алкена (II) могут быть получены путем проведения стереоселективного восстановления RR/SS тетрабеназина с использованием три-втор-бутилборгидрида лития с получением смеси SRR и RSS энантиомеров дигидротетрабеназина, разделения энантиомеров (например, фракционной кристаллизацией), а затем дегидрированием отделенного индивидуального энантиомера дигидротетрабеназина с получением преимущественно или исключительно индивидуального энантиомера соединения формулы (II).
Способы A и B более подробно проиллюстрированы ниже на схемах 1 и 2 соответственно.
Схема 1
Схема 1 иллюстрирует получение индивидуальных изомеров дигидротетрабеназина, имеющих 2S,3S,11bR и 2R,3R,11bS конфигурации, в которых атомы водорода, присоединенные к положениям 2- и 3- расположены в транс взаимной ориентации. Эта схема реакции включает в себя описанный выше Способ А.
Исходной точкой последовательности реакций на Схеме 1 является коммерчески доступный тетрабеназин (IV), который представляет собой рацемическую смесь RR и SS оптических изомеров тетрабеназина. В каждых RR и SS изомерах атомы водорода в положениях 3- и 11b- расположены в транс взаимной ориентации. В качестве альтернативы использованию коммерчески доступного соединения, тетрабеназин может быть синтезирован в соответствии с процедурой, описанной в патенте США № 2830993 (см. в конкретном примере 11).
Рацемическую смесь RR и SS тетрабеназина восстанавливают с использованием боргидридного восстанавливающего агента три-втор-бутилборгидрида лития («L-Селектрид») с получением смеси известных 2S,3R,11bR и 2R,3S,11bS изомеров (V) дигидротетрабеназина, из которых для простоты показан только 2S,3R,11bR изомер. Используя более стерически затрудненный L-Селектрид в качестве боргидридного восстанавливающего агента, а не боргидрида натрия, образование RRR и SSS изомеров дигидротетрабеназина сводится к минимуму или подавляется.
Изомеры дигидротетрабеназина (V) взаимодействуют с дегидрирующим агентом, таким как пентахлорид фосфора, в апротонном растворителе, таком как хлорированный углеводород (например, хлороформ или дихлорметан, предпочтительно дихлорметан) с образованием ненасыщенного соединения (II) в виде пары энантиомеров, из которых только R-энантиомер показан на Схеме. Реакцию восстановления обычно проводят при температуре ниже комнатной температуры, например, примерно при 0-5°C.
Ненасыщенное соединение (II) затем подвергают стереоселективной регидратации с получением дигидротетрабеназина (VI) и его зеркального изображения или антипода (не показан), в котором атомы водорода в положениях 3- и 11b- расположены в цис-взаимной ориентации, а атомы водорода в положениях 2- и 3- расположены в транс-взаимной ориентации. Стереоселективную регидратацию проводят методом гидроборирования с использованием боран-ТГФ в тетрагидрофуране (ТГФ) с образованием промежуточного боранового комплекса (не показан), который затем окисляют перекисью водорода в присутствии основания, такого как гидроксид натрия.
Затем можно провести начальную стадию очистки (например, с помощью ВЭЖХ) с получением продукта (V) последовательности реакции регидратации, в виде смеси 2S,3S,11bR и 2R,3R,11bS изомеров, из которых на Схеме показан только 2S,3S,11bR изомер. Для разделения изомеров смесь обрабатывают R(+)кислотой Мошера в присутствии оксалилхлорида и диметиламинопиридина (DMAP) в дихлорметане с получением пары диастереоизомерных сложных эфиров (VII) (из которых показан только один диастереоизомер), которые затем можно разделить, используя ВЭЖХ. Индивидуальные сложные эфиры затем можно гидролизовать, используя гидроксид щелочного металла, такой как гидроксид натрия, с получением отдельного изомера (VI).
В одном варианте последовательности стадий, показанных на Схеме 1, следующих за восстановлением RR/SS тетрабеназина, результирующую смесь энантиомеров дигидротетрабеназина (V) можно разделить с получением индивидуальных энантиомеров. Разделение можно провести путем образования соли с хиральной кислотой, такой как (+) или (-)камфорсульфоновая кислота, разделения полученных в результате диастереоизомеров фракционной кристаллизицией с получением соли отдельного энантиомера, а затем высвобождения из соли свободного основания.
Отделенный энантиомер дигидротетрабеназина можно подвергнуть дегидратации с получением отдельного энантиомера алкена (II). Последующая регидратация алкена (II) затем даст преимущественно или исключительно отдельно взятый энантиомер цис-дигиротетрабеназина (VI). Преимуществом этого варианта является то, что он не включает в себя образование сложных эфиров кислоты Мошера, и, следовательно, избегает хроматографического разделения, обычно используемого для разделения сложных эфиров кислоты Мошера.
Схема 2 иллюстрирует получение индивидуальных изомеров дигидротетрабеназина, имеющих 2R,3S,11bR и 2S,3R,11bS конфигурации, в которых атомы водорода, присоединенные в положениях 2- и 3- находятся в цис взаимной ориентации. Эта схема реакции заключает в себе описанный выше Способ В.
Схема 2
На Схеме 2, ненасыщенное соединение (II) получают восстановлением тетрабеназина с образованием 2S,3R,11bR и 2R,3S,11bS изомеров (V) дигидротетрабеназина и дегидрированием с использованием PCl5 способом, описанным выше на Схеме 1. Однако вместо проведения гидроборирования соединения (II), 2,3-двойную связь преобразовывают в эпоксидную, реакцией с мета-хлорпербензойной кислотой (MCPBA) и перхлорной кислотой. Реакцию эпоксидирования удобно проводить в спиртовом растворителе, таком как метанол, обычно примерно при комнатной температуре.
Эпоксид (VII) затем подвергают восстановительному раскрытию цикла, используя боран-ТГФ в качестве электрофильного восстанавливающего агента с получением промежуточного боранового комплекса (не показано), который затем окисляют и расщепляют перекисью водорода в присутствии щелочи, такой как гидроксид натрия, с получением дигидротетрабеназина (VIII) в виде смеси 2R,3S,11bR и 2S,3R,11bS изомеров, из которых для простоты показан только 2R,3S,11bR. Обработка смеси изомеров (VIII) R (+) кислотой Мошера в присутствии оксалилхлорида и диметиламинопиридина (DMAP) в дихлорметане дает пару эпимерных сложных эфиров (IX) (из которых показан только один эпимер), который затем можно отделить хроматографией и подвергнуть гидролизу гидроксидом натрия в метаноле, способом, описанным выше, в отношении Схемы 1.
Полагают, что химические производные (II) и (III) являются новыми и представляют дополнительный аспект данного изобретения.
Биологические свойства и терапевтическое применение
Тетрабеназины оказывают свои терапевтические эффекты путем ингибирования везикулярного транспортера моноаминов VMAT2 в головном мозге и путем ингибирования как пре-синаптических, так и пост-синаптических дофаминовых рецепторов.
Новые изомеры дигидротетрабеназина по данному изобретению также являются ингибиторами VMAT2, с изомерами C и B дающими наибольшую степень ингибирования. Подобно тетрабеназину, соединения по данному изобретению имеют только низкую аффинность к VMAT1, изоформе VMAT, обнаруженной в периферических тканях и некоторых эндокринных клетках, тем самым указывая на то, что они не должны давать побочных эффектов, связанных с резерпином. Соединения C и B также не проявляют ингибирующей активности в отношении катехол О-метилтрансферазы (COMT), моноаминоксидазы изоформ A и B и изоформ 1d и 1b 5-гидрокситриптамина.
Неожиданно изомеры C и B также демонстрируют заметное расхождение в VAMT2 и дофамин рецепторной активности в том смысле, что хотя они являются высокоактивными в связывании с VMAT2, оба соединения проявляют только слабую связывающую активность в отношении рецептора дофамина, или она не существует, и недостаточную связывающую активность в отношении переносчика дофамина (DAT). Фактически, ни один из изомеров не проявляет значительной DAT-связывающей активности. Это дает основания предположить, что данные соединения могут не иметь дофаминэргических побочных эффектов, вызываемых тетрабеназином. Изомеры С и В также являются либо слабоактивными, либо неактивными в качестве ингибиторов адренэргических рецепторов, и это дает основания предположить, что данные соединения могут не иметь адренэргических побочных эффектов, часто встречающихся у тетрабеназина. Действительно, в исследованиях двигательной функции, проводимых на крысах, тетрабеназин демонстрировал дозозависимый седативный эффект, тогда как после введения изомеров В и С по изобретению седативные эффекты не наблюдались.
Кроме того, как изомер С, так и изомер В являются мощными ингибиторами белка-переносчика серотонина SERT. Ингибирование SERT является одним механизмом, посредством которого антидепрессанты, такие как флуоксетин (Prozac®) оказывают свои терапевтические эффекты. Следовательно, способность изомеров С и В ингибировать SERT указывает на то, что эти изомеры могут действовать как антидепрессанты, в отличие от тетрабеназина, для которого депрессия является хорошо известным побочным эффектом.
На основании исследований, проведенных к настоящему времени, предусматривается, что дигидротетрабеназиновые соединения по данному изобретению будут эффективны при профилактике или лечении заболеваний и состояний, для которых в настоящее время используется или предлагается тетрабеназин. Таким образом, в качестве примера и без ограничения, дигидротетрабеназиновые соединения по данному изобретению могут быть использованы для лечения гиперкинетических расстройств, таких как болезнь Хантингтона, гемибаллизм, сенильная хорея, тик, поздняя дискинезия, дистония и синдром Туретта.
Также предполагается, что дигидротетрабеназиновые соединения по данному изобретению могут быть эффективны при лечении депрессии.
Эти соединения в основном будут назначать пациенту, нуждающемуся в таком назначении, например, пациенту - человеку или животному, предпочтительно человеку.
Эти соединения обычно будут вводить в количествах, которые являются терапевтически или профилактически эффективными и которые в основном являются нетоксичными. Однако в определенных ситуациях польза от введения дигидротетрабеназинового соединения по данному изобретению может перевешивать вред от любых токсических или побочных эффектов, при этом можно считать целесообразным введение соединений в количествах, которые связаны с некоторой степенью токсичности.
Обычная суточная доза соединения может находиться в интервале от 0,025 миллиграмм до 5 миллиграмм на килограмм массы тела, например, до 3 миллиграмм на килограмм массы тела, и чаще от 0,15 миллиграмм до 5 миллиграмм на килограмм массы тела, хотя, когда требуется, можно вводить большие или меньшие дозы.
Для примера, начальную исходную дозу 12,5 мг можно вводить 2-3 раза в день. Эту дозу можно увеличить на 12,5 мг каждые 3-5 дней до достижения максимально переносимой и эффективной дозы для индивидуума, определяемой лечащим врачом. В конечно счете, количество введенного соединения будет соответствовать природе заболевания или физиологическому состоянию, подвергаемого лечению, и терапевтическим эффектам и наличию или отсутствию побочных эффектов, вызываемых установленным режимом дозирования, и на усмотрение лечащего врача.
Фармацевтические композиции
Изобретение также относится к дигидротетрабеназиновым соединениям, определенным здесь ранее, в виде фармацевтических композиций.
Фармацевтические композиции могут быть в любой форме, подходящей для перорального, парентерального, местного, интраназального, внутрибронхиального, глазного, ушного, ректального, внутривагинального или чрескожного введения. В тех случаях, когда композиции предназначены для парентерального введения, они могут быть получены для внутривенного, внутримышечного, внутрибрюшинного, подкожного введения или для прямой доставки к целевому органу или ткани путем инъекции, инфузии или другими способами доставки.
Фармаце