Стабилизированные твердые композиции полипептидов фактора vii
Иллюстрации
Показать всеИзобретение относится к химически и физически стабильным композициям, включающим фактор VII или полипептид, родственный фактору VII, так что такие композиции могут храниться, быть пригодными для работы с ними и применяться при комнатной температуре. Композиция содержит эффективное количество полипептида фактора VII и сочетание сахарозы и полиола, при влажности композиции не более чем около 3%. Изобретение также относится к способу получения стабильного полипептида фактора VII, который включает стадии введения указанного полипептида фактора VII, раствор, содержащий сочетание сахарозы и полиола как стабилизатора, и обработку указанного раствора с получением твердой композиции. В сочетании с сахарозой и полиолом может быть добавлен и антиоксидант, представляющий собой, например, гомоцистеин, цистеин, цистатионин, метионин или глютатион. Полиол представляет собой, например, маннит, сорбит или ксилит. Предложен также способ лечения реактивного синдрома фактора VII, включающий введение индивиду композиции фактора VII с сахарозой и полиолом. Предложено также применение полипептида фактора VII для получения лекарственного средства, предназначенного для лечения реактивного синдрома фактора VII. Изобретение относится к стабильным композициям полипептида фактора VII, не содержащим продуктов деградации и не проявляющим снижения активности полипептидов фактора VII после хранения в условиях окружающей среды в течение по меньшей мере 6 месяцев. 4 н. и 44 з.п. ф-лы, 9 табл., 4 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к химически и физически стабильным композициям, включающим фактор VII или полипептид, родственный фактору VII, так что в отношении указанных композиций возможны хранение, работа и использование при комнатной температуре.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Фактор VII представляет собой полипептид, участвующий в процессе свертывания крови. В настоящее время фактор VIIа может быть получен по рекомбинантным методикам (rFVIIa) и образованный по такому варианту фактор широко используется как про-гемостатическое средство. Фактор VII (человеческий фактор дикого типа) описан в патенте США No. 4 784 950. Используемый в настоящее время rFVIIa позволяет добиваться быстрого и высокоэффективного про-гемостатического ответа у индивидуумов с гемофилией, имеющих кровотечение. Рекомбинантный фактор VIIa может также с успехом применяться для лечения индивидуумов с гемофилией, которых нельзя лечить другими продуктами, созданными на основе коагулирующих факторов, из-за образования у них антител. Кроме того, указанное средство rFVIIa может с успехом применяться для лечения индивидуумов, страдающих от недостаточности фактора VII, или индивидуумов, имеющих нормальную систему коагуляции, но у которых тем не менее имеется обширное кровотечение.
При разработке лекарственного средства, включающего полипептид, такой как, например, фактор VIIа, должны приниматься во внимание ряд параметров. В качестве примера, следует указать, что такое лекарственное средство должно быть эффективным, безопасным и комфортным для принимающего его пациента. Кроме того, данное лекарственное средство может быть введено в состав композиции, применяемой для парентерального введения с использованием фармацевтически приемлемых наполнителей, которые должны удовлетворять критериям, утвержденным различными медицинскими регламентирующими учреждениями во всем мире. Для целей парентерального введения может быть весьма желательно, чтобы композиция была почти изотонической и чтобы pH такой композиции находился в физиологически приемлемом диапазоне при инъекции/инфузии, в противном случае ее применение может привести к развитию болевых и других дискомфортных ощущений у пациента. Общий обзор белковых композиций содержится, например, в работе Клеланда с соавт. и Ванга с соавт. (Cleland et al.: The development of stable protein formulations: A closer look at protein aggregation, deamidation and oxidation, Critical Reviews in Therapeutic Drug Carrier Systems 1993, 10(4): 307-377; и Wang et al., Parenteral formulations of proteins and peptides: Stability and stabilizers, Journal of Parenteral Science and Technology 1988 (supplement), 42(25)).
Существенно, что для случая лекарственных средств, включающих полипептиды, безопасность может иметь непосредственное отношение к физической и химической стабильности полипептида. Будучи полипептидом, фактор VII или полипептид, родственный фактору VII, чувствителен к физическому разрушению, включая денатурацию и агрегацию, такую как образование растворимых или нерастворимых агрегатов в виде димеров, олигомеров и полимеров, или к химической деградации, включающей, например, гидролиз, дезаминирование и окисление. Впоследствии указанная физическая и химическая нестабильность может приводить к потере активности полипептида фактора VII, образованию токсичных и иммуногенных продуктов деградации, серьезному риску образования и развития тромбоза при инъекции таких разложившихся полипептидов фактора VII, закупорке игл, используемых для инъекции, и к риску негомогенного эффекта, если назвать лишь несколько следствий такой нестабильности.
Таким образом, существенно важно разработать композицию, включающую полипептиды фактора VII, которые были бы стабильны в отношении физического и химического разложения.
К настоящему времени получаемый по рекомбинантным методикам полипептид FVII предлагается в виде лиофилизированного продукта, который хранится при температуре от примерно 2 до примерно 8°С. Потребность в охлаждении создает дополнительную трудность и неудобства как для производителя или поставщика, так и для конечного пользователя (пациента).
Используемым в настоящее время рекомбинантным продуктом фактора VII является препарат НовоСэвен® (NovoSeven®) (Novo Nordisk A/S, Дания), который состоит из 1,2 мг рекомбинантного человеческого фактора VIIа, 5,84 мг NаCl, 2,94 мг CaCl2×2H2O, 2,64 мг глицилглицина, 0,14 мг полисорбата 80 и 60,0 мг маннита. При восстановлении в 2,0 мл воды для инъекций (ВДИ) достигается pH 5,5 и полученный таким образом содержащий FVII раствор характеризуется достаточной стабильностью в течение 24 часов при комнатной температуре.
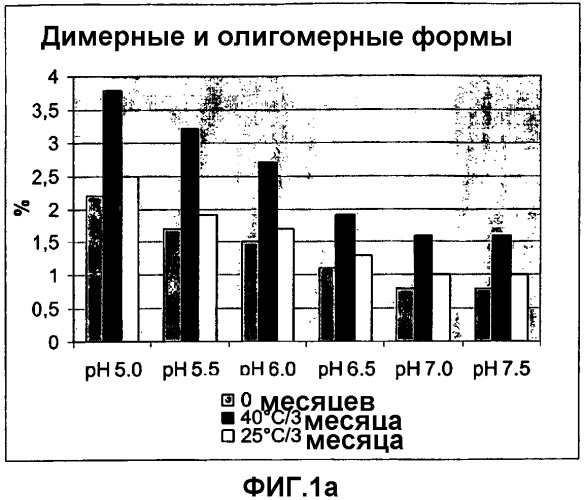
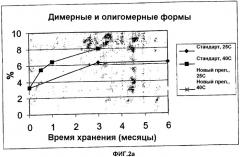
Авторы настоящего изобретения обнаружили, что при хранении лиофилизированного продукта НовоСэвен® в течение 6 месяцев при температуре 25°С примерно от 6 до 7 мас.% от исходного содержания rFVIIa присутствует в виде агрегатов.
Таким образом, композиции, включающие полипептиды фактора VII, должны быть стабилизированы, с тем, чтобы обеспечить возможность их хранения и работы с такими препаратами при температурах окружающей среды. Однако нестабильность полипептида определяется несколькими факторами и невозможно предсказать заранее подходящий способ стабилизации фактора VIIa или полипептида, родственного фактору VII.
Один подход к стабилизации белков относится к удалению воды из белка, например, такой как подход, который связан с получением белка в виде лиофилизированной лепешки в качестве окончательного продукта процесса сушки при замораживании. Однако процесс сушки при замораживании сам по себе также вреден для белков, поскольку во время сушки при замораживании белковый раствор вначале охлаждают до соответствующего уровня и имеющаяся вода в белковом растворе на данной стадии образует лед. В этой связи, белок подвергается стрессу, вызванному замораживанием, который приводит к деформации и осаждению. На следующей стадии, так называемой стадии первичной сушки, лед сублимируется и на второй стадии сушки адсорбированная или связанная вода удаляется при повышенных температурах. В процессе удаления воды белки могут терять свойственную им конформацию, которая обеспечивается главным образом за счет водородных связей.
В этой связи, для сохранения конформации белка, его активности и стабильности в процессе сушки при замораживании к раствору полипептида необходимо внести добавки достаточных количеств соответствующих наполнителей с криопротекторными и/или лиопротекторными свойствами, так чтобы защитить белок от стресса, вызванного замораживанием, и/или от стресса, связанного с удалением воды, соответственно.
Дополнительно, при получении лиофилизированного продукта основное внимание уделяется свойствам лиофилизированной лепешки. Указанная лиофилизированная лепешка должна обладать хорошими свойствами с точки зрения ее формы и структуры, то есть она не должна подвергаться слеживанию, поскольку такие слежавшиеся лепешки будут твердыми или даже не пригодными к растворению (восстановлению) перед использованием. И наоборот, физическая структура лиофилизированной лепешки не должна быть слишком рыхлой и мягкой. В этой связи, к белковому раствору перед проведением сушки замораживанием добавляют один или более так называемых объемных наполнителей.
Ниже приведены другие публикации, относящиеся к стабилизации полипептида:
U.S. 20010031721 A1 (American Home Products) относится в основном к высококонцентрированным, лиофилизированным жидким композициям фактора IX;
WO 97/26909 (Институт генетики) относится к лиофилизированным препаратам фактора IX, пригодным для хранения и введения. Указанные препараты могут включать сахарозу или маннит в качестве криопротектора.
WO 95/28954 (Институт генетики) относится к препаратам фактора IX, пригодным для хранения и введения. Указанные препараты могут включать сахарозу в качестве криопротектора.
Целью настоящего изобретения является создание стабильных композиций полипептида фактора VII, которые по существу не содержат продуктов деградации и не демонстрируют снижения активности полипептидов фактора VII, предпочтительно после увеличенного периода хранения в условиях окружающей среды, например, в течение по меньшей мере 6 месяцев. Кроме того, объектом настоящего изобретения являются стабильные композиции, которые пригодны для парентерального введения, не создавая при этом какого-либо дискомфорта для пациента.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Авторами настоящего изобретения было показано, что полипептиды фактора VII могут быть изготовлены в виде композиции, которая является достаточно стабильной, так что создается возможность хранить ее при комнатной температуре в течение по меньшей мере 8 месяцев. Авторы обнаружили также, что достижение такой стабилизации имеет отношение к соответствующему объединению в составе композиции некоторых фармацевтически приемлемых наполнителей.
Соответственно, настоящее изобретение в первом своем аспекте относится к стабилизированным композициям, которые имеют содержание влаги не более чем примерно 3%, и включают полипептиды фактора VII и по меньшей мере одно средство, способствующее стабильности, выбранное из группы, состоящей из компонентов: а) - е)
а) сочетание антиоксиданта и маннита;
b) сочетание метионина и полиола;
c) сочетание сахарида и маннита;
d) сочетание сахарозы и полиола и
e) метионин.
В другом аспекте настоящее изобретение относится к способу получения стабильного полипептида фактора VII, включающему стадии:
i) Создание указанного полипептида фактора VII в растворе, включающем по меньшей мере одно средство, способствующее стабильности, выбранное из группы, состоящей из компонентов а) - е):
а) сочетание антиоксиданта и маннита;
b) сочетание метионина и полиола;
c) сочетание сахарида и маннита;
d) сочетание сахарозы и полиола и
e) метионин.
ii) Обработка указанного раствора с получением твердой композиции, характеризующейся содержанием влаги не более чем примерено 3 мас.%.
Как указывалось выше, достичь стабилизации полипептидов фактора VII необходимо для минимизации риска развития побочных реакций, а также для повышения безопасности и эффективности процесса введения полипептида фактора VII с терапевтической целью. В этой связи, еще один аспект настоящего изобретения относится к использованию полипептида фактора VII для получения лекарственного средства, предназначенного для лечения фактор VII-реактивного синдрома, причем указанное лекарственное средство содержит композицию, включающую:
полипептид фактора VII и по меньшей мере одно средство, способствующее стабильности, выбранное из группы, состоящей из:
а) сочетания антиоксиданта и маннита;
b) сочетания метионина и полиола;
c) сочетания сахарида и маннита;
d) сочетания сахарозы полиола и
e) метионина,
где указанная композиция характеризуется содержанием влаги не более чем примерно 3%.
И, наконец, настоящее изобретение относится к введению указанных полипептидов фактора VII для лечения фактор VII-реактивного синдрома, включающему введение субъекту, при необходимости, эффективного количества композиции, содержащей полипептид фактора VII и по меньшей мере одно средство, способствующее стабильности, выбранное из группы, состоящей из:
а) сочетания антиоксиданта и маннита;
b) сочетания метионина и полиола;
c) сочетание сахарида и маннита;
d) сочетание сахарозы полиола и
e) метионина,
где указанная композиция характеризуется содержанием влаги не более чем примерно 3%.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к стабильным при хранении композициям, включающим полипептиды фактора VII. Композиции могут храниться при комнатной температуре в течение увеличенных периодов времени без проявления признаков существенной деградации полипептида фактора VII. Под комнатной температурой следует понимать температуру окружающей среды в комнате, в норме указанная температура варьирует от примерно 5°С до примерно 40°С и включает, например, диапазон температур от примерно 10°С до 30°С или от 15°С до 25°С.
Путем предварительного определения соответствующего сочетания конкретных фармацевтически приемлемых носителей авторы настоящего изобретения создали стабилизированные композиции, включающие полипептиды фактора VII, что позволяет хранить такие композиции в условиях комнатной температуры в течение увеличенных периодов времени, по меньшей мере примерно 8 месяцев. Преимуществом изобретения является тот факт, что стабилизированные композиции не нужно хранить в условиях охлаждения, таких как в диапазоне температур от 2 до 8°С.
Настоящее изобретение также относится к стабильным при хранении композициям, которые остаются стабильными в течение по меньшей мере примерно 8 месяцев при хранении в условиях температуры примерно 30°С. Композицию предпочтительно хранят в темноте. Таким образом, настоящее изобретение делает возможным хранение таких композиций при комнатной температуре без повышения риска развития побочных реакций у пациентов после введения таких композиций. Преимуществом является тот факт, что использование композиции с улучшенной стабильностью приводит к снижению стоимости, поскольку не требуется специальных условий охлаждения для хранения, что также сказывается на большем удобстве при работе с композицией в процессе ее использования.
Термин “полипептид фактора VII” в контексте настоящего описания обозначает любой полипептид фактора VII, который эффективен в плане предупреждения или лечения кровотечения. Указанный термин включает полипептиды фактора VII, полученные из крови или плазмы, или изготовленные рекомбинантными методами.
В контексте настоящего описания термин "полипептид фактора VII" включает, без ограничения, фактор VII, а также полипептиды, родственные фактору VII. Термин "фактор VII" в контексте настоящего описания включает, без ограничения, полипептиды, имеющие аминокислотную последовательность 1-406 человеческого фактора VII дикого типа (описанную в патенте США 4 784 905), а также фактора VII дикого типа, полученного из других видов живых организмов, например, из быка, свиньи, собаки, мыши и лосося, при этом указанный фактор VII получают из крови или плазмы или создают рекомбинантными методами. Настоящее изобретение также относится к природным аллельным вариациям фактора VII, которые могут существовать и обнаруживаться у одного или другого индивидуума. Кроме того, степень и локализация гликозилирования или других пост-трансляционных модификаций могут варьировать, в зависимости от выбранных клеток-хозяев и от природы окружения клетки-хозяина. Термин "фактор VII" в контексте настоящего описания относится также к полипептидам фактора VII в их нерасщепленной форме (в форме зимогена), а также к таким полипептидам, которые были обработаны протеолитическими ферментами с образованием соответствующих биоактивных форм, обозначенных как фактор VIIа. В типичном случае фактор VII подвергается расщеплению между остатками 152 и 153 с образованием фактора VIIа.
Как указывалось выше, термин "полипептиды фактора VII" в контексте настоящего описания также обозначает термин "полипептиды, родственные фактору VII". Термин "полипептиды, родственные фактору VII" в контексте настоящего описания обозначает такие полипептиды в их нерасщепленной форме (форме зимогена), а также те полипептиды, которые были получены путем протеолитической обработки с образованием соответствующих биоактивных форм. В контексте настоящего описания термин "полипептиды, родственные фактору VII" включает, без ограничения, полипептиды, демонстрирующие по существу ту же или усиленную биологическую активность относительно человеческого фактора VII дикого типа. Указанные полипептиды включают, без ограничения, фактор VII или фактор VIIа, которые были химически модифицированы, и варианты фактора VII, в которые введены специфические изменения аминокислотной последовательности, которые в некоторой степени модифицируют или улучшают биологическую активность полипептида.
Кроме того, полипептиды, родственные фактору VII, включающие варианты фактора VII, которые проявляют по существу ту же или усиленную биологическую активность, что и фактор VII дикого типа, включают, без ограничений, полипептиды, имеющие аминокислотную последовательность, которая отличается от последовательности фактора VII дикого типа за счет инсерций, делеций или замещений одной или более аминокислот.
Полипептиды, родственные фактору VII, включающие варианты, имеющие по существу ту же или усиленную биологическую активность, что и фактор VII дикого типа, относятся к таким полипептидам, которые демонстрируют по меньшей мере примерно на уровне 25%, предпочтительно по меньшей мере примерно на уровне 50%, более предпочтительно по меньшей мере примерно на уровне 75%, более предпочтительно по меньшей мере примерно на уровне 100%, более предпочтительно по меньшей мере примерно на уровне 110%, более предпочтительно по меньшей мере примерно на уровне 120% и наиболее предпочтительно по меньшей мере примерно на уровне 130% от удельной активности фактора VIIа дикого типа, который был получен в клетках того же типа при исследовании в одном или большем числе тестов, включающих тест на свертываемость, тест на протеолиз или тест на связывание с TФ, как описано в настоящем изобретении.
В некоторых вариантах осуществления настоящего изобретения полипептиды фактора VII представляют собой полипептиды, родственные фактору VII, причем те конкретные варианты, где соотношение между активностью указанного полипептида фактора VII и активностью нативного человеческого фактора VIIа (FVIIa дикого типа) составляет по меньшей мере примерно 1,25 при анализе в тесте на гидролиз in vitro (см. пример 9, приведенный ниже). В других вариантах осуществления настоящего изобретения указанное соотношение составляет по меньшей мере примерно 2,0 и в других вариантах указанное соотношение составляет по меньшей мере примерно 4,0. В некоторых вариантах осуществления настоящего изобретения полипептиды фактора VII представляют собой полипептиды, родственные фактору VII, в частности такие варианты, в которых соотношение между активностью указанного полипептида фактора VII и активностью нативного человеческого фактора VIIа (FVIIa дикого типа) составляет по меньшей мере примерно 1,25 при анализе в тесте на протеолиз in vitro (см. пример 9, приведенный ниже); в других вариантах осуществления настоящего изобретения указанное соотношение составляет по меньшей мере примерно 2,0, а в других вариантах указанное соотношение составляет по меньшей мере примерно 4,0, и в дополнительных вариантах указанное соотношение составляет по меньшей мере примерно 8,0.
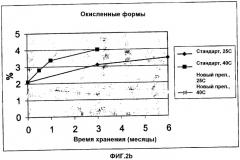
Не ограничивающие примеры вариантов фактора VII, обладающие по существу той же или улучшенной биологической активностью, что и фактор VII дикого типа, включают S52A-FVII, S60A-FVII (Lino et al., Arch.Biochem. Biophys. 352; 182-192, 1998); L305V-FVII, L305V/M306D/D3095-FVII, L305I-FVII, L305T-FVII, F374P-FVII, V158T/M298Q-FVII, V158D/E296V/M298Q-FVII, K337A-FVII, M298Q-FVII, V158D/M298Q-FVII, L305V/К337A-FVII, V158D/E296V/M298Q/L305V-FVII, V158D/E296V/M298Q/K337A-FVII, V158D/E296V/M298Q/L305V/K337A-FVII, K157A-FVII, E296V-FVII, E296V/M298Q-FVII, V158D/E296V-FVII, V158D/M298Q-FVII и S336G-FVII; варианты FVIIа, проявляющие повышенную протеолитическую активность, описанные в патенте США Nо. 5 580 560; фактор VIIа, который был протеолитически расщеплен между остатками 290 и 291 или между остатками 315 и 316 (Mollerup et al., Biotechnol. Bioeng. 48:501-505, 1995); окисленные формы фактора VIIа (Kornfelt et al., Arch. Biochem. Biophys. 363:43-54, 1999); варианты FVII, описанные в PCT/DK02/00189; варианты FVII, демонстрирующие повышенную протеолитическую активность, описанные в WO 02/38162 (Scripps Research Institute); варианты FVII, содержащие модифицированный Gla-домен и демонстрирующие повышенный уровень связывания с мембраной, описанные в WO 99/20767 (Университет Миннесоты); варианты FVII, описанные WO 01/58935 (Maxygen ApS); варианты FVII, обладающие повышенной биологической активностью в сравнении с FVIIа дикого типа, описанные в WO 01/83725, WO 02/22776, WO 02/077218, PCT/DK02/00635, в заявке на патент Дании PA 2002 01423, в заявке на патент Дании PA 2001 01627; в WO 02/38162 (Scripps Research Institute) и варианты FVIIа с повышенной активностью, описанные JP 2001061479 (Chemo-Sero-Therapeutics Res Inst).
Примеры полипептидов фактора VII или полипептидов, родственных фактору VII, включают, без ограничения, фактор VII дикого типа, L305V-FVII, L305V/M306D/D309S-FVII, L305I-FVII, L305T-FVII, F374P-FVII, V158T/M298Q-FVII, V158D/E296V/M298Q-FVII, K337A-FVII, M298Q-FVII, V158D/M298Q-FVII, L305V/K337A-FVII, V158D/E296V/M298Q/L305V-FVII, V158D/E296V/M298Q/K337A-FVII, V158D/E296V/M298Q/L305V/K337A-FVII, K157A-FVII, E296V-FVII, E296V/M298Q-FVII, V158D/E296V-FVII, V158D/M298K-FVII и S336G-FVII, L305V/K337A-FVII, L305V/V158D-FVII, L305V/E296V-FVII, L305V/M298Q-FVII, L305V/V158T-FVII, L305V/K337A/V158T-FVII, L305V/K337A/M298Q-FVII, L305V/K337A/E296V-FVII, L305V/K337A/V158D-FVII, L305V/V158D/M298Q-FVII, L305V/V158D/E296V-FVII, L305V/V158T/M298Q-FVII, L305V/V158T/E296V-FVII, L305V/E296V/M298Q-FVII, L305V/V158D/E296V/M298Q-FVII, L305V/V158T/E296V/M298Q-FVII, L305V/V158T/K337A/M298Q-FVII, L305V/V158T/E296V/K337A-FVII, L305V/V158D/K337A/M298Q-FVII, L305V/V158D/E296V/K337A-FVII, L305V/V158D/E296V/M298Q/K337A-FVII, L305V/V158T/E296V/M298Q/K337A-FVII, S314E/K316H-FVII, S314E/K316Q-FVII, S314E/L305V-FVII, S314E/K337A-FVII, S314E/V158D-FVII, S314E/E296V-FVII, S314E/M298Q-FVII, S314E/V158T-FVII, K316H/L305V-FVII, K316H/K337A-FVII, K316H/V158D-FVII, K316H/E296V-FVII, K316H/M298Q-FVII, K316H/V158T-FVII, K316Q/L305V-FVII, K316Q/K337A-FVII, K316Q/V158D-FVII, K316Q/E296V-FVII, K316Q/M298Q-FVII, K316Q/V158T-FVII, S314E/L305V/K337A-FVII, S314E/L305V/V158D-FVII, S314E/L305V/E296V-FVII, S314E/L305V/M298Q-FVll, S314E/L305V/V158T-FVII, S314E/L305V/K337A/V158T-FVII, S314E/L305V/K337A/M298Q-FVII, S314E/L305V/K337A/E296V-FVII, S314E/L305V/K337A/V158D-FVII, S314E/L305V/V158D/M298Q-FVII, S314E/L305V/V158D/E296V-FVII, S314E/L305V/V158T/M298Q-FVII, S314E/L305V/V158T/E296V-FVII, S314E/L305V/E296V/M298Q-FVII, S314E/L305V/V158D/E296V/M298Q-FVII, S314E/L305V/V158T/E296V/M298Q-FVII, S314E/L305V/V158T/K337A/M298Q-FVII, S314E/L3O5V/V158T/E296V/K337A-FVII, S314E/L3O5V/V158D/K337A/M298Q-FVII, S314E/L305V/V158D/E296V/K337A-FVII, S314E/L305V/V158D/E296V/M298Q/K337A-FVII, S314E/L305V/V158T/E296V/M298Q/K337A-FVII, K316H/L305V/K337A-FVII/K316H/L305V/V158D-FVII, K316H/L305V/E296V-FVII, K316H/L305V/M298Q-FVH, K316H/L305V/V158T-FVII, K316H/L305V/K337A/V158T-FVIl, K316H/L305V/K337A/M298Q-FVII, K316H/L305V/K337A/E296V-FVII, K316H/L305V/K337A/V158D-FVII, K316H/L305V/V158D/M298Q-FVII, 6H/L305V/V158D/E296V-FVII, K316H/L305V/V158T/M298Q-FVII, K316H/L305V/V158T/E296V-FVII, K316H/L305V/E296V/M298Q-FVII, K316H/L305V/V158D/E296V/M298Q-FVII, K316H/L305V/V158T/E296V/M298Q-FVII, K316H/I305V/V158T/K337A/M298Q-FVII, K316H/L305V/V158T/E296V/K337A-FVII, K316H/L305V/V158D/K337A/M298Q-FVII, 6H/L305V/V158D/E296V/K337A -FVII, 6H/L305V/V158D/E296V/M298Q/K337A-FVII, K316H/L305V/V158T/E296V/M298Q/K337A-FVII, K316Q/L305V/K337A-FVII, 6Q/L305V/V158D-FVII, K316Q/L305V/E296V-FVII, K316Q/L305V/M298Q-FVII, K316Q/L305V/V158T-FVII, K316Q/L305V/K337A/V158T-FVII, K316Q/L305V/K337A/M298Q-FVII, K316Q/L305V/K337A/E296V-FVII, K316Q/L305V/K337A/V158D-FVII, K316Q/L305V/V158D/M298Q-FVII, K316Q/L305V/V158D/E296V-FVII, K316Q/L305V/V158T/M298Q-FVII, K316Q/L305V/V158T/E296V-FVII, K316Q/L305V/E296V/M298Q-FVII, K316Q/L305V/V158D/E296V/M298Q-FVII, K316Q/L305V/V158T/E296V/M298Q-FV1I, K316Q/L305V/V158T/K337A/M298Q-FVII, K316Q/L305V/V158T/E296V/K337A-FVII, K316Q/L305V/V158D/K337A/M298Q-FVII, K316Q/L305V/V158D/E296V/K337A-FVII, K316Q/L305VAA158D/E296V/M298Q/K337A-FVII, K316Q/L305V/V158T/E296V/M298Q/K337A-FVII, F374Y/K337A-FVII, F374Y/V158D-FVII, F374Y/E296V-FVII, F374Y/M298Q-FVII, F374Y/V158T-FVII, F374Y/S314E-FVII, F374Y/L305V-FVII, F374Y/L305V/K337A-FVII, F374Y/L305V/V158D-FVII, F374Y/L305V/E296V-FVII, F374Y/L305V/M298Q-FVII, F374Y/L305V/V158T-FVII, F374Y/L305V/S314E-FVII, F374Y/K337A/S314E-FVII, F374Y/K337A/V158T-FVII, F374Y/K337A/M298Q-FVII, F374Y/K337A/E296V-FVII, F374Y/K337A/V158D-FVII, F374Y/V158D/S314E-FVII, F374Y/V158D/M298Q-FVII, F374Y/V158D/E296V-FVII, F374Y/V158T/S314E-FVII, F374Y/V158T/M298Q-FVII, F374Y/V158T/E296V-FVII, F374Y/E296V/S314E-FVII, F374Y/S314E/M298Q-FVII, F374Y/E296V/M298Q-FVI!, F374Y/L305V/K337A/V158D-FVII, F374Y/L305V/K337A/E296V-FVII, F374Y/L305V/K337A/M298Q-FVII, F374Y/L305V/K337A/V158T-FVII, F374Y/L305V/K337A/S314E-Pyil,F374Y/l305V/V158D/E296V-FVII, F374Y/L305V/V158D/M298Q-FVII, F374Y/l305V/V158D/5314E-FVII, 374Y/IJ05V/E296V/M298Q-FVII, F374Y/L305V/E296V/V158T-FVII, F374Y/L305V/E296V/S314E-FVII, F374Y/L305V/M298Q/V158T-FVII, F374Y/L305V/M298Q/S314E-FVII, F374Y/G05V/V158T/S314E-FVII, F374Y/K337A/S314E/V158T-FVII, F374Y/K337A/S314E/M298Q-FVII, F374Y/K337A/S314E/E296V-FVII, F374Y/K337A/S314E/V158D-FVII, F374Y/K337A/V158T/M298Q-FVII, F374Y/K337A/V158T/E296V-FVII, F374Y/K337A/M298Q/E296V-FVII, F374Y/K337A/M298Q/V158D-FVII, F374Y/K337A/E296V/V158D-FVII, F374Y/V158D/S314E/M298Q-FVII, F374Y/V158D/S314E/E296V-FVII, F374Y/V158D/M298Q/E296V-FVII, F374Y/V158T/S314E/E296V-FVII, F374Y/V158T/5314E/M298Q-FVII, F374Y/V158T/M298Q/E296V-FVII, F374Y/E296V/5314E/M298Q-FVII, F374Y/L305V/M298Q/K337A/S314E-FVII, F374Y/L305V/E296V/K337A/S314E-FVII, F374Y/E296V/M298Q/K337A/5314E-FVII, F374Y/L305V/E296V/M298Q/K337A-FVII, F374Y/L305V/E296V/M298Q/S314E-FVII, F374Y/V158D/E296V/M298Q/K337A-FVII, F374Y/V158D/E296V/M298Q/S314E-FVII, F374Y/L305V/V158D/K337A/5314E-FVII, F374Y/V158D/M298Q/K337A/S314E-FVII, F374Y/V158D/E296V/K337A/5314E-FVII, F374Y/L305V/V158D/E296V/M298Q-FVII, F374Y/L305V/V158D/M298Q/K337A-FVII, F374Y/L305V/V158D/E296V/K337A-FVII, F374Y/L305V/V158D/M298Q/S314E-FVII, F374Y/L305V/V158D/E296V/5314E-FVII, F374Y/V158T/E296V/M298Q/K337A-FVII, F374Y/V158T/E296V/M298Q/5314E-FVII, F374Y/L305V/V158T/K337A/5314E-FVII, F374Y/V158T/M298Q/K337A/5314E-FVII, F374Y/V158T/E296V/K337A/S314E-FVII, F374Y/L305V/V158T/E296V/M298Q-FVII, F374Y/L305V/V158T/M298Q/K337A-FVII, F374Y/L305V/V158T/E296V/K337A-FVII, F374Y/L305V/V158T/M298Q/5314E-FVII, F374Y/L305V/V158T/E296V/S314E-FVII, F374Y/E296V/M298Q/K337A/V158T/S314E-FVII, F374Y/V158D/E296V/M298Q/K337A/S314E-FVII, F374Y/L305V/V158D/E296V/M298Q/5314E-FVII, F374Y/L305V/E296V/M298Q/V158T/5314E-FVII, F374Y/L305V/E296V/M298Q/K337A/V158T-FVII, F374Y/L305V/E296V/K337A/V158T/5314E-FVII, F374Y/L305V/M298Q/K337A/V158T/S314E-FVII, F374Y/L305V/V158D/E296V/M298Q/K337A-FVII, F374Y/L305V/V158D/E296V/K337A/S314E-FVII, F374Y/B05V/V158D/M298Q/K337A/S314E-FVII, 374Y/B05V/E296V/M298Q/K337A/V158T/S314E-FVII, F374Y/L305V/V158D/E296V/M298Q/K337A/S314E-FVII, S52A-Фактор VII, S60A-ФакторVII и P11Q/K33E-FVII, T106N-FVII, K143N/N145T-FVII, V253N-FVII, R290N/A292T-FVII, G291N-FVII, R315N/V317T-FVII, K143N/N145T/R315N/V317T-FVII; FVII, имеющий замещения, добавки или делеции аминокислотной последовательности от 233Thr до 240Asn, FVII, имеющий замещения, добавки или делеции в аминокислотной последовательности от 304Arg до 329Cys, а также FVII, имеющий замещения, делеции или добавки аминокислотной последовательности на участке Ile153-Arg223.
Для целей настоящего изобретения биологическая активность полипептидов фактора VII ("биологическая активность фактора VII") может быть количественно определена путем оценки способности препарата ускорять свертывание крови с использованием дефицитной по фактору VII плазмы и тромбопластина, как описано в патенте США Nо. 5 997 864. В данном тесте биологическая активность выражается в виде снижения времени свертывания относительно контрольного образца и переводится в единицы фактора VII при сравнении с объединенной человеческой сывороткой в качестве стандарта, содержащей 1 единицу/мл активности фактора VII. Альтернативно, биологическая активность фактора VII может быть количественно определена посредством
(i) измерения способности фактора VIIа или полипептида, родственного фактору VIIа способствовать образованию активированного фактора Х (фактора Ха) в системе, включающей TФ, погруженный в липидную мембрану, и фактор Х (Persson et al., J. Biol. Chem. 272:19919-19924, 1997);
(ii) определения уровня гидролиза фактора Х в водной системе (тест на протеолиз in vitro, см. пример 12, приведенный ниже);
(iii) определения уровня физического связывания фактора VIIа или полипептида, родственного фактору VIIа с TФ с использованием инструмента, функционирующего на основе поверхностного резонанса плазмонов (Persson, et al., FEBS Letts. 413:3590363, 1997):
(iv) определения уровня гидролиза синтетического субстрата фактора VIIа фактора и/или полипептида, родственного фактору VIIа (тест на гидролиз in vitro, см. пример 12, приведенный ниже); и
(v) определения уровня образования тромбина в TФ-независимой системе in vitro.
Термин "биологическая активность фактора VII" или "активность фактора VII" в контексте настоящего описания обозначает способность образовывать тромбин; данный термин также включает способность образовывать тромбин на поверхности активированных тромбоцитов в отсутствие тканевого фактора.
В примере 12 в данном описании подробно описывается тест, используемый для анализа биологической активности фактора VII.
Кроме того, используемые в данном описании термины имеют описанные ниже значения:
Термин "стабилизация" в контексте настоящего описания относится к минимизации образования агрегатов (нерастворимых и/или растворимых) и/или химической деградации, а также к обеспечению условий поддержания pH и соответствующей конформации белка при хранении или при изготовлении композиции, так что достигается существенное удержание биологической активности и стабильности белка. Кроме того, стабилизация также относится к процессам лиопротекции и криопротекции белка в ходе изготовления композиции в условиях сушки при замораживании.
Термины "структурная стабилизация" или "структурная стабильность" в контексте настоящего описания обозначают способность образовывать лиофилизированный/ую сгусток или лепешку с явно выраженными свойствами и внешней формой, так что указанные сгусток или лепешка не слеживается и легко растворяется перед использованием.
Термин "стабильный при хранении" в контексте настоящего описания обозначает продукт, который стабилизируется при хранении в условиях температуры от 5°С до 40°С и остается, в течение приемлемого периода времени - часто в течение нескольких месяцев, в пределах значений, разрешенных в спецификации на данный продукт.
Термин "физическая стабильность" полипептидов фактора VII относится к образованию нерастворимых и/или растворимых агрегатов в виде димерных, олигомерных или полимерных форм полипептидов фактора VII, а также к любой структурной деформации и денатурации молекулы.
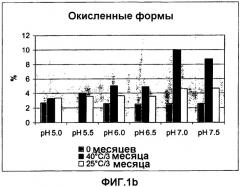
Термин "химическая стабильность" в контексте настоящего описания относится к появлению любых химических изменений в полипептидах фактора VII при хранении, после растворения или в твердом состоянии в условиях ускоренного старения композиции. В качестве соответствующих примеров можно указать на процессы гидролиза, дезамидирования и окисления. В частности, серосодержащие аминокислоты имеют тенденцию к окислению с образованием соответствующих сульфоксидов.
Термин "криопротекторы" в контексте настоящего описания в основном включает средства, которые обеспечивают поддержание стабильности белка в условиях стрессов, вызванных замораживанием. Примеры криопротекторов включают полиолы, такие как маннит, и включают также сахариды, такие как, например, сахароза, а также поверхностно-активные вещества, такие как, например, полисорбат, полоксамер или полиэтиленгликоль, а также другие вещества. Криопротекторы могут также способствовать приданию нужных тонизирующих свойств композиции.
Термин "лиопротекторы" в контексте настоящего описания включает средства, которые придают стабильность белку в процессе удаления воды при лиофилизации. Например, данный результат достигается за счет поддержания соответствующей конформации белка. Примеры лиопротекторов включают сахариды, в частности ди- или трисахариды. Криопротекторы могут также оказывать лиопротекторный эффект.
Фраза "средство, подходящее для поддержания pH в диапазоне значений от 3 до 9°С" относится к тем средствам, которые позволяют поддерживать pH раствора в приемлемом диапазоне значений от 3,0 до 9,0. Типичные примеры средств, способных поддерживать pH в диапазоне значений от 3 до 9, включают кислую форму или соли лимонной кислоты, уксусной кислоты, гистидина, яблочной кислоты, фосфорной кислоты, винной кислоты, янтарной кислоты, MES, HEPES, PIPES, имидазола, TРИС, молочной кислоты, глютаровой кислоты и глицилглицина. Следует понимать, что в настоящем изобретении может использоваться также сочетание средств, если такое сочетание средств пригодно для поддержания pH в указанном диапазоне.
Термин "лиофилизированная лепешка" в контексте настоящего описания обозначает твердую композицию, получаемую при обработке растворенной или по меньшей мере частично растворенной композиции в условиях, включающих по меньшей мере одну стадию охлаждения указанной растворенной/частично растворенной композиции на льду с последующей по меньшей мере одной стадией вакуумной сушки.
Термин "лиофилизация" и "сушка при замораживании" в контексте настоящего описания обозначает процесс, в ходе которого удаляется жидкость из растворенной или по меньшей мере частично растворенной композиции в условиях, включающих введение по меньшей мере одной стадии охлаждения растворенного или по меньшей мере частично растворенного раствора на льду с последующей вакуумной сушкой. Лиофилизация, или сушка при замораживании представляет собой самый обычный процесс, осуществляемый при изготовлении твердых белковых фармацевтических средств. Указанный процесс состоит из двух основных стадий: замораживания белкового раствора и сушки замороженного твердого вещества в вакууме. Стадия сушки также подразделяется на две фазы: первичная и вторичная сушки. Первичная сушка позволяет удалить замороженную воду (сублимирование льда), а вторичная сушка удаляет незамороженную "связанную" воду (десорбция воды). Более подробный анализ каждой из стадий лиофилизации содержится, например, в работе Ванга с соавт. (Wang et al., International Journal of Pharmaceutics 293 (2000): 1-60 (см. раздел 4, страница 16ff)).
В типичном случае композицию подвергают сушке при замораживании путем распределения по флаконам, замораживания на полках в аппарате для лиофильной сушки, после чего создают вакуум и полки нагревают для осуществления первичной сушки (или сублимации льда). Далее, проводят вторичную сушку (или десорбцию сорбированной воды) при повышенной температуре до завершения процесса, то есть до такого состояния, при котором композиция содержит достаточно низкое количество влаги (воды). Способы сушки при замораживании в основном известны в данной области технике (см., например, Wang et al., International Journal of Pharmaceutics 293 (2000): 1-60). Любой практикующий в данной области специалист в состоянии без труда оптимизировать условия сушки при замораживании, в частности, в том, что касается выбора температур, времени обработки при каждой температуре, а также уровня давления, который следует использовать в данном процессе для данной конкретной композиции.
Термин "содержание влаги" в контексте настоящего описания обозначает воду, связанную с данным продуктом, и включает, без ограничения, воду в адсорбированной форме, такую как не замороженная вода, захваченная или адсорбированная на замороженной растворенной фазе и/или объединенная с аморфной фазой или адсорбированная на кристаллическом твердом веществе. Термин "содержание воды" используется взаимозаменяемо с термином "содержание влаги". Желательный уровень остаточной влажности (содержание влаги) представляет собой функцию длительности и температуры на стадии вторичной сушки. В данной области известны несколько способов определения уровня остаточной влаги в процессе лиофилизации, например, может использоваться электронный гигрометр или анализатор остаточного газа. Содержание влаги в лиофильно высушенных композициях может быть определено несколькими известными в технике методами, такими как, например, определение потери веса при сушке, титрование по методу Карла Фишера, тепловой гравиметрический анализ (TГA), газовая хроматография (ГХ) или анализ в инфракрасном спектре (см, например, Wang et al., International Journal of Pharmaceutics 293 (2000): 1-60). Способы определения содержания воды (содержания влаги) также описаны в руководствах по Европейской Фармакопее и Фармакопее США. Например, определение содержания воды может быть осуществлено по методике кулонометрического титрования Карла Фишера, описанной в руководстве по Фармакопее США (USP<921, lc>) или в руководстве по Европейской Фармакопее (EP<2.5.32>).
В общих чертах указанная методика включает следующую процедуру:
Определение содержания воды путем кулонометрического титрования: используют реакцию Карла Фишера в методике кулонометрического определения воды, основанную на количественной реакции воды с двуокисью серы и иодом в безводной среде. Иод образуется электрохимически в реакционной ячейке при окислении иодида. Образуемый на аноде иод вступает сразу же в реакцию с водой и двуокисью серы, содержащимися в реакционной ячейке. Количество воды в веществе прямо пропорционально количеству электричества, необходимого для титрования до конечной точки. После потребления всей воды в ячейке достигается конечная точка и появляется избыток иода, который выявляется электрохимически, что позволяет определить конечную точку. Затем вычисляют процентное содержание воды.
Содержание влаги может быть определено на основании веса образца во флаконе на момент анализа (то есть твердое вещество плюс содержащаяся в нем вода, так называемый сырой вес) или может быть определено в условиях, когда возможна коррекция на количество имеющейся в образце воды (то есть по сухому весу). В случае лиофилизированных продуктов с низким содержанием влаги оба измерения (определение влажного веса и сухого веса) должны давать очень близкие результаты. В контексте настоящего описания содержание влаги определяют в терминах твердое вещество плюс содержащаяся в нем вода (то есть на основе влажного веса).
Термин "объемный наполнитель " в контексте настоящего описания включает средства, которые обеспечивают образование лиофилизированных лепешек с явно выраженными свойствами, на основе которых возможно получить фармацевтический продукт, удовлетворяющий эстетическим требованиям, а также преодолеть различные стрессы, которым подвергается белок, например, сдвиг при перемешивании/замораживании, например, сопряженные с процессом лиофилизации, и которые позволяют сохранять уровень белковой активности в процессе лиофилизации и последующего хранения. Типичные примеры таких наполнителей включают маннит, глицин, сахарозу и лактозу. Указанные средства могут также способствовать поддержанию тоничности композиции.
Термин "модификатор тоничности" в контексте настоящего описания обозначает любое средство, способное корректировать тонус композиции таким образом, что при растворении композиции на момент ее использования получаемая композиция будет иметь тонус в физиологическом диапазоне крови, перитонеальной жидкости или других соответствующих жидкостей организма. Очевидно, что тону