Способ создания восстановителей фертильности ярового рапса (brassica napus l.)
Иллюстрации
Показать всеИзобретение относится к биотехнологии и может быть использовано для получения восстановителей фертильности. Изобретение представляет собой способ создания восстановителей фертильности ярового рапса in vitro. Отбирают донорский материал и проводят предобработку центральных кистей растений ярового рапса со стерильной цитоплазмой и генами восстановления фертильности температурой +4-6°С в течение суток. Вводят в культуру неоплодотворенные семязачатки с бутонов длиной 2-4 мм и культивируют их на питательной среде MS с добавлением 1 мг/л кинетина, 0,2 мг/л НУК и 0,1 мг/л 2,4-Д, осуществляют стабилизацию и микроразмножение гаплоидных линий, диплоидизацию путем добавления 0,005% раствора колхицина в питательную среду. Укорененные растения пересаживают в грунт, где они формируют семена, которые высевают в поле для получения растений-восстановителей фертильности. Изобретение позволяет получить новый исходный материал для гетерозисной селекции на основе ЦМС. 2 ил., 2 табл.
Реферат
Изобретение относится к сельскому хозяйству, в частности, к селекции и может быть использовано в сельскохозяйственной биотехнологии при культивировании неоплодотворенных семязачатков для получения нового исходного гомозиготного материала для гетерозисной селекции.
Известен аналогичный заявленному способ получения восстановителей фертильности ярового рапса, включающий скрещивание стерильной линии с восстановителем фертильности, проведение возвратных скрещиваний в течение 5-7 поколений для создания фертильного аналога стерильной линии, затем самоопыление в течение еще одного поколения для перевода гена восстановления (Rf) в гомозиготное состояние (McVetty P.B.E. Hybrid canola seed production in Western Canada using the POL CMS system / P.B.E McVetty, R. Scarth, S.R.Rimmer; R. Pinnisch // Proc. of the 9th Intern. Rapeseed Congress, Cambridge, UK, 4-7.07.1995 - Vol.1. - P.104-106). Недостатком метода является длительность процесса создания гомозиготных линий (5-7 лет).
Наиболее близким из известных, принятым за прототип, является способ получения гомозиготного материала ярового рапса путем культивирования изолированных пыльников в условиях in vitro, заключающийся в введении эксплантов в культуру, получении гаплоидных растений, их диплоидизации, корнеобразовании и пересадке в грунт (Dunwell J. M., Cornish M., De Courcel A.G.LJ and Middlefell-Williams J.E. Induction and growth of microspore derived embryos of Brassica napus ssp. oleifera // J. Exp.Bot. - 1983. - Vol.34, №12. - P.1768-1778).
Недостатком данного метода является невозможность получения исходного материала ярового рапса для гетерозисной селекции на основе цитоплазматической мужской стерильности (ЦМС), т.к. эксплантом являются пыльники, а у растений с ЦМС пыльца стерильна. В связи с этим сохранение материнской цитоплазмы возможно только с помощью культивирования неоплодотворенных семяпочек in vitro. В ходе проведения патентного поиска авторами не обнаружено аналогичных исследований для ярового рапса.
Задачей изобретения является создание исходного материала для гетерозисной селекции на основе ЦМС.
В гетерозисной селекции основным требованием, предъявляемым к родительским компонентам, является их гомозиготность по большинству генов. Одним из путей получения гомозиготных линий ярового рапса является гаплоидия - явление возникновения особей с гаметическим числом хромосом. С помощью методов биотехнологии гаплоиды получают из репродуктивных клеток при культивировании изолированных пыльников или неоплодотворенных семяпочек на искусственных питательных средах. При этом процесс формирования гомозиготных линий ускоряется по сравнению с традиционными методами селекции в 5-7 раз.
Предлагается способ создания восстановителей фертильности ярового рапса с помощью культивирования неоплодотворенных семяпочек in vitro. Развитие семяпочек идет по пути образования каллуса с формированием на нем ростовых почек с последующим их развитием в растения.
Указанный способ включает в себя следующие операции:
1. Донорским материалом являются гибриды между стерильным образцом и восстановителями фертильности.
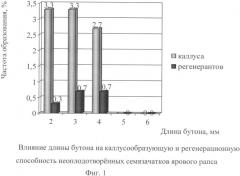
Бутоны предпочтительно брать с центральной кисти, так как по сравнению с побегами первого и второго порядков они обладают максимальной способностью к каллусообразованию (5,7%) и регенерации (1,3%). Для изолирования семязачатков используются бутоны длиной 2-4 мм с центральной кисти основного побега ярового рапса, частота образования каллуса у которых составляет 3,3%, а выход регенерантов достигает 0,7% (фиг.1).
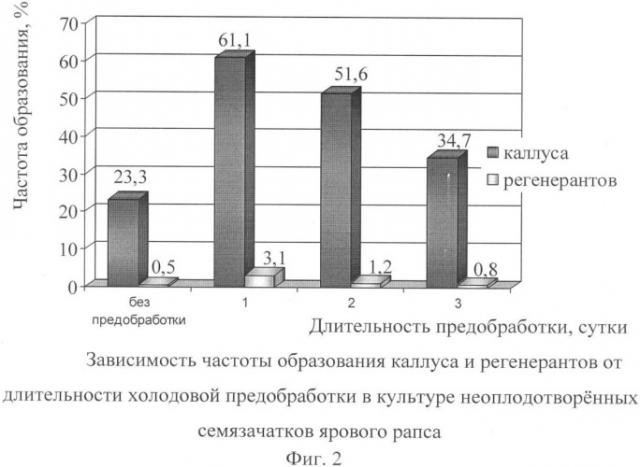
2. Предобработку соцветий донорского материала для увеличения индуцирующей способности неоплодотворенных семязачатков перед стерилизацией следует проводить пониженной температурой +4-6°С в течение суток (фиг.2).
3. Для стерилизации бутонов ярового рапса наряду с 7%-м раствором Domestos используются экологически чистые электроактивированные водные растворы анолит и смесь анолита с католитом (рН=7), ускоряющие развитие неоплодотворенных семяпочек ярового рапса в культуре in vitro (табл.1).
| Таблица 1Эффективность стерилизации бутонов различными дезинфицирующими веществами при введении неоплодотворенных семязачатков ярового рапса в культуру in vitro (2004-2005 г.) | |||||
| Дезинфицирующий раствор | Концентрация раствора, % | Инфицировано семязачатков, % | Получено регенерантов, % | Развитие регенерантов (по 5-бальной шкале) | |
| грибной инфекцией | бактериальной инфекцией | ||||
| Хлорамин | 7 | 9,8 | 21,1 | 0,8 | 3 |
| 10 | 0 | 0 | 2,5 | 3 | |
| Domestos | 5 | 0 | 12,5 | 4,2 | 3 |
| 7 | 0 | 0 | 8,0 | 5 | |
| 10 | 0 | 0 | 5,1 | 4 | |
| Анолит | рН=6 | 0 | 0 | 12,7 | 5 |
| Анолит+католит | рН=7 | 0 | 0 | 21,0 | 5 |
| рН=9 | 0 | 0 | 14,5 | 5 |
4. Культивирование неоплодотворенных семязачатков осуществляется на питательной среде MS, содержащей 1 мг/л кинетина, 0,2 мг/л НУК и 0,1 мг/л 2,4-Д при 16-часовом фотопериоде и освещенности 5 тыс. люкс. Образовавшиеся на каллусе ростовые почки переносятся на безгормональную среду, на которой происходит регенерация гаплоидных проростков.
5. Стабилизация гаплоидов осуществляется одновременно с микроразмножением и проводится в течение 3-4 пассажей с чередованием ростовой (ГК, кинетин, 6-БАП по 0,2 мг/л) - безгормональной - ростовой сред для нормально развитых регенерантов, и безгормональной - ростовой - безгормональной для слабо развитых регенерантов.
6. Диплоидизация гаплоидного материала осуществляется путем добавления в питательную среду 0,005% колхицина и выдержке на ней эксплантов в течение 48 часов. Стабилизация колхицинированных растений ведется при последующем культивировании на питательной среде, содержащей 0,25 мг/л кинетина, в течение месяца.
8. Формирование корней осуществляется при культивировании микроклонов на среде с 1 мг/л НУК. Затем следует пересадить растения в грунт, где они формируют семена.
9. Семена полученных линий высеваются в поле и собранной с них пыльцой проводится опыление форм с ЦМС для анализа способности восстанавливать фертильность.
В результате применения метода культуры неоплодотворенных семязачатков получены линии, донорские растения которых имели стерильную цитоплазму типа Polima и гены восстановления фертильности. В условиях теплицы и поля полученные растения цвели и после опыления их пыльцой формы, обладающей ЦМС, завязались семена.
10. Семена полученных растений высеваются в поле и проводится анализ фертильности пыльцевых зерен.
Полученные семена были высеяны в теплице, и у растений в период цветения проведен анализ фертильности, позволивший выявить 87,3-94,5% фертильных пыльцевых зерен (табл.2).
Установлено, что фертильность донорского растения №8 повысилась в результате индуцирования гаплоидии в культуре неоплодотворенных семязачатков in vitro с 78,7% до 94,5%, что свидетельствует о том, что линия РЛ 8 может быть использована в качестве восстановителя фертильности в гетерозисной селекции ярового рапса.
| Таблица 2Фертильность пыльцевых зерен линий, полученных в культуре неоплодотворенных семязачатков | |||
| № растения | Просмотрено | ||
| Всего, шт. | фертильных пыльцевых зерен | ||
| шт. | % | ||
| Контроль | 2357 | 1854 | 78,7 |
| РЛ 8/1 | 643 | 575 | 89,4 |
| РЛ 8/2 | 754 | 658 | 87,3 |
| РЛ 8/3 | 689 | 651 | 94,5 |
| РЛ 8/4 | 725 | 668 | 92,1 |
| РЛ - реституционная линия, полученная в культуре неоплодотворенных семязачатков | НСР05=0,15 |
Разработанный способ получения восстановителей фертильности в течение 1-1,5 лет может обеспечить получение необходимого объема растений ярового рапса для включения в селекционный процесс.
Данный подход к получению восстановителей фертильности возможен и для других видов культурных растений, у которых семеноводство гетерозисных гибридов осуществляется на основе ЦМС.
Способ создания восстановителей фертильности ярового рапса in vitro, включающий введение эксплантов в культуру, получение гаплоидных растений, их диплоидизацию, корнеобразование и пересадку в грунт, отличающийся тем, что проводят предобработку центральных кистей растений со стерильной цитоплазмой и генами восстановления фертильности температурой 4-6°С в течение суток, вводят в культуру неоплодотворенные семязачатки с бутонов длиной 2-4 мм, культивируют на питательной среде MS с добавлением 1 мг/л кинетина, 0,2 мг/л НУК и 0,1 мг/л 2,4-Д, осуществляют стабилизацию и микроразмножение гаплоидных линий, диплоидизацию путем добавления 0,005% раствора колхицина в питательную среду; укорененные растения пересаживают в грунт, где они формируют семена, которые высевают в поле для получения растений-восстановителей фертильности.