Способ получения и индукции направленной дифференцировки культуры мультипотентных клеток сердца для клеточной терапии и/или тканевой инженерии в зоне ишемии миокарда
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, в частности к клеточной и тканевой инженерии, и может быть использовано в медицине и ветеринарии. Предложен новый источник аутологичных стволовых клеток сердца (СКС) - ткань удаляемой хирургическим путем аневризмы сердца и разработан способ выделения и культивирования СКС из этого источника, а также способ индукции дифференцировки этих клеток в направлении образования кардиомиоцитов, эндотелиальных, гладкомышечных и нейральных клеток. Получаемые согласно изобретению культуры СКС могут быть использованы в клинике для регенерации поражений миокарда у определенной категории больных. 3 з.п. ф-лы, 1 табл., 6 ил.
Реферат
Настоящее изобретение относится к области биотехнологии, в частности к клеточной и тканевой инженерии, и может быть использовано в медицине и ветеринарии при разработке клинического метода восстановления ткани миокарда. Предлагается способ получения культуры мультипотентных клеток, заключающийся в выделении и культивировании мультипотентных клеток из ткани аневризмы, которые могут быть затем индуцированы in vitro к дифференцировке в направлении образования кардиомиоцитов, эндотелиальных, гладкомышечных и нейральных клеток с целью последующего использования для клеточной терапии и/или тканевой инженерии зоне ишемии миокарда.
Сердечно-сосудистые заболевания продолжают лидировать в списке по количеству смертельных исходов во всех промышленно развитых странах. Сердечная недостаточность, вызываемая ишемической болезнью сердца (ИБС) или кардиомиопатиями, является одним из самых тяжелых заболеваний с плохим прогнозом. Наиболее часто сердечная недостаточность возникает в результате острого инфаркта миокарда. При инфаркте миокарда происходят процессы воспаления, некротической и апоптотической гибели кардиомиоцитов, гиперплазии и ремоделирования как пораженного, так и здорового участка миокарда. До недавнего времени считалось, что кардиомиоциты взрослых млекопитающих не обладают способностью к самообновлению, и замещение дефекта сердечной мышцы происходит без их участия, в основном за счет пролиферации клеток стромы (фибробластов).
Однако в последние годы появляется все больше свидетельств тому, что сердце не является терминально дифференцированным органом и обладает определенным регенеративным потенциалом, благодаря наличию в сердечной ткани пула незрелых кардиомиоцитов, получивших название стволовых клеток сердца (СКС) (Beltrami et al., 2001; Beltrami et al., 2003; Torella et al., 2004). Эти данные важны не только в плане дальнейшего исследования механизмов регенерации ткани миокарда, но и с точки зрения открывающихся возможностей в области клеточной терапии, связанных с использованием нового источника аутологичных клеток для регенерации ткани в зоне ишемии.
Уровень техники.
В 2001 году Пьеро Анверза и соавт. (Beltrami et al., 2001), исследуя постмортальные срезы миокарда человека, впервые обнаружили присутствие в сердечной ткани пролиферирующих миоцитов. Позднее было показано, что в сердце присутствует популяция резидентных стволовых клеток (СКС), которые являются мультипотентными и проявляют способность к самообновлению и пролиферации. Для СКС характерна экспрессия поверхностного маркера стволовых клеток c-kit (c-kit - рецептор фактора стволовых клеток SCF), а также белка-транспортера MDR-1 (multiple drug resistance protein 1); они не экспрессируют маркеров гематопоэтических клеток CD34 и CD45 (Lin-), эндотелиальных клеток CD31 и плохо формируют гематопоэтические колонии при культивировании in vitro (Anversa et al., 2003). СКС локализуются среди кардиомиоцитов в так называемых «нишах» (Anversa et al., 2006; Beltrami et al., 2003). «Ниши» с СКС анатомически располагаются в хорошо защищенных зонах миокарда, в наименьшей степени подверженных гемодинамическим нагрузкам (верхушка желудочка и предсердия). Пролиферация СКС в «нише» находится под контролем факторов роста и цитокинов. При стимуляции пролиферации СКС, например, при инфаркте миокарда или при аортальном стенозе (Urbanek et al., 2003; Urbanek et al., 2005), в результате ассиметричного деления образуется две клетки. Одна из этих двух клеток - собственно новая СКС остается связанной со своим микроокружением в «нише», а другая становится сначала прогениторной клеткой, а затем коммитированным предшественником. Прогениторные клетки экспрессируют маркеры СКС (c-kit, Lin-, MDR-1 у человека или Sca-1 у мыши) и транскрипционные факторы кардиомиоцитарного (GATA-4, Nkx-2.5, MEF2C), гладкомышечного (GATA-6) или эндотелиального (Ets1, Erg1) направления дифференцировки, но еще не экспрессируют характерных для специализированных клеток цитоплазматических белков. Клетки-предшественники экспрессируют специфические для определенного типа клеток цитоплазматические белки (для кардиомиоцитов - нестин, десмин, тяжелые цепи миозина, α-саркомерный актин, коннексин 43, тропонин I и др.; для эндотелиальных клеток - CD31, фактор вон Виллебранда, flk1; для гладкомышечных клеток - TGF-β1 рецептор, flk1, α-гладкомышечный актин) и постепенно теряют экспрессию маркеров СКС (Leri et al., 2007).
Недавно в работах, проведенных на животных моделях с экспериментальной индукцией инфаркта миокарда, были получены прямые доказательства того, что СКС способны мигрировать в зону инфаркта, участвовать в регенерации ткани миокарда и улучшать функцию сердца, причем значительно эффективней, чем использовавшиеся в качестве контроля фибробласты (Messina et al., 2004; Smith et al., 2007; Leri et al., 2007). Позитивный эффект, который наблюдается при введении СКС, обусловлен целым рядом причин. Во-первых, на моделях in vivo и in vitro было показано, что СКС способны дифференцироваться во все основные типы клеток, присутствующих в сердце (эндотелиальные, гладкомышечные клетки и фибробласты), и формировать ткань миокарда со всеми необходимыми элементами стромы и сосудов. Во-вторых, СКС способны сливаться с существующими кардиомиоцитами хозяина, что повышает выживаемость и пролиферацию кардиомиоцитов в условиях ишемии. В-третьих, СКС оказывают паракринный эффект, секретируя факторы, способствующие выживанию кардиомиоцитов и ангиогенезу в зоне ишемии (Lyngbaek et al., 2007). С учетом указанных позитивных особенностей, а также в силу выраженной в большей степени, чем у других стволовых клеток, способности к кардиомиоцитарной дифференцировке резидентные стволовые клетки сердца потенциально представляют собой один из самых перспективных типов клеток для клеточной терапии при ишемической болезни сердца и кардиомиопатиях различного происхождения.
В ряде работ, которые могут рассматриваться в качестве аналогов настоящего изобретения, описано выделение СКС, получение на их основе первичных культур и кардиогенная индукция культивированных клеток in vitro (Smith et al., 2007; Bearzi et al., 2007). Однако перспективы клинического применения этих культур существенно ограничены в связи с тем, что в качестве источника для получения СКС используется биопсийный материал.
При создании настоящего изобретения была найдена возможность преодоления указанного недостатка, которая заключалась в том, что для выделения СКС впервые была использована ткань постинфарктной аневризмы сердца, подлежащей удалению хирургическим путем.
Таким образом, настоящее изобретение представляет собой разработку, в которой предпринята попытка выделения СКС из аневризмы сердца человека, их культивирования и индукции дифференцировки в направлениях, значимых для регенерации пораженных участков миокарда.
Раскрытие изобретения
Предложен новый источник аутологичных стволовых клеток, которые в дальнейшем могут быть использованы в клинике для регенерации поражений миокарда у определенной категории больных - ткань удаляемой хирургическим путем аневризмы сердца. Разработан способ выделения СКС из различных участков (из мышечной и жировой части) и всей ткани аневризмы сердца человека и культивирования этих клеток в условиях in vitro, а также условия для индукции их дифференцировки в кардиомиоцитарном, эндотелиальном, гладкомышечном и нейральном направлении.
Обширный инфаркт миокарда часто приводит к формированию аневризмы сердца, которая представляет собой выпячивание истонченного участка, чаще всего левого желудочка. По структуре и организации аневризма представляет собой ригидную фиброзную ткань с вкраплениями миокарда (мышечная часть аневризмы), вокруг которой может формироваться жировая ткань. Иногда аневризма имеет слоистую структуру, где слои фиброзной ткани перемежаются слоями миокарда.
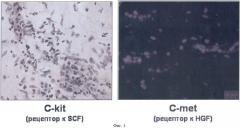
В процессе создания изобретения срезы ткани аневризмы были проанализированы методом иммуногистохимического и иммунофлуоресцентного окрашивания с использованием антител, выявляющих собственно СКС и клетки-предшественники. Всего было проанализировано 10 аневризм, содержащих фиброзную, мышечную и жировую ткань. При этом было установлено, что как в мышечной, так и в жировой ткани аневризмы содержатся клетки, экспрессирующие маркеры СКС, такие как c-kit и c-met (Пример 1), однако преимущественно они обнаруживаются в тех участках, где сохранилась мышечная ткань (фиг.1).
Для проверки возможности получения и культивирования этих клеток была разработана методика их выделения из ткани аневризмы (Пример 2) и найдены оптимальные условия для поддержания их в культуре. В результате культивирования была получена культура клеток, содержащая c-kit+ клетки и клетки-предшественники, в которой экспрессия c-kit сохранялась как минимум на первых 2-х пассажах (фиг.3).
Поскольку содержание c-kit+ клеток в клеточной популяции, выделяемой из аневризмы, исходно составляло менее 1%, была предпринята попытка обогатить исходную клеточную популяцию c-kit+ клетками с помощью метода непрямого иммуно-магнитного сортинга (Пример 4). В результате содержание c-kit+ клеток в культуре удалось увеличить до 20% (фиг.4).
Путем переноса культуры, обогащенной c-kit+ клетками, в различные среды для индукции того или иного вида дифференцировки (Пример 5, табл.1), были получены культуры с явным преобладанием типа клеток, определяемого составом используемой дифференцировочной среды, а именно клеток эндотелиального, кардиомиоцитарного и нейронального направления дифференцировки. Свидетельством эндотелиальной дифференцировки являлось присутствие в культуре клеток, экспрессирующих маркер эндотелиальных клеток-предшественников - CD105 и/или маркер зрелых эндотелиальных клеток - CD31 (фиг.5). Индукцию кардиомиогенеза в культуре детектировали по присутствию клеток, экспрессирующих маркеры ранней кардиогенной дифференцировки GATA-4 и Nkx-2.5, а также по наличию клеток, экспрессирующих структурные белки зрелых кардиомиоцитов: тропонин I, легкую цепь-1 миозина сердца, коннексин 43 и α-aктинин (фиг.5). При индукции дифференцировки в нейрональном направлении выявлялись клетки, по морфологии напоминающие нейральные (фиг.6), которые при окрашивании антителами к различным маркером нервных клеток демонстрировали экспрессию маркера нейральной дифференцировки βIII тубулина и не экспрессировали маркер глиальных клеток GFAP.
При выделении клеток из ткани аневризмы в исходной культуре присутствовали гладкомышечные клетки, которые экспрессировали гладкомышечный α-актин; гладкомышечные клетки также обнаруживались в культуре при индукции эндотелиального направления дифференцировки (фиг.6).
Таким образом, объектом настоящего изобретения является способ получения и индукции направленной дифференцировки культуры мультипотентных клеток, предусматривающий выделение популяции клеток из ткани аневризмы сердца, обработку клеток методом непрямого иммуно-магнитного сортинга с отделением фракции, обогащенной с-kit-позитивными клетками, культивирование полученной фракции клеток в стандартной питательной среде для клеток млекопитающих без добавления специфических факторов роста в течение примерно 9-10 дней и индукцию дифференцировки клеток культуры в эндотелиальном, кардиомиоцитарном или нейральном направлении путем помещения их в соответствующую дифференцировочную среду, составом которой определяется желаемое направление дифференцировки.
Предлагаемое изобретение основано на установленном заявителями факте присутствия стволовых клеток сердца в ткани аневризмы, которые демонстрируют способность пролиферировать в культуре и при определенных условиях дифференцироваться в кардиомиоциты, эндотелиальные, гладкомышечные и нейральные клетки. Поскольку все названные типы клеток в норме присутствуют в миокарде, получаемые при осуществлении изобретения индуцированные культуры мультипотентных клеток представляются одним из наиболее перспективных средств для клеточной терапии, проводимой с целью регенерации повреждений сердечной ткани. При этом явным преимуществом предлагаемого метода (техническим результатом) является отказ от получения биопсийного материала и использование в качестве источника выделения СКС иссекаемой при операции ткани аневризмы.
Краткое описание чертежей
Фиг.1. Иммуногистохимическое (на наличие маркера c-kit) и иммунофлуоресцентное (на наличие маркера c-met) выявление клеток, экспрессирующих маркеры, характерные для стволовых клеток сердца, на криосрезах ткани мышечной части аневризмы сердца человека.
Фиг.2. Иммуногистохимическое выявление экспрессии маркеров стволовых клеток сердца (с-kit) и зрелых эндотелиальных клеток (CD31) на криосрезах ткани аневризмы сердца человека. С-kit-позитивные клетки располагаются в ткани либо в виде отдельных клеток (В), либо характерными кластерами (Г). На последовательных срезах ткани аневризмы наблюдается локализация c-kit+ клеток в основном вблизи крупных сосудов (А, Б).
Фиг.3. Иммунофлуоресцентное выявление экспрессии маркеров стволовых клеток сердца (с-kit) и мезенхимальных клеток-предшественников (CD105, SDF-1, виментин) в клетках из ткани аневризмы, культивированных в условиях in vitro. Обнаружение CD105 - маркера, SDF-1 и виментина свидетельствует о присутствии в культуре клеток-предшественников мезенхимального происхождения.
Фиг.4. Обогащение популяции клеток, выделяемых из ткани аневризмы сердца, с-kit-позитивными клетками методом иммуно-магнитного сортинга. 1 - прижизненное изображение культуры клеток после иммуно-магнитного сортинга (на фотографии видны бусины, покрытые антителами к с-kit). 2 - увеличение содержания с-kit-позитивных клеток в культуре (от 1 до 20%).
Фиг.5. Индукция эндотелиальной и кардиомиоцитарной дифференцировки в культуре клеток после иммуно-магнитного сортинга, определяемая методом иммунофлуоресцентного окрашивания. После культивирования с-kit+ обогащенной культуры клеток на среде для дифференцировки в эндотелиальном направлении выявлялось присутствие эндотелиальных клеток-предшественников (маркер CD105) и зрелых эндотелиальных клеток (маркер CD31), а на среде для дифференцировки в кардиомиoцитарном направлении - клеток-предшественников кардиомиоцитов (транскрипционный фактор Nkx - 2,5) и зрелых кардиомиоцитов (структурный белок тропонин I).
Фиг.6. Индукция нейральной и гладкомышечной дифференцировки в культуре клеток после иммуно-магнитного сортинга, определяемая методом иммунофлуоресцентного окрашивания. После культивирования с-kit+ обогащенной культуры клеток на среде для нейральной дифференцировки выявлялось присутствие клеток, экспрессирующих маркер нейральной дифференцировки βIII тубулин; на среде для эндотелиальной дифференцировки, помимо эндотелиальных клеток-предшественников и зрелых эндотелиальных клеток (см. фиг.5), выявлялись клетки, экспрессирующие гладкомышечный альфа-актин.
Осуществление изобретения.
При осуществлении изобретения, помимо методов, подробно раскрытых в нижеследующих примерах, были использованы хорошо известные специалистам способы и средства, описанные в методических руководствах, а также в цитированных в описании источниках.
Пример 1. Получение срезов ткани аневризмы и их анализ с помощью иммуногистохимического и иммунофлуоресцентного окрашивания.
Для выявления клеток-предшественников в ткани аневризмы использовали жировую и мышечную части аневризмы, включая все слои и структуры. Образец ткани помещали в среду для замораживания Tissue-Tek (О.С.Т.™ Compound 4583), замораживали в парах жидкого азота и использовали для изготовления тонких криосрезов толщиной 6 микрон на криотоме (Microm HM 505E). Срезы помещали на чистые стекла для замороженных срезов (Superfrost, Fisher Scientific 12-550-143) и хранили при -20°С.
Стекла со срезами постепенно размораживали при комнатной температуре, затем промывали теплым фосфатно-солевым буфером (ФСБ: 137 мМ NaCl, 2.7 мМ KCl, 4.3 мМ Na2HPO4·2H2O, 1.4 мМ KH2PO4), фиксировали в 4% формалине на ФСБ в течение 15 мин и отмывали в ФСБ 3 раза по 10 мин. Для инактивации эндогенной пероксидазы стекла со срезами помещали в 3% раствор перекиси водорода на 30 минут, далее отмывали в ФСБ 2 раза по 10 мин. Для предотвращения неспецифического связывания антител срезы ткани инкубировали в 10% растворе нормальной сыворотки донора вторых антител на 1% БСА (бычий сывороточный альбумин) в ФСБ в течение 40 мин. После этого наносили первые антитела. В качестве первых антител использовались следующие препараты: с-kit (Miltenyi Biotec), CD31 (PECAM-1) (mouse antirat, Pharmingen 22711D), c-met (mouse, Zymed, 71-8000), тропонин I (mouse, Chemicon, MAB3438), α-aктин (mouse, DAKO, M0851), α-актинин (mouse, Sigma, A-7811), разведенные на 1% растворе БСА в ФСБ до концентрации, рекомендованной производителем, и инкубировали во влажной камере в течение 1 часа при комнатной температуре. Затем срезы отмывали от первых антител в ФСБ 3 раза по 10 мин и наносили вторые биотинилированные антитела (mouse IgG, Vectastain, Vector) на 14 мин в разведении, рекомендованном производителем. По окончании реакции стекла со срезами отмывали в ФСБ 2 раза по 5 мин и наносили пероксидазный ABС-комплекс (ABC kit, Vector, PK-6102) в разведении 1:50 (µ1) на 5-10 мин. Затем стекла со срезами отмывали в ФСБ 2 раза по 5 мин и проявляли окраску с использованием субстрата DAB (Sigma, D-4168), при этом время проявления контролировали под микроскопом. Реакцию останавливали в дистиллированной воде и докрашивали ядра гематоксилином в течение 15 мин, дифференцируя окраску в проточной воде. Далее, используя стандартную гистологическую проводку, стекла со срезами проводили по спиртам до толуола и заключали в канадский бальзам.
Для иммунофлуоресцентного окрашивания стекла со срезами обрабатывали методом, описанным в Примере 3 для культивированных клеток. Препараты анализировали при помощи микроскопа Axiovert 200M (Zeiss). Документирование изображений производили с помощью цифровой видеокамеры Axiocam НRС (Zeiss, Германия) с использование программ Axiovision 3.1 и Axiovision 4.6 (Zeiss).
В результате анализа полученных срезов ткани было установлено, что клетки, экспрессирующие маркеры стволовых клеток, присутствуют как в мышечной (фиг.1), так и в жировой части аневризмы (фиг.2В и Г). При этом с-kit-позитивные клетки располагаются в ткани аневризмы либо в виде отдельных клеток (фиг.2В), либо характерными кластерами, напоминающими описанные выше «ниши» (фиг.2Г). Иммуногистохимическое окрашивание последовательных срезов ткани аневризмы показало, что c-kit+ клетки часто локализуются вблизи сосудов (фиг.2А и Б), однако эти клетки не являются циркулирующими в крови предшественниками, так как не обнаруживаются в просвете сосудов (фиг.2А и Б).
Пример 2. Получение популяции клеток из ткани аневризмы.
Выделение клеток из полученного в результате операции материала осуществляли в стерильных условиях ламинарного бокса. Ткань аневризмы разделяли на жировую и мышечную части, каждую часть отдельно измельчали сосудистыми ножницами до консистенции суспензии мелких кусочков (размером не более нескольких кубических миллиметров) и смешивали с растворами ферментов коллагеназы I типа (200 ед./мл, Worthington Biochemical, США) и диспазы (40 ед./мл Invitrogen Corporation, Германия) при соотношении объема ткани (в мл) к объему ферментативного раствора (в мл) 1:2. Образец инкубировали при 37°С в течение 30 мин для жировой ткани и 50 мин для мышечной части аневризмы при постоянном покачивании; по окончании инкубации к образцу добавляли равный объем среды DMEM (Gibco)/10% фетальная сыворотка быка (HyClone) и центрифугировали при 600 оборотах в течение 5 мин. Осадок ресуспендировали в среде DMEM/10% фетальная сыворотка быка или MyeloCult (Stemcell, #M5300)/100 Ед/мл пенициллин/10 мкг/мл стрептомицин (GIBCO BRL), высаживали клетки на чашки Петри (Corning) диаметром 60 мм и культивировали в
СО2-инкубаторе (5% СО2; 95% воздуха) при 37°С. Смену среды проводили каждые 2-3 дня; при достижении монослоя клетки пассировали с использованием 0,25% раствора трипсин/ЭДТА. Было проведено 7 пассажей. Клетки анализировали методом имммунофлуоресцентного окрашивания на 2, 3, 4 и 5 пассажах.
Пример 3. Иммунофлуоресцентный анализ клеток в процессе культивирования.
Клетки на стеклах промывали теплым фосфатно-солевым буфером (ФСБ: 137 мМ NaCl, 2.7 мМ KCl, 4.3 мМ Na2HPO4·2H2O, 1.4 мМ KH2PO4), фиксировали в 4% формалине на ФСБ в течение 15 мин и отмывали в ФСБ 3 раза по 10 мин. Для предотвращения неспецифического связывания стекла с клетками инкубировали в 10% растворе нормальной сыворотки донора вторых антител на 1% БСА (бычий сывороточный альбумин) в ФСБ в течение 40 мин. После этого наносили первые антитела, разведенные 1% БСА до концентрации, рекомендованной производителем, и инкубировали во влажной камере в течение 1 часа при комнатной температуре. Клетки отмывали от первых антител в ФСБ 3 раза по 10 мин и наносили вторые антитела, меченные флуорохромом; инкубировали в течение 40-50 мин, отмывали в ФСБ 3 раза по 10 мин и докрашивали ядра DAPI (Molecular Probes, США) в концентрации 1 мкл/1 мл ФСБ в течение 20 минут. Затем стекла промывали 3 раза по 10 минут в ФСБ и заключали в водорастворимой специализированной среде для заключения иммунофлуоресцентных препаратов (Polysciences, Inc США). В качестве первых антител использовались следующие препараты: с-kit (Miltenyi Biotec), CD31 (PECAM-1) (mouse antirat, Pharmingen 22711D), c-met (mouse, Zymed, 71-8000), SDF-1 (mouse, R@D, МАВ350), CD34 (mouse, BD, 550390), виметин (mouse Sigma, V-6630), GATA-4 (rabbit, Santa Cruz, 1404), Nkx2,5(rabbit, Santa Cruz, sc-14033), тропонин I (mouse, Chemicon, MAB3438), легкая цепь-1 миозина сердца (mouse, Abcam, ab680), коннексин 43 (mouse, Zymed, 40587905), α-aктин (mouse, DAKO, M0851), α-aктинин (mouse, Sigma, A-7811), βIII тубулин (Chemicon, MAB1637), GFAP (Chemicon, MAB360); в качестве вторых антител использовали флуоресцентно меченные антитела осла против кролика (donkey antirabbit Alexa 488, Molecular Probes, A-21207) и антитела осла против мыши (donkey antimouse Alexa 594, Molecular Probes, A-21203). Для визуализации ядер клетки докрашивали флуоресцентым красителем DAPI (4′,6-diamidino-20phenyl-indole, dihydrochloride, Molecular Probes, 28В2-6). Препараты анализировали при помощи флуоресцентного микроскопа Axiovert 200M (Zeiss). Флуоресцентный анализ изображений производили с использованием микроскопа Axiovert 200M (Zeiss), цифровой видеокамеры Axiocam НRС (Zeiss, Германия) и обработки изображения в программе Axiovision 3.1 и Axiovision 4.6.
Иммунофлуоресцентный анализ культур подтвердил наличие стволовых клеток в ткани обеих (мышечной и жировой) частях аневризмы (фиг.3). Полученные при количественной оценке клеточного состава данные показали, что в популяции клеток, выделяемых как из мышечной, так и из жировой части аневризмы, количество с-kit-позитивных клеток составляет не более 1%, в связи с чем была поставлена задача повышения их содержания в исходной популяции клеток.
Для обогащения культуры клеток, выделяемых из аневризмы, с-kit-позитивными клетками использовали суммарную популяцию клеток из всей ткани (мышечной + жировой части) аневризмы, которую подвергли иммуно-магнитному сортингу.
Пример 4. Иммуномагнитный сортинг клеток.
Общую популяцию клеток, выделенных из ткани аневризмы, разделили методом непрямого иммуно-магнитного сортинга на две фракции: c-kit-позитивные клетки и c-kit-негативные клетки. Для иммуно-магнитного сортинга использовали магнитные частицы (бусины) размером 4,5 микрон, коньюгированные с антителами против Fc-фрагмента мышиных IgG (CELLection PanMouse IgG, №115.31, Dynal Biotech). Бусины сначала отмывали от азида натрия, а затем инкубировали с мышиными моноклональными антителами против человеческого антигена c-kit (CD117) на льду в течение 30-40 минут при покачивании. После этого бусины отмывали от не связавшихся антител и добавляли к суспензии клеток из расчета 4 бусины на клетку. Клетки инкубировали с бусинами в течение 30-40 мин на льду при покачивании, после чего смесь клеток и бусин помещали в магнит (Dynal Biotech) на 1-2 мин и разделяли на две фракции: клетки, не связавшиеся с иммуно-магнитными бусинами, оставались в растворе, а клетки, связавшиеся с бусинами, вместе с бусинами иммобилизовались на стенке пробирки. Содержание c-kit+ клеток в культуре удалось увеличить до 20% (фиг.4). Все клетки высаживали на стерильные покровные стекла в чашки Петри (Corning) в среду DMEM/10% FSB/100 Ед/мл пенициллин/10 мкг/мл стрептомицин (GIBCO BRL). Через двое суток среду сменяли, а еще через неделю клетки переводили на дифференцировочные среды.
Пример 5. Индукция дифференцировки.
Для индукции дифференцировки клетки переводили на культивирование в одной из дифференцировочных сред, приведенных в таблице. Среды для культивирования готовили непосредственно перед использованием; смену среды проводили через каждые 3-5 дней; культивирование проводили в тех же условиях, что и в примере 2. Визуальное наблюдение проводили ежедневно с использованием инвертированного микроскопа (Nikon). Для исследования на наличие специфических маркеров клетки окрашивали методом иммунофлуоресцентного окрашивания и анализировали, как описано в Примере 3.
| Таблица | ||
| Состав дифференцировочных сред | ||
| Направление дифференцировки | Состав среды культивирования | Ростовые факторы/добавки |
| Кардиомиогенное | DMEM/IMDM/5% FBS/100 Ед/мл пенициллин/10 мкг/мл стрептомицин | LIF, EGF, bFGF |
| Нейрональное | DMEM /199/5% FBS/100 Ед/мл пенициллин/10 мкг/мл стрептомицин | LIF, EGF, bFGF |
| Эндотелиальное | DMEM /IMDM/5% FBS/100 Ед/мл пенициллин/10 мкг/мл стрептомицин | EGF, bFGF, VEGF |
В результате проведенных экспериментов было установлено, что при культивировании мультипотентных клеток в среде для кардиомиогенной дифференцировки (см. таблицу) через 1-3 дня в культуре наблюдались клетки, экспрессирующие маркеры ранней кардиогенной дифференцировки GATA-4 и Nkx-2.5, а через 7-9 дней в культуре обнаруживались клетки, экспрессирующие структурные белки зрелых кардиомиоцитов: тропонин I, легкую цепь-1 миозина сердца, коннексин 43 и α-aктинин (фиг.5).
При культивировании мультипотентных клеток в среде для эндотелиальной дифференцировки уже на 1 день в культуре наблюдались клетки, экспрессирующие маркер эндотелиальных клеток-предшественников - CD105 и/или маркер зрелых эндотелиальных клеток - CD31 (фиг.5). Помимо этого, в культурах, поддерживавшихся на среде для эндотелиальной дифференцировки, выявлялись гладкомышечные клетки, экспрессировавшие гладкомышечный альфа-актин (фиг.6).
При индукции дифференцировки в нейрональном направлении на 5 день выявлялись клетки, по морфологии напоминающие нейральные (фиг.6), которые при окрашивании антителами к различным маркерам нервных клеток демонстрировали экспрессию маркера нейральной дифференцировки βIII тубулина и при этом не экспрессировали маркер глиальных клеток GFAP.
Заключение
Таким образом, при создании настоящего изобретения показано, что ткань аневризмы сердца содержит пул стволовых клеток, способных при выделении и культивировании в соответствующих условиях пролиферировать и дифференцироваться с образованием кардиомиоцитов, нейральных, эндотелиальных и гладкомышечных клеток сосудов. Выделение, экспансия и дифференцировка in vitro стволовых клеток сердца из данного источника представляется новым перспективным подходом, который может быть в дальнейшем использован для клеточной терапии пораженных участков миокарда у определенной категории больных.
1. Способ получения и индукции направленной дифференцировки культуры мультипотентных клеток сердца, предусматривающий выделение популяции клеток из ткани аневризмы сердца, обработку их методом непрямого иммуномагнитного сортинга с получением фракции, обогащенной c-kit-позитивными клетками, культивирование полученной фракции клеток в питательной среде для выращивания клеток млекопитающих без добавления специфических факторов роста в течение 9-10 дней и индукцию дифференцировки мультипотентных клеток в эндотелиальном, кардиомиоцитарном или нейральном направлении путем помещения культуры в дифференцировочную среду, составом которой определяется желаемое направление дифференцировки.
2. Способ по п.1, отличающийся тем, что для индукции дифференцировки клеток в эндотелиальном направлении используют среду DMEM/IMDM/5% FBS с добавлением EGF, bFGF и VEGF.
3. Способ по п.1, отличающийся тем, что для индукции дифференцировки клеток в кардиомиоцитарном направлении используют среду DMEM/IMDM/5% FBS с добавлением LIF, EGF и bFGF.
4. Способ по п.1, отличающийся тем, что для индукции дифференцировки клеток в нейральном направлении используют среду DMEM/199/5% FBS с добавлением LIF, EGF и bFGF.