Быстро диспергирующиеся таблетки с желатиновым покрытием
Иллюстрации
Показать всеИзобретение относится к улучшенной дозированной форме с желатиновым покрытием, имеющей две концевые области, покрытые желатиновыми материалами, и открытую круговую полосу. В открытой полосе выполнено, по меньшей мере, одно отверстие для раскрывания материала ядра. Изобретение также относится к способам производства таких дозированных форм с желатиновым покрытием. Дозированная форма по изобретению имеет улучшенные характеристики растворения и распада по сравнению с коммерчески доступными продуктами, имеющими желатиновое покрытие. 5 н. и 24 з.п. ф-лы, 3 ил., 7 табл.
Реферат
Перекрестная ссылка на родственные заявки
Настоящая заявка представляет собой заявку, поданную в частичное продолжение, находящуюся в процессе одновременного рассмотрения, имеющую регистрационный № CША 10/756528 и дату подачи 13 января 2004 г.
Настоящее изобретение относится к дозированной форме, содержащей ядро таблетки, имеющей два конца. Ядро таблетки, предпочтительно в прессованной форме, снабжено полимерным внутренним покрытием поверх ее наружной поверхности. Кроме того, дозированная форма имеет желатиновые покрытия на ее обоих концах. На противоположных концах удлиненного ядра таблетки или на противоположных сторонах круглого ядра таблетки создаются желатиновые колпачки так, чтобы они не соприкасались и образовывали круговой промежуток или полосу, через которую видно внутреннее покрытие. В дозированной форме выполнены отверстия, которые проходят через внутреннее покрытие к наружной поверхности ядра удлиненной или круглой таблетки. Предпочтительно отверстия делают только в открытом промежутке наружных покрытий.
Уровень техники
Капсулы давно известны как предпочтительная дозированная форма для пероральной доставки активных ингредиентов, которые могут находиться в форме порошка, жидкости или гранул различных композиций, в случае доставки в желудочно-кишечный тракт человека. Преимуществами капсул в качестве дозированной формы являются множество конфигураций и цветовых комбинаций (в том числе различное окрашивание колпачков и корпусов), улучшающих их уникальную идентификацию, их блестящий элегантный внешний вид и возможность легкого проглатывания. Один из типов обычно используемой капсулы представляет собой состоящую из двух частей капсулу с твердой оболочкой, обычно изготовленной из желатина, крахмала или производных целлюлозы. Капсулы с твердой оболочкой обычно включают удлиненный корпус, имеющий наружный диаметр, и относительно более короткий колпачок, имеющий внутренний диаметр, который точно соответствует наружному диаметру корпуса. Колпачок плотно накладывается поверх корпуса, создавая перекрывающуюся часть капсулы.
Ввиду возможности фальсификации капсул старого образца, изготовленных из двух половинок твердой оболочки капсулы различных диаметров, которые могут развалиться на части, с 1980-х гг. предприняты шаги производства капсульных оболочек, которые после сборки не могут быть разобраны без их разрушения. Одним из таких примеров является капсула Capsugel CONI-SNAP®, которая имеет желобки, скрепляющие колпачок и корпус вместе после заполнения капсулы. Другой такой пример составляет капсула Parke-Davis KAPSEAL®, в которой корпус и колпачок соединены герметично с использованием ободка из желатина. Хотя герметичное скрепление или соединение половинок оболочки твердой капсулы по большей части считается эффективным для того, чтобы сделать фальсификацию очевидной, по крайней мере, для потребителя, некоторые компании предпочитают производить твердые дозированные формы, имеющие плотно спрессованные ядра, чтобы дополнительно уменьшить возможность фальсификации.
Один из первых типов удлиненных прессованных таблеток с пленочным покрытием был назван «каплета» (caplet) (капсульная таблетка). Форма каплеты обеспечивает улучшенное проглатывание, аналогичное улучшенному проглатыванию капсул, в сравнении с непокрытыми таблетками, благодаря их удлиненной конфигурации и покрытой пленкой поверхности. Однако у них нет многоцветного блестящего внешнего вида поверхности капсул. Хотя сегодня каплеты все еще остаются популярными, следующее поколение дозированных форм, которые обеспечивают все указанные преимущества капсулы, включает плотно спрессованные ядра, которые покрыты желатином или аналогичным блестящим материалом, обычно состоящим из двух частей, имеющих различные цвета. Патенты США №№ 5089270, 5213738, 4820524, 4867983 и 4966771 предлагают различные методики создания продукта в конфигурации капсулы в виде удлиненной таблетки, имеющей покрытие, которое обеспечивает внешний вид и, следовательно, потребительную приемлемость ранее популярной капсулы.
Патенты США №№ 5415868 и 5317849 раскрывают различные способы, с помощью которых или две половинки твердой оболочки капсулы могут быть одеты с усадкой на таблетку (патент '868), или ядро таблетки покрывают на противоположных концах половинками мягкой оболочки желатиновой капсулы, а затем сушат для имитации лекарственной формы, похожей на капсулу (патент '849). В патенте США № 5464631 указывается, что исследования также показали функциональное значение для потребителя создания похожих на капсулы твердых дозированных форм, которые являются многоцветными. Применение двух цветов функционально идентифицирует тип лекарственного средства, а также обеспечивает похожий на капсулу продукт, который психологически воспринимается как обладающий медицинской эффективностью. Кроме того, эстетически потребители однозначно предпочитают привлекательный внешний вид многоцветных капсул, чем одноцветно окрашенных капсул.
Таким образом, фармацевтическая промышленность решительно нацелена на разработку продаваемых в розницу дозированных форм с желатиновым покрытием, имитирующих внешний вид капсул и имеющих широкий выбор различных цветов, которые идентифицируют тип медикамента; это дает возможность потребителю легко определять, например, является ли продукт конкретным типом анальгетика или он включает антигистаминные средства или другие активные ингредиенты в комбинации с анальгетиками. Такие твердые дозированные формы предпочтительно имеют конфигурацию удлиненной таблетки, и их определяют как гелевые капсулы (гелькапы), когда твердое удлиненное ядро покрыто желатиновым покрытием, или как гелевые таблетки (гельтабы), когда ядро имеет конфигурацию круглой таблетки с желатиновым покрытием.
Настоящее изобретение развивает эти более ранние достижения посредством создания усовершенствованной гелевой капсулы или гелевой таблетки, имеющей более короткое время распада и/или растворения по сравнению с коммерчески доступными продуктами, имеющими желатиновое покрытие.
Краткое описание чертежей
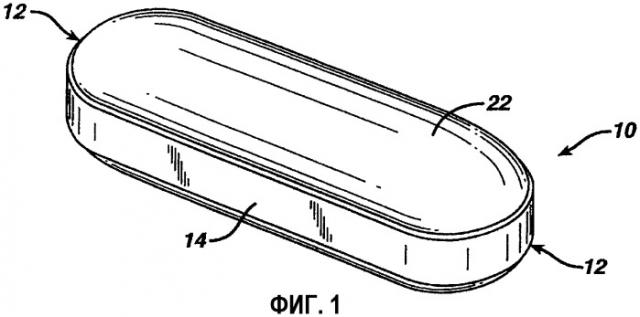
Фиг. 1 представляет собой увеличенную изометрическую проекцию прессованного ядра в форме удлиненной таблетки с цилиндрической конфигурацией, называемого ядром «гелькапы».
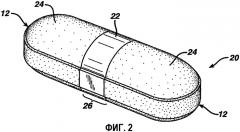
Фиг. 2 представляет собой увеличенную изометрическую проекцию промежуточной дозированной формы.
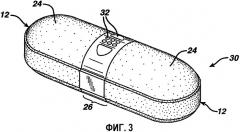
Фиг. 3 иллюстрирует конечную дозированную форму по настоящему изобретению.
Подробное описание изобретения
Используемое в данном случае определение «дозированная форма» относится к любому твердому объекту, полутвердой или жидкой композиции, изготовленным так, чтобы они содержали конкретное заранее определенное количество (дозу) некоторого ингредиента, например активного ингредиента, определенного ниже. Подходящими дозированными формами могут быть фармацевтические системы доставки лекарства, в том числе системы доставки для перорального введения, буккального введения, ректального введения, местного применения или введения через слизистые, или подкожные имплантаты и другие имплантированные системы доставки лекарства; или композиции для доставки минеральных веществ, витаминов и других пищевых добавок, средств для ухода за ротовой полостью, ароматических (вкусовых) веществ и т.д. Предпочтительными дозированными формами по настоящему изобретению считаются твердые формы, однако они могут содержать жидкие или полужидкие компоненты. В особенно предпочтительном варианте осуществления изобретения дозированная форма представляет собой перорально вводимую систему для доставки фармацевтического активного ингредиента в желудочно-кишечный тракт человека. В другом предпочтительном варианте дозированная форма представляет собой перорально вводимую систему «плацебо», содержащую фармацевтически неактивные ингредиенты, и дозированная форма выполнена так, чтобы она имела такой же внешний вид, что и определенная фармацевтически активная дозированная форма, чтобы ее можно было использовать в качестве контроля при клинических исследованиях для оценки, например, безопасности и эффективности конкретного фармацевтически активного ингредиента.
Используемое в данном случае определение «таблетка» относится к твердой форме, полученной путем прессования порошков на таблетирующем прессе, как это хорошо известно в области фармацевтики. Таблетки могут быть изготовлены в различных конфигурациях, включая круглые или удлиненные, такие как сплющенные овальные или цилиндрические конфигурации. Используемое в данном описании определение «ядро гелькапы» относится к одному из типов удлиненной, обычно цилиндрической или в форме капсулы, таблетки, имеющей прямые или слегка выгнутые стороны и обычно округлое поперечное сечение и имеющей отношение длины к диаметру приблизительно от 2 до 5, например, приблизительно от 2,5 до 3,5, например, приблизительно 3.
Каплета представляет собой один из типов удлиненной таблетки, покрытой пленочным покрытием. На фиг. 1 показано ядро 10 в конфигурации удлиненной таблетки, имеющей два конца 12 на противоположных сторонах продольной оси. Опоясывающая кромка 14 присутствует вдоль всей продольной окружности, где таблетка находится в контакте со стенками пресс-формы во время прессования.
Ядро может иметь любое число фармацевтически приемлемых конфигураций таблетки. Таблетка, как подразумевается в наиболее широком смысле, охватывает сформованные прессованные дозированные формы. Удлиненная таблетка представляет собой тип таблетки, имеющей удлиненную конфигурацию. Один из типов ядра гелькапы, представленный на фиг. 1, обычно имеет округлое поперечное сечение, которое часто сужается от средней части к верхушке или к концевой области. Для целей указанного применения продольная ось проходит через центр обоих концов ядра гелькапы.
Ядро (или основа) может находиться в любой твердой или полутвердой форме. Ядро может быть получено с помощью любого подходящего способа, например ядро может быть прессованной дозированной формой или может быть формованной. Используемое в данном случае определение «основа» относится к поверхности или находящейся изнутри подложке, на которой находится другое вещество или на которую оно действует, а определение «ядро» относится к материалу, который, по меньшей мере, частично обернут или окружен другим материалом. Для задач настоящего изобретения определения могут использоваться взаимозаменяемо: то есть определение «ядро» также может быть использовано для обозначения «основы». Предпочтительно ядро включает твердое вещество, например ядро может представлять собой прессованную или формованную таблетку, твердую или мягкую капсулу, суппозиторий или кондитерскую форму, такую как лепешка, нуга, карамель, помадка, или композицию на основе жира. В некоторых других вариантах в конечной дозированной форме ядро может находиться в виде полутвердого вещества или жидкости.
В одном из вариантов изобретения ядро имеет одну или несколько основных лицевых поверхностей. Ядро может находиться в различных конфигурациях. Например, в одном из вариантов ядро может иметь конфигурацию усеченного конуса. В других вариантах ядро может иметь конфигурацию многогранника, такого как куб, пирамида, призма или др.; или ядро может иметь геометрию объемной фигуры с некоторыми неплоскими лицевыми поверхностями, такую как конус, цилиндр, сфера, тор или др. Примерами конфигураций ядра, которые могут быть использованы, являются конфигурации таблеток, образованных из форм прессовочного оборудования, описанных в публикации “The Elizabeth Companies Tablet Design Training Manual” (Elizabeth Carbide Die Co., Inc., p. 7 (McKeesport, Pa.) (включена в данное описание посредством ссылки) следующим образом (конфигурация таблетки соответствует обратно пропорциональной конфигурации прессующего оборудования):
Неглубокая вогнутость
Стандартная вогнутость
Глубокая вогнутость
Очень глубокая вогнутость
Модифицированная шаровая вогнутость
Бисект стандартной вогнутости
Двойной бисект стандартной вогнутости
Европейский бисект стандартной вогнутости
Неполный бисект стандартной вогнутости
Двойной радиус
Скос и вогнутость
Горизонтальная плоскость
Плоская скошенная кромка (F.F.B.E.)
Бисект F.F.B.E.
Двойной бисект F.F.B.E.
Кольцо
Углубление
Эллипс
Овал
Капсула
Прямоугольник
Квадрат
Треугольник
Шестиугольник
Пятиугольник
Восьмиугольник
Ромб
Размерная стрелка
Пуля
Бочонок
Полулуние
Козырек
Сердце
Миндаль
Бытовая тарелка
Параллелограмм
Трапеция
Цифра 8/Гантель
Галстук-бабочка
Неравнобедренный треугольник
Ядро 10 прессуют из смеси подходящих активных ингредиентов и наполнителей, которые могут иметь их натуральный цвет, в том числе белый, или, по желанию, могут быть приемлемым способом окрашены с получением обычного ядра или ядра с удлиненной конфигурацией любого желаемого цвета.
Дозированная форма по настоящему изобретению предпочтительно содержит один или несколько активных ингредиентов. Подходящими активными ингредиентами в целом являются, например, фармацевтические средства, минеральные вещества, витамины и другие пищевые добавки, средства ухода за полостью рта, вкусоароматические вещества и их смеси. Подходящими фармацевтическими средствами являются анальгетики, противовоспалительные агенты, средства против артрита, анестезирующие средства, антигистаминные средства, противокашлевые средства, антибиотики, противоинфекционные средства, противовирусные средства, антикоагулянты, антидепрессанты, противодиабетические средства, противорвотные средства, ветрогонные средства, противогрибковые средства, противосудорожные средства, средства для снижения аппетита, бронхолитические средства, сердечно-сосудистые средства, средства для центральной нервной системы, стимуляторы центральной нервной системы, противоотечные средства, оральные противозачаточные средства, диуретики, отхаркивающие средства, препараты против мигрени, продукты против морской болезни, муколитические средства, мышечные релаксанты, препараты против остеопороза, полидиметилсилоксаны, респираторные средства, снотворные средства, средства для мочевых путей и их смеси.
Примерами подходящих вкусоароматических веществ являются ментол, перечная мята, мятные вкусоароматические вещества, фруктовые вкусоароматические вещества, шоколад, ваниль, вкусоароматические добавки жевательных резинок, кофейные вкусоароматические вещества, ликерные вкусоароматические вещества, их комбинации и т.д.
Примерами подходящих желудочно-кишечных агентов являются антациды, такие как карбонат кальция, гидроксид магния, оксид магния, карбонат магния, гидроксид алюминия, бикарбонат натрия (дигидроксиалюминий)карбонат натрия; стимулирующие слабительные средства, такие как бисакодил, cascara sagrada, дантрон, сена, фенолфталеин, алоэ, касторовое масло, рицинолеиновая кислота и дегидрохолевая кислота и их смеси; антагонисты Н2-рецептора, такие как фамотидин, ранитидин, циметидин, низатидин; ингибиторы протонного насоса, такие как омепразол или лансопразол; желудочно-кишечные цитопротекторы, такие как сукрафлат и мизопростол; желудочно-кишечные прокинетики, такие как прукалоприд; антибиотики для H.рyroli, такие как кларитромицин, амоксициллин, тетрациклин и метронидазол; противодиарейные средства, такие как дифеноксилат и лоперамид; гликопирролат; противорвотные средства, такие как ондансетрон; анальгетики, такие как месаламин.
Примерами подходящих полидиметилсилоксанов, которые включают, но не ограничиваются только ими, диметикон и симетикон, являются полидиметилсилоксаны, описанные в патентах США №№ 4906478, 5275822 и 6103260, содержание каждого из которых специально приведено в данном описании в качестве ссылки. При использовании в данном случае определение «симетикон» относится к более широкому классу полидиметилсилоксанов, в том числе, но без ограничения, к симетикону и диметикону.
В одном из вариантов осуществления изобретения, по меньшей мере, один активный ингредиент может быть выбран из бисакодила, фамотидина, ранитидина, циметидина, прукалоприда, дифеноксилата, лоперамида, лактазы, месаламина, висмута, антацидов и их фармацевтически приемлемых солей, сложных эфиров, изомеров и их смесей.
В другом варианте осуществления изобретения, по меньшей мере, один активный ингредиент выбран из анальгетиков, противовоспалительных средств и жаропонижающих средств, например нестероидных противовоспалительных лекарств (НПВС), включая а) производные пропионовой кислоты, например ибупрофен, напроксен, кетопрофен и т.д.; b) производные уксусной кислоты, например индометацин, диклофенак, сулиндак, толметин и т.д.; с) производные фенамовой кислоты, например мефенамовая кислота, меклофенамовая кислота, флуфенамовая кислота и т.д.; d) производные бифенилкарбодиловой кислоты, например дифлунизал, флуфенизал и т.д.; е) оксикамы, например пироксикам, судоксикам, изоксикам, мелоксикам и т.д.; f) НПВС, селективные для циклооксигеназы-2 (СОХ-2); и g) фармацевтически приемлемые соли перечисленных лекарств.
В одном из конкретных вариантов осуществления изобретения, по меньшей мере, один активный ингредиент выбран из НПВС, производных пропионовой кислоты, которые представляют собой фармацевтически приемлемые анальгетики/нестероидные противовоспалительные лекарства, содержащие свободную группу -СН(СН3)СООН или СН2СН2СООН или фармацевтически приемлемую солевую группу, такую как -СН(СН3)СОО-Na+ или СН2СН2СОО-Na+, которые обычно прикреплены напрямую или через карбонильную функциональную группу к циклической системе, предпочтительно ароматической циклической системе.
Примерами пригодных производных пропионовой кислоты являются ибупрофен, напроксен, беноксапрофен, напроксен-натрий, фенбуфен, флурбипрофен, фенопрофен, фенбупрофен, кетопрофен, индопрофен, пирпрофен, карпрофен, оксапрофен, пранопрофен, микропрофен, тиоксапрофен, супрофен, алминопрофен, тиапрофеновая кислота, флупрофен, буклоксиновая кислота и их фармацевтически приемлемые соли, производные и комбинации. В одном из вариантов изобретения производное пропионовой кислоты выбрано из ибупрофена, кетопрофена флубипрофена и их фармацевтически приемлемых солей, производных и их комбинаций. В другом варианте изобретения производное пропионовой кислоты представляет собой ибупрофен, 2-(4-изобутилфенил)пропионовую кислоту, или его фармацевтически приемлемую соль, такую как соль ибупрофена с аргинином, лизином или гистидином. Другие фармацевтически приемлемые соли ибупрофена описаны в патентах США №№ 4279926, 4873231, 5424075 и 5510385, содержание которых включено в данное описание посредством ссылки.
В другом конкретном варианте изобретения, по меньшей мере, один активный ингредиент может представлять собой анальгетик, выбранный из ацетаминофена, ацетилсалициловой кислоты, ибупрофена, напроксена, кетопрофена, флубипрофена, диклофенака, циклобензаприна, мелоксикама, рофекоксиба, целекоксиба и их фармацевтически приемлемых солей, сложных эфиров, изомеров и смесей.
В другом конкретном варианте изобретения, по меньшей мере, один активный ингредиент может быть выбран из псевдоэфедрина, фенилпропаноламина, хлорфенирамина, декстрометорфана, дифенгидрамина, азтемизола, терфенадина, фексофенадина, лоратадина, деслоратадина, цетиризина, их смесей и их фармацевтически приемлемых солей, сложных эфиров, изомеров и их смесей.
В другом конкретном варианте изобретения, по меньшей мере, один активный ингредиент представляет собой НПВС и/или ацетаминофен и их фармацевтически приемлемые соли.
Активный ингредиент или ингредиенты присутствуют в дозированной форме в терапевтически эффективном количестве, которое представляет собой количество, продуцирующее желаемую терапевтическую реакцию при пероральном введении, и указанное количество может быть легко определено специалистом в данной области. При определении указанных количеств необходимо рассматривать конкретный активный ингредиент, подлежащий введению, характеристики биологической доступности активного ингредиента, схему приема лекарства, возраст и вес пациента, а также другие факторы, которые известны в данной области. Обычно дозированная форма содержит, по меньшей мере, 1% мас., предпочтительно дозированная форма содержит, по меньшей мере, приблизительно 5% мас., например, приблизительно 20% мас комбинации одного или нескольких активных ингредиентов. В одном из предпочтительных вариантов изобретения ядро содержит суммарно, по меньшей мере, приблизительно 25% мас. (из расчета на массу ядра) одного или нескольких активных ингредиентов.
Активный ингредиент или ингредиенты могут присутствовать в дозированной форме в любом виде. Например, один или несколько активных ингредиентов могут быть диспергированы на молекулярном уровне, например расплавлены или растворены, в пределах дозированной формы или могут находиться в форме частиц, которые в свою очередь могут иметь покрытие или могут быть непокрытыми. Если активный ингредиент находится в форме частиц, частицы (или с покрытием или непокрытые) обычно имеют средний размер частиц приблизительно 1-2000 микрон. В одном из предпочтительных вариантов такие частицы представляют собой кристаллы, имеющие средний размер частиц приблизительно 1-300 микрон. В другом предпочтительном варианте изобретения частицы представляют собой гранулы или пеллеты, имеющие средний размер частиц приблизительно 50-2000 микрон, предпочтительно 50-1000 микрон, наиболее предпочтительно приблизительно 100-800 микрон.
В некоторых вариантах изобретения, по меньшей мере, часть одного или несколько активных ингредиентов необязательно может быть покрыта модифицирующим высвобождение покрытием, известным в данной области. Это преимущественно дает дополнительное средство для модифицирования профиля высвобождения активного ингредиента из дозированной формы. Например, ядро может содержать покрытые частицы одного или нескольких активных ингредиентов, в которых покрытие частиц выполняет функцию модифицирования высвобождения, что известно в данной области техники. Примеры подходящих модифицирующих высвобождение покрытий для частиц описаны в патентах США №№ 4173626, 4863742, 4980170, 4984240, 586497, 5912013, 6270805 и 6322819. Также могут быть использованы коммерчески доступные покрытые активные частицы с модифицированным высвобождением. Таким образом, все количество или часть одного или нескольких активных ингредиентов в ядре может иметь покрытие из модифицирующего высвобождение материала.
В вариантах осуществления изобретения, в которых желательно, чтобы, по меньшей мере, один активный ингредиент был абсорбирован в кровообращение большого круга животного, активный ингредиент или ингредиенты предпочтительно обладают способностью к растворению при контакте с растворяющей средой, такой как вода, желудочный сок, кишечная жидкость или др.
В одном из вариантов изобретения характеристики растворения, по меньшей мере, одного активного ингредиента соответствуют «профилю немедленного высвобождения». В данном случае профиль немедленного высвобождения представляет собой профиль, при котором активный ингредиент растворяется без значительной задержки или замедления из-за дозированной формы. Такой профиль может отличаться от растворения при модифицированном высвобождении, например, в случае дозированных форм с отсроченным или контролируемым высвобождением. В одном из вариантов скорость растворения немедленно высвобожденного активного ингредиента из дозированной формы настоящего изобретения увеличивается в пределах приблизительно 20% от скорости растворения активного ингредиента из чистого кристаллического порошка указанного активного ингредиента; например, время в случае растворения 50%, 75%, 80% или 90% активного ингредиента из дозированной формы не более чем на 20% продолжительнее, чем соответствующее время при растворении 50%, 75%, 80% или 90% активного ингредиента из чистого кристаллического порошка указанного активного ингредиента. В другом варианте растворение активного ингредиента, немедленно высвобожденного из дозированной формы по настоящему изобретению, удовлетворяет спецификациям Фармакопеи США (USP) для таблеток, гелевых капсул или капсул с немедленным высвобождением, содержащим активный ингредиент. Например, для таблеток ацетаминофена в USP 24 определено, что в фосфатном буфере с рН 5,8 при использовании USP прибора 2 (лопасти) при 50 об/мин, по меньшей мере, 80% ацетаминофена, содержащегося в дозированной форме, высвобождается из нее в течение 30 минут после введения дозы; для капсул ацетаминофена и кодеин-фосфата в USP 24 определено, что, по меньшей мере, 75% ацетаминофена, содержащегося в дозированной форме, растворяется в течение 30 мин в 900 мл 0,1 н. соляной кислоты при использовании USP прибора 2 (лопасти) при 50 об/мин; для таблеток ибупрофена в USP 24 определено, что в фосфатном буфере с рН 7,2 при использовании USP прибора 2 (лопасти) при 50 об/мин, по меньшей мере, 80% ибупрофена, содержащегося в дозированной форме, высвобождается из нее в течение 60 минут (см. USP 24, 2000 Version, 19-20 и 856, 1999). В еще одном варианте изобретения, в котором немедленно высвобожденный активный ингредиент представляет собой ацетаминофен, при испытании в воде с температурой 37°С с использованием USP прибора II (лопасти) при 50 об/мин, по меньшей мере, 80%, предпочтительно, по меньшей мере, 85%, ацетаминофена, содержащегося в дозированной форме, высвобождается из нее в течение 30 минут.
В еще одном варианте осуществления изобретения время высвобождения, по меньшей мере, 80%, предпочтительно, по меньшей мере, 85%, по меньшей мере, одного активного ингредиента, содержащегося в дозированной форме и высвобождаемого из нее, составляет не более чем приблизительно 50%, например, не более чем приблизительно 40% времени, определенного с помощью метода растворения, указанного в публикации "United States New Drug Application" для данного конкретного активного ингредиента.
В одном из предпочтительных вариантов изобретения, когда немедленно высвобождаемым активным ингредиентом является ацетаминофен, при испытании в воде с температурой 37°С с использованием USP прибора II (лопасти) при 50 об/мин, по меньшей мере, 80% ацетаминофена, содержащегося в дозированной форме, высвобождается из нее в течение приблизительно 6 минут, например, в течение приблизительно 5 минут или в течение приблизительно 3 минут.
В другом варианте осуществления изобретения характеристики растворения одного или нескольких активных ингредиентов модифицированы, например, обеспечено контролируемое, постепенное, продленное, замедленное, пролонгированное, отложенное и др. высвобождение. В конкретном варианте изобретения, в котором один или несколько активных ингредиентов высвобождаются модифицированным образом, активный или активные компоненты с модифицированным высвобождением предпочтительно находятся в ядре. В данном описании определение «модифицированное высвобождение» означает высвобождение активного ингредиента из дозированной формы или из ее части, отличное от модели немедленного высвобождения, то есть отличное от немедленного высвобождения при контакте дозированной формы или ее части с жидкой средой. Как известно в данной области техники, виды модифицированного высвобождения включают отсроченное или контролируемое высвобождение. Видами контролируемого высвобождения являются пролонгированное, постепенное, продленное, замедленное и др. высвобождения. Профилями модифицированного высвобождения, которые имеют признак отложенного высвобождения, являются пульсирующее, повторное действие и др. Как известно в данной области, подходящим механизмом для достижения модифицированного высвобождения активного ингредиента является диффузия, эрозия, регулирование площади поверхности посредством геометрии и/или с помощью непроницаемых или полупроницаемых барьеров и другие известные механизмы. Общая информация по испытанию растворимости может быть найдена в Фармакопее США, часть 711. Согласно USP допустимо добавление не более чем 3,2 г очищенного пепсина, имеющего активность от 800 до 2500 единиц, на мг белка или не более чем 5г панкреатина на 1000 мл среды, как это принято в случае желатиновых капсул, что не соответствует спецификациям растворения с использованием воды и определенной среды в случае таблеток с немедленным высвобождением.
В некоторых предпочтительных вариантах изобретения на ядро 10 впоследствии наносится внутреннее покрытие 12, которое может представлять собой любое количество медицински приемлемых покрытий. Применение внутренних покрытий хорошо известно в данной области техники и описано, например, в патенте США № 5234099, который включен в данное описание посредством ссылки. В соответствии с настоящим изобретением может быть использована любая композиция, приемлемая для покрытия таблетки пленкой. Примеры подходящих внутренних покрытий описаны в патентах США №№ 4683246, 4543370, 4643894, 4828841, 4725441, 4802924, 5630871 и 6274162, которые включены в данное описание посредством ссылки. Подходящими композициями для применения в качестве внутренних покрытий являются композиции, производимые компанией Colorcon, подразделение Berwind Pharmaceutical Services, Inc., 415 Moyer Blvd., West Point, PA 19486, под торговым названием “OPADRY®” (сухой концентрат, содержащий пленкообразующий полимер и необязательно пластификатор, краситель и другие полезные эксципиенты). Другие подходящие внутренние покрытия включают один или несколько следующих ингредиентов: сложные эфиры целлюлозы, такие как гидроксипропилметилцеллюлоза, гидроксипропилцеллюлоза и гидроксиэтилцеллюлоза; полиуглеводы, такие как ксантановая камедь, крахмал и мальтодекстрин; пластификаторы, включая, например, глицерин, полиэтиленгликоль, пропиленгликоль, дибутилсебацинат, триэтилцитрат, растительные масла, такие как касторовое масло, поверхностно-активные вещества, такие как Polysorbate-80, лаурилсульфат натрия и диоктилнатрийсульфосукцинат; полиуглеводы, пигменты и агенты для достижения непрозрачности.
В одном из вариантов осуществления изобретения внутреннее покрытие содержит приблизительно от 2 до 8%, например, приблизительно от 4 до 6% растворимого в воде простого эфира целлюлозы и приблизительно от 0,1 до 1% касторового масла, что подробно описано в патенте США № 5658589, который включен в данное описание посредством ссылки. В другом варианте внутреннее покрытие включает приблизительно от 20 до 50%, например, приблизительно от 25 до 40% ГПМЦ (НРМС); приблизительно от 45 до 75%, например, от 50 до 70% мальтодекстрина и приблизительно от 1 до 10%, например, приблизительно от 5 до 10% ПЭГ 400. Высушенное внутреннее покрытие обычно присутствует в количестве из расчета на сухую массу ядра приблизительно от 0 до 5%. Для нанесения покрытия на таблетку обычным способом внутреннее покрытие обычно получают путем разбрызгивания в поддоне для нанесения покрытия или в псевдоожиженном слое. Композиция внутреннего покрытия необязательно подкрашивается или окрашивается с помощью красящих веществ, таких как пигменты, красители и их смеси.
В одном из вариантов изобретения внутреннее покрытие 12 вначале наносят на всю наружную поверхность ядра 10. Внутреннее покрытие 12 может быть нанесено в виде бесцветного, прозрачного покрытия так, чтобы можно было видеть ядро. Выбор диктуется предпочтением производителя и экономикой продукта. В предпочтительном варианте коммерчески доступный пигмент включен в композицию внутреннего покрытия в достаточном количестве, чтобы получить непрозрачную пленку, имеющую визуально различаемый цвет относительно ядра.
Неожиданное улучшение, полученное в результате модифицированного процесса окунания в гель, привело к изменениям в требованиях к внутреннему покрытию. Обычно внутреннее покрытие используется в количествах, достаточных, по меньшей мере, для 3,5%, обычно, по меньшей мере, 4% увеличения массы (то есть масса покрытого ядра на 3,5-4% больше массы непокрытого ядра). Обычные процессы окунания в гель требуют увеличения массы за счет внутреннего покрытия, по меньшей мере, на 3,5%, чтобы предотвратить вспучивание наносимого окунанием покрытия (называемого в данном описании желатиновым покрытием) и другие технологические проблемы. Установлено, что для дозированных форм, на которые покрытие нанесено в соответствии с настоящим изобретением (в котором используют несколько неперекрывающихся желатиновых покрытий), количество, измеренное по увеличению массы, внутреннего покрытия может быть уменьшено не более чем приблизительно до 3%, например, не более чем приблизительно до 2,75% или не более чем приблизительно до 2,5%, или не более чем приблизительно 2,1%; то есть приблизительно 2% увеличения массы все еще обеспечивает приемлемые покрытые желатином дозированные формы. Расчеты увеличения массы хорошо известны специалистам в данной области.
Фиг. 2 иллюстрирует промежуточную дозированную форму 20, имеющую два конца 12 с желатиновыми покрытиями 24, которые не примыкают друг к другу или не перекрывают друг друга. Желатиновые покрытия 24 отделены друг от друга и образуют промежуток 26. После нанесения внутреннего покрытия 22 на ядро 10 оба конца 12 ядра 10 покрывают желатиновыми покрытиями 24, предпочтительно содержащими краситель или красящий агент. Противоположные концы 12 дозированной формы 20 могут быть покрыты бесцветными желатиновыми материалами или желатиновыми материалами, которые имеют тот же цвет, что и ядро 10, тот же цвет, что и цвет внутреннего покрытия, цвет, отличающийся от цвета ядра 10 и/или внутреннего покрытия 22, и они могут быть одинаковыми или могут отличаться друг от друга. Окрашивание желатинового покрытия 24 может быть результатом введения в желатиновые материалы подходящих чернил, красителя или пигмента. В предпочтительном варианте изобретения используется достаточное количество пигмента, чтобы создать непрозрачное окрашенное покрытие.
В некоторых предпочтительных вариантах изобретения дозированная форма дополнительно имеет одно или несколько, предпочтительно множество отверстий, выполненных в открытой части внутреннего покрытия. Отверстия могут иметь любую форму и размер и необязательно могут быть расположены по схеме. В вариантах изобретения, в которых отверстия получены лазерной абляцией, ширина или диаметр наименьшего отверстия обычно составляет, по меньшей мере, 1-2 длины волны света, обеспечиваемого используемым лазером. По меньшей мере, часть отверстий могут быть достаточно большими, чтобы их можно было увидеть невооруженным глазом, и находятся по ширине или по диаметру в интервале приблизительно от 400 нанометров до любого размера открытого внутреннего покрытия. Обычно такие отверстия будут иметь минимальную ширину или диаметр, по меньшей мере, приблизительно 500 нанометров, например, по меньшей мере, приблизительно 700 нанометров, или, по меньшей мере, приблизительно 70 микрон. Обычно видимые отверстия будут иметь максимальную ширину или диаметр не более чем ширина таблетки или не более чем ширина открытой полосы внутреннего покрытия, например, не более чем приблизительно 6,5 миллиметра или не более чем приблизительно 3,5 миллиметра, или не более чем приблизительно 2,5 миллиметра. С другой стороны, несколько или все отверстия могут быть микроскопическими по размеру, находясь в интервале приблизительно от 1 нанометра и менее чем до 400 нанометров по ширине или диаметру. В вариантах изобретения, в которых несколько или все отверстия являются видимыми невооруженным глазом, множество отверстий может быть расположено по схеме, создавая перфорацию или малозаметное пятно в пленке, что ускоряет распад. Хотя для данного изобретения не имеет критического значения достаточно большой размер начальных отверстий, чтобы обеспечить поступление воды, особенно когда используется растворимое в воде внутреннее покрытие, следует отметить, что установлено, что в некоторых предпочтительных вариантах изобретения размер отверстия приблизительно 0,030 дюймов по ширине или диаметру п