Средство для коррекции нарушений женской репродуктивной функции, вызванных цитостатическим воздействием
Иллюстрации
Показать всеИзобретение относится к области лекарственных средств, в частности применению в качестве средства для коррекции нарушений женской репродуктивной функции, вызванных цитостатическим воздействием, препарата
тио-фан-бис-[(3,5-ди-трет-бутил-4-гидроксифенил)пропил]сульфида, являющегося серосодержащим фенольным антиоксидантом. Задачей, решаемой данным изобретением, является расширение арсенала средств, используемых для коррекции нарушений женской репродуктивной функции, вызванных цитостатическим воздействием, сокращение побочных эффектов. 3 ил.
Реферат
Изобретение относится к области экспериментальной медицины и касается средства для коррекции нарушений женской репродуктивной функции, вызванных цитостатическим воздействием.
Цитостатические препараты, независимо от механизма их противоопухолевого действия, обладают выраженным токсическим действием на активно делящиеся нормальные (не поврежденные опухолью) ткани организма. К числу последних принадлежат ткани женских половых желез [1], в которых происходит постоянная смена морфологических структур, связанная как с развитием женских половых клеток, так и с формированием эндокринной функции. Следствием овариотоксичности цитостатических препаратов может быть снижение возможности наступления беременности, вероятности ее сохранения, пониженная жизнеспособность потомства. Эти эффекты могут быть обусловлены истощением генеративного пула [2], повреждающим действием цитостатиков (в том числе и мутагенным) на созревающую яйцеклетку [3]. Генотоксичность цитостатиков на половые клетки повышает риск появления неполноценного потомства [4]. Нарушение женской репродуктивной системы, наблюдаемое на фоне цитостатического воздействия, по этиологии, патогенезу отличается от других видов патологических процессов, которые сопровождаются угнетением воспроизводящей функции (воспаление, эндокринные расстройства, генетические заболевания).
В течение последних лет произошел значительный прогресс в цитостатическом лечении целого ряда злокачественных новообразований. Некоторые формы опухолей являются принципиально излечимыми [5]. Для молодых пациенток с высокими показателями безрецидивной выживаемости актуальными становятся вопросы о возможности наступления и сохранения беременности после цитостатической химиотерапии, о риске появления неполноценного потомства [6, 4]. К их числу относятся, прежде всего, женщины, находящиеся в длительной ремиссии после лечения лимфогранулематоза, трофобластической опухоли, перенесшие органосохраняющие операции и химиотерапию по поводу начальных стадий рака молочной железы, яичников. Актуальной, в связи с этим, является также проблема защиты яичников и женской репродуктивной системы в целом от цитостатического воздействия [7, 2]. Изначально важным при этом является то, чтобы корректоры не снижали лечебные эффекты цитостатиков, а еще лучше, если бы при их применении эффективность химиотерапии на опухоль возрастала.
Известен ряд лекарственных средств синтетического происхождения, используемых в качестве корректоров нарушений женской репродуктивной функции, вызванных цитостатическими препаратами [8, 2].
К их числу относятся препараты гормонального происхождения - синтетические аналоги природного гонадотропина - агонисты гонадотропин-рилизинг гормона (золодекс) и женские половые стероиды, в частности эстраген-гестагенные препараты (марвелон) [2]. При их сочетанием применении с цитостатическими препаратами прослеживается благоприятный репродуктивный катамнез: способность к деторождению сохраняется, беременность и роды протекают нормально, дети рождаются в срок, жизнеспособными [2].
Однако применение данных лекарственных средств ограничено, так как они имеют ряд существенных недостатков. Они обладают рядом выраженных побочных эффектов. Как эстроген-гестагенные препараты, так и агонисты гонадотропин-рилизинг гормона могут вызвать кожную сыпь, тошноту, головную боль, депрессию и т.д. Эстроген-гестагенные препараты имеют целый ряд противопоказаний, к числу которых относятся некоторые виды злокачественных опухолей [9, 10].
К числу лекарственных средств синтетического происхождения принадлежит препарат месна. Месна используется в онкологической практике для снижения уротоксичности оксазафосфоринов [10]. Препарат относится к SH-содержащим соединением и обладает антиоксидантной активностью (инактивирует образование перекиси, гидроперикиси, супкроксидные и гидроксидные радикалы) [11]. Корректорные свойства месны в отношении репродуктивной системы крыс-самок были выявлены при ее сочетанном использовании с цитостатическим платиносодержащим препаратов карбоплатином. Последний приводит к снижению возможности наступления беременности, судя по проценту родивших крыс. Кроме того, наблюдается снижение вероятности сохранения беременности. Об этом свидетельствует возрастание эмбриональной гибели. Потомство таких самок характеризуется пониженной жизнеспособностью, судя по индексу выживаемости [8]. На фоне сочетанного использования месны и карбоплатина вероятность наступления беременности сохранялась на уровне контрольных значений, а потомство оказывается более жизнеспособным по сравнению с таковым на фоне введения одного цитостатика [8].
Препарат синтетического происхождения месна, являющийся серосодержащим антиоксидантом, является наиболее близким к заявляемому средству по природе происхождения и по механизму действия и выбран в качестве прототипа.
Недостатком месны является наличие ряда побочных эффектов. Он может вызывать тошноту, рвоту, головную боль, снижение артериального давления, аллергические реакции [10].
Недостатком месны является отсутствие эффективности в отношении показателей эмбриональной гибели крыс [8], которые характеризуют у человека вероятность сохранения беременности [12], что позволяет заключить, что использование препарата не способствует предотвращению самопроизвольного прерывания беременности.
Месна не обладает противоопухолевыми свойствами и при сочетанном введении с цитостатическими препаратами не усиливает их эффективность [10].
Задачей, решаемой данным изобретением, является расширение арсенала средств, используемых для коррекции нарушений женской репродуктивной функции, вызванных цитостатическим воздействием, сокращение побочных эффектов.
Поставленная задача решается путем применения в качестве корректора нарушений женской репродуктивной функции, вызванных цитостатическим воздействием, синтетического препарата тио-фан бис-[(3,5-ди-трет-бутил-4-гидроксифенил)-пропил]сульфида, являющегося серосодержащим антиоксидантом.
Препарат тио-фан является высокоэффективным ингибитором перикисного окисления липидов [13]. Он относится к малотоксичным соединениям, не обладает иммунотоксическими и аллергизирующими свойствами. Установлено, что препарат обладает гепатопротекторными, иммуностимулирующими и антиатерогенными свойствами. В настоящее время показана целесообразность и возможность использования тио-фана в онкологической практике. Установлено достоверное ингибирующее влияние тио-фана и его комбинации с цисплатиной на процесс диссеминации опухоли, которое проявлялось в уменьшении числа и площади метастазов [13]. Это свидетельствует о том, что тиофан усиливает лечебный эффект цитостатика (основного препарата).
В результате проведенных нами экспериментальных исследований обнаружено неизвестное до сих пор свойство тио-фана - оказывать коррегирующее влияние при нарушениях женской репродуктивной фунуции, вызванных цитостатическим воздействием.
Новое свойство тио-фана является для специалиста фактом неочевидным и не вытекает из уровня техники, не обнаружено в патентной и научно-медицинской литературе. Тио-фан может быть использован в медицинской практике в качестве средства коррекции нарушений женской репродуктивной системы, вызванного цитостатическим воздействием. Таким образом, предлагаемое техническое решение соответствует критериям патентоспособности изобретения, а именно «новизна», «изобретательский уровень» и «промышленная применимость».
Данное изобретение будет понятно из следующего описания и приложенных к нему чертежей.
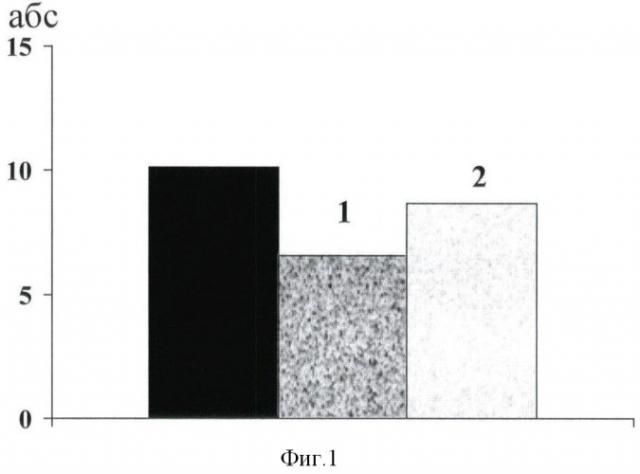
На фиг.1 изображены данные подсчета числа живых плодов (из расчета на одну самку) у крыс-самок контрольной группы, у крыс-самок, скрещенных через 3 мес после введения цисплатина, и его сочетанного применения с тио-фаном (здесь и на фиг.2, 3 - контроль, - цисплатин, - цисплатин + тио-фан; 1 - различия достоверны по сравнению с контролем, при Р≤0,05. 2 - различия достоверны по сравнению с группой цисплатин, при Р≤0,05).
На фиг.2 изображены данные показателей эмбриональной гибели (постимплантационной) у крыс контрольной группы, у крыс-самок, скрещенных через 3 мес после введения цисплатина, и его сочетанного применения с тио-фаном.
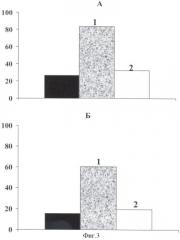
На фиг.3. представлены результаты определения времени для принятия правильного решения в стресс-ситуации (тест Хандерсона в модификации Бондаренко) крысятами - самцами (а), крысятами - самками (б), полученными от крыс-самок контрольной группы, крыс, получавших цисплатин, и цисплатин + тио-фан.
Эксперименты проведены на 42-х крысах-самках линии Вистар. Для скрещивания были использованы 20 крыс-самцов. В качестве модели цитостатического воздействия был выбран широко используемый в онкологической практике препарат, принадлежащий к группе комплексных соединений платины, - цисплатин (платидиам, Lachema, Чехия). Препарат оказывает токсическое действие на репродуктивную систему крыс-самок при введении его в МПД. Так, его введение за 3 мес до скрещивания вызывает повышение эмбриональной гибели, снижает жизнеспособность потомства, судя по его адаптивным способностям [14]. Выбор препарата обусловлен тем, что при его сочетанном использовании с тио-фаном лечебный эффект данного цитостатика возрастает [13].
Пример. Экспериментальные животные были разделены на 3 группы. Крысам первой группы (n=10) вводили цисплатин, однократно внутривенно в максимально-переносимой дозе, равной 4,6 мг/кг, рассчитанной методом графического пробит-анализа. Крысы второй группы (n=12) получали тио-фан в дозе 50 мл/кг в течение 2-х недель, начиная со следующего дня после введения цитостатического препарата. Крысы контрольной группы (n=20) получали эквиобъемное количество растворителя. Через 3 мес после введения цисплатина крыс-самок контрольной и опытной групп ссаживали с интактными самцами в течение 10 дней (продолжительность двух эстральных циклов). Спаривание регистрировали с помощью вагинальных мазков. На 20-й день беременности часть самок забивали (методом дислокации шейных позвонков), вскрывали, подсчитывали количество желтых тел в яичниках, мест имплантации в матке, число живых плодов (из расчета на одну самку). Вычисляли пре и постимплантационную смертность [15]. Часть самок оставляли до родов. На 20-й день беременности самок рассаживали в клетки по одной на роды. Определяли процент родивших крыс. Фиксировали день родов, определяли индекс выживаемости потомства. Жизнеспособность полученного потомства (крысят-самок, крысят-самцов) оценивали также в двухмесячном возрасте по способности к адаптивному поведению в тесте избегания стресс-ситуации по Хандерсону в модификации Бондаренко [16]. Испытания проводили с помощью 2-х цилиндров, один из которых (высотой 0,14 м и диаметром 0,16 м) помещен внутрь другого (высотой 0,55 м и диаметром 0,42 м). Больший цилиндр заполнен водой, так что ее уровень на 1 см выше нижнего края внутреннего цилиндра. Крысы, которых помещали во внутренний цилиндр, должны были, поднырнув под его край, найти сеточную полоску, прикрепленную к краю внешнего цилиндра. Тестирование проводилось в течение 3 мин, при этом регистрировалось время нахождения (мин) во внутреннем цилиндре. Результаты исследований обрабатывали статистически с помощью критериев - Вилкоксона-Манна-Уитни и углового преобразования Фишера [17].
В результате проведенных исследований установлено, что во всех сравниваемых группах животных число желтых тел в яичниках, мест имплантации в матке, преимплантационная смертность были сходными. Вероятность наступления беременности, судя по проценту родивших крыс, во всех сравниваемых группах животных оказалась также сходной. Крысята всех опытных групп не отличались друг от друга по индексу выживаемости. Однако, судя по другим исследуемым показателям, цисплатин приводил к угнетению воспроизводящей функции крыс-самок. На фиг.1, 2 видно, что наблюдалось снижение количества живых плодов (на 20-й день беременности), возрастание постимплантационной смертности по сравнению с таковыми в контроле. Потомство (крысята-самцы, крысята-самки) характеризовалось сниженной жизнеспособностью, судя по времени, необходимому на избегание стресс-ситуации (фиг.3, а б.)
Введение тио-фана нивелировало повреждающее действие цисплатина на воспроизводящую функцию крыс-самок. Количественное подтверждение корректорных свойств тио-фана было получено при подсчете числа живых плодов, постимплантационной гибели и времени для принятия крысятами адекватной реакции в стресс-ситуации. На фиг.1 видно, что число живых плодов на 20-й день беременности на фоне введения цисплатина составило 6,56±1,14, при сочетанном введении с тио-фаном оно возрастало и составило 8,64±0,56 (Р≤0,05). На фиг.2 видно, что при сочетанном введении цитостатика и корректора постимплантационная гибель снижалась до 7,36±2,05, в то время как при использовании одного цисплатина она составила 26,66+9,99 (Р≤0,05). Фиг.3 свидетельствует о том, что на фоне сочетанного введения препаратов время, необходимое крысятам для принятия правильного решения в стресс-ситуации, составило 32,29±12,24 (для самцов, фиг.3 а, в) и 19, 63±3,58 (для самок, фиг.3б), в то время как при использовании одного цисплатина оно составило 83,29±14,96 и 60,17±11,64 соответственно (Р≤0,05). Следует отметить, что значения отмеченных выше показателей в группе комбинированной терапии практически не отличались от таковых в контроле.
Представленные данные свидетельствуют о том, что при применении тио-фана на фоне цитостатического воздействия наблюдались более высокие показатели воспроизводящей функции крыс-самок. Так, возрастала вероятность сохранения беременности, судя по увеличению числа живых плодов и более низкой эмбриональной гибели (постимплантационной). Потомство характеризовалось большей жизнеспособностью, судя по его адаптивным возможностям.
Полученные данные свидетельствуют о способности тио-фана, как и у его прототипа (месны), оказывать защитное действие при нарушениях женской репродуктивной функции, вызванных введением цитостатического препарата. Оба препарата увеличивали жизнеспособность потомства. По сравнению с месной тио-фан имеет следующие преимущества: он является малотоксичным лекарственным средством. Препарат, в отличие от прототипа, увеличивает вероятность сохранения беременности, о чем свидетельствует более высокое число живых плодов и более низкая эмбриональная гибель, по сравнению с животными, которым вводили один цитостатик. Преимуществом тио-фана является также его способность усиливать лечебный эффект цитостатического воздействия (цисплатина).
Список литературы
1. Гершанович М.Л. Осложнения при химио- и гормонотерапии злокачественных новообразований. - М. Медицина: 1982. - С.51, 80.
2 Шилин Д.Е., Игнашина Е.В. Использование овариопротекторов при цитостатической химиотерапии у пациенток репродуктивного возраста // Пробл. эндокринологии. - 1999. - Т.45, № 6. - С.37.
3. Дурнев А.Д., Середенин С.Б. Мутагены. Скрининг и фармакологическая профилактика воздействий. - М.: Медицина. - 1999. -. С.60.
4. Урманчеева А.Ф., Кутушева Г.Ф. Проблемы фертильности, контрацепции и заместительной терапии у пациенток после лечения рака молочной железы // Онкология. - 2002. - Т.3, № 1. - С.53.
5. Противоопухолевая химиотерапия. / Под ред. Н.И.Переводчиковой. - М.: Медицина, 1993. - С.10.
6. Новикова Е.Г., Сидоров И.С., Антошечкина М.А. и др. Сохранение репродуктивной функции после излечения начальных форм рака шейки матки, эндометрия и яичников // Росс. онкол. журнал. - 1996. - № 1. - С.33-37.
7. Зенкова Е.В. Состояние эндокринной системы при некоторых формах гемобластозов в динамике противоопухолевой химиотерапии: Автореф. дисс.… к-та мед. наук. - Новосибирск, 2004. - 23 с.
8. Пахомова А.В. Гонадотоксические эффекты платиносодержащих цитостатических препаратов: Автореф. дисс.… к-та мед. наук. - Томск, 2004. - 23 с.
9. Видаль. Справочник. Лекарственные препараты в России. - 1998.
10. Видаль. Специалист // Справочник "Онкология". - 2005. - С.318.
11. Богуш Т.А., Калдаева Е.Ю, Смирнова Г.Б. и др. Влияние месны на летальный эффект и гематологическую токсичность таксола и вепезида у мышей // Бюлл. эксперим. биол. и мед. - 2001. - Т.132, № 9. - С.301-305.
12. Овчаренко Е.П. К вопросу о методологии переноса на человека результатов экспериментального изучения влияния ионизирующей радиации на репродуктивную функцию // Актуальные проблемы влияния ионизирующего излучения на репродуктивную функцию: Тез. докл. - Обнинск. - 1992. - С.56-57.
13.Просенко Ф.Е., Терах Е.И., Кандалинцева Н.В. и соавт. Серосодержащий фенольный антиоксидант ТИО-ФАН как перспективный лекарственный препарат // Компенсаторно-восстановительные процессы: фундаментальные экологические и клинические процессы. Новосибирск. - 2004. - Материалы Всесоюзной конференции 5-7 окт. 2004 г. - С.391-392.
14. Боровская Т.Г, Гольдберг В.Е. Овариотоксичность цитостатических препаратов и способы ее фармакологической коррекции. - Томск. - 2007. - С.46-70.
15. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. / Под ред. Хабриева Р.У. - М.: Медицина, 2005.
16. Бондаренко Н.А. Рукопись деп. во ВИНИТИ, 1986. - № 20. - С.38-80.
17. Лакин Г.Ф. Биометрия. - М.: Высшая школа. - 1990. - 387 с.
Применение тио-фана-бис-[(3,5-ди-трет-бутил-4-гидроксифенил) пропил]сульфида в качестве средства для коррекции нарушений женской репродуктивной системы, вызванных цитостатическим воздействием.