Средство для стимуляции регенерации кардиомиоцитов и их внутриклеточных структур и способы его применения
Иллюстрации
Показать всеНастоящая группа изобретений относится к медицине, а именно к кардиологии, и может использоваться для стимуляции физиологической или репаративной регенерации кардиомиоцитов и их внутриклеточных структур. Для этого применяют экстракт коры свиных надпочечников. Для стимуляции физиологической регенерации кардиомиоцитов и их ядер осуществляют 5-недельный курс введения экстракта коры свиных надпочечников, через день в разовых дозах 0,5 мл. Для стимуляции репаративной регенерации митохондрий кардиомиоцитов в условиях гипобароической гипоксии используют 2-кратное введение экстракта свиных надпочечников накануне и за 30 минут до гипоксии. Предложенные изобретения обеспечивают эффективную физиологическую или репаративную регенерацию кардиомиоцитов, в том числе за счет разработанных режимов введения экстрактов свиных надпочечников. 3 н.п. ф-лы, 2 табл., 6 ил.
Реферат
Предлагаемое изобретение относится к медицине, а именно к кардиологии, и может использоваться для стимуляции физиологической и репаративной регенерации кардиомиоцитов и их внутриклеточных структур (ядер, митохондрий).
В перспективе (после проведения соответствующих клинических исследований) возможной областью использования предлагаемой группы изобретений может быть лечение дистрофических процессов в мышце сердца, потери части сократительного миокарда и сердечной недостаточности.
Проблема метаболизма миокарда является самым обсуждаемым вопросом в современной кардиологии. Распространенность сердечной недостаточности (СН) в европейских странах колеблется в пределах от 1,5 до 4,0%. Как показали исследования в восьми регионах России (В.Ю.Мареев и соавт 2003), встречаемость такого критерия как одышка плюс наличие какого-либо сердечно-сосудистого заболевания, в популяции было 9,7%. При ужесточении критерия встречаемость триады симптомов - одышка, утомляемость и сердцебиение - составляла 5,5%, что примерно в 2,5 раза больше, чем в Западной Европе. Но если оценивать еще более жесткий критерий - одышка, утомляемость, сердцебиение и отеки, т.е. признаки клинически выраженной СН - третьего-четвертого функционального класса (Ш-1У ФК), то таких больных 2,3%.
Оценка влияния нозологии на формирование СН показала, что первичным диагнозом в подавляющем большинстве случаев (в 78%) была хроническая форма ишемической болезни сердца (ИБС). Но если рассматривать относительный риск, то тогда оказывается, что артериальная гипертония (АГ) за счет распространенности выходит на первое место. На втором месте ИБС, сахарный диабет выходит на третье место. Если же рассматривать больных с выраженной СН (Ш-1У ФК), тех, у которых кроме одышки, сердцебиения, утомляемости есть еще и отеки (их всего 2,3%), то АГ и ИБС как факторы риска остаются безусловными лидерами, а диабет определенно уходит на третье место. Если рассматривать значение добавочной роли популяционного риска СН - предположительное число случаев возникновения выраженной СН(Ш-1УФК)у больных с тем или иным заболеванием будут иметь СН 80 пациентов с АГ из 1000 (8%), 5,5% с ИБС и 1,3% с СД.
На любом из этапов развития сердечной недостаточности имеются нарушения метаболизма миокарда. Даже при небольшом снижении кровотока развиваются метаболические изменения, которые связаны с уменьшением образования аденозинтрифосфатов, нарушением утилизации кислорода, увеличением продукции лактата, ионов водорода.
При хронической сердечной недостаточности (ХСН) метаболический синдром включает нарушения углеводного и белкового обмена, нарушения метаболизма лептина и синдром растраты (Л.И.Ольбинская, 2003). Нарушения углеводного обмена связаны с инсулинорезистентностью и рефлекторной гиперинсулинемией. Это приводит к тому, что нарушается толерантность к глюкозе и впоследствии может развиться сахарный диабет, как правило, второго типа. Среди причин на первом месте активация симпатоадреналовой системы, на втором - активация системы цитокинов, изменения в системе лептина, эндотелиальная дисфункция с нарушениями продукции оксида азота и с нарушением образования брадикинина, а также морфофункциональные изменения в органах и тканях, в частности в поджелудочной железе.
Нарушения белкового обмена выражаются в усилении процессов катаболизма, потерь белка в результате повышенной активности симпатоадреналовой системы, повышения образования лептина, активации системы цитокинов и нарушения функции почек. С другой стороны, нарушения белкового обмена связаны с нарушением усвоения и синтеза белка, в частности с нарушением всасывания в кишечнике при застойных явлениях. Нарушения белкового обмена проявляются прогрессирующим похуданием и астенией, появляются безбелковые отеки, не связанные с сердечной недостаточностью. Наблюдается выраженное снижение толерантности к физической нагрузке, параллельно отмечается диспротеинемия. Содержание альбуминов в плазме резко снижается, развививаются анемия, нарушения функции печени, почек и иммунодефицитные состояния.
Лептин - гормон пептидной природы, близкий по структуре к провоспалительным цитокинам, секретируется клетками жировой ткани и циркулирует в крови в свободном и связанном состоянии. Он приводит к уменьшению потребления пищи, а уменьшение потребления пищи увеличивает активность лептина. Повышение активности симпатоадреналовой системы также увеличивает активность лептина, который может увеличивать расход энергии, повышая скорость обменных процессов. Лептин имеет рецепторы в легких, почках, печени, поджелудочной железе, надпочечниках и мышцах. И от состояния этих рецепторов зависит степень нарушения обмена, его агрессивное влияние.
Критериями «синдрома растраты» является непреднамеренная потеря более 70% массы тела в сроки более шести месяцев, индекс массы тела менее 24 кг/м2, гипотрофия и атрофия мышц, атрофия височных мышц, снижение мышечной силы. Среди причин на первом месте стоит активация системы провоспалительных цитокинов, также активация симпатоадреналовой системы и связанное с этим повышение метаболизма, гиперлипидемия, особенно гиперрезистентность к лептину, нарушение всасывания в кишечнике, нарушения питания и сопутствующая анорексия.
При лечении хронической сердечной недостаточности большое место отводится лекарственным средствам, влияющим на метаболизм в тканях: снижение активности симпатоадреналовой системы, коррекция нарушений в системе оксида азота, влияние на систему брадикинина и снижение активности системы цитокинов, а также влияние на метаболизм лептина.
В числе средств, которые используются для коррекции нарушенного углеводного обмена у больных ХСН - препараты максонидина (физиотенз в суточной дозе не более 1-2 мг), акарбоза, замедляющие всасывание углеводов из тонкого кишечника путем ингибирования фермента а-глюкозидазы.
Нарушения белкового обмена корригируются торможением процессов катаболизма, что достигается использованием бета-адреноблокаторов, а также блокаторов рецепторов к фактору некроза опухоли -ФНО-а (этанерцепт, ремикейд). Восполнение белковых потерь и нарушение синтетических функций печени осуществляется с помощью нутритивной поддержки (нутрилан и др), парентерального введения альбумина. Снижению активности ФНО-а способствует включение бесопролола. Нарушение обмена лептина достигается назначением бета-адреноблокаторов и ингибиторов ангиотензинпревращающего фермента (АПФ).
Поскольку «синдром растраты» связан с повышением активности симпатоадреналовой системы и ренин-ангиотензи-альдостероновой системы (РААС), то применяются препараты, которые прерывают этот процесс. Это бета-адреноблокаторы (карведиол, метопролол, бисопролол), ингибитороы АПФ (периндоприл), антиоксиданты и препараты, улучшающие тканевое дыхание (гипоксен). Для подавления активности ФНО-а рекомендуются также пентоксифилин (трентал), антогонисты рецепторов ФНО-а (этанерцепт).
Заслуживает внимание тот факт, что применение всех гипотензивных и ингибирующих активность ферментов препаратов при гипертонической болезни и ишемической болезни сердца сопровождаются побочными явлениями, представленными в различных сочетаниях и разной степени выраженности. Так, например, применение каптоприла (ингибитора АПФ) может сопровождаться потерей аппетита, тошнотой, рвотой, головной болью, сонливостью, атаксией, нарушением аккомодации. Бывает лейкопения, тромбоцитопения, агранулоцитоз, гепатит, аллергические реакции в виде кожной сыпи, дерматита, отеки, лимфаденопатия, интерстициальный нефрит, галакторея, гипо- или гипертония, гинекомастия.
Применение конкора (бета1-селективный адреноблокатор) может вызвать усталость, головокружение, ощущение приливов крови к лицу, головные боли, расстройство сна, депрессию, галлюцинации, уменьшение слезоотделения, конъюнктивит, ортостатическую гипотензию, брадикардию, нарушение атриовентрикулярной проводимости, у некоторых усиление сердечной недостаточности с развитием периферических отеков, диарею, запор, тошноту, боли в животе, мышечную слабость, судороги, зуд, повышенную потливость, возможно появление псориазоподобных высыпаний или усиление имеющегося псориаза, снижение толерантности к глюкозе, снижение потенции.
Кордафлекс (блокатор кальциевых каналов) может привести к выраженной артериальной гипотонии, периферическим отекам, тахикардии, редко - усилению приступов стенокардии, парестезии в конечностях, тремору, нарушению сна, сонливости, незначительным преходящим расстройствам зрения, гипертрофическому гингивиту, диарее, запору, внутрипеченочному холестазу, повышению активности печеночных трансаминаз, тромбоцитопении, лейкопении, редко - анемии, вызвать экзантему, кожный зуд, гиперемию лица и кожи верхней части туловища, лихорадку, гипергидроз, миалгии, гинекомастию, снижение либидо и пр.
В последние годы разрабатываются подходы к миокардиальной протекции. Это стратегия подавления метаболизма жирных кислот и стимуляция метаболизма глюкозы. Достигается ингированием ферментов, осуществляющих окисление жирных кислот в митохондриях (в основном триметазидином); ингибированием ферментов, ответственных за транспорт жирных кислот через митохондриальные мембраны (этомоксином); ингибированием биосинтеза переносчика жирных кислот через митохондриальные мембраны (карнитином). В условиях недостатка кислорода наблюдается нарушение утилизации жирных кислот и увеличение их содержания.
Наиболее изучен специфический модулятор метаболизма жирных кислот - триметазидин, который предотвращает увеличение окисления жирных кислот при реперфузии. Сегодня установлен механизм действия триметазидина, приводящий к снижению окисления жирных кислот и стимуляции окисления глюкозы. Итогом кардиопротективного эффекта триметазидина является оптимизация функции миокарда в условиях ишемии за счет снижения продукции протонов и ограничения внутриклеточного накопления натрия и кальция. Это ускорение обновления мембранных фосфолипидов и защита мембран от повреждающих действий длинноцепочечних ацильных производных.
Эффект триметазидина изучен как в виде монотерапии, так и комбинированной терапии, в том числе при тяжелой СН. Терапия триметазидином в дозе 60 мг в течение двух месяцев сопровождалась достоверным увеличением фракции выброса и уменьшением конечного диастолического объема.
По данным Шляхто Е.В (2003), проводившим лечение триметазидином больных СН в течение трех месяцев, уменьшался функциональный класс СН с 2,9 до 2,27 по сравнению с контролем, наблюдалось увеличение фракции выброса. Эффекты триметазидина происходили без значительных изменений гемодинамики, без изменения артериального давления, числа сердечных сокращений, реализовались на уровне миокарда.
Эффективность современного лечения сердечно-сосудистых заболеваний, сопровождающихся потерей части работоспособного миокарда (ишемическая болезнь сердца, инфаркт миокарда, сердечная недостаточность), ограничивается 30-35% снижения риска смерти. Дальнейший прогресс в этом направлении связан с разработкой новых подходов медикаментозного лечения, в частности регенеративной или клеточной терапией (Ю.Н.Беленков, Ф.Т. Агеев, В.Ю.Мареев и др., 2003).
Представления о регенерации менялись по мере расширения возможностей познания биологических процессов, в особенности с внедрением электронной микроскопии. Л.В.Полежаев (1968) относил к регенерации «восстановление организма, органа, ткани, клеток или части клеток после их повреждения». В то же время А.А.Войткевич (1968) писал о том, что «регенерация представляет собой образование новых клеточных и субклеточных компонентов органа». Д.С.Саркисов (1970) относит внутриклеточные регенераторные и гиперпластические процессы к основным формам регенераторной реакции. По его мнению, если бы закономерности регенераторной реакции изучали в эксперименте в условиях, близких к клиническим, а не имеющих с ними мало общего, то без труда увидели бы, что при многочисленных патологических процессах в различных внутренних органах важнейшими, наиболее распространенными и постоянно встречающимися являются дистрофические изменения клеток и последующее их исчезновение в случаях выздоровления, т.е. столкнулись бы прежде всего с деструктивными и регенераторными процессами, сосредоточенными внутри клеток. Митотическая активность, т.е. размножение клеток, тут отступает на второй план, так как речь идет не столько о гибели клеток, сколько о той или иной степени их повреждения, а затем восстановлении. (Регенерация и ее клиническое значение, 1970, стр.64.) Репаративная внутриклеточная регенерация может выражаться не только в нормализации строения дистрофически измененных клеток, но и в компенсаторной интенсификации ритма внутриклеточной физиологической регенерации ультраструктур. Следующей формой внутриклеточной репаративной регенерации является компенсаторная гиперплазия ультраструктур в одной клетке при гибели другой. Наконец, еще одной формой репаративной внутриклеточной регенерации является компенсаторная гиперплазия ультраструктур при гиперфункции органа.
Внутриклеточная репаративная регенерация обычно наблюдается при диффузных и очаговых дистрофических изменениях мышечных волокон, возникающих при паренхиматозных и интерстициальных миокардитах разной этиологии, различных токсических воздействиях, гипоксических состояниях, нарушениях питания и т.д., причем в чистом виде она бывает именно в тех случаях, когда дистрофические изменения не доходят до некротических, т.е. когда нет гибели мышечных волокон. Если же последняя тоже имеет место, то к внутриклеточной репаративной регенерации в той или иной мере присоединяется и внутриклеточная компенсаторная гиперплазия ультраструктур. Физические нагрузки сопровождаются принципиально такими же изменениями ультраструктур мышечных клеток сердца, которые возникают при различных патологических процессах: набуханием митохондрий, просветлением их матрикса, частичным или значительным уменьшением числа их внутренних перегородок, расширением канальцев саркоплазматического ретикулума. Физиологическая регенерация при крайних ситуациях сближается с репаративной регенерацией.
Внутриклеточная форма регенераторной реакции свойственна миокарду и является наиболее целесообразным способом материального обеспечения различных режимов работы сердца. Примечательно, что после убыли даже значительного объема миокарда вес сердца вскоре восстанавливается за счет внутриклеточной компенсаторной гиперплазии ультраструктур оставшейся мышцы. В органах, которым свойственна преимущественно внутриклеточная регенераторная реакция (к которым относятся прежде всего мозг и мышца сердца), структурной (узловатой) перестройки паренхимы в процессе болезни не происходит.
При анализе причин и механизмов декомпенсации гипертрофированного сердца Д.С.Саркисов предлагает иметь в виду три основные предпосылки, что:
1) гипертрофия миокарда представляет собой особую форму регенераторной реакции, столь же полноценную в смысле обеспечения компенсации нарушенных функций, как и другие, но в отличие от них сосредоточенную преимущественно внутримышечных волокон;
2) гипертрофия миокарда в принципе может достигать очень высоких степеней и длительно обеспечивать необходимый уровень сердечной деятельности, однако, как правило, этого не бывает и декомпенсация последней наступает задолго до того, как миокард исчерпает свои резервные возможности;
3) важнейшую роль в таком преждевременном наступлении сердечной недостаточности играют факторы, лежащие вне мышечного волокна. К ним относятся нейроэндокринные влияния, анатомические изменения сосудов (атеросклероз) и развитие кардиосклероза.
Следует заметить, в неврологии (как и в кардиологии применительно к кардиомиоцитам) принято считать, что нейроны головного мозга не способны к регенерации. Однако в последние годы появился интерес к пролиферации новых нейронов из предшественников в поджелудочковых структурах мозга (зубчатой извилине и гиппокампе), миграции их в другие регионы, которые больше выражены в раннем возрасте, но, уменьшаясь, сохраняются в течение всей жизни. Dentate gyrus взрослого млекопитающего содержит нервные клетки предшественники с мультипотенциалом развития и самовозобновлением. Происхождение и созревание нервных предшественников определены в соответствии с составом и уровнем трофических факторов в их микроокружающей cpeдe (Kosaka N. et аl, 2006).
Что касается клеточной терапии, то наиболее продвинутыми в настоящее время являются методы трансплантации аутологичных миобластов, а также стволовых клеток (СК) костного мозга непосредственно в поврежденные ткани сердца. Миобласты скелетной мускулатуры не являются стволовыми клетками. С самого начала, являясь высокодифференцированными клетками, миобласты практически утрачивают способность делиться и не самовоспроизводятся (за исключением 5% мышечных клеток сателлитов). Однако после специальной обработки восстанавливается способность миобластов к митозу, по крайней мере in vitro. До 2003 года в странах Европы и США было проведено лечение более чем 50 таких больных. Вначале во всех случаях у больных отмечалось улучшение состояния, повышение сократимости миокарда. В дальнейшем у части оперированных наряду с клиническим улучшением стали появляться эпизоды жизнеугрожающей желудочковой аритмии, связанной с данным вмешательством. Этот феномен стали объяснять формированием вместе трансплантации миобластов колоний мышечных клеток, не ассоциированных с окружающей тканью и без соответствующей электрической инфраструктуры.
В те же сроки (с 2001 по 2003 г) трансплантация стволовых клеток костного мозга была выполнена более чем у 100 больных в странах Европы, Японии и США. Стволовые клетки в количестве 2 млн. за инфузию вводились через катетр в ишемизированные зоны. Отмечалось общее улучшение, повышение сократительной способности миокарда, особенно заметной в тех сегментах, в которые производились инъекции, уменьшались зоны гипоперфузии. Однако остается много не решенных вопросов, в частности причины массовой гибели пересаженных клеток, какие клеточные и генетические механизмы регулируют эти процессы.
Таким образом, среди известных средств нет таких, которые бы оказывали непосредственное воздействие на регенерацию кардиомиоцитов и их внутриклеточных структур.
В задачу предлагаемого изобретения положена разработка средства и способов стимуляции регенерации кардиомиоцитов и их внутриклеточных структур (ядер, митохондрий).
Поставленная задача достигается применением экстрактов коры свиных или фетальных надпочечников в качестве средства стимуляции физиологической и репаративной регенерации кардиомиоцитов и их внутриклеточных структур.
Поставленная задача достигается также способом стимуляции физиологической регенерации кардиомиоцитов и их ядер, ОТЛИЧАЮЩИМСЯ тем, что вводят экстракт коры свиных или фетальных надпочечников в разовой дозе 0,5 мл на 100 г массы тела организма через день, общим курсом 5 недель.
Поставленная задача достигается также способом стимуляции репаративной регенерации митохондрий кардиомиоцитов в условиях гипобарической гипоксии, ОТЛИЧАЮЩИМСЯ тем, что вводят экстракт коры свиных или фетальных надпочечников в разовой дозе 0,5 мл накануне и за 30 минут до воздействия гипобарической гипоксии.
Возможность использования экстрактов свиных или фетальных надпочечников в качестве средства стимуляции регенерации кардиомиоцитов и их внутриклеточных структур показана в предлагаемом изобретении впервые. Ранее экстракты коры свиных и фетальных надпочечников использовались по другим назначениям, а именно: для стимуляции репаративных процессов в патологически измененной печени (RU №2185835, С2 27.07.2002); для коррекции острой почечной недостаточности при токсическом гепаторенальном синдроме (RU №2290940, С2 10.01.2007); для нормализации энергетических процессов в тканях организма в условиях гипоксии (RU №2190416, С2 10.10.2002).
В современных подходах к пониманию СН сохраняются ранее установившиеся представления о важнейшем значении нейроэндокринных механизмов, которые вызывают различные функциональные изменения в миокарде и через оксидативный стресс, ишемию, экспрессию генов индуцируют апоптоз.
В свете этих данных заслуживают внимания полученные нами анаболические эффекты минорных концентраций кортакостероидов, содержащихся в экстрактах коры фетальных и свиных надпочечников, на миокард экспериментальных животных в условиях гипобарической гипоксии и при длительном (в течение 5 недель) парентеральном введении.
Как известно, надпочечники вместе с плацентой играют исключительную роль в обеспечении интенсивного внутриутробного роста. В первые 5 месяцев длина тела плода равняется возрасту в месяцах, возведенному в квадрат, а в последующие 5 месяцев - возрасту в месяцах, умноженному на 5. Так интенсивно организм никогда больше не растет. Этому способствует сочетание отдельных гормонов, присутствие в повышенной концентрации дегидроэпиандростерона, являющегося слабым андрогеном и предшественником тестостерона и эстрогенов, которые синтезируются из него на тканевом уровне. Пиковых концентраций в крови дегидроэпиандростерон достигает к 25 годам, а после 40 лет постепенно снижается на 95% приблизительно к 85-летнему возрасту. Имеются предпосылки связывать долговечность и меньшую вероятность смерти от сердечно-сосудистой болезни при высокой обеспеченности организма этим гормоном. Недавно обнаружена способность дегидроэпиандростерона подавлять провоспалительные цитокины, такие как интерлейкин-6, фактор некроза опухоли-альфа, которые возрастают при старении организма и занимают важное место в патогенезе сердечной недостаточности. Кроме того, дегидроэпиандростерон увеличивает способность организма « преобразовывать продовольствие в энергию и сжигать дополнительный жир» (LeowattanaW/2001).
Экспериментальными исследованиями на растущих крысах (Patel M.A. et all, 2006) было показано, что в дозе 1 мг/кг в течение 5 недель дегидроэпиандростерон не изменял прибавки в массе тела, но увеличивал массу мозга в послеродовой жизни, стимулировал окислительные процессы в митохондриях мозга, повышая содержание цитохромов (3) и b, активность дегидрогеназ и АТФ-азную деятельность.
Таким образом, экстракты коры надпочечников, содержащие гамму гормоноактивных соединений, оказывающих паракринные влияния на метаболические процессы в тканях, могут оказаться полезными при дистрофических процессах в мышце сердца, потере части сократительного миокарда и сердечной недостаточности.
Предлагаемый способ разработан в двух сериях экспериментов на растущих животных. В первой серии эксперимент проводился на 25 растущих беспородных крысах-самцах с массой тела в начале опыта 99,8+-3,7 г и длиной тела 12,44+-0,58 см. В конце опыта животные имели вес 181,7+-12,7 г и длину тела 14,0 см. Животные были разделены на 5 групп, из которых 5 животных были интактными (1 группа контроля), 5 животных получали 10% раствор этилового спирта на физиологическом растворе хлорида натрия (2 группа контроля), 5 животных получали гидрокортизон (10 мг/кг) на основе 10% раствора этилового спирта (3 группа); 5 животных получали экстракт коры свиных надпочечников (4 группа) и 5 животных получали экстракт коры фетальных надпочечников, взятых при вскрытии погибших в родах плодов человека (5 группа).
В другой серии исследований (18 крыс) животные подвергались гипобарической гипоксии с медленным подъемом (по 1000 м в минуту) на высоту 10000 м, пребыванием их на такой высоте в течение 40 минут и в последующем таким же медленным опусканием (по 1000 м в минуту) до нормального атмосферного давления. За сутки и за 30 минут до гипобарической гипоксии 3 группам животных вводились подкожно в объеме 0,5 мл препараты: экстракт коры фетальных надпочечников, экстракт коры свиных надпочечников, гидрокортизон (10 мг/кг) на основе изотонического раствора хлорида натрия. В качестве контроля (1 группа) использовались интактные (1 группа); животные, которые подвергались гипобарической гипоксии без предварительного введения препаратов (2 группа); животные с предварительным введением этилового спирта на основе физиологического раствора хлорида натрия составили 3 группу. После возврата животные подвергались декапитации и забиралось их сердце для электронной микроскопии.
Экстракты коры надпочечников готовились по принципу органных препаратов, из 3,0 г ткани получали 1 мл экстракта. Препараты в объеме 0,5 мл вводились через день в течение 5 недель. Методом радиоиммунологического анализа в экстрактах коры надпочечников были определены концентрации гидрокортизона, дегидроэпиандростерона и прогестерона. В 0,5 мл экстракта коры свиных надпочечников содержалось гидрокортизона - 65 нмоль, дегидроэпиандростерона - 0,83 нмоль и прогестерона - 1,1 нмоль. В 0,5 мл экстракта коры фетальных надпочечников содержалось гидрокортизона - 5,0 нмоль, дегидроэпиандростерона - 1,15 нмоль и прогестерона - 0,45 нмоль. В 0,5 мл вводимого животным раствора гидрокортизона содержалось 2,6 мкмоль препарата.
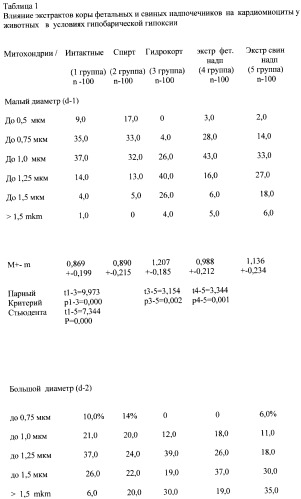
После 16 инъекций препаратов через день животные забивались, сердце подвергалось парафинизации и срезы окрашивались гематоксилином и эозином. Микроскопические измерения проводились при увеличении 7×90 и с помощью шкалы определялись два диаметра ядра (большой и малый) и поперечный диаметр кардиомиоцита. Ценность деления шкалы была определена с помощью микрометра, одно деление шкалы составляло 16,6 mkm.
При расчете площади ядра пользовались формулой
S mkm2=3,14·0,12·(a/2·16,6)·(b/2·16,6), где 0,12 поправочный коэффициент на оптические среды микроскопа, а - большой диаметр, b - малый диаметр, 16,6 - ценность одного деления шкалы. Диаметры ядра клеток определялись по формуле:
d1,d2mkm=3,14·0,12·а (или b)·16,6. При измерении диаметров митохондрий из формулы исключался поправочный коэффициент (0,12). Полученное электронной фотографией увеличение в компьютере умножалось в 2,5 раза.
Ранее вычисленные таким способом размеры клеток были сопоставимы с нормативными данными, приводимыми Ю.М.Жаботинским в монографии «Нормальная и патологическая морфология нейрона», 1965, а размеры митохондрий кардиомиоцита - нормативным данным, приводимым в учебнике гистологии для студентов медицинских институтов 1983 (Ю.И.Афанасьев, стр.340).
Существенными являются количественные показатели предлагаемых способов стимуляции регенерации.
Разовая доза вводимых экстрактов коры свиных и фетальных надпочечников
(0,5 мл на 100 г массы тела) существенно не изменяет физиологических концентраций гормонов в организме и, по меньшей мере, в 30 раз ниже используемых в лечебной практике применительно к гидрокортизону, что позволяет избежать отрицательных эффектов больших доз гормонов. Как показали ранее выполненные нами исследования, вводимые в такой дозе экстракты коры свиных и фетальных надпочечников оказывали положительное влияние на регенераторные и энергетические процессы в других тканях.
Двукратное введение экстрактов коры надпочечников обусловлено тем, что ожидался больший стимул организма на повторное введение препарата, что используется и при вакцинации. Введение экстрактов коры надпочечников за 30 минут до гипобарической гипоксии определялось достаточностью такого времени для всасывания препарата в кровь после подкожного введения его (Т.Т.Подвигина и др., 2002), что было важно для животных, подвергаемых гипоксическому стрессу.
Данные исследований представлены в таблицах и электронных фотоснимках.
На фиг.1 представлена фотография электронной микроскопии сердца интактного животного (увеличение 6 тыс.×2,5).
На фиг.2 представлена фотография электронной микроскопии сердца животного после гипобарической гипоксии (увеличение 13 тыс.×2,5).
На фиг.3 представлена фотография электронной микроскопии сердца животного после гипобарической гипоксии с предварительным введением экстракта коры фетальных надпочечников (увеличение 6 тыс.× 2,5).
На фиг.4 представлена фотография электронной микроскопии сердца животного после гипобарической гипоксии с предварительным введением экстракта коры свиных надпочечников (увеличение 6 тыс.×2,5).
На фиг.5 представлена фотография электронной микроскопии сердца животного после гипобарической гипоксии с предварительным введением гидрокортизона. (увеличение: 7 тыс.×2,5).
На фиг.6 представлена фотография электронной микроскопии сердца животного после гипобарической гипоксии с предварительным введением 10% раствора этилового спирта на физиологическом растворе NaCl (увеличение: 6 тыс.×2,5).
Как показывают исследования, в сравнении с интактными животными (фиг.1) при гипобарической гипоксии без защиты препаратами (фиг.2) наблюдается значительный отек структур кардиомиоцита, набухание и разрывы митохондрий, фетальных надпочечников (фиг.3) гипобарическая гипоксия протекала с небольшим отеком кардиомиоцита, митохондрии представлены в увеличенном количестве, разных размеров и сохраненной структурой, хорошо представлены кристы, отсутствуют разрывы митохондрий.
У животных, получивших экстракт коры свиных надпочечников (фиг.4), перед проведением эксперимента с гипобарической гипоксией электронно-микроскопическая картина кардиомиоцита мало отличалась от таковой после введения экстракта фетальных надпочечников. Умеренно выражен внутриклеточный отек, расширения эндоплазматической сети, митохондрии разных размеров, хорошо представлены кристы, разрывов митохондрий нет.
Обращает внимание принципиально отличающаяся картина электронной фотографии кардиомиоцита у животных, которым перед подъемом на высоту вводился гидрокартизон в дозе 10 мг/кг массы (фиг.5). Митохондрии увеличены, смазан рисунок их крист и миофибрилл, подчеркнуты границы митоходрий (возможно, за счет уменьшения синтеза гексозоаминогликанов, отличающихся гидрофильностью, и чем отчасти можно объяснить противовоспалительный эффект при их использовании).
Следует заметить, что аналогичную картину представляет электронная микроскопия у животных, получивших вместо экстрактов коры надпочечников 10% раствор спирта на физиологическом растворе (фиг.6). По-видимому, этиловый спирт легко проникает в митохондрии и, обладая осмотическим эффектом, привел к набуханию митохондрий и дегидратации окружающих структур.
Эти данные позволяют считать, что кортикостероиды, содержащиеся в экстрактах коры надпочечников в минорных концентрациях, смягчают отрицательные воздействия как гипоксии, так и этилового спирта.
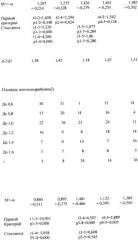
В таблице 1 обращает внимание увеличение обоих диаметров и площади митохондрий в группе животных, которым вводился гидрокортизон; на округление митохондрий указывает и уменьшение d2/d1 (1,18). При введении экстрактов коры фетальных надпочечников длина митохондрий была больше поперечника (d2/d1=1,43); при введении экстрактов коры свиных надпочечников отношений длины к поперечнику митохондрий было несколько меньше, что отражало некоторое округление и соответственно площадь митохондрий была больше (1,389+-0,505 мкм2). Следует подчеркнуть, что площадь митохондрий после введения экстрактов коры фетальных надпочечников в меньшей мере была увеличена в сравнении с контролем, что, на наш взгляд, отражает мягкость их анаболического эффекта.
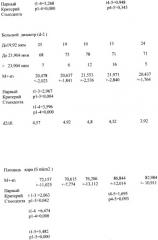
Как показано в таблице 2, после длительного (5-недельного) введения экстрактов коры надпочечников диаметр кардиомиоцита был существенно увеличен только у животных, получивших экстракты коры надпочечников, и в большей мере после введения экстрактов коры фетальных надпочечников в сравнении со свиными (р=0,005). Площадь ядра кардиомиоцита также была больше у животных, получивших экстракты коры надпочечников (р1-4,5=0,000), имелась тенденция к большему увеличению площади ядра после введения экстракта коры фетальных надпочечников в сравнении со свиными (р4-5=0,093). Округление ядра кардиомиоцита было представлено больше после введения экстракта свиных надпочечников (d2/d1=3,92), а удлинение ядра - после гидрокортизона (d2/d1=4,8) и раствора спирта (d2/d1=4,92).
Проведенные экспериментальные исследования подтверждают защитную роль минорных концентраций кортикостероидов, содержащихся в экстрактах коры фетальных и свиных надпочечников на мышцу сердца, в условиях гипоксии в противоположность этиловому спирту и гидрокортизону, представленному в терапевтических дозировках.
При длительном применении экстрактов коры надпочечников увеличиваются в размерах кардиомиоциты и их ядра, что связано с трофическим воздействием минорных концентраций гормонов (в отличие от фармацевтических концентраций гидрокортизона) на метаболические процессы в клетках, обеспечивающих их регенерацию. Анаболическому эффекту минорных концентраций кортикостероидов, содержащихся в экстрактах коры надпочечников, возможно, способствуют и тормозящие эффекты дегидроэпиандростерона, прогестерона и гидрокортизона на активность ядерного фактора транскрипции В (NFkappaB), обладающего провоспалительным действием через активацию IL-1,6 и TNF и др. цитокинов. Вместе с тем, дегидроэпиандростерон, прогестерон и гидрокортизон в низких концентрациях подавляют активность провоспалительных цитокинов и сдерживают активность протеасом 26, устраняя избыточную потерю внутриклеточных белков в отличие от высоких концентраций гидрокортизона, которые стимулируют глюконеогенез ценой белковой растраты. Следует заметить, что катаболическому эффекту избыточного материнского гидрокортизона на плод в период внутриутробного развития препятствует плацента, в которой повышена активность 11-бета гидрооксистероид дегидрогеназы, инактивирующая активность гидрокортизона, превращая его в неактивный кортизон, чем предотвращается задержка роста и развития (Michael A.E. et al, 2003); в то же время нарушения образования и поступления гидрокортизона в организм плода задерживают рост и дифференцировку его органов, в особенности легких, что приводит к синдрому дыхательных расстройств у незрелых новорожденных, требующих введение гидрокортизона в перинатальный период (G.A.Lodygensky et.al. 2005).
Литература
1. Афанасьев Ю.И. Сердечно-сосудистая система. Сердце. Гистология. Учебная литература для студентов медицинских институтов. Изд.3 под ред. В.С.Елисеева, Ю.И.Афанасьева, Н.А.Юриной. М.: Медицина, 1983, стр.340.
2. Беленков Ю.Н, Мареев В.Ю., Агеев Ф.Т., Фомин И.В, Хохлов Р.А, Галявич А.С, Камалов Г.М., Тарновская Е.И., Щербина Е.В., Сайфутдинова Р.И.Макарова В.Г. Якушин С.С., Кечетжиева С.Г., Макарова Н.В., Маленкова В.Ю. Первые результаты Российского эпидемиологического исследования по ХСН. Журнал Сердечная недостаточность, том 4, №1(17), 2003, 17-18.
3. Беленков Ю.Н., Агеев Ф.Т., Мареев В.Ю., Сычев А.В., Саидова М.О. Стволовые клетки и их применение для регенерации миокарда. Журнал Сердечная недостаточность. Том 4. №4(20), 2003, 168-173.
4. Войткевич А.А. Архив анатомии, гистологии и эмбриологии. 1968, 9,84.
5. Ольбинская Л.И. Метаболический синдром у больных с хронической сердечной недостаточностью: подходы к лечению. Журнал Сердечная недостаточность, том 4,31 (17), 2003, 12-14.
6. Подвигина Т.Т., Богданов А.И., Филаретова Л.П. Зависимость процессов заживления эрозий слизистой оболочки желудка, вызванных индометацином от содержания глюкокортикоидов в крови у крыс. Патологическая физиология и экспериментальная терапия, 2002 (2), 29-31.
7. Полежаев Л.В. Утрата и восстановление регенерационной способности органов и тканей у животных. М.: 1968.
8. Саркисов Д.С. Внутриклеточные регенераторные и гиперпластические процессы - одна из основных форм регенераторной реакции. Особенности регенераторного процесса в сердце. Регенерация и ее клиническое значение. М.: Медицина, 1970, 57-71 и 207-239.
9. Шляхто Е.В. Метаболизм миокарда у больных ИБС. Журнал Сердечная недостаточность. Том 4, №1(17) 2003, 19-21).
10. Bovenberg S.A., van Uum S.H., Hennus A.R. Dehydroepiandrosterone administration in humans: evidence based? Neth J. Med. 2005, 63(8):300-4.
11. Leowattana W / DHEA(S): the fountain of youth. J. Med. Assoc. Thai. 2001, Oct; 84 Suppi 2:S 605-12.
12. Lodygensky G.A., Rademaker K., Zimine S., Gex-Fabry M., Lieftink A.F., Lazeyras F., Groenendaal F., de Vries L.S., Huppi P.S. Structural and functional brain development after hydrocortisone treatment for neonatal chronic lung disease. Pediatrics, 2005; 116