4-n-(4-арил-2,4-диоксобутирил)аминобензолсульфамиды, проявляющие противовоспалительную, анальгетическую и антимикробную активности
Иллюстрации
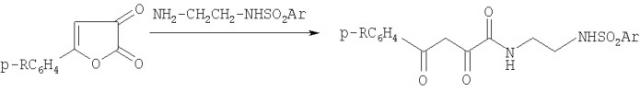
Показать все4-N-(4-Арил-2,4-диоксобутирил)аминобензолсульфамиды общей формулы:
где R=Н, С2Н5O, Cl, проявляющие противовоспалительную, анальгетическую и антимикробную активности. 3 табл.
Реферат
Изобретение относится к органической химии, а именно к ранее неизвестным сульфамидам 4-арил-2,4-диоксобутановых ароилпировиноградных кислот, проявляющих биологическую активность.
Из доступных заявителю источников известен способ получения близких по строению β-арилсульфониламиноэтиламидов ароилпировиноградных кислот, проявляющих слабую противовоспалительную и анальгетическую активность (А.В.Милютин, P.P.Махмудов, Ю.С.Андрейчиков, А.Ф.Голенева, Г.А.Тульбович, Т.И.Ковина. Химико-фармацевтический журнал. 1996. Т.30. №6. С.20-22).
где R=H, Me, MeO, 2,4-Me, F, Br, Cl; Ar=Ph, C6H4Me-p.
Недостатком указанных соединений является слабый противовоспалительный и анальгетический эффект и отсутствие антимикробной активности.
Задачей настоящего изобретения является синтез 4-N-(4-арил-2,4-диоксобутирил)аминобензолсульфамидов, свободных от указанного недостатка, и расширение арсенала средств воздействия на живой организм. Указанная задача решается 4-N-(4-арил-2,4-диоксобутирил)аминобензолсульфамидами общей формулы:
где R=H, С2Н5O, Cl,
проявляющими противовоспалительную, анальгетическую и антимикробную активность.
Синтез вышеуказанных соединений осуществляют взаимодействием 5-арил-2,3-дигидрофуран-2,3-дионов с п-аминобензолсульфамидом в диоксане при комнатной температуре в течение 30-60 минут с последующим выделением целевого продукта известными приемами.
где R=H, С2Н5O, Cl.
Реакция фурандиона с п-аминобензолсульфамидом протекает при комнатной температуре в растворе диоксана. Независимо от соотношения реагентов (1:1 или 2:1) образуются 4-N-(4-арил-2,4-диоксобутирил)аминобензолсульфамиды. При избытке фурандиона в реакционной смеси присутствует вышеуказанный амид и непрореагировавший фурандион (по данным хроматограммы). Повышение температуры до 100°С на течение реакции не влияет, однако вместо избытка фурандиона на хроматограмме наблюдается известный 6-арил-3-ароил-4-гидрокси-2-пиранон (Ю.С.Андрейчиков, Ю.А.Налимова, А.П.Козлов, И.А.Русаков. Журнал органической химии. 1978. Т.14. Вып.11. С.2436-2440).
Ниже приведены примеры синтеза заявляемых соединений.
Пример 1. 4-N-(4-Фенил-2,4-диоксобутирил)аминобензолсульфамид
В раствор 0,01 моль фенилфурандиона в 20 мл безводного диоксана добавляется 0,01 моль n-аминобензолсульфамида и перемешивается на магнитной мешалке в течение одного часа. Растворитель упаривается, выделившийся осадок перекристаллизовывают из ДМФА.
Получают 2.84 г (85%) вещества. C16H14N2O5S. Т.пл. 218-220°С (ДМФА).
Вычислено, %: С=57.8; Н=4.2; N=8.4;
Найдено, %: С=57.6; Н=4.1; N=8.5.
Пример 2. 4-N-(4-п-этоксифенил-2,4-диоксобутирил)аминобензолсульфамид
В раствор 0,01 моль п-этоксифенилфурандиона в 20 мл безводного диоксана добавляется 0,01 моль n-аминобензолсульфамида и перемешивается на магнитной мешалке в течение 30 мин. Растворитель упаривается, выделившийся осадок перекристаллизовывают из ДМФА.
Получают 3.5 г (91%) вещества. C18H18N2O6S. Т.пл. 225-226°С (ДМФА).
Вычислено, %: С=57.3; Н=4.7; N=7.4;
Найдено, %: С=57.2; Н=4.5; N=7.5.
Пример 3. 4-N-(4-хлорфенил-2,4-диоксобутирил)аминобензолсульфамид
В раствор 0,01 моль п-хлорфенилфурандиона в 20 мл безводного диоксана добавляется 0,01 моль n-аминобензолсульфамида и перемешивается на магнитной мешалке 40 минут. Растворитель упаривается, выделившийся осадок перекристаллизовывают из ДМФА.
Получают 3.57 г (94%) вещества. C16H13N2O5SCl. Т.пл. 235-234°С (ДМФА).
Вычислено, %: С=52.4; Н=3.5; N=7.6;
Найдено, %: С=52.6; Н=3.4; N=7.5.
Структура полученных сульфамидов 1-3 доказана ИК- и ПМР-спектрами. В ИК-спектрах сульфамидов, снятых в вазелиновом масле, наблюдается полоса в области 1705-1710 см-1, соответствующая поглощению амидного карбонила. В области 1600-1620 см-1 присутствует широкая полоса валентных колебаний = С-Н двух бензольных колец и Н - хелатного цикла. В интервале 3200-3280 и 3300-3370 см-1 присутствуют пики связей = N-H и -NH2.
В ПМР-спектре сульфамидов, снятых в растворе дейтеродиметилсульфоксида в интервале 6,63-8,23 м.д., находятся сигналы протонов ароматических колец, на которые наложились сигналы -N-H и =С-Н групп. В области 10,76-10,93 м.д. находится широкая полоса группы -NH2. Отсутствие сигнала метиленовой группы свидетельствует о нахождении этих соединений в растворе ДМСО исключительно в енольной форме. Отсутствие сигнала енольного гидроксила в области 14-16 м.д., по-видимому, связано с обменом протонов растворителя. Енольный гидроксил в H-хелатном цикле обнаруживается качественной реакцией с хлоридом окисного железа (появляется характерное темно-фиолетовое окрашивание).
| Таблица 1 | |||||
| 4-N-(4-Арил-2,4-диоксобутирил)аминобензолсульфамиды | |||||
| % | v, см-1 | δ, м.д. | № | ||
| 1600 (С6H5, С6Н4, С=O…ОН | 7,00-8,23 м | ||||
| H | 85 | 218-220 | 1710 (С=O амид) | (11H, C6H5, C6H4, CH=, NH) | 1 |
| 3260, 3370 (NH, NH2) | 10,83 ш.п. (2H, NH2) | ||||
| 1600-1615 (2С6Н4, С=О…ОН) | 1,23 т (3Н, СН3), 4,00 с (2Н, СН2) | ||||
| С2Н5O | 91 | 225-226 | 1705 (С=O амид) | 4,5 с (2Н, СН2), 6,63-8,13 м (10Н, | 2 |
| 3230, 3300 (NH, NH2) | 2С6Н4, СН=,NH), 10,76 ш.п. (2H, NH2) | ||||
| 1600 (2C6H6, C=O…OH) | 4,60 с (2Н, СН2), 7,06-8,23 м (10Н, | ||||
| Cl | 94 | 234-235 | 1700 (С=O амид) | 2С6Н4, СН=, NH), 10,93 ш.п. (2H, NH2) | 3 |
| 3280, 3350 (NH, NH2) |
Эффективность заявляемых 4-N-(4-арил-2,4-диоксобутирил)аминобензолсульфамидов подтверждается скринингом на анальгетическую активность по методу «горячей пластинки» (Н.В.Эдди, Д.Леймбах. Фармакология и токсикология. 311, 1960), противовоспалительной активности на модели «каррагенинового отека» {Методические рекомендции по экспериментальному изучению нестероидных противовоспалительных веществ. Фармкомитет, Москва, 1982). Чувствительность микроорганизмов к заявляемым соединениям определяли стандартным методом двукратных серийных разведений с оценкой активности по минимально действующей концентрации. Результаты биологической активности приведены в таблице 2 и 3.
| Таблица 2 | ||||
| Противовоспалительная и анальгетическая ативность 4-N-(4-арил-2,4-диоксобутирил)аминобензолсульфамидов | ||||
| Соединение и препарат сравнения | Токсичность ЛД50, мг/кг | Доза, мг/кг | Вид активности | |
| Противовоспалительная | Анальгетическая | |||
| Ингибирование отека через 4 ч, % | Величина оборонительного рефлекса, сек | |||
| 1 | 1000 | 50 | 49 | 26,0 |
| 2 | 1000 | 50 | 60 | 27,8 |
| 3 | 1000 | 50 | 30 | 23,8 |
| Контроль (крахмальная слизь) | 0 | 11,2 | ||
| Вольтарен | 380 | 8 | 53,9 | 26,0 |
| β-арилсульфониламиноэтиламиды ароилпировиноградных кислот | >1000 | 50 | 18-43,4 | 17-24 |
| Таблица 3 | |||
| Противомикробная активность 4-N-(4-арил-2,4-диоксобутирил)аминобензолсульфамидов | |||
| Соединение и препарат сравнения | Токсичность ЛД50, мг/кг | Противомикробная активность мкг/мл | |
| Е.coli | St.aureus | ||
| 1 | 1000 | 1000 | 500 |
| 2 | 1000 | 500 | 500 |
| 3 | 1000 | 250 | 500 |
| Фурациллин | 1000 | 500 |
Соединения 1-3 сопоставимы по токсичности с β-арилсульфониламиноэтиламидами ароилпировиноградных кислот. По анальгетической активности и противовоспалительному действию заявляемые соединения превосходят взятые за эталон сравнения β-арилсульфониламиноэтиламиды ароилпировиноградных кислот. Дополнительно к перечисленным активностям заявляемые соединения проявляют антимикробное действие по отношению к кишечной палочке и стафилококку, сопоставимое (соединение 1) или превосходящее (соединение 2 и 3) действие медицинского препарата фурациллин.
Предлагаемые биологически активные соединения после клинической апробации найдут применение в практическом здравоохранении.
4-N-(4-Арил-2,4-диоксобутирил)аминобензолсульфамиды общей формулы где R - Н, С2Н5О, Cl,проявляющие противовоспалительную, анальгетическую и антимикробную активности.