Способ получения антиракового средства
Иллюстрации
Показать всеСпособ получения антиракового средства на основе координационного соединения двухвалентной платины, в соответствии с которым указанным соединением платины обрабатывают водный раствор, содержащий гуминовые вещества. В качестве координационных соединений платины выбирается соединение из ряда: калия тетрахлороплатинат, цис-дихлородиаминплатина, тетрахлороплатинат водорода, калия тетрабромоплатинат. Обработку проводят под воздействием волнового излучения до величины содержания высокомолекулярной фракции гуминовых веществ не более 5%. В качестве волнового излучения выбирают излучение в ультразвуковом диапазоне частот от 18 кГц до 66 кГц с мощностью от 0,5 до 5 Вт/см3. При мощности излучения 5 Вт/см3 с частотой 22 кГц обработку проводят в течение 5-20 мин. В качестве волнового излучения может быть выбрано излучение в микроволновом диапазоне частот от 30 до 0,3 ГГц с от 0,5 до 50 Вт/см3. При мощности микроволнового облучения 0,5 Вт/см3 и частоте 2,45 ГГц поддерживают температуру обрабатываемого продукта в пределах 40-50°С в течение 30-90 мин. Способ обеспечивает получение более однородного и более стабильного при хранении продукта путем снижения относительного содержания высокомолекулярной фракции. 5 з.п. ф-лы, 5 табл., 2 ил.
Реферат
Область применения
Изобретение относится к области получения лекарственных препаратов, в частности к получению противоопухолевых средств, представляющих собой комплексные соединения металлов, а более точно к способу получения антиракового средства, содержащего комплексы платины.
Уровень техники
Противоопухолевые и антираковые препараты, содержащие координационные комплексы платины, вызывают нарушение генетического аппарата опухолевых клеток и отличаются сильным противоопухолевым действием, вследствие чего привлекают к себе внимание специалистов.
Известен способ получения координационного комплекса цис-дихлороамминизопропиламинплатины (II) из водного раствора тетрахлороплатината (II) калия с использованием органических лигандов: аммиака и изопропиламина (А, РФ 2086559). В соответствии со способом раствор тетрахлороплатината (II) калия подвергают взаимодействию с оксалатом аммония и обрабатывают смесь последовательно растворами аммиака, изопропиламина и соляной кислоты.
В описании к охранному документу приведен пример, иллюстрирующий заявленный способ получения координационного комплекса платины. Расчетные количества тетрахлороплатината калия K2[PtCl4], оксалат-иона в виде оксалата калия К2С2O4·Н2О и оксалата аммония (NH4)2C2O4 растворяют в расчетном количестве воды и нагревают при 60°С в течение 30 мин, поддерживают рН=6,5 добавлением гидроксида натрия до оранжевой окраски раствора. Затем раствор охлаждают до 25°С и добавляют в необходимом количестве изопропиламин. Реакционную смесь выдерживают в течение 2 ч (не допуская потемнения раствора). Затем добавляют расчетное количество концентрированной соляной кислоты и выдерживают в течение 40 мин. Выпавший светло-желтый осадок цис-дихлороамминизопропиламинплатины (II) отфильтровывают, промывают спиртом и сушат. Общее количество выделенного комплекса составляет 47% от теоретического выхода.
К недостаткам этого способа следует отнести не очень хорошие экономические показатели. Это обусловлено тем, что соединения платины очень трудно вступают в реакцию с органическими соединениями, и, при соотношении в используемом в известном способе реакционном растворе потенциальных лигандов и соединений платины приблизительно 1:1, значительная часть соединений платины не участвует в образовании конечного продукта.
Известен способ получения противоопухолевого средства (А, РФ 2182482) на основе координационного соединения двухвалентной платины, а именно тетрахлороплатината калия. В соответствии со способом раствором тетрахлороплатината калия обрабатывают водный раствор, содержащий гуминовые вещества. Обработку проводят под действием волнового излучения в ультразвуковом диапазоне с мощностью излучения 40 Вт/см2, с частотой 22 кГц в течение 4-8 мин.
Как указывается в описании, гуминовые вещества получают окислением древесного лигнина в щелочной среде кислородсодержащим газом при температуре 170±20°С, давлении 1,9-2,5 МПа в течение 1-3 ч и последующими охлаждением реакционной массы, отделением твердой фазы от раствора и подкислением последнего до рН 2-3. Образовавшийся после подкисления раствора осадок очищают от примесей и растворяют в дистиллированной воде.
В полученный раствор, представляющий собой водный раствор солей гуминовых кислот, относящихся к гуминовым веществам, вносят расчетное количество тетрахлороплатината калия и создают процесс развитой акустической кавитации под действием ультразвука с мощностью излучения 40 Вт/см2 и частотой 22 кГц в течение 4 мин.
Полученный продукт представляет собой водный раствор солей комплексных соединений платины, в котором лигандами выступают фрагменты гуминовых веществ. Этот раствор использовали для испытаний на животных для определения его противоопухолевой активности, которую подтвердили результаты испытаний.
Этот способ позволяет более полно использовать соединения платины, поскольку соотношение исходных соединений платины и органических соединений (гуминовых веществ) в несколько раз ниже, чем в описанном выше способе, т.е. на единицу (молекулу) соединения платины приходится приблизительно втрое больше потенциальных лигандов.
Противоопухолевая, в том числе и антираковая активность полученного продукта обусловлена наличием платины и свойствами гуминовых веществ. Продукт обладает более низкой токсичностью благодаря относительно низкой концентрации соединений платины. Обработка ультразвуком при указанных значениях обеспечивает достаточно эффективное взаимодействие тетрахлорплатината калия с гуминовыми веществами и образование активных (с точки зрения противоопухолевой активности) полиядерных хелатных комплексов.
Экспериментально показано, что среди гуминовых веществ наиболее активными являются водорастворимые вещества с молекулярными массами 500-10000 Да. Более тяжелые компоненты менее активны, так как имеют низкую растворимость и практически не усваиваются организмом.
В концентрированных растворах гуминовых веществ (более 0,5-1%) достаточно часты межмолекулярные взаимодействия указанных соединений, а именно реакции конденсации и полимеризации, что приводит к увеличению средней молекулярной массы. Поэтому для эффективного взаимодействия и образования комплексов с соединениями платины концентрация гуминовых веществ в растворе должна быть относительно невысокой. Но даже при этом некоторые молекулы гуминовых веществ вступают в реакции конденсации и полимеризации друг с другом и образуют конгломераты или соединения с высокой молекулярной массой.
Помимо ухудшения противоопухолевой активности препарата это ведет к нарушению однородности получаемых продуктов, выпадению осадка, изменению физико-химических свойств и нестабильности препаратов при хранении. Так, при хранении в условиях искусственного старения в препарате, полученном известным способом, уже через 10-20 суток были выявлены инородные включения (высокомолекулярные соединения) и изменения цветности, свидетельствующие об ухудшении физико-химических свойств препарата.
В основу настоящего изобретения поставлена задача создать такой способ получения антиракового препарата, который бы обеспечивал получение более однородного и более стабильного при хранении продукта путем снижения относительного содержания высокомолекулярной фракции.
Поставленная задача решается тем, что в способе получения антиракового препарата на основе координационного соединения двухвалентной платины, в соответствии с которым указанным соединением платины обрабатывают водный раствор, содержащий гуминовые вещества, обработку проводят под воздействием волнового излучения, в соответствии с изобретением указанную обработку осуществляют до величины содержания высокомолекулярной фракции гуминовых веществ не более 5%.
Экспериментально было установлено, что при снижении величины содержания высокомолекулярной фракции ниже указанного значения существенно повышается однородность и стабильность препарата при хранении.
В качестве координационных соединений платины могут быть выбраны соединения из ряда: калия тетрахлороплатинат, цис-дихлородиаминплатина, тетрахлороплатинат водорода, калия тетрабромоплатинат.
Все эти соединения являются соединениями двухвалентной платины, которые используются при создании противоопухолевых и/или противораковых препаратов.
Целесообразно в качестве волнового излучения использовать излучение в ультразвуковом диапазоне частот от 18 кГц до 66 кГц при мощности излучения от 0,5 до 5 Вт/см3.
Предпочтительно обработку проводить при мощности излучения 5 Вт/см3 с частотой 22 кГц в течение 5-20 мин.
В качестве волнового излучения может быть выбрано излучение в микроволновом диапазоне частот от 30 до 0,3 ГГц при мощности излучения от 0,5 до 50 Вт/см3. При мощности микроволнового облучения 5 Вт/см3 и частоте 2,45 ГГц поддерживают температуру обрабатываемого продукта в пределах 40-50°С в течение 30-90 мин.
Краткое описание чертежей
Изобретение иллюстрируется чертежами.
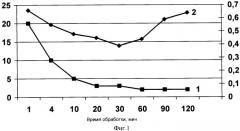
Фиг.1 показывает зависимость свойств гуминовых веществ препаратов от времени ультразвуковой обработки при мощности 0,5 Вт/см3 и частоте 22 кГц.
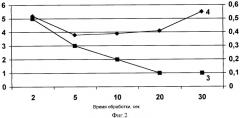
Фиг.2 показывает зависимость свойств гуминовых веществ препаратов от времени ультразвуковой обработки при мощности 5 Вт/см2 и частоте 66 кГц.
Наилучший пример воплощение изобретения
Более подробно заявляемый способ описывается в примерах, приведенных ниже. Гуминовые вещества для получения антираковых препаратов получали способом, приведенным в (А, РФ 2182482) и описанным выше.
Во всех примерах, приведенных ниже, количество используемого координационнного соединения платины приведено к содержанию платины в тетрахлороплатинате калия, т.е. на 1 г солей гуминовых кислот используют такое количество соединения платины, в котором содержание этого металла составляет 0,1242 г.
Пример 1.
Препарат 1 получают путем добавления 0,27 г тетрахлороплатината калия (координационного соединения платины) на 1 г солей гуминовых кислот в условиях акустической кавитации под действием ультразвука с мощностью излучения 40 Вт/см3 и частотой 22 кГц в течение 4 мин.
Препарат 2 отличается от препарата 1 тем, что в качестве координационного соединения платины использовалась дихлородиаминплатина в количестве 0,18 г на 1 г солей гуминовых кислот.
Препарат 3 содержит в качестве координационного соединения платины тетрабромоплатинат калия в количестве 0,40 г на 1 г солей гуминовых кислот.
Препарат 4 содержит в качестве координационного соединения платины тетрахлороплатинат водорода в соотношении 0,22 г на 1 г солей гуминовых кислот.
Антираковое действие препаратов изучалось на модели опухоли рабдомиосаркомы RA-23, которая обычно используется как модельная при изучении способности антиопухолевых и антираковых препаратов ингибировать развитие стромы, которая характерна для большинства опухолей.
В эксперименте были использованы беспородные крысы. Животные были разделены на 5 групп. Введение препаратов было начато на следующий день после перевивки опухоли и производилось в режиме 0,8 мл на крысу для всех каждый третий день. Контрольная группа получала инъекции физиологического раствора. На 20 день животные были умерщвлены, и в ходе вскрытия были подсчитаны количество и масса метастазов. При статистической обработке данных использовали t-критерий Стьюдента.
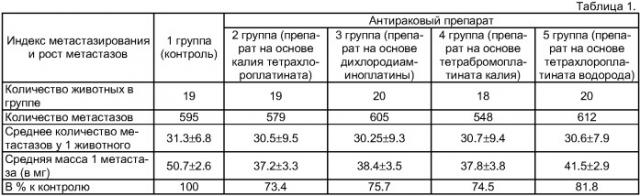
Результаты эксперимента представлены в таблице 1. Все полученные препараты отличались выраженной и примерно равной антираковой активностью, которая преимущественно выражалась в снижении массы метастазов.
Результаты сравнительного исследования активности антираковых препаратов, содержащих различные координационные соединения платины, приведены в таблице 1.
Пример 2.
Препараты для исследований получали, как Препарат 1 в примере 1, за исключением времени обработки ультразвуком. Время обработки колебалось от 1 мин до 180 мин. Для препаратов оценивалась цветность растворов (D445/D665), изменение которой косвенно свидетельствует о развитии процессов конденсации и полимеризации молекул, и молекулярная масса. Цветность оценивалась для растворов выравненной концентрации 0,001% на спектрофотометре с использованием кюветы 10 мм. Молекулярная масса оценивалась методом тонкослойной хроматографии на пластинке «силуфол» («Silufol», производитель фирма «Chemapol», Чехия) с использованием обычного элюента в соотношении 1:4. Количество высокомолекулярной фракции (X, %) оценивали сравнением интенсивности окраски стартового пятна и остаточного пятна после элюирования. Зависимость свойств гуминовых веществ препаратов от времени ультразвуковой обработки при мощности 0,5 Вт/см3 и частоте 22 кГц приведена на фиг.1, где по оси ординат указано время обработки, мин, по оси абсцисс - количество высокомолекулярной фракции гуминовых веществ, %, а по дополнительной оси значений - величина коэффициента цветности. Кривая 1 показывает изменение количества высокомолекулярной фракции гуминовых веществ в зависимости от времени обработки, а кривая 2 - изменение коэффициента цветности в зависимости от времени обработки. Из фиг.1 видно, что при увеличении времени обработки ультразвуком при указанных параметрах волнового излучения количество высокомолекулярной фракции гуминовых веществ закономерно снижается (от 20 до 2%), в то время как коэффициент цветности сначала снижается (от 0,66 до 0,39 на участке от 1 до 30 мин), а затем снова повышается (до 0,63). Т.е. наибольший эффект диспергирования при этих режимах частоты и мощности достигается в интервале обработки от 10 до 30 мин.
Пример 3.
Препарат получали аналогично тому, как это описано выше в примере 2, за исключением режимов ультразвуковой обработки. Обработка производилась с мощностью 5 Вт/см3 при частоте излучения 66 кГц. Время обработки колебалось от 2 до 30 с. В полученной субстанции оценивали количество высокомолекулярной фракции гуминовых веществ X, %, и коэффициент цветности D4/D6, как описано в примере 2. Зависимость свойств гуминовых веществ препаратов от времени ультразвуковой обработки (при мощности 5 Вт/см3 и частоте 66 кГц) показана на фиг.2. Кривая 3 иллюстрирует зависимость количества высокомолекулярной фракции гуминовых веществ X, %, а кривая 4 - коэффициента цветности D4/D6 раствора от времени обработки (в секундах) при указанных параметрах волнового излучения.
При увеличении времени обработки ультразвуком с частотой 66 кГц при мощности 5 Вт/см3 количество высокомолекулярной фракции гуминовых веществ также закономерно снижается, а оптимальные значения коэффициента цветности регистрируются при режимах обработки от 5 до 20 с.
Результаты проведенных экспериментов показывают, что сходный результат достигается при различных режимах ультразвуковой обработки, причем время обработки находится в обратной зависимости от мощности и частоты ультразвука.
Пример 4.
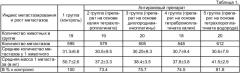
Препарат получали аналогично тому, как это описано в примерах 1 или 2, за исключением режима волновой обработки. В этом случае для диспергирования использовали микроволновую обработку мощностью 0,5 кВт и частотой 2,45 ГГц при поддержании температуры в пределах 40-50°С.
Данные о влиянии времени микроволновой обработки (при мощности 0,5 кВт и частоте 2,45 ГГц) на свойства препарата приведены в таблице 2.
| Таблица 2. | |||||||||
| Время, мин | |||||||||
| 10 | 20 | 30 | 60 | 90 | 120 | 180 | 240 | 300 | |
| D445/D665 | 0.67 | 0.55 | 0.48 | 0.46 | 0.42 | 0.45 | 0.57 | 0.60 | 0.65 |
| Х, % | 15 | 10 | 7 | 5 | 3 | 3 | 2 | 2 | 2 |
Как следует из таблицы, микроволновая обработка препарата в течение 30-120 мин обеспечивает наилучшие характеристика продукта по коэффициенту цветности и средней молекулярной массе гуминовых веществ и может применяться наряду с ультразвуковой обработкой.
Пример 5
Стабильность препаратов, полученных так, как это было описано в примерах 2-4, и имеющих оптимальные показатели молекулярной массы и цветности, была изучена в экспериментах по «ускоренному старению», которые заключались в хранении препаратов при температуре 60°С в течение 45 сут. Контролем стабильности служили показатели рН, количество молекулярных агрегатов (проявляющих себя как инородные включения при флюорометрическом анализе) и изменение показателя цветности. Основные результаты представлены ниже.
Изменение рН растворов при хранении в условиях «ускоренного старения» образцов препарата, изготовленных в соответствии с различными вариантами заявляемого способа, приведено в таблице 3.
Для обозначения режимов обработки в таблицах использованы сокращенные обозначения: УЗ - ультразвуковая обработка, MB - микроволновая обработка.
| Таблица 3. | |||||
| рН раствора препарата при его хранении | |||||
| Препарат, способ получения | Исходный раствор | 10 суток | 20 суток | 30 суток | 45 суток |
| УЗ 22 кГц 10 мин | 8.71 | 8.80 | 8.81 | 8.83 | 8.78 |
| УЗ 22 кГц 60 мин | 8.79 | 8.80 | 8.81 | 8.78 | 8.78 |
| УЗ 66 кГц 5 с | 8.82 | 8.82 | 8.81 | 8.81 | 8.80 |
| УЗ 66 кГц 20 с | 8.82 | 8.82 | 8.80 | 8.81 | 8.80 |
| MB 2.45 ГГц 60 мин | 8.70 | 8.72 | 8.70 | 8.71 | 8.77 |
| MB 2.45 ГГц 120 мин | 8.80 | 8.80 | 8.80 | 8.89 | 8.78 |
| Прототип | 8.74 | 8.79 | 8.70 | 8.64 | 8.61 |
Хранение в условиях «ускоренного старения» образцов препарата, приготовленных в соответствии с различными вариантами заявляемого способа, и число образцов, показавших наличие инородных включений (по данным флюорометрического анализа серии из 100 образцов), приведены в таблице 4.
| Таблица 4. | |||||
| Число образцов, содержащих инородные включения (в серии из 100 образцов) | |||||
| Препарат, способ получения | Исходный раствор | 10 суток | 20 суток | 30 суток | 45 суток |
| УЗ 22 кГц 10 мин | Нет | Нет | Нет | 1 | 1 |
| УЗ 22 кГц 60 мин | Нет | Нет | Нет | Нет | Нет |
| УЗ 66 кГц 5 с | Нет | Нет | Нет | 1 | 1 |
| УЗ 66 кГц 20 с | Нет | Нет | Нет | Нет | Нет |
| MB 2.45 ГГц 60 мин | Нет | Нет | Нет | Нет | 1 |
| MB 2.45 ГГц 120 мин | Нет | Нет | Нет | Нет | Нет |
| Прототип | 1 | 1 | 2 | 2 | 3 |
Изменение коэффициентов цветности образцов препарата различных вариантов приготовления в условиях «ускоренного старения» приведено в таблице 5.
| Таблица 5. | |||||
| D445/D665 | |||||
| Препарат, способ получения | Исходный раствор | 10 суток | 20 суток | 30 суток | 45 суток |
| УЗ 22 кГц 10 мин | 0.48 | 0.50 | 0.51 | 0.49 | 0.52 |
| УЗ 22 кГц 60 мин | 0.44 | 0.43 | 0.46 | 0.48 | 0.48 |
| УЗ 66 кГц 5 с | 0.38 | 0.42 | 0.41 | 0.43 | 0.42 |
| УЗ 66 кГц 20 с | 0.41 | 0.44 | 0.45 | 0.43 | 0.46 |
| MB 2.45 ГГц 60 мин | 0.46 | 0.48 | 0.51 | 0.53 | 0.49 |
| MB 2.45 ГГц 120 мин | 0.45 | 0.49 | 0.50 | 0.52 | 0.50 |
| Прототип | 0.55 | 0.60 | 0.65 | 0.67 | 0.70 |
Тест на «ускоренное старение» показал, что препараты, полученные в соответствии с изобретением, обладают более высокими характеристиками стабильности, а именно коэффициентом цветности и наличием инородных включений, по сравнению с прототипом по истечении установленного срока ускоренного старения. При этом показатели кислотности оказались примерно одинаковыми для образцов, полученных в соответствии с заявляемым способом и способом-прототипом.
Промышленная применимость
Предлагаемый способ позволяет изготавливать препараты, обладающие противораковой активностью и имеющие более высокие характеристики стабильности по сравнению с известным способом.
Предлагаемый способ может быть реализован на стандартном оборудовании с использованием обычного сырья.
1. Способ получения антиракового средства на основе координационного соединения двухвалентной платины, в соответствии с которым указанным соединением платины обрабатывают водный раствор, содержащий гуминовые вещества, при этом обработку проводят под воздействием волнового излучения, отличающийся тем, что указанную обработку осуществляют до величины содержания высокомолекулярной фракции гуминовых веществ не более 5%.
2. Способ получения по п.1, отличающийся тем, что в качестве координационных соединений платины выбирается соединение из ряда:калия тетрахлороплатинат, цис-дихлородиаминплатина, тетрахлороплатинат водорода, калия тетрабромоплатинат.
3. Способ получения по п.1 или 2, отличающийся тем, что в качестве волнового излучения выбирают излучение в ультразвуковом диапазоне частот от 18 до 66 кГц, а мощность излучения при этом составляет от 0,5 до 5 Вт/см3.
4. Способ получения по п.3, отличающийся тем, что обработку проводят при мощности излучения 5 Вт/см3 с частотой 22 кГц в течение 5-20 мин.
5. Способ получения по п.1 или 2, отличающийся тем, что в качестве волнового излучения выбирают излучение в микроволновом диапазоне частот от 30 до 0,3 ГГц, а мощность излучения при этом составляет от 0,5 до 50 Вт/см3.
6. Способ получения по п.1, отличающийся тем, что при мощности микроволнового облучения 0,5 Вт/см3 и частоте 2,45 ГГц, поддерживают температуру обрабатываемого продукта в пределах 40-50°С в течение 30-90 мин.