Биотрансплантат, способ лечения хронических заболеваний печени и способ лечения цирроза печени и портальной гипертензии
Иллюстрации
Показать всеИзобретение относится к медицине, в частности к гепатологии и биотехнологии, и касается лечения хронических диффузных заболеваний печени, а также лечения цирроза печени и портальной гипертензии посредством полученного для этого биотрансплантата (БТ). БТ содержит смешанную популяцию клеток, в которой 40% составляют стволовые клетки, включая стромальные мезенхимальные и печеночные бипотентные стволовые клетки, а остальные 60% - прогениторные клетки в различной стадии дифференциации, включая молодые незрелые гепатобласты и клетки-предшественники эритроидного ряда, гемопоэтические клетки. Смешанная популяция клеток БТ характеризуется экспрессией следующих поверхностных маркеров: CD13, CD29, CD44, CD90, CD117 (c-Kit) и отсутствием экспрессии CD34. Для лечения вводят указанный БТ в виде суспензии в физиологическом растворе в дозе 2-4 млн клеток на 1 кг веса пациента. При циррозе печени и портальной гипертензии БТ вводят виде суспензии в физиологическом растворе при суммарном количестве клеток БТ от 350 до 500 млн. Указанное введение БТ, являясь самостоятельным способом лечения заболеваний печени, обеспечивает устойчивое снижение активности процесса, уменьшение дегенеративно-дистрофических изменений, течение безрецидивного периода продолжительностью 12 месяцев. 3 н.п. ф-лы, 9 табл., 12 ил.
Реферат
Изобретение относится к медицине и биотехнологии и касается получения биотрансплантата, содержащего стволовые клетки (мезенхимальные стволовые клетки, бипотентные стволовые клетки, прогениторные клетки в различной степени дифференциации), и способа лечения хронических диффузных заболеваний печени, таких как хронические гепатиты, циррозы печени, портальная гипертензия, с помощью этого биотрансплантата.
Основными методами лечения больных циррозом печени (ЦП) и портальной гипертензии (ПГ) на современном этапе все еще остаются поддерживающий метод, включающий использование специализированной диеты и различных медикаментозных средств, а также хирургический метод, который включает в себя паллиативные вмешательства, направленные на борьбу с осложнениями заболевания (кровотечения, асцит), и радикальный - ортотопическая трансплантация печени.
Известен, например, способ оперативного лечения гипертензии путем удаления селезенки (Курс оперативной хирургии и топографической анатомии. Г.Е.Островерхов и др. - М.: Медицина, 1964. - 839 с.).
Известен другой способ лечения портальной гипертензии путем создания внеорганных сосудистых анастомозов между системами воротной и нижней полой вен. Оперативная хирургия с топографической анатомией детского возраста (Ю.Ф.Исаков и др. - М.: «Медицина», 1977. - 639 с.).
Из SU 1232229 (опубликовано 23 мая 1986 года) известен способ лечения портальной гипертензии, включающий частичное перемещение печени в забрюшинное пространство и заключающийся в том, что с целью обеспечения стойкого гипотензивного эффекта при болезни Бадда-Киари путем увеличения числа внебрюшинных сосудистых связей в забрюшинное пространство частично перемещают также селезенку, при этом с обоих органов на участках перемещения удаляют капсулу и подшивают к ее краям рассеченную париетальную брюшину.
Однако известные способы дополняются обязательной сплекэктомией, что само по себе является травматичным паллиативным вмешательством.
Из RU 2135098 (опубликовано 27 августа 1999 года) известен способ лечения портальной гипертензии и асцита при циррозе печени. Согласно этому способу проводят видеолапароскоп через троакар, установленный в пятом межреберье по передней и задней подмышечными линиями. Фиксируют нижнюю долю правого легкого к печени через окно в диафрагме. Накладывают эндошвы с экстракорпоральным завязыванием узлов. Способ позволяет уменьшить травматичность и длительность вмешательства.
Для каждого из этих направлений свойственны определенные недостатки. Несмотря на широкий спектр предлагаемых консервативных мер и большой арсенал используемых препаратов, эффективность поддерживающей терапии в значительной мере ограничена. Сложно было бы представить, что таким образом можно в существенной степени улучшить деятельность гепатоцитов, несущих огромный объем информации и выполняющих до 500 различных функций. В ближайшей перспективе не приходится рассчитывать на то, что органная трансплантация может кардинально изменить ситуацию, сложившуюся в лечении этого тяжелого страдания, в связи со сложностями, связанными с организацией донорского этапа и рядом других, прежде всего экономических, проблем. Диапазон паллиативных хирургических вмешательств очень широк, однако основная цель этих вмешательств - это борьба с клиническими проявлениями ПГ и ее осложнений, которая не затрагивает важнейший клинический синдром заболевания - хроническую печеночную недостаточность.
Хроническая гепатоцеллюлярная недостаточность (ХГЦН) является важнейшим синдромом, определяющим клиническое течение и прогноз заболевания у больных ЦП и ПГ. Это касается пациентов с четко очерченными как терапевтическими, так и хирургическими проблемами, включая больных, находящихся в листе ожидания органной трансплантации. На современном этапе главной стратегической линией в лечении ХГЦН может стать переход от борьбы с «биохимическим беспорядком в больных клетках» к своевременному направленному восполнению имеющегося дефицита информационного поля в печени. Особое место в этом занимает клеточная трансплантация. Клинический опыт в этой области крайне мал, что не позволяет в должной мере оценить роль и место клеточной терапии в комплексе лечебных мероприятий у больных ЦП и ПГ. В этой проблеме имеется много нерешенных вопросов.
Единственным эффективным методом лечения конечных стадий печеночно-клеточной недостаточности остается трансплантация печени. Однако дефицит донорских органов является лимитирующим фактором. В этой связи большой интерес представляют технологии заместительной клеточной терапии, которые являются альтернативой органной трансплантации. Известно, что высокая регенераторная способность печени обусловлена пролиферацией гепатоцитов. Поэтому одним из направлений заместительной клеточной терапии является трансплантация зрелых гепатоцитов. Изолированные гепатоциты могут вводиться в подкожную клетчатку, селезенку, паренхиму печени (Hepatocyte transplantation: clinical and experimental application. Ohashi K., Park F., Kay M.A. // J. Mol. Med. - 2001. - Vol.79. - P.617-630).
При этом в качестве донорского материала могут использоваться не только гепатоциты взрослого человека, но и клетки фетальной печени (Hagihara M. et al: Effects of iso- and xeno- fetal liver fragments transplantation on acute and chronic liver failure in rats. Cell Transpant 3:283-290, 1994,
Sukhikh G.T., Shtil A.A. Stem cell transplantation for treatment of liver diseases: From biological foundations to clinical experience (Reviev) // Inter. J. Mol. Med. - 2003. - Vol.11. - P.395-400).
Так, описан метод, согласно которому с целью купирования печеночно-клеточной недостаточности аутологичные гепатоциты, выделенные из фрагментов печени, вводились в селезенку больным с циррозом печени и хроническим гепатитом (Mito M., Kusano M., Kawaraura Y. Hepatocyte transplantation in man // Transplant Proc. - 1992. - P.3052-3053).
Трансплантация не сопровождалась развитием каких-либо осложнений, однако в силу использования аутологичного материала и получения малого количества гепатоцитов заметного клинического эффекта отмечено не было. Известен также способ, согласно которому пациентам под капсулу прямой мышцы живота вводили аллогенные клетки (в количестве около миллиарда клеток), полученные из печени 9-17-недельных плодов человека. Введение таких клеток не сопровождалось развитием трансплантационных реакций и у части пациентов сопровождалось уменьшением проявлений печеночно-клеточной недостаточности (В.И.Шумаков., Э.И.Гальперин, Е.А.Неклюдова. Трансплантация печени. - M., 1981).
Недостатком вышеизложенных методов является то, что введение гепатоцитов позволяет только временно улучшить функцию печени, не влияя существенным образом на процессы репарации поврежденной печеночной паренхимы. Большую проблему представляет изоляция донорских гепатоцитов и поддержание их функциональной активности при хранении, риск переноса инфекции при использовании аллогенного донорского материала и возможность развития трансплантационных реакций. Проведенные впоследствии исследования показали, что наряду с гепатоцитами важную роль в регенерации печени, особенно при хронических повреждениях печеночных клеток, играют стволовые клетки печени, способные дифференцироваться в гепатоциты и холангиоциты.
В настоящее время в современной биомедицине формируется новый раздел - клеточная терапия, которая позволяет с помощью трансплантации клеток восполнить недостаточную функциональную активность тканей и регенерировать поврежденные органы. Функцию обновления и восстановления тканей in vivo выполняют стволовые клетки, которые представляют собой пул запасных недифференцированных предшественников клеток различных типов. В связи с этим применение стволовых клеток является наиболее перспективным направлением клеточной терапии, и наибольшую актуальность приобретают работы по выделению стволовых клеток из различных тканей человека.
Стволовые клетки тканей взрослого организма служат клеточной основой для поддержания в нем гомеостаза и лежат в основе репаративных процессов в организме. В связи с этим наибольшую актуальность приобретают работы по выделению стволовых клеток из различных тканей человека. В настоящее время выделены эмбриональные стволовые клетки, а также стволовые клетки тканей взрослого организма - гематопоэтические (предшественники клеток крови), нейрональные (предшественники клеток нервной ткани), мезенхимальные (клетки, способные дифференцироваться в клетки тканей мезенхимального происхождения, а также способны трансдифференцироваться в клетки тканей других зародышевых листков) и др.
Относительная простота выделения и культивирования, способность пролиферировать в течение долгого времени in vitro и широкий спектр дифференцировки делают данный тип клеток привлекательным для фундаментальных исследований и открывают возможность для клинического применения.
Известно, что в регенерации печени могут участвовать стволовые клетки костного мозга. Так, Goff и Peterson был предложен способ трансплантации клеток костного мозга с целью стимуляции регенерации и восстановления печени [Патент №WO 0050048, опубликовано 31 августа 2000 года]. Согласно данному способу для стимуляции регенерации в организм реципиента вводятся клетки костного мозга в дозе, достаточной, чтобы обеспечить образование новых гепатоцитов, холангиоцитов и/или овальных клеток печени. В качестве источника стволовых клеток также может использоваться обогащенная фракция овальных клеток печени, выделенных с помощью антител, распознающих Thy 1 антиген. Клетки костного мозга или овальные клетки могут быть генно модифицированы, чтобы экспрессировать функциональный активный протеин, трансплантированы на матриксе или обработаны перед трансплантацией ростовыми факторами. Перед трансплантацией клетки костного мозга могут быть обогащены с помощью выделения клеток, экспрессирующих маркеры стволовых клеток (Thy 1, CD34, Flt-3 ligand, c-Kit), с помощью методов сепарации на магнитных бусах, аффинной хроматографии или проточной цитофлюориметрии. При этом появление в печени клеток (гепатоциты, холангиоциты, овальные клетки) донорского костномозгового происхождения доказывалось на экспериментальных моделях крыс по появлению гепатоцитов с маркерами донорских стволовых клеток.
Также из RU 2283113 известен способ лечения хронических диффузных заболеваний печени, включающий использование гепатопротекторов и трансплантацию стволовых клеток костного мозга, заключающиеся в том, что используют стволовые клетки, непосредственно выделенные из аспирата костного мозга пациента, порцию которых рассчитывают таким образом, чтобы количество СD34-позитивных клеток в ней составило от 40 до 240х10 клеток, которую делят на две половины, первую вводят внутрипеченочно, а вторую - внутривенно.
Итак, как следует из вышеприведенных источников, в современной медицине отчетливо сформировалось отдельное направление, использующее тканевые и клеточные трансплантаты в терапевтических целях. Одним из научно-практических результатов этого направления является признание того, что фетальные ткани и клетки и их ассоциаты, а также биологически активные вещества из них обладают большей терапевтической эффективностью, чем зрелые ткани и дифференцированные клетки взрослого человека. Это обусловлено особыми свойствами клеток в период эмбриогенеза.
Терапевтический эффект фетальных трансплантатов зависит не только от количества имплантированных фетальных тканей, клеток и их ассоциатов, но и от строгого соблюдения условий, обеспечивающих содержание в трансплантате клеток, обладающих всеми перечисленными выше уникальными свойствами.
Из RU 2272638, опубликовано 27.03.2006 известен биотрансплантат, способ его получения и способ лечения хронического гепатита и цирроза печени.
Известный биотрансплантат характеризуется тем, что он содержит культуру фетальных гепатоцитов человека из печени эмбрионов человека 1-2-го триместра беременности, селективно размноженных в условиях культивирования, и представляет собой суспензию клеточной культуры в физиологическом растворе с концентрацией клеточных элементов 1-15 млн клеток на 1 кг веса пациента. Способ лечения хронического гепатита и цирроза печени заключается в том, что используют ранее указанные биотрансплантаты, при этом суспензию мезенхимальных стволовых или фетальных гепатоцитов или их комбинацию вводят в виде суспензии в физиологическом растворе с концентрацией клеточных элементов 1-15 млн. клеток на 1 кг веса пациента.
Известный из RU 2272638 биотрансплантат и способ по технической сущности и достигаемому результату являются наиболее близкими к заявленной группе изобретений.
Задачей заявленной группы изобретений является исследование и определение необходимых и достаточных свойств биотрансплантата для наиболее эффективного (комплексного) воздействия на пораженную печень человека и разработка наиболее эффективного способа лечения хронических гепатитов, циррозов печени и других хронических заболеваний печени, таких как лечение портальной гипертензии.
Поставленная задача достигается заявленной группой изобретений, в которую входят биотрансплантат с его определенными характеристиками, а также способы лечения хронических диффузных заболеваний печени, в частности, такие как способы лечения цирроза печени и лечение портальной гипертензии.
Для выявления необходимых характеристик биотрансплантата, решающих поставленную ранее задачу, нами были исследованы биотрансплантаты, полученные из фетальной печени млекопитающего.
При этом установлено, что необходимыми свойствами обладает биотрансплантат, содержащий смешанную популяцию клеток, в которой 40% составляют стволовые клетки, включая стромальные мезенхимальные и печеночные бипотентные стволовые клетки, а остальные 60% - прогениторные клетки в различной стадии дифференциации, включая молодые незрелые гепатобласты и клетки-предшественники эритроидного ряда, гемопоэтические клетки, при этом смешанная популяция клеток биотрансплантата характеризуется экспрессией следующих поверхностных маркеров: CD13, CD29, CD44, CD90, CD117 (c-Kit), отсутствием экспрессии CD34.
Такая гетероструктура биотрансплантата может быть получена из различных источников, не только из фетальных тканей человека, но и других млекопитающих, например свиньи.
Биотрансплантат по изобретению используют для лечения таких заболеваний печени, как гепатиты, цирроз печени, острая печеночная недостаточность, портальная гипертензия.
Итак, еще одним изобретением заявленной группы является способ лечения хронических диффузных заболеваний печени, характеризующийся тем, что используют разработанный биотрансплантат, содержащий смешанную популяцию клеток, включающую стромальные мезенхимальные стволовые клетки, собственно печеночные бипотентные стволовые клетки, а также прогениторные клетки в различной стадии дифференциации, для чего его вводят в виде суспензии в физиологическом растворе с концентрацией клеточных элементов 2-4 млн клеток на 1 кг веса пациентов.
В частности, способ предназначен для лечения гепатита, цирроза печени, острой печеночной недостаточности, хронической недостаточности печени, портальной гипертензии и характеризуется тем, что разработанный биотрансплантат вводят в виде суспензии в физиологическом растворе, при этом суммарное количество клеток биотрансплантата составляет от 200 до 500 млн.
Состав клеточного трансплантата анализировался с использованием методов проточной цитофлюорометрии и иммуногистохимического анализа.
При получении биотрансплантата следует обратить особое внимание на экспрессию специфических маркеров гепатоцитов или гепатобластов - AFP (альфа-фетопротеина) и альбумина (табл.1).
| Таблица 1. | |
| Антигенная характеристика клеточного препарата | |
| Антигены | Результаты |
| CD13 | Positive (+) |
| CD29 | Positive (+) |
| CD34 | Negative (-) |
| CD44 | Positive (+) |
| CD90 | Positive (+) |
| CD117 (c-Kit) | Positive (+) |
| Albumin | Positive (+) |
| AFP | Positive (+) |
Представленная выше табл.1 свидетельствует о том, что с помощью специфических маркеров в используемой смешанной популяции клеток выявлены различные стволовые клетки, а также прогениторные клетки, способные выполнять определенные функции (синтез специфических белков), свойственных собственно гепатобластам (альфа-фетопротеин), а также более дифференцированным печеночным клеткам, стоящим ближе к гепатоцитам (альбумин).
Итак, используемая смешанная популяция стволовых и прогениторных клеток сразу содержит различные стволовые клетки, включая: стромальные мезенхимальные стволовые клетки, собственно печеночные бипотентные стволовые клетки, а также прогениторные или клетки-предшественники.
Состав клеточного трансплантата анализировался с использованием методов проточной цитофлюорометрии и иммуногистохимического анализа.
С использованием широкого набора обозначенных моноклональных антител выявлены специфические антигены, среди которых следует обратить особое внимание на экспрессию специфических маркеров гепатоцитов - AFP и альбумин (табл.1).
Непосредственное введение клеточной суспензии (биотрансплантата) осуществляется в обычном физиологическом растворе (0,9% раствор NaCl).
Курс лечения состоит, в частности, в повторных внутривенных инъекциях биотрансплантата аллогенных стволовых и прогениторных клеток (АСПК). Кратность внутривенных пересадок клеток зависит от конкретной клинической ситуации, тяжести течения заболевания и степени компенсации печеночной недостаточности. Тем не менее, оптимальная схема включает в себя 3 процедуры с интервалом 1 и 3 месяца, а затем возможны дополнительные сеансы через 6 месяцев и через год после первой пересадки. Для одной группы больных с относительно компенсированным течением заболевания и низкой активностью заболевания может оказаться достаточным однократное введение клеток. Для других пациентов с субкомпенсированным или даже декомпенсированным течением заболевания могут потребоваться повторные пересадки в течение относительно длительного периода времени (1-2 года), чаще всего с интервалом 3-6 месяцев. Хотя в некоторых наиболее тяжелых ситуациях могут потребоваться форсированные технологии пересадки (3 пересадки в течение 1,5 месяцев).
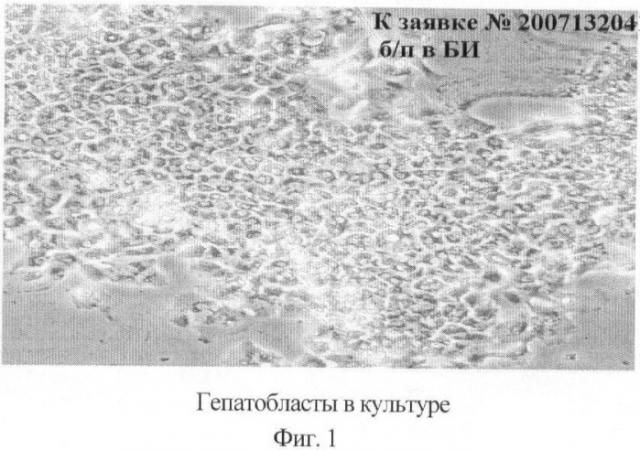
При трансплантации вводится до 200-500 млн смешанной популяции клеток, из которых 40% составляют бипотентные и мезенхимальные стволовые клетки печени, а остальную часть представляют прогениторные клетки, включая гепатобласты (фиг.1) и клетки гематопоэтические. Жизнеспособность клеток перед пересадкой составляет 90-95%. Количество жизнеспособных клеток оценивали в тесте с трипановым синим.
Противовирусный эффект трансплантации клеток может быть достигнут при любом способе их введения: внутриорганном (в печень или селезенку) или системном, когда клеточная взвесь вводится через какую-либо периферическую вену. С учетом того, что ликвидация вирусной персистенции является важнейшей задачей у больных с гепатитом, а у больных с циррозом печени эта проблема не является ведущей, то есть усложнять технологию пересадки путем использования более инвазивных (внутриорганных) методов введения клеток нецелесообразно.
Тем не менее, у больных циррозом печени вирусной этиологии путь введения клеток регулируется другими факторами, при этом могут быть использованы как более инвазивные методы, так и более простой системный путь трансплантации.
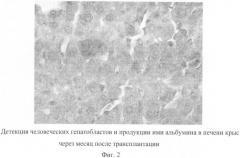
В эксперименте на крысах при системном введении разработанного нами клеточного биотрансплантата установлено, что эти клетки способны инкорпорироваться в ткань печени и продуцировать человеческий альбумин (фиг.2). Данные этого эксперимента свидетельствуют в пользу того, что даже при системном введении клеток примененная популяция клеток (биотрансплантат) обладает тропностью к печеночной ткани, и, обладая «навигационной памятью», под влиянием определенных сигналов эти клетки устремляются к печени реципиента, приживляются и функционируют в ней.
Пока не известны в точности все механизмы, благодаря которым достигается противовирусных эффект аллотрансплантации стволовых и прогениторных печеночных клеток. Проведенные исследования проливают свет на один возможный и достаточно важный механизм.
Способность стволовых и прогениторных печеночных клеток приживляться и выполнять специфические функции в печени реципиента обусловливают первый и наиболее важный механизм лечебного эффекта АСПК. Другим важным механизмом, обеспечивающим, по-видимому, морфологически подтвержденный, противовоспалительный, антифибротический и регенерационный эффекты АСПК, является влияние пересадки клеток на содержание и профиль цитокинов и ростовых факторов в ткани печени реципиента. Исследовавшиеся в ткани печени реципиента цитокины были распределены на 2 группы: провоспалительные и противовоспалительные. Они представлены в табл.2.
| Таблица 2 | |
| Цитокины | |
| Провоспалительные | Противовоспалительные |
| IL-1 | IF-gamma |
| IL-4 | IL-10 |
| IL-6 | HGF |
| TNF-α | |
| TGF-β | |
| PDGF |
В табл.3 представлены средние значения относительных единиц цитокинов до и после АСПК.
| Таблица 3 | ||
| Средние значения относительных единиц цитокинов до и после АСПК | ||
| Цитокины | Среднее значение цитокинов | |
| До АСПК | После АСПК | |
| IL-1 | 4,1±1,7 | 4,5±1,8 |
| IL-4 | 6,1±3,6 | 3,22±2,9 |
| IL-6 | 5,4±1,7 | 6,2±3,7 |
| TNF-α | 22,9±10,4 | 6,22±4,7 |
| PDGF | 8,25±2,02 | 2,85±1,85 |
| TGF-β | 14,6±6,2 | 10,35±8,3 |
| IL-10 | 2,36±0,96 | 8,54±5,8 |
| IF-gamma | 3,75±1,1 | 7,75±2,75 |
| HGF | 11,9±4,8 | 22,4±10,08 |
| IF-gamma/IL-4 | 0,61±0,3 | 2,4±0,94 |
Как видно из табл.3, при исследовании спектра провоспалительных цитокинов в биоптате печени после трансплантации отмечается тенденция к увеличению средних значений IL-1 и IL-6. В то же время мы наблюдали значительное снижение уровней TNF-α, PDGF и TGF-β. Торможение PDGF и IL-4, который, в свою очередь, блокирует синтез TGF-P, играет большую роль в процессах «блокировки» факторов, «повреждающих» печень, поскольку от уровня этих цитокинов зависит скорость прогрессирования цирротических изменений в печени.
К контрольному сроку отмечено повышение средних значений противовоспалительных цитокинов IL-10 с 2,36±0,96 до 8,54±5,8, IF-gamma с 3,75±1,1 до 7,75±2,75 и HGF с 11,9±4,8 до 22,4±10,08. Повышение IF-gamma и снижение содержания IL-4 в печени через 7 дней после трансплантации обеспечило увеличение коэфициента IF-gamma/IL-4 с 0,61±0,3 до 2,4±0,94, свидетельствующего о выраженном иммуномодулирующем эффекте АСПК.
При контрольном исследовании в системе провоспалительных цитокинов произошли следующие изменения: увеличилась экспрессия IL-1 - у 4 пациентов, IL-6 - у 4, TGF-β - у 3 пациентов и TNF-α у 1 пациента. Уменьшение выработки IL-1 отмечалось у 4 пациентов, IL-6 - у 4, TGF-β - у 5 и TNF-α - у 7 больных. У всех пациентов отмечалось значительно низкий уровень экспрессии IL-4 и PDGF по сравнению с исходным. Результаты исследования провоспалительных цитокинов представлены в табл.4.
| Таблица 4 | |||||||
| Динамика экспрессии генов провоспалительных цитокинов | |||||||
| Экспрессия гена | Число больных | IL-1 | IL-4 | IL-6 | TGF-β | PDGF | TNF-α |
| ↓ понижена | n | 4 | 8 | 4 | 5 | 8 | 7 |
| ↑ повышена | n | 4 | - | 4 | 3 | - | 1 |
Как видно из табл.4, наряду с повышением у части больных некоторых провоспалительных цитокинов, таких как IL-1, и IL-6 и TGF-β, у всех больных отмечено уменьшение экспрессии IL-4 и PDGF, а у большинства пациентов (у 7 больных) произошло уменьшение экспрессии гена, контролирующего образование TNF-α.
Результаты исследования противовоспалительных цитокинов представлены в табл.5. При контрольном исследовании в спектре антивоспалительных цитокинов у всех больных отмечено увеличение экспрессии HGF, IL-10 и IF-gamma.
| Таблица 5 | ||||
| Динамика экспрессии генов противовоспалительных цитокинов | ||||
| Экспрессия гена | Число больных | IF-gamma | IL-10 | HGF |
| ↓ понижена | n | - | - | - |
| ↑ повышена | n | 8 | 8 | 8 |
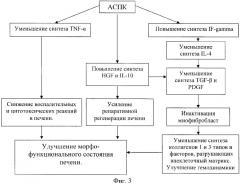
Результаты исследования цитокинов в ткани печени после трансплантации позволяют предположить, что механизмы положительных эффектов разработанного биотрансплантата на морфофункциональное состояние, очевидно, опосредуются активацией мощных противовоспалительных цитокинов: IF-gamma, IL-10 и HGF. Эта группа цитокинов реализуют свое действие по многим направлениям, включая усиление регенерационных процессов в печени, иммуномодулирующие эффекты, интенсификацию противовирусной активности и т.д. Но этот вывод является достаточно упрощенным, так как не учитывает в полной мере изменения в спектре провоспалительных цитокинов. Полученные данные не позволяют в полной мере оценить роль сложной мозаики взаимоотношений основных составляющих этих двух групп цитокинов, особенно во временном аспекте, от которого во многом зависит результат трансплантации. Тем не менее, имеющиеся данные позволяют схематически представить общую картину и механизмы клеточных влияний на течение патологического процесса в печени (фиг.3).
Данная схема (фиг.3) достаточно условна, она не может характеризовать временные взаимоотношения, характеризующие последовательность включения тех или иных цитокинов. Тем не менее, она достаточно информативно представляет гипотезу о возможном механизме действия АСПК на морфофункциональное состояние печени, которое опосредуется сложными каскадными взаимовлияниями различных групп цитокинов печени.
При клиническом применении биотрансплантата с представленным составом отсутствовали какие-либо побочные посттрансплантационные осложнения в связи с отсутствием антигенов комплекса гистосовместимости 2 класса.
Ниже представлены для иллюстрации отдельные примеры.
Пример 1. История болезни пациента Воронина П.А. началась с 10 лет, когда лечился по поводу геморрагического васкулита в детской больнице. Лечение проводилось глюкокортикоидами в течение 8 мес. В тот момент о наличии цирроза печени речи не шло, хотя было обнаружено увеличение размеров печени (функциональные пробы в норме), изменения в почках (высокий белок, гематурия), иммунные тесты были в целом без патологии, однако отмечена тенденция к их снижению. В 1997 при обследовании для военкомата выявлены ВРВ пищевода 2-3 мм, тромбоцитопения (в 1998 году ВРВП до 10 мм). В 1998 г. установлен диагноз: криптогенный цирроз печени, гепатоспленомегалия. В анализах существенных изменений не выявлено. С 1998 года отмечено повышение уровня трансаминаз (активно занимался спортом - хоккей с шайбой). Чувствовал себя удовлетворительно, в связи с чем в течение 5 лет у врачей не наблюдался. Впервые в апреле 2003 года - увеличение печени, тяжесть в правом подреберье, пальпаторно и на УЗИ увеличение печени, селезенки, портальной вены до 14 мм и селезеночной до 9 мм. При ЭГДС - ВРВ 1,0-1,5 мм.
29.09.03 - впервые кровотечение после поездки в Турцию.
27.10.03 - выполнена гастротомия с прошиванием ВРВ пищевода и желудка. В п\о периоде на 10-е сутки малиновый стул. При колоноскопии - ангиопатия, васкулит терминального отдела толстой и тонкой кишок.
При обследовании: печень умеренно увеличена, уплотнена. Кровоток - 700 мл/мин. ФВ -58%. При ЭГДС: ВРВП и желудка 3 степени. При сцинтиграфии: накопление печень - 44%, селезенка - 56%. Тц-52,1, лц - 3,4, АлАт - 147, АсАт -180, ПВ-14,7, АЧТВ - 34, фибриноген - 3,0, альбумины - 53,42, гамма - 22,45. Обнаружен вирус С в 2003 году.
В последующем спустя полгода с 24.02.2004 по 4.03.2004 находился в РНЦХ - выполнена трансплантация стволовых и прогениторных клеток соответствующего состава биотранстплантата через селезеночную артерию в селезенку. 4.03.2004 - повторное внутривенно введение биотрансплантата. Пациент каждый месяц в течение 2004 года контролировал биохимические показатели и показатели крови. Отмечена тенденция к снижению трансаминаз (до 2-х норм), однако повышение билирубина. Нормальные показатели билирубина достигнуты к концу 2004 года.
17.05.04 - вирус С обнаружен, генотип - 1в, 5.08.04 - вирус С не обнаружен.
УЗИ: печень нормальных размеров, кровоток - 1000 мл\мин, реканализована пупочная вена. Сцинтиграфия печени от 8.10.04: накопление печень - 52%, селезенка - 48.
При амбулаторном обследовании: 9.02.05 УЗИ - печень нормальных размеров.
31.01.2005 вирус С не обнаружен.
Госпитализация 28.01.2005 - 11.02.2005 в плановом порядке.
Клинически достигнута полная компенсация заболевания.
Концентрация клеток при пересадке составляет в среднем 2-4 млн. на кг веса больного (реципиента).
Приведенные данные исследований по клиническому применению клеточного биотрансплантата у больных циррозом печени свидетельствуют в пользу того, что при использовании данного метода лечения можно достичь не только морфофункционального и клинического улучшения в течении заболевания, но, что особенно важно, повлиять на персистенцию вируса в организме больных.
Противовирусный эффект аллотрансплантации стволовых и прогениторных печеночных клеток разработанного биотрансплантата прослежен у 20 из 27 больных с вирусным генезом заболевания, то есть у 74% пациентов, что существенно выше потенциальных возможностей существующих технологий противовирусной терапии, эффективность которых колеблется в пределах 20-40%.
Следует подчеркнуть, что сама идеология выявленного феномена противовирусного эффекта клеточной терапии коренным образом отличается от существующих методов противовирусного лечения у больных с гепатитами и циррозом печени.
Существующие методы есть не что иное, как методы химиотерапии, со множеством побочных эффектов по многим направлениям функционирования организма. Предлагаемый метод мобилизует и использует в борьбе с вирусом собственные резервы организма. Важными механизмами в этом процессе являются:
- повышение концентрации цитокинов с выраженным противовоспалительным действием и снижение концентрации цитокинов с преимущественно провоспалительным эффектом действия;
- иммуномодулирующий эффект пересадки клеток, проявляющийся в виде повышения уровня гамма-интерферона и соотношения между уровнем интерферона и интерлейкина-4;
- стимуляция образования в организме ростовых печеночных факторов, усиливающих регенерационные процессы в печени.
Пример 2. Б-ая Б., 66 лет, с тяжелым декомпенсированным течением цирроза печени, которое проявлялось в виде диуретикорезистентного асцита, высокой активности процесса в печени и различных проявлениях хронической печеночной недостаточности, имела, согласной вирусологическим исследованиям, средний уровень репликации вируса гепатита «С» (генотип 1б). После 4 сеансов введения биотрансплантата, выполненных в течение 1,5 лет, маркеры к вирусу гепатита «С» не выявлены, что, наряду с другими эффектами клеточной трансплантации, обеспечило значительное клиническое улучшение с достижением компенсации заболевания.
Пример 3. Пациент М., 54 лет, находившийся в отделении с диагнозом цирроз печени, портальная гипертензия. В анамнезе сеансы эндоскопического лигирования варикозно расширенных вен пищевода в связи с эпизодом пищеводно-желудочного кровотечения. При обследовании установлена вирусная этиология заболевания: выявлены положительные маркеры к вирусу гепатита «С» (генотип 3а) со средней степенью репликации вируса (30 тыс. копий в мкл). Произведены 2 сеанса системного введения биотрансплантата (суммарно 300 млн. клеток) с интервалом 3 месяца. При контрольном вирусологическом исследовании через 5 месяцев после первого сеанса пересадки интенсивность репликации вируса резко снизилась (1 тыс. копий в мкл), значительно улучшились лабораторные печеночные пробы и общее состояние больного.
Далее ниже представлено подробное описание методики лечения (с помощью данного заявленного биотрансплантата) цирроза печени (ЦП) и портальной гипертензии (ГП), относящихся к хроническим заболеваниям печени.
Основную группу больных составили 32 пациента, которым была проведена трансплантации. Из них 21(65,6%) больной был мужского пола, 11 (34,4%) - женского. Возраст больных колебался от 17 до 68 лет (средний возраст 40,9±12,47 лет). Длительность заболевания с момента постановки диагноза составляла от 22 лет до 1 года и составила в среднем 5,7±4,4 лет.
По этиологическому признаку ЦП распределялся следующим образом:
вирусная этиология зафиксирована у 19 (59%) больных (вирус гепатита «С» выявлен у 10 больных, вирус гепатита «В» - у 7 больных, из которых у трех выявлена суперинфекция «Д», сочетание вирусов «С» и «В» - у 2 больных), хроническая алкогольная интоксикация явилась причиной заболевания у 5 (16%) пациентов, у 1 (3%) больной диагностирован аутоиммунный цирроз печени, у 1 (3%) больной установлен диагноз первичный биллиарный цирроз (ПБЦ), в остальных случаях - у 6 (19%) больных установить причину заболевания не удалось.
Характеристика методов исследования
Всем больным перед введением разработанного биотрансплантата, содержащего АСПК, а также через 3, 6 и 12 месяцев после нее проводилось полное клиническое обследование, включающее физикальное исследование и общие инструментально-лабораторные методы исследования. Кроме того, в описанные сроки выполнялись специальные методы исследования, позволяющие более детально оценить функциональное состояние печени.
В общеклиническое обследование больных, помимо физикальных методов, вошли следующие лабораторные тесты:
- клинический анализ крови
- биохимический анализ крови
- серологическое исследование крови на наличие: HbsAg, анти-HCV, анти-ВИЧ, реакция Вассермана
- общий анализ мочи
- рентгенография грудной клетки
- электрокардиография
- ультразвуковое исследование (УЗИ) брюшной полости
- эзофагогастродуоденоскопия (ЭГДС)
Специальные методы обследования:
- ультразвуковая доплерография сосудов портальной системы (УЗДГ)
- электроэнцефалография (ЭЭГ)
- сцинтиграфия печени и селезенки
- морфологическое исследование печени
- изучение питательного статуса пациентов и аминограммы крови
- ангиографическое исследования
- изучение экспрессии цитокинов печени.
При трансплантации производилось введение от 200 до 500 млн. смешанной популяции клеток биотрансплантата в виде суспензии в физиологическом растворе. У пациентов брали информированное согласие на выполнение всех действий, связанных с трансплантацией.
Технические особенности введения биотрансплантата
Основными органами-мишенями при трансплантации служили печень (20 наблюдений) и селезенка (12 наблюдений). Трансплантация в селезенку производилась при наличии признаков значительной компрометации морфофункционального состояния печени: маленькая по размерам печень, уменьшение кровотока по печеночной артерии и воротной вене, резко обедненное сосудистое русло в печени, декомпенсация заболевания.
Устранение угрозы пищеводно-желудочного кровотечения являлось одним из важных условий, предшествовавших трансплантации. Оно осуществлялось любым способом в соответствии с тяжестью течения заболевания: хирургическим (наложение ПКШ-7 больных, гастротомия с прошиванием ВРВПЖ - 8 больных), эндоскопическим (лигирование ВРВПЖ - 4 больных, склерозирование ВРВПЖ - 3 больных) или их сочетанием.
Трансплантация осуществлялась двумя способами - интраоперационно (11 больных) и рентгеноэндоваскулярным способом (20 больных). В одном из наблюдений было использовано введение клеток путем чрескожной пункции селезенки. Однако из-за высокого риска развития внутрибрюшного кровотечения в дальнейшем мы отказались от данного метода.
Оценка эффективности биотрансплантации и результатов лечения у больных циррозом печени и портальной гипертензией
Оценка эффективности трансплантации проводилась через 3, 6 и 12 месяцев и основывалась на анализе динамики клинического статуса и результатов лабораторно-инструментальных методов исследований.
Основные синдромы заболевания:
- астеновегетативный
- печеночная энцефалопатия
- желтуха
- цитолитический
- б