Полипептид актинии, обладающий анальгетическим действием
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к биологически активным полипептидам, обладающим анальгетическим действием, и может быть использовано в медицине. Получают средство, направленное против боли, за счет структуры полипептида АРНС1, имеющего следующую аминокислотную последовательность:
H2N-Gly1-Ser2-lle3-Cys4-Leu5-Glu6-Pro7-Lys8-Val9-Val10-Gly11-Pro12-Cys13-Thr14-Ala15-Tyr16-Phe17-Arg18-Arg19-Phe20-Tyr21-Phe22-Asp23-Ser24-Glu25-Thr26-Gly27-Lys28-Cys29-Thr30-Val31-Phe32-lle33-Tyr34-Gly35-Gly36-Cys37-Gly38-Gly39-Asn40-Gly41-Asn42-Asn43-Phe44-Gly45-Thr46-Leu47-Arg48-Ala49-Cys50-Arg51-Ala52-lle53-Cys54-Arg55-СООН. Изобретение позволяет получить эффективный анальгетический препарат нового поколения, имеющий направленное действие на клеточную мишень. 8 ил., 1 табл.
Реферат
Изобретение относится к биохимии, конкретно к биологически активным полипептидам, обладающим анальгетическим или противовоспалительным действием, которые могут найти применение в медицине или научных исследованиях.
В настоящее время одной из основных причин обращения людей за врачебной помощью является боль. Патологическая боль, появляющаяся при различных состояниях, представляет собой нежелательное явление, резко снижающее качество жизни, работоспособность и вызывающее страдания. До 40% взрослого населения развитых стран страдает от хронической боли. Наиболее широко в качестве анальгетических препаратов традиционно используются морфин (и другие опиоиды), аспирин (а также другие нестероидные противовоспалительные средства) и разнообразные вещества неспецифического действия (антиконвульсанты, антидепрессанты). Несмотря на большой ассортимент анальгетических средств различной химической природы, некоторые типы болевых состояний, например различные нейропатии, практически нечувствительны к этим агентам. Кроме того, неспецифичность действия вышеперечисленных веществ в ряде случаев вызывает нежелательные побочные эффекты, что сильно ограничивает возможность их применения.
В последнее время особое внимание было уделено разработке и получению принципиально новых анальгетических средств, специфично действующих на молекулярные механизмы генерации боли с минимальными побочными эффектами. Что подразумевает использование высокоселективных агентов, способных адресно включать, выключать или модифицировать определенный фрагмент на пути прохождения болевого сигнала от очага поражения в головной мозг.
Одними из наиболее перспективных источников таких соединений являются природные яды, как правило, содержащие в своем составе компоненты, проявляющие высокий уровень специфичности по отношению к различным рецепторам нервной системы. Общий анальгетический эффект был неоднократно описан как для препаратов, полученных на основе природных ядов, так и для отдельно выделенных компонентов.
Известны и нашли практическое применение полипептиды Ziconotide SNX-111 или омега-конотоксин MVIIA и АМ-336 или омега-конотоксин СVID (оба - блокаторы Са2+-каналов). Эти нейротоксины и их близкие гомологи известны не только как анальгетические соединения, но и как средства для лечения гипертонии, шизофрении, снятия различных воспалительных процессов, восстановления нервной системы после ишемии [Olivera В.М., Mcintosh J.M., Watkins М., Garrett J.E., Cruz L.J., Grilley M., Walker C.S., Shetty R., Jones R.M., Schoenfeld R.M. // WO 02064740 - 2002].
Недостатком известных средств является подверженность остатков метионина, входящих в их состав, к окислению, что приводит к снижению терапевтических свойств препаратов на их основе. Кроме того, они вводятся в организм посредством длительной инъекции в спинномозговой столб (например, через имплантированные микронасосы), что во многих случаях трудновыполнимо и требует применения специального медицинского оборудования и высококвалифицированного персонала.
Известен полипептидный препарат конотоксин Vc1.1 (имеющий также название ACV1), который проходит испытание как средство борьбы с болью. Показано его действие на нейрональный ацетилхолиновый рецептор и изучен эффект in vivo на нескольких животных моделях, воспроизводящих человеческие нейропатические боли [Livett B.G., Sandall D.W., Keays D., Down J., Gayler K.R., Satkunanathan N., Khalil Z. Therapeutic applications of conotoxins that target the neuronal nicotinic acetylcholine receptor. // Toxicon. - 2006. - vol.48. - p.810-829]. Кроме того, было показано его позитивное влияние на скорость регенерации поврежденных нервных тканей.
Недостатком ACV1 является ограниченность его применения, связанная с преимущественным расположением его молекулярной мишени в периферической нервной системе. Поэтому потенциальным кругом его применения, в первую очередь, является использование для анальгезии при механическом или тепловом разрушении поверхностных тканей. Возможность использования его при лечении нейрологических заболеваний центральной нервной системы не доказана.
Изобретение решает задачу расширение ассортимента анальгетических лекарственных препаратов нового поколения, имеющих направленное действие на клеточную мишень.
Поставленная задача решается за счет структуры полипептида АРНС1, имеющего следующую аминокислотную последовательность:
H2N-Gly1-Ser2-lle3-Cys4-Leu5-Glu6-Pro7-Lys8-Val9-Val10-Gly11-Pro12-Cys13-Thr14-Ala15-Tyr16-Phe17-Arg18-Arg19-Phe20-Tyr21-Phe22-Asp23-Ser24-Glu25-Thr26-Gly27-Lys28-Cys29-Thr30-Val31-Phe32-lle33-Tyr34-Gly35-Gly36-Cys37-Gly38-Gly39-Asn40-Gly41-Asn42-Asn43-Phe44-Glu45-Thr46-Leu47-Arg48-Ala49-Cys50-Arg51-Ala52-lle53-Cys54-Arg55-СООН
Заявляемый анальгетический полипептид состоит из 56 аминокислотных остатков, может быть выделен хроматографическими методами из нематоцитов морских актиний или получен в виде рекомбинантного белка генно-инженерными методами на основании нуклеотидной последовательности, имеющей нижеследующую структуру: gatcactttctccaaccacaacagagagcaaagacaagataacaagATGAAGGGAACTTTTCTTATT TGTCTGATCCTAATTGCAGGTTTCTCTTTCAAAAGCACTCAAGCCGGTAGCATTGTTTAGAACCCAA AGTAGTTGGCCCGTGTACCGCGTATTTTCGAAGATTCTACTTCGATTCAGAGACTGGAAAGTGCACA GTGTTCATCTACGGTGGATGCGAGGGAAATGGAAATAACTTTGAGACCCTGCGTGCATGCCGAGCTA TATGCAGGGCGTAAtcttgttagaagagcaatgagaagttccaaattgctacaaaaagtcaagtaaa gataaaaataaaagatgtaaattcattaacgtggatttagtaattgtattaagtgaaaatgggaata aaaggatggcaatccactaaaaaaaaaaaaaaaaaaaaaaaaaaa
Заявляемый полипептид проявляет анальгетическую активность на млекопитающих, как было показано в тестах на диком типе мышей, и способен уменьшать in vitro проводимость каналов TRPV1 рецепторов, экспрессированных в ооцитах лягушки. Половинный эффект уменьшения проводимости капсаицин индуцированных токов TRPV1-ED50 составляет 54±4 нМ при расчетном значении коэффициента Хилла 2,12±0,19.
Биологическая активность полипептида АРНС1 обуславливается уникальными аминокислотными остатками, расположенными в областях слабой гомологии с последовательностями ингибиторов протеаз (см. фиг.1).
Заявляемый полипептидный агент, именуемый АРНС1, способен модулировать рецептор болевых стимулов - ванилоидный рецептор тип 1 (TRPV1), который инициирует нейрональный ответ при воспалительных процессах. Эти канальные рецепторы были обнаружены как в периферических и висцеральных нервных тканях, так и в тканях головного мозга. Опыты с нокаутными мышами, дефектными по гену TRPV1 рецептора, убедительно доказывают его роль в восприятии боли [Caterina MJ, Leffler A, Malmberg АВ, Martin WJ, Trafton J, Petersen-Zeitz KR, Koltzenburg M, Basbaum AI, Julius D. Impaired nociception and pain sensation in mice lacking the capsaicin receptor. // Science. - 2000. - vol.288. - p.306-313]. Широкое вовлечение TRPV1 в различные процессы нейропередачи позволяет применять заявляемый полипептид для лечения самых различных заболеваний, связанных с воспалительными или нейропатологическими процессами, например астма, интерстициальный цистит и артрит, а также использоваться как анальгетический агент.
АРНС1 является первым соединением полипептидной структуры, способным оказывать анальгетический эффект через уменьшение проводимости TRPV1 рецепторов. В его аминокислотной последовательности отсутствуют аминокислотные остатки метионина, что вместе с чрезвычайно стабильной пространственной структурой (ингибиторов протеаз типа Куница) придает молекуле стабильность при внутримышечном введении. И как следствие, этого улучшает потребительские свойства фармакологических препаратов на его основе, такие как длительность воздействия и простота использования.
Изобретение иллюстрируют фиг.1-8
Фиг.1. Сравнение аминокислотной последовательности АРНС1 и близких структурных гомологов, имеющих тип пространственной укладки полипептидной цепи «ингибиторов типа Куница». Сходные по свойствам аминокислотные остатки выделены серым цветом, сверху черными прямоугольниками обозначены участки максимальных различий.
Фиг.2. Основные стадии хроматографического выделения анальгетического полипептида АРНС1 из спиртового экстракта нематоцитов актинии Heteractis crispa. На первом этапе используют гидрофобную колонку Полихром-1 (7×30 см) и скорость элюирования 1,2 л/ч; на 2 этапе используют ионообменную колонку Bio-Rex 70 (2,5×60 см) 5 мМ аммоний-ацетатный буфер (рН 4,5) и скорость элюции 22 мл/ч; на 3 этапе используют ионообменную колонку SP-Sephadex С-25 (2,5×40 см), 5 мМ аммоний-ацетатный буфер (рН 4,5) и скорость элюции 70 мл/ч; на последнем 4 этапе используют обращеннофазную колонку Jupiter С5 (4,6×150 мм), буфер, содержащий 0,1% трифторуксусной кислоты и скорость элюции 1 мл/мин.
Фиг.3. Структура нуклеотидной последовательности гена, кодирующего анальгетический полипептид АРНС1, и выведенная аминокислотная последовательность его белка, предшественника. Последовательность выщепляемого сигнального пептида подчеркнута, а фрагмент аминокислотной последовательности, определенный автоматическим методом секвенирования, выделен жирным шрифтом.
Фиг.4. Схема клонирования гена рекомбинантного АРНС1. Место вставки аминокислотного остатка Met для последующего расщепления бромцианом отмечено черным треугольником, черные прямоугольники обозначают домен тиоредоксина и последовательность 6 гистидинов для металлоаффинной хроматографии.
Фиг.5. ВЭЖХ гидролизата 2 мг химерного белка Тrx-APHCl на обращеннофазной колонке Jupier С4 (Phenomenex) 10×250 мм. Разделение со скоростью 2 мл/мин проводят в линейном градиенте концентрации ацетонитрила в присутствии 0,1% трифторуксусной кислоты. Детекция при длине волны 210 нм. Место выхода рекомбинантного АРНС1 обозначено.
Фиг.6. Воздействие АРНС1 на капсаицин индуцируемые каналы TRPV1. А - записи проводимости каналов после добавления 2 мкМ капсаицина (ток Io) и 2 мкМ капсаицина совместно с 300 нМ АРНС1 (ток I). Б - кривая зависимости доза - ответ, построенная как отношение тока после совместной аппликации АРНС1 с капсаицином к уровню тока возбуждения контрольного эксперимента.
Фиг.7. Анальгетический эффект АРНС1 в тесте отдергивания хвоста. По оси абсцисс отложено время, прошедшее с момента инъекции препарата; по оси ординат - время реакции на болевой стимул. Статистически достоверные различия отмечены звездочкой (*). А-тестирование в первом временном интервале. Б-тестирование во втором временном интервале.
Фиг.8. Анальгетический эффект АРНС1 в тесте горячей пластины. По оси абсцисс отложено время, прошедшее с момента инъекции препарата; по оси ординат - время реакции на болевой стимул. Статистически достоверные различия отмечены звездочкой (*).
Изобретение иллюстрируют примеры
Пример 1. Выделение анальгетического полипептида АРНС1.
Актинии гомогенизируют в холодной дистиллированной воде и выдерживают 24 часа при температуре 4°С, прибавляют этиловый спирт до конечной концентрации
70% и проводят экстракцию еще 4 часа, после чего фильтруют через несколько слоев ткани. Тонкий осадок удаляют центрифугированием при 3500g, а получаемый супернатант повторно центрифугируют при 8000g. Осветленный супернатант лиофильно высушивают и хранят при температуре (-20)°С до последующего применения.
Выделение и очистку анальгетического полипептида из этанольного экстракта актинии Heteractis crispa проводят по разработанной схеме (см. фмг.2), включающей гидрофобную хроматографию на полихроме-1 (политетрафторэтилене), позволяющем сорбировать биологически активные полипептиды актиний и не задерживать находящиеся в экстракте в значительных количествах ионогенные примеси (этап 1); ионообменную хроматографию на носителях Bio-Rex 70, SP-Sephadex С-25 (этап 2 и 3) и ВЭЖХ на колонке с обращенной фазой С5 Jupiter (4,6×150 мм, размер пор 300 Å, диаметр частиц 5 мкм, Phenomenex) - 4 этап. Активность промежуточных фракций подтверждают в биологических тестах на животных или методами электрофизиологии на каналах TRPV1, экспрессированных в ооцитах лягушек.
На 1 этапе выделения элюцию (скорость 1,2 л/час) адсорбировавшихся на полихроме-1 полипептидов проводят ступенчатым градиентом этанола от 0 до 70%. Детектирование хроматографических фракций на всех стадиях выделения проводят спектрофотометрически при длине волны 280 нм. Ионообменную хроматографию на Bio-Rex 70 и SP-Sephadex С-25 проводят в слабокислом буферном растворе: 5 мМ аммоний-ацетатный буфер (рН 4,5) со скоростями элюции 22 мл/ч и 70 мл/ч соответственно. Для формирования градиента используют второй буферный раствор, содержащий 1М NaCl, а в случае хроматографии на SP-Sephadex С-25 после элюции 2 л градиент формируют добавлением 3 буферного раствора: 5 мМ аммоний-ацетатный буфер (рН 7,3). На последнем этапе фракционирование проводят со скоростью 1 мл/мин в линейном градиенте концентрации ацетонитрила от 0 до 70% (v/v) в 0,1%-ной (v/v) трифторуксусной кислоте.
Пример 2. Установление частичной аминокислотной последовательности.
Определение N-концевой аминокислотной последовательности очищенного полипептида АРНС1 проводят методом ступенчатой деградации по Эдману на автоматическом секвенаторе Prоcise 492 (Applied Biosystems, США). В результате устанавливают аминокислотную последовательность первых 15 аминокислотных остатков: H2N-Gly1-Ser2-lle3-Cys4-Leu5-Glu6-Pro7-Lys8-Val9-Val10-Gly11-Pro12-Cysl3-Thr14-Ala15-
Пример 3. Установление структуры гена и полной аминокислотной последовательности АРНС1.
Для получения суммарной фракции мРНК свежепрепарированный образец актинии (50 мг) гомогенизируют пестиком в 0,5 мл буфера для выделения РНК RNAwiz (Ambion, Canada), инкубируют при комнатной температуре 5 мин, затем добавляют 0,1 мл хлороформа, встряхивают и инкубируют еще 10 мин. Полученную смесь центрифугируют при температуре 4°С (15 мин, 14000g) и отбирают верхнюю водную фазу. Последовательно добавляют 0,25 мл дистиллированной воды и 0,5 мл изопропанола, центрифугируют при температуре 4°С (15 мин, 14000g). К осадку добавляют 1 мл 75% этилового спирта и осаждают центрифугированием при температуре 4°С (5 мин, 14000g). Осадок РНК подсушивают на воздухе и растворяют в 50 мкл дистиллированной воды, не содержащей РНКаз. Концентрацию РНК определяют спектрофотометрически.
Для синтеза первой цепи кДНК 5 мкг суммарной РНК смешивают с праймером Сар(Т)20: (AAG CAG TGG ТАА САА CGC AGA GTA С(Т)20 VN, где N = смесь A,C,G,T; и V = смесь A,G,C), доводят дистиллированной водой объем смеси до 12 мкл, инкубируют 5 мин при температуре 70°С и охлаждают в ледяной бане. Добавляют 4 мкл 5-кратного реакционного буфера (250 мМ Трис-HCl (рН 8,3 при 25°С), 250 мМ КСl, 20 мМ MgCl2, 50 мМ дитиотреитола), 1 мкл ингибитора рибонуклеаз RNAsin (Promega), 2 мкл 10 мМ dNTP. Инкубируют 5 мин при температуре 37°С. Реакцию проводят 1 ч при температуре 42°С, добавляя в реакционную смесь 1 мкл (200 ед. активности) обратной транскриптазы RevertAidТМ (Fermentas, Латвия).
Для определения полной нуклеотидной последовательности гена, кодирующего белок-предшественник АРНС1, синтезируют: один универсальный праймер Т7сар (GTA ATA CGA СТС ACT ATA GGG САА GCA GTG GTA АСА ACG CAG AGT); два вырожденных праймера, рассчитанных из частичной аминокислотной последовательности искомого полипептида: для определения 3'-концевой последовательности Ing1 (ATA TGT СТА GAA ССТ AAR GTN GTN GG), Ing2 (CCT AAG GTT GTA GGA CCN TGY CAN GC); и один праймер для определения 5'-концевой последовательности IngR (GGC ATG СAC GCA GGG ТСТС).
ПЦР проводят с использованием Taq Platinum polymerase (Gibco) при следующих условиях 94°С - 20 с, 55°С - 20 с, 72°С 20 с, 25 циклов. Амплифицированные фрагменты около 350 п.о. (в эксперименте по определению 3'-концевой последовательности) или около 300 п.о. (в эксперименте по определению 5'-концевой последовательности) клонируют в плазмиду pBS-SK+. Нуклеотидную последовательность нескольких клонов определяют на многоканальном автоматическом секвенаторе PRISM 3100-Avant (ABI-Perkin Elmer). Полноразмерную структуру гена, кодирующего белок-предшественник, определяют после множественного выравнивания всех полученных 5'-концевых и 3'-концевых последовательностей (см. фиг.3).
Правильность конечной аминокислотной последовательности подтверждают сравнением расчетных и измеренных молекулярных масс триптических пептидов, полученных ограниченным протеолизом природного полипептида.
Пример 4. Определение относительной молекулярной массы.
Индивидуальность очищенных веществ подтверждают масс-спектрометрическим анализом. Масс-спектры получают на MALDI-времяпролетном масс-спектрометре Ultraflex II TOF/TOF (Bruker Daltonik, Германия) с идентификацией положительных ионов в рефлекторном режиме. В качестве матрицы используют α-циано-4-гидроксикоричную кислоту (10 мг/мл) в 50%-ном (v/v) ацетонитриле, содержащем 0,1%-ную (v/v) трифторуксусную кислоту. Для калибровки прибора используют стандартную смесь пептидов с диапазоном молекулярных масс 700-3500 Да (Sigma, США).
Измеренная средняя молекулярная масса природного полипептида АРНС1 составляет 6187,0 Да. Расчетная средняя молекулярная масса полипептида составляет 6187,08 Да, т.е. отличается от измеренной на 0,08 Да. С учетом точности метода определения масс выносят заключение об отсутствии любой пост-трансляционной модификации у природного полипептида.
Пример 5. Создание генно-инженерной конструкции для получения рекомбинантного АРНС1.
Для получения генно-инженерной конструкции, способной экспрессировать АРНС1 в клетках Е.coli, аминокислотную последовательность преобразуют в нуклеотидную с учетом оптимизации использования кодонов в клетке хозяине (Е.coli). Синтезируют 5 олигонуклеотидных праймеров, перекрывающих полную аминокислотную последовательность полипептида, и два праймера для клонирования в плазмиду рЕТ-32b(+) (см. таблицу 1).
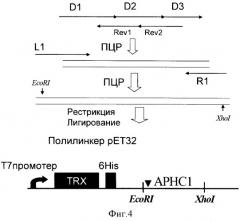
Аминокислотную последовательность АРНС1 вставляют в гибридный белок после фрагмента тиоредоксина и последовательности 6 аминокислотных остатков гистидина для прокариотической экспрессии в виде водорастворимого химерного белка (см. фиг.4).
Для этого с праймерами, кодирующими внутреннюю часть гена (прямыми D1-D3 и комплиментарными им обратными Revl-Rev2), проводят 15 циклов ПЦР. Получаемую амплифицированную ДНК используют как матрицу для второго раунда ПЦР, которую проводят с парой праймеров, содержащих сайты рестрикции и комплементарных краям внутренних частей генов (R1, L1). Все 3 раунда ПЦР проводят при сходных условиях 94°С - 20 с, 55°С - 20 с, 72°С - 20 с, 25 циклов, используя Taq Platinum polymerase (Gibco).
После обработки рестриктазами EcoRI и Xhol собранный ген АРНС1 и экспрессирующий вектор pET32b+ (Novagen) лигируют друг с другом. В результате получают плазмиду, кодирующую химерный белок Тrх-АРНС1 под контролем Т7 промотера. Полученную плазмиду трансформируют в клетки XL1-Blue и проверяют правильность сборки и лигирования секвенированием.
Таблица 1. Структура олигонуклеотидных праймеров. Жирным шрифтом обозначен кодон метионина, вводимый перед первой аминокислотой целевого продукта для химического выщепления рекомбинантного АРНС1 из гибридного белка. Сайты рестрикции для клонирования в плазмиду pET-32b(+) EcoRI (праймер L1) и Xhol (праймер R1) подчеркнуты.
| Название | Последовательность |
| Dl | CCTGGAACCGAAAGTTGTTGGTCCGTGCACCGCTTACTTCCGTCGTTTCT |
| D2 | ACTTCGACTCTGAAACCGGTAAATGCACCGTTTTCATCTACGGTGGTTGC |
| D3 | GAAGGTAACGGTAACAACTTCGAAACCCTGCGTGCTTGCCGTGCTATC |
| Revl | CGGTTTCAGAGTCGAAGTAGAAACGACGGAAGTAAG |
| Rev2 | GTTGTTACCGTTACCTTCGCAACCACCGTAGATGAAA |
| L1 | (5'-GGAATTCC ATG GGT TCT АТС TGC CTG GAA CCG AAA GTT GTTG) |
| Rl | (5'-CTCTCGAG TCA AGC ACG GCA GAT AGC ACG GCA AGC ACG CAG) |
Пример 6. Получение рекомбинантного APHC1.
Клетки BL21(DE3) трансформируют экспрессионным вектором рЕТ32b+АРНС1. После селекции на чашках с селективным антибиотиком (ампицилин) клетки пересеивают в 200 мл колбы и выращивают до оптической плотности ~0.6 единиц при перемешивании. Индукцию экспрессии проводят добавлением изопропил-β-D-1-тиогалактопиранозида до концентрации 0,2 мМ, после чего растят клетки еще 12 ч при 24°С. Клетки осаждают и ресуспендируют в буфере для дезинтеграции (20 мМ Трис-HCl рН 7,2, 150 мМ NaCl). Дезинтегрируют клетки ультразвуком, осаждают клеточный дебрис и тельца включения центрифугированием. Целевой химерный белок содержится в растворимой фракции.
В результате экспрессии созданной конструкции наработка рекомбинантного АРНС1 происходит в составе химерного белка с тиоредоксином, где последовательность тиоредоксина совместно с полигистидиновым тяжем предшествует АРНС1. Металлоаффинную хроматографию на Со2+-сорбенте проводят в буфере (20 мМ Трис-HCl рН 7,2, 150 мМ NaCl), для элюирования химерного белка используют буфер (150 мМ имидазол, 300 мМ NaCl, 20 мМ Tris, рН 7,5). Собранный белок обессоливают на PD-10 картриджах (GE Healthcare), используя дистиллированную воду как элюент, и лиофилизируют.
Высушенный химерный белок растворяют в 0,1 М НСl до концентрации белка 2 мг/мл, расщепляют бромцианом 15 ч в темноте, используя 600-кратный молярный избыток бромциана к химерному белку. Растворитель и избыток бромциана удаляют на вакуумном концентраторе, далее смесь продуктов протеолиза растворяют в хроматографическом буфере А (0,1% трифторуксусной кислоты) и наносят на колонку с обращенной фазой Jupier C4 (Phenomenex) 10×250 мм для выделения целевого полипептида (см. фиг.5). Фракционирование проводят в линейном градиенте концентрации ацетонитрила от 10 до 70% (v/v) в 0,1%-ной (v/v) трифторуксусной кислоте в течение 40 мин со скоростью элюции 2 мл/мин. Детекцию осуществляют спектрофотометрически по оптическому поглощению при 210 нм.
Контроль чистоты и правильности синтеза рекомбинантного АРНС1 проверяют при помощи масс-спектрометрического анализа; сравнением хроматографических подвижностей природного и рекомбинантного полипептида на аналитической колонке Jupier С5 (Phenomenex) 2×150 мм; а также сравнением биологических свойств.
Пример 7. Экспрессия каналов TRPV1 в ооцитах лягушки.
Коммерчески доступную плазмиду (клон EX W 1312-В02), содержащую Т7 промотер перед кодирующей областью TRPV1, расщепляют рестриктазой NotI и обрабатывают «фенол/хлороформом». Для чего: к реакционной смеси, объемом 200 мкл добавляют равный объем фенола, сильно встряхивают, центрифугируют 10000g 1 мин и отбирают верхнюю фазу; повторно добавляют 200 мкл хлороформа, центрифугируют 10000g 1 мин и снова отбирают верхнюю фазу; добавляют 600 мкл 96% этилового спирта, центрифугируют 14000g 5 мин и высушивают полученный осадок; растворяют осадок в 33 мкл дистиллированной воды.
РНК, кодирующую TRPV1, получают при помощи набора реагентов RiboMAX Large Scale RNA Production System (Promega), для чего к 33 мкл расщепленной и очищенной плазмиды добавляют 20 мкл 5-кратного буфера для транскрипции (400 мМ HEPES-KOH, 120 мМ MgCl2, 10 мМ спермедина, 200 мМ дитиотриэтола), 20 мкл смеси рибонуклеозидтрифосфатов (25 мМ ATP, СТР, UTP и 2 мМ GTP), 7 мкл Cap-аналога (в концентрации 40 мМ) и 10 мкл Т7 РНК полимеразы (Promega). Реакционную смесь инкубируют 3 ч при 37°С. Очистку РНК проводят вышеописанным методом «фенол/хлороформом». Полученные образцы растворяют в воде, анализируют в агарозном гель-электрофорезе и хранят при температуре -80°С несколько недель.
Ооциты Xenopus laevis вынимают из яичника лягушки, обрабатывают смесью коллагеназ типа I (Sigma) в концентрации 1 мг/мл для удаления фолликулярной оболочки при 22°С 2 ч. Дефолликулированные ооциты помещают в стерильную среду ND96 (96 мМ NaCl, 2 мМ КСl, 1,8 мМ СаСl2, 1 мМ MgCl2, HEPES 5 мМ, титрованный NaOH до рН 7,4) с добавлением антибиотика гентамицина 50 мкг/мл и пирувата 5 мМ и выдерживают ночь при температуре 17°С. Раствор РНК (5 нг в 30 нл воды) вкалывают при удерживающем давлении 20 кПа и рабочем давлении 1000 кПа. Заколотые ооциты инкубируют 4 дня при температуре 18°С в среде ND96, содержащей гентамицин в концентрации 50 мкг/мл. Контроль уровня экспрессии TRPV1 проводят в электрофизиологических экспериментах путем активации проводимости экспрессируемых каналов 2 мкМ раствором капсаицина.
Пример 8. Влияние АРНС1 на проводимость каналов TRPV1.
Двухэлектродную систему фиксации мембранного потенциала используют для измерения проводимости каналов TRPV1 в ооцитах. Разность потенциалов -50 мВ поддерживают цифровым усилителем GeneClamp 500 (Axon Instruments, СА), сигналы регистрируют с частотой 100 Гц. Микроэлектроды заполняют раствором 3 М КСl, а буферный раствор Ca2+-free ND96 (96 мМ NaCl, 2 мМ КСl, 0,1 мМ ВаСl2, 1 мМ MgCl2, 5 мМ HEPES, титрованный NaOH до рН 7,4) используют как рабочий буфер. Лиганд активируемые токи вызывают кратковременной (20 с) инкубацией ооцита в растворе, содержащем 2 мкМ капсаицина и 0,1% бычьего сывороточного альбумина. Для испытаний используют ооциты, показавшие стабильный ответ (3 и более раза) в диапазоне амплитуды суммарного тока 200-1000 нА.
Контрольным значением тока принимают усредненную по нескольким измерениям проводимость канала TRPV1 после воздействия 2 мкМ капсаицина (обозначена на фиг.6А как Iо). Совместную аппликацию капсаицина и АРНС1 проводят с несколькими концентрациями исследуемого полипептида (10 нМ, 30 нМ, 90 нМ, 300 нМ, 900 нМ и 3 мкМ) в пяти повторах для каждой концентрации и измеряют ток ингибирования (обозначен как I на фиг.6, А). Изучаемая концентрационная зависимость действия АРНС1 показывает, что действие полипептида даже в насыщающих концентрациях не вызывает полной блокады TRPV1 каналов. Скорость восстановления ответа после отмывки полипептида менее 120 с, а само его действие полностью обратимо. На основании получаемых кривых доза - ответ (см. 6, Б) рассчитывают половинный эффект ингибирования капсаицин индуцированных токов TRPV1-ED50, который составляет 54±4 нМ при расчетном значении коэффициента Хилла 2,12±0,19, максимальное ингибирование составляет в среднем 32±9% (наибольшее значение 50%).
Пример 9. Тестирование анальгетической активности АРНС1 на мышах в тесте отдергивания хвоста.
Мышей делят на 2 группы (контрольную и экспериментальную) по 5 особей в каждой. Тесты проводят на самцах беспородных белых мышей массой около 20 г.На время опыта мышей помещают в отдельные пластиковые пеналы таким образом, чтобы хвост находился снаружи. Болевое раздражение моделируют погружением хвоста в горячую воду с температурой 50°С. Для предотвращения ожогов хвоста время раздражения ограничивают 12 с интервалом. До проведения тестирования у животных регистрируют исходный индивидуальный уровень болевой чувствительности. Тестируемый образец АРНС1 растворяют в стерильном физиологическом растворе до концентрации 0,1 мг/кг и вводят 100 мкл раствора внутримышечно в область основания хвоста. Контрольным животным вводят эквивалентный объем (100 мкл) стерильного физиологического раствора. Анальгетический эффект определяют по изменению латентного периода отдергивания хвоста (время избавления от болевого раздражителя). Учитывая физиологическую особенность действия полипептида, измерения проводят в двух временных интервалах: интервал 90 мин с измерениями через каждые 15 мин и 5-часовое наблюдение с интервалами измерения в 1 ч.
На основании полученных результатов определяют, что анальгетический эффект при внутримышечном введении наступает не сразу, а в течение 1-2 ч, при этом анальгетическое действие продолжается более 2 ч. Результаты обрабатываются статистически, с помощью ANOVA и теста Тьюки (р<0,05) и определяют уровень достоверности полученных результатов.
Пример 10. Тестирование анальгетической активности АРНС1 на мышах в тесте горячая пластина.
Мышей делят на 2 группы (контрольную и экспериментальную) по 5 особей в каждой. Тесты проводят на самцах беспородных белых мышей массой около 20 г. Болевое раздражение моделируют, помещая мышь на металлическую поверхность, разогретую до 52°С. Для предотвращения ожогов лап время воздействия раздражения ограничивают 35 с. До проведения тестирования у животных регистрируют исходный индивидуальный уровень болевой чувствительности. Тестируемый образец АРНС1 растворяют в стерильном физиологическом растворе до концентрации 0,1 мг/кг и вводят 100 мкл раствора внутрибрюшинно. Контрольные животные получают эквивалентный объем (100 мкл) стерильного физиологического раствора.
Анальгетический эффект измеряют по увеличению времени, прошедшего от момента посадки животного на пластину до момента первого облизывания задней лапы. Измерение болевой чувствительности проводят через 15 и 30 мин после введения препарата. Быстрое всасывание препарата при этом методе введения приводит к быстрому анальгетическому эффекту, сразу же достигающего максимального значения. Результаты обрабатывают статистически, достоверность отличий результатов контрольной и экспериментальной групп определяют с помощью ANOVA и теста Тьюки (р<0,05).
Полипептид, проявляющий анальгетическую активность (АРНС1), имеющий следующую аминокислотную последовательность:H2N-Gly1-Ser2-lle3-Cys4-Leu5-Glu6-Pro7-Lys8-Val9-Val10-Gly11-Pro12-Cys13-Thr14-Ala15-Tyr16-Phe17-Arg18-Arg19-Phe20-Tyr21-Phe22-Asp23-Ser24-Glu25-Thr26-Gly27-Lys28-Cys29-Thr30-Val31-Phe32-lle33-Tyr34-Gly35-Gly36-Cys37-Glu38-Gly39-Asn40-Gly41-Asn42-Asn43-Phe44-Glu45-Thr46-Leu47-Arg48-Ala49-Cys50-Arg51-Ala52-lle53-Cys54-Arg55-СООН.