Способ получения загруженных белком полиэлектролитных нано- и микрокапсул
Иллюстрации
Показать всеИзобретение относится к области биохимии и касается способа получения загруженных белком полиэлектролитных нано- и микрокапсул. Готовят составные микросферолиты карбонатов щелочноземельных металлов и инкапсулируемого белка, формируют капсулы путем поочередной адсорбции на составные микросферолиты противоположно заряженных полиэлектролитов, которые предварительно подбирают, поочередно исследуя влияние каждого полиэлектролита в растворе на активность инкапсулируемого белка. Карбонаты щелочноземельных металлов из капсул удаляют с помощью ЭДТА или другого хелатного агента или подкислением среды. Полиэлектролиты берут как биодеградабельные, так и не способные к биодеградации поликатионы и полианионы, преимущественно линейной структуры. После адсорбции желаемого количества слоев полиэлектролитов осуществляют контроль активности белка. Изобретение обеспечивает сохранение функциональных свойств белка в процессе его инкапсулирования. 5 з.п. ф-лы, 5 ил.
Реферат
Предлагаемое изобретение относится к области биохимии, преимущественно полимерной нанотехнологии.
В число значимых объектов полимерной нанотехнологии входят полиэлектролитные нано- и микрокапсулы (ПНМК). ПНМК обладают рядом интересных свойств. Из них наиболее ярким является полупроницаемость полиэлектролитной оболочки капсул - проницаемость для низкомолекулярных соединений и их мелких агрегатов и непроницаемость для высокомолекулярных веществ и крупных частиц (Antipov A.A., Sukhorukov G.В. // Advances in Colloid and Interface Science. 2004. V.111. №1-2. P.49-61.; Antipov A.A., Viera, E., et al. (2002). Controlled and sustained release properties of polyelectrolyte multilayer capsules. WO 0217888).
Имеющиеся в литературе данные свидетельствуют о широких возможностях использования ПНМК в ряде областей техники, химии, физики, биотехнологии и фармакологии (Möhwald H., Donath E. and Sukhorukov G.В. In book: Multilayer Thin Films. Sequential Assembly of Nanocomposite Materials (Ed. By G.Decher and J.B.Schlenoff). Wiley-VCH, 2002, P.363-392.; Fery A. Mohwald H., Sukhorukov G.В. // Progr. Polymer. Sci. 2005. V.30(8-9). P.885).
Показана возможность использования ПНМК для получения пролонгированных лекарственных средств (Radtchenko I.L., Sukhorukov G.B., Mohwald H. (2002). A novel method for encapsulation of poorly water-soluble drugs: precipitation in polyelectrolyte multilayer shells. // Intern. J. Pharmaceutics, 242 (1-2):219-223). Полученные результаты свидетельствуют о преимуществе такого подхода по сравнению, например, с использованием микрогелей, мицелл или липосомного капсулирования. В отличие от последнего методом послойного полиэлектролитного капсулирования (ППК) формируется пространственно организованная надмолекулярная структура, устойчивая к действию кислорода и других окислителей. Привлекательность метода ППК для получения переносчиков и контейнеров биологически активных веществ и соответственно пролонгированных лекарственных средств, возможно, с адресной доставкой заключается и в его простоте. В самое последнее время с использованием метода послойного полиэлектролитного капсулирования начата разработка новых методов ферментативного определения концентраций анализируемого низкомолекулярного вещества в сложной биологической жидкости. Это направление исследований основано на работах по включению ферментов в полиэлектролитные микрокапсулы (ПЭ-микрокапсулы).
В настоящее время имеется ряд подходов к загрузке белков в полиэлектролитные микрочастицы. Первый из них был предложен в 1999 году (Бобрешова М.Е., Сабурова Е.А. и др. // Биофизика. 2000. Т.44. №5. С.813-820). Этот способ включает в себя стадию образования микроагрегатов белка в процессе его высаливания и последующую стадию поочередной адсорбции противоположно заряженных полиэлектролитов на эти микроагрегаты. Включение фермента в полиэлектролитную микрочастицу составляло ~ 70% от количества агрегатов белка, но его активность была заметно снижена и зависела от ряда факторов. Основной недостаток этого метода состоит в том, что содержащие фермент микрочастицы имеют неправильную форму и их размер невозможно проконтролировать.
Известен способ включения белка непосредственно в полые ПНМК, в оболочках которых специально создавались «поры» (оболочка разрыхлялась) добавлением органического растворителя, изменением солевого состава и pH среды для проникновения белка сквозь оболочку в капсулу. Количество включенного таким способом в капсулу белка составляло менее 10% и при этом его большая часть сосредотачивалась в оболочке микрокапсулы (Lvov Y., Antipov A.A., Mamedov A. et al. // Nanoletters 2001. V.1. №3. P.125-128).
Наибольшего внимания заслуживает предложенный недавно и принятый нами в качестве прототипа способ включения белков в полиэлектролитную микрокапсулу, основными стадиями которого являются предварительное формирование ядра капсулы - «кора», в виде микросферолита CaCO3 с включенным в нее белком, последующей за этим стадией послойной сорбции поли электролита на такой кор. Окончательной стадией капсулирования белка является удаление CaCO3 из капсулы добавлением ЭДТА или другого хелатного агента. Этим методом может включаться более 60% от добавленного в раствор белка. Подробно метод изложен в работе A.Petrov, D.Volodkin, G.Sukhorukov. Protein-Calcium Carbonate Coprecipitation: A tool for protein encapsulation. // Biotechnol. Progr., 2005, v.27, p.918-925.
В этой работе предполагается, что полиэлектролитные оболочки, полученные описанным выше способом, инертны по отношению к заключенным в них белкам, в том числе ферментам.
Однако наши исследования показали, что многие полиэлектролиты вызывают инактивацию ферментов, которые по своей природе являются белком. Из полученных нами данных следует, что активность инкапсулированных белков в существенной степени определяется природой полиэлектролитов, составляющих оболочку, и может уменьшаться вплоть до полной инактивации.
Таким образом, метод принятый нами в качестве прототипа в том виде, как он представлен авторами, имеет серьезный недостаток, который состоит в том, что метод не предусматривает влияние полиэлектролитной оболочки на функции белка.
Задача, на решение которой направлено предлагаемое изобретение, состоит в обеспечении возможности сохранения активности белка, в частном случае фермента, при его инкапсулировании в полиэлектролитную оболочку.
Поставленная задача решена тем, что предложен способ получения загруженных белком полиэлектролитных нано- и микрокапсул, включающий получение составных микросферолитов карбонатов щелочноземельных металлов и инкапсулируемых белков (ферментов), формирование капсул путем поочередной адсорбции на указанные составные микросферолиты противоположно заряженных полиэлектролитов и удаление указанных карбонатов щелочноземельных металлов из указанных капсул, в котором согласно изобретению предварительно проводят подбор по меньшей мере первой пары полиэлектролитов, поочередно исследуя влияние каждого полиэлектролита в растворе на активность инкапсулируемого белка.
При этом в качестве предпочтительных полиэлектролитов для формирования капсулы для определенного, заранее заданного белка отбирают полиэлектролиты, не влияющие в концентрации, оптимальной для формирования указанной капсулы, на активность этого белка либо имеющие эффективность ингибирования по меньшей мере одной функции белка до желаемого предела.
В частном случае осуществления способа тестирование полиэлектролита осуществляют при смешивании раствора белка с раствором полиэлектролита.
В частном случае осуществления способа в качестве белка берут фермент.
Влияние полиэлектролита на ингибирование фермента определяют при концентрации этого полиэлектролита, оптимальной для формирования указанной капсулы, обычно 1,5-3 мг/мл.
Для формирования капсулы берут полиэлектролиты как биодеградабельные, так и не способные к биодеградации поликатионы и полианионы, преимущественно линейной структуры.
Для формирования микросферолита (кора) преимущественно берут CaCO3.
Карбонаты щелочных металлов из указанных капсул удаляют с помощью ЭДТА или другого хелатного агента или подкислением среды.
Сущность изобретения заключается в том, что предлагается формировать оболочку капсулы лишь из селективно подобранных полиэлектролитов. Такой подбор особенно важен для формирования первого слоя оболочки, поскольку он непосредственно контактирует с инкапсулированнным белком. Это обусловлено тем, что, как было нами экспериментально установлено, многие полиэлектролиты при взаимодействии с ферментом способны его инактивировать. Поэтому технология получения ПНМК, содержащих белки и в частном случае ферменты, должна включать в себя контроль за ингибиторным действием полиэлектролитов, используемых для конструирования оболочки капсулы.
Неочевидность предложенного изобретения состоит в том, что прежде чем осуществлять сложную процедуру формирования капсулы, в результате которой можно получить капсулу с неактивным белком, нами предложено предварительно проверять влияние каждого в отдельности полиэлектролита на функциональную активность инкапсулируемого белка.
Сущность изобретения подтверждена тем, что был исследован большой набор полиэлектролитов как биодеградабильных, так и небиодеградабильных в отличие от прототипа, в котором были получены капсулы, составленные лишь из небиодеградабильной пары - полиаллиламина (ПАА) и полистиролсульфоната (ПСС), а точнее капсулы с оболочкой состава (ПАА/ПСС)5.
Нами была изучена способность к инактивации белков для 8 различных полиэлектролитов, 4 биодеградабильных и 4 небиодеградабильных. Такие исследования по инактивации проводились преимущественно на двух ферментах: уреаза и лактатдегидрогеназа (ЛДГ). Были получены зависимости активности этих ферментов от концентрации полиэлектролитов.
Анализ этих зависимостей привел к выводу, что наиболее простым критерием выбора полиэлектролитов для инкапсулирования является величина активности фермента при добавлении полиэлектролита в среду с концентрацией 1,5-3,0 мг/мл, Потеря активности фермента при этом не должна превышать 50% от исходного значения.
Для лучшего понимания изобретения ниже приведены примеры конкретного осуществления предлагаемого способа со ссылками на прилагаемые чертежи, где
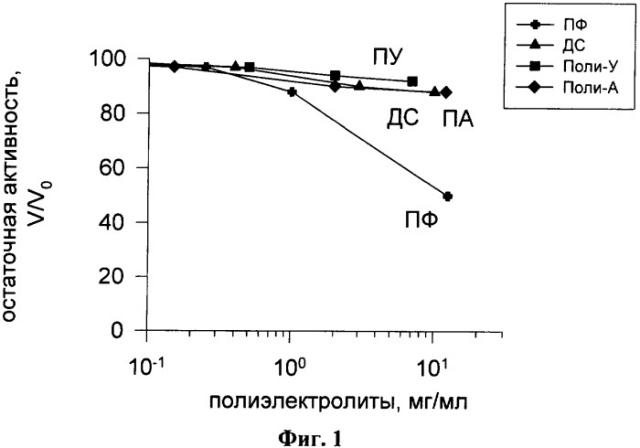
На фиг.1 показана зависимость активности лактатдегидрогеназы (ЛДГ) от концентрации биодеградабельных полиэлектролитов: декстрансульфат (ДС), полифосфат (ПФ), полиуридилат (ПУ) и полиаденилат (ПА). Реакционная смесь для определения активности ЛДГ: пируват 1 мМ; NADH 0,2 мМ; ЛДГ 0,5 мкг/мл; 0,05 М трис-HCl буфер pH 6,2.
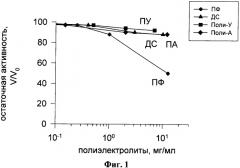
На фиг.2 показана зависимость активности ЛДГ от концентрации небиодеградабельных полиэлектролитов: зависимость активности ЛДГ от концентрации полиэлектролитов - полистиролсульфонат (ПСС), полиаллиламин (ПАА), полидиаллилдиметиламмоний (ПДАДМА), полиметакрилат (ПМ). Реакционная смесь для определения активности ЛДГ: пируват 1 мМ; NADH 0,2 мМ; ЛДГ 0,5 мкг/мл; 0,05 М трис-HCl буфер pH 6,2.
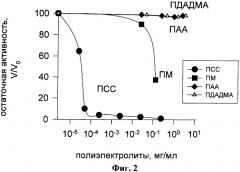
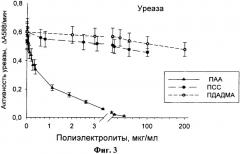
На фиг.3 показана зависимость активности уреазы от концентрации небиодеградабельных полиэлектролитов: полистиролсульфонат (ПСС), полиаллиламин (ПАА) и полидиаллилдиметиламмоний (ПДАДМА). Условия определения активности уреазы: уреаза 0,5 мкг/мл, мочевина 125 мМ, бромкрезол фиолетовый 0,015 мМ, pH 6,2.
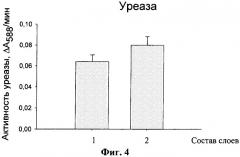
На фиг.4 приведена диаграмма, иллюстрирующая активность уреазы, заключенной в микрокапсулы, образованные из разных небиодеградабельных полиэлектролитов. Состав капсул: ПСС(ПСС/ПАА)3 - 1, ПСС(ПСС/ПДАДМА)3 - 2.
На фиг.5 приведена диаграмма, иллюстрирующая активность лактатдегидрогеназы (ЛДГ), заключенной в микрокапсулы, образованные из разных биодеградабельных и небиодеградабельных полиэлектролитов. Состав капсул: (ПАА/ПСС)3 - 1; (ПДАДМА/ПСС)3 - 2; (ПАА/ДС)(ПАА/ПСС)2 - 3; (ПАА/ДС)2(ПАА/ПСС) - 4, (ПАА/ДС)3 - 5.
Примеры осуществления изобретения
Для подтверждения возможности осуществления предлагаемого изобретения использовали следующие реактивы:
- лактатдегидрогеназу (Е.С.1.1.1.27) (ЛДГ) из скелетных мышц свиньи (изоформа M4) выделяли согласно методу, используемому в работе (Сабурова Е.А., Хечинашвили Н.Н. и Елфимова Л.И. Полиол-белковые взаимодействия. Микрокалориметрические исследования денатурации лактатдегидрогеназы. Молек. биол. 1996, т.30. С.1219-1228);
- уреазу (Е.С.3.5.1.5, jack bean) использовали фирмы Fluka, №94285 с активностью 97,0 U/mg;
- полистиролсульфонат натрия (ПСС, 70 кДа), полидиаллилдиметиламмоний хлорид (ПДАДМА, 100-200 кДа) и полиаллиламин гидрохлорид (ПАА, 70 кДа) фирмы Aldrich (Germany);
- полиметакрилат натрия, полифосфат натрия декстрансульфат (ДС, 10 кДа) и этилендиаминтетрауксусную кислоту (EDTA) фирмы Sigma (Germany);
- хлорид кальция (CaCl2·2H2O), карбонат и хлорид натрия фирмы Реахим (Россия).
Пример 1. Подбор полиэлектролитов для получения микродиагностикума, содержащего фермент
Под микродиагностикумом здесь и далее понимается инкапсулированный в полиэлектролитную нано- или микроразмера капсулу фермент, пригодный для анализа в многокомпонентной биологически активной среде, какой является, например, кровь, моча, спинномозговая жидкость и т.д., низкомолекулярного вещества - субстрата, ингибитора или активатора инкапсулированного фермента.
1.1. Подбор полиэлектролитов для микродиагностикума, содержащего в качестве фермента лактатдегидрогеназу (ЛДГ)
Подбор полиэлектролитов для получения микродиагностикума осуществляли исходя из их инактивирующего действия на фермент.
Для этого определяли активность свободной лактатдегидрогеназы в присутствии полиэлектролита по реакции восстановления пирувата в присутствии NADH по изменению оптической плотности в полосе поглощения NADH при 340 нм как описано в справочной литературе (Passonneau J.V., Lowry O.H. In: Methods of Enzymatic Analysis (Edited by Bergmeyer H.U.), V.3, N.Y., Acad. Press, 1974. P.1452).
Для определения активности ЛДГ концентрацию ЛДГ в свободном (растворенном) состоянии измеряли спектрофотометрически, используя известные для ЛДГ молярные коэффициенты экстинкции: ε280 HM 1мг/мл=1,29 согласно расчетам, используя программу (http://cn.expasy.org/sprot/).
При изучении степени инактивации ЛДГ полиэлектролитом в реакционную смесь добавляли необходимое количество полиэлектролита, предварительно растворенного в воде и дотитрованного до pH 6.2.
На фиг.1 показана зависимость активности ЛДГ от концентрации биодеградабельных полиэлектролитов: декстрансульфат (ДС), полифосфат (ПФ), полиуридинилат (ПУ) и полиаденилат (ПА). Реакционная смесь для определения активности ЛДГ: пируват 1 мМ; NADH 0,2 мМ; ЛДГ 0,5 мкг/мл; 0,05 М трис-HCl буфер pH 6,2.
Из приведенных на фиг.1 данных видно, что среди исследованных нами биодеградабельных полиэлектролитов для ЛДГ наиболее сильным ингибитором является полианион полифосфат, хотя концентрация его при 50%-тном ингибировании ЛДГ (12,5 мг/мл) превышает концентрацию полиэлектролита, используемую в процессе приготовления капсул (2,5 мг/мл). Таким образом, все эти биодеградабельные полиэлектролиты являются претендентами для формирования оболочки капсулы, содержащей ЛДГ.
На фиг.2 показана зависимость активности ЛДГ от концентрации небиодеградабельных полиэлектролитов: полистиролсульфонат (ПСС), полиаллиламин (ПАА), полидиаллилдиметиламмоний (ПДАДМА), полиметакрилат (ПМ). Реакционная смесь для определения активности ЛДГ: пируват 1 мМ; NADH 0,2 мМ; ЛДГ 0,5 мкг/мл; 0,05 М трис-HCl буфер pH 6,2.
Как видно из фиг.2, среди исследованных нами небиодеградабельных полиэлектролитов для ЛДГ наиболее сильным ингибитором является полианион полистиролсульфонат, концентрация его при 50%-тном ингибировании ЛДГ составляет 5 мкг/мл. Остальные исследованные полиэлектролиты являются допустимыми для приготовления оболочки в указанных пределах их концентраций. Таким образом, все эти небиодеградабельные полиэлектролиты являются претендентами для формирования оболочки капсулы, содержащей ЛДГ, а полистиролсульфонат требует изоляции от прямого контакта с ЛДГ и, следовательно, допустим для использования только во внешних слоях оболочки капсулы.
На фиг.3 показана зависимость активности уреазы от концентрации небиодеградабельных полиэлектролитов: полистиролсульфонат (ПСС), полиаллиламин (ПАА) и полидиаллилдиметиламмоний (ПДАДМА). Условия определения активности уреазы: уреаза 0,5 мкг/мл, мочевина 125 мМ, бромкрезол фиолетовый 0,015 мМ, pH 6,2.
Из фиг.3 видно, что для уреазы, в отличие от ЛДГ, поликатион - полиаллиламин, является наиболее сильным ингибитором: 50%-тное ингибирование уреазы происходит при малых концентрациях этого полиэлектролита (доли мкг/мл).
Таким образом, проведенные эксперименты показывают, что при построении полиэлектролитной оболочки белковой ПНМК наилучшими полиэлектролитными парами являются для ЛДГ ПАА/ДС и ПАА/ПСС, для уреазы ПСС/ПАА и ПСС/ПДАДМА в указанной последовательности наслоения. На основе этого нами были сконструированы лактатдегидрогеназные и уреазные микрокапсулы с разным полиэлектролитным составом и числом слоев.
Пример 2. Получение микродиагностикума с использованием биодеградабельных и небиодеградабельных полиэлектролитов с учетом их инактивирующего действия
А) Получение микродиагностикума, содержащего уреазу
К 0,33 М раствору CaCl2, содержащему 2,0 мг/мл уреазы и интенсивно перемешиваемому на магнитной мешалке, быстро добавляли равный объем 0,33 М раствора Na2CO3. Смесь перемешивали в течение 30 с, после чего перемешивание прекращали, а образовавшуюся суспензию выдерживали 15 мин до полного просветления надосадочной жидкости. В результате этой процедуры получали составной микросферолит CaCO3-уреаза. Этот процесс «созревания» микросферолитов контролировали с помощью светового микроскопа.
Затем надосадочную жидкость декантировали, осадок промывали водой. Количество включенного в сферолит белка - фермента, определяли спектрофотометрически при сравнении абсорбции (λ=280 нм) исходных растворов белка и супернатанта, отобранного при осаждении указанных микросферолитов CaCO3-уреаза. Содержание белка определяли также по методу Бредфорда (Anal. Bioch. 1976. V.72. P.248-254) с использованием красителя Coomassie Brilliant Blue G-250 (λ=595 нм).
Далее на составных микросферолитах CaCO3-уреаза, используя их как коровые частицы, формировали мультислойные полиэлектролитные микрокапсулы путем поочередной адсорбции противоположно заряженных полиэлектролитов на коровые частицы.
В качестве полиэлектролитов использовали в качестве полианиона полистиролсульфонат (ПСС) и в качестве поликатиона полиаллиламин (ПАА) или полидиаллилдиметиламмоний (ПДАДМА), которые готовили с концентрацией 2 мг/мл в 0,5 М растворе NaCl. Исходя из полученных нами данных по инактивирующему действию полиэлектролитов на ферменты (Пример 1) адсорбцию первого слоя производили, используя неинактивирующий полиэлектролит для уреазы полистиролсульфонат (ПСС) и далее соответственно противоположную ему пару - полиаллиламин (ПАА) или полидиаллилдиметиламмоний (ПДАДМА). Число слоев с неинактивирующими полиэлектролитами задавали в каждом случае индивидуально исходя из дополнительных задач.
Затем на завершающей стадии неорганический компонент составного микросферолита CaCO3 растворяли в ЭДТА.
Формирование микрокапсул проводили с использованием охлажденных (5-10°С) растворов в условиях поддержания нейтральной pH. Для предотвращения агрегации частиц в процессе адсорбции полиэлектролитов суспензию микрочастиц периодически через каждые 5 мин обрабатывали ультразвуком в течение 1-3 с. При этом за агрегацией частиц следили с помощью светового микроскопа. После адсорбции на коровую частицу каждого полиэлектролитного слоя суспензию центрифугировали при 1 тыс. об/мин и осадок тщательно промывали от несвязавшегося полиэлектролита. Процедуру промывки повторяли трижды. Затем после заданного числа послойной адсорбции полиэлектролитов коровую частицу растворяли в 0,2 М растворе ЭДТА при pH 7,5 в течение 12 ч.
На фиг.4 приведена диаграмма, иллюстрирующая активность Vmax инкапсулированной уреазы. Состав капсул с уреазой: ПСС (ПСС/ПАА)3 - 1, ПСС(ПСС/ПДАДМА)3 - 2. Условия реакции для определения активности уреазы такие же, как в описании к фиг.3.
Титр капсул, содержащих уреазу, составлял 1,2*106 капсул/мл.
Б) Получение микродиагностикума, содержащего лактатдегидрогеназу
Получение микрокапсул, загруженных ЛДГ, осуществляли так же, как описано в части А этого примера для уреазы, за исключением выбора противоположно заряженных полиэлектролитных пар. Принципиальным различием было включение в некоторые слои оболочки капсулы в качестве полианиона неинактивирующего полиэлектролита - декстрансульфата. Были изучены микродиагностикумы с включенным ЛДГ, содержащие оболочки, в состав которых входили как биодеградабельные, так и небиодеградабельные полиэлектролиты, имеющие следующий состав: (ПАА/ПСС)3, (ПАА/ДС)(ПАА/ПСС)2, (ПАА/ДС)2(ПАА/ПСС), (ПАА/ДС)3, а также содержащие поликатион ПДАДМА вместо ПАА: (ПДАДМА/ПСС)3.
На фиг.5 представлена диаграмма, иллюстрирующая активность Vmax инкапсулированной лактатдегидрогеназы (ЛДГ), заключенной в микрокапсулы, полученные, как описано соответственно в части Б примера 2, из разных поликатионов и разных полианионов.
Состав капсул с ЛДГ: (ПАА/ПСС)3 - 1; (ПДАДМА/ПСС)3 - 2; (ПАА/ДС)(ПАА/ПСС)2 - 3; (ПАА/ДС)2(ПАА/ПСС) - 4, (ПАА/ДС)3 - 5.
Условия определения активности ЛДГ: пируват 1 мМ, NADH 0,2 мМ, 0,05 М фосфатный буфер pH 6,2. Титр капсул, содержащих ЛДГ, составлял 1,2*106 капсул/мл.
Среди разных полиэлектролитных оболочек наиболее оптимальной для функционирования микродиагностикума с ЛДГ оказалась оболочка (ПАА/ДС)2ПАА/ПСС.
Такой цикл аналитических исследований можно выполнить и на других микрокапсулах с любой активностью инкапсулированного фермента, которую чувствуют существующие в настоящее время методы.
1. Способ получения загруженных белком полиэлектролитных нано- и микрокапсул, включающий получение составных микросферолитов карбонатов щелочноземельных металлов и инкапсулируемого белка, формирование капсул путем поочередной адсорбции на указанные составные микросферолиты противоположно заряженных полиэлектролитов, и удаление указанных карбонатов щелочноземельных металлов из указанных капсул, отличающийся тем, что предварительно проводят подбор, по меньшей мере, первой пары непосредственно контактирующих с инкапсулируемым белком полиэлектролитов, поочередно исследуя влияние каждого полиэлектролита в растворе на активность инкапсулируемого белка, и отбирают полиэлектролиты, не влияющие в концентрации оптимальной для формирования указанной капсулы на активность этого белка, либо имеющие эффективность ингибирования, по меньшей мере, одной функции белка до желаемого предела.
2. Способ по п.1, отличающийся тем, что в частном случае в качестве белка берут фермент, при этом потеря активности фермента не должна превышать 50% от исходного значения.
3. Способ по п.1, отличающийся тем, что составные микросферолиты карбонатов щелочноземельных металлов и инкапсулируемых белков получают преимущественно путем копреципитации.
4. Способ по п.1, отличающийся тем, что карбонаты щелочных металлов из указанных капсул удаляют с помощью ЭДТА или другого хелатного агента или подкислением среды.
5. Способ по п.1, отличающийся тем, что для формирования капсулы берут в качестве полиэлектролитов как биодеградабельные, так и неспособные к биодеградации поликатионы и полианионы, преимущественно линейной структуры.
6. Способ по п.1, отличающийся тем, что дополнительно осуществляют контроль активности белка после адсорбции желаемого количества слоев полиэлектролитов.