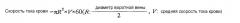Средство для профилактики и лечения заболеваний печени, содержащее производное пиразолопиримидинона
Иллюстрации
Показать всеНастоящее изобретение относится к ингибитору фиброза печени, содержащему в качестве активного ингредиента производное пиразолопиримидинона формулы (1), фармацевтической композиции для профилактики и лечения цирроза печени, ингибитору портальной гипертензии, содержащему производное пиразолопиримидинона формулы (1), фармацевтической композиции для профилактики и лечения осложнений, вызываемых портальной гипертензией, содержащей в качестве активного ингредиента производное пиразолопиримидинона формулы (1). Изобретение улучшает лекарственную комплаентность пациентов, страдающих от хронических заболеваний печени. 4 н. и 1 з.п. ф-лы, 3 табл., 4 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к фармацевтической композиции для профилактики и лечения заболевания печени, содержащей производное пиразолопиримидинона в качестве активного ингредиента, более точно к фармацевтической композиции для профилактики и лечения фиброза печени, цирроза печени, вызываемого фиброзом печени, портальной гипертензии и различных осложнений, к которым приводит портальная гипертензия, содержащей производное пиразолопиримидинона в качестве активного ингредиента.
УРОВЕНЬ ТЕХНИКИ
Печень осуществляет больше биохимических функций, чем любой другой орган. Это жизненно важный орган, через который проходят всосавшаяся пища, лекарственные средства и другие чужеродные вещества, и печень осуществляет функцию элиминации приобретенных или внутренних токсических веществ после преобразования этих токсических веществ в водорастворимую форму. И она в основном принимает участие в метаболических функциях различных органов. Ткани печени синтезируют и снабжают организм человека жизненно важными белками, такими как альбумин, и в то же самое время вырабатывают и выводят активные вещества in vivo. Как объяснено выше, печень является ключевым органом, контролирующим метаболические функции у человека, в котором протекают многочисленные химические процессы. К настоящему времени подтверждено, что в печени протекают приблизительно 500 химических процессов за короткий период времени. Гепатоциты представляют собой главные функциональные клетки печени, и каждый отдельный гепатоцит составляет 15-30 микрон в диаметре. Печень человека содержит приблизительно 250 миллиардов гепатоцитов.
Повреждение гепатоцитов приводит к некрозу клеток. После некроза, однако, гепатоциты регенерируют благодаря своей исключительной внутренне присущей способности к регенерации. Тем не менее, повторение некроза и регенерации запускает фиброз печени, и в результате, таким образом, возникают цирроз печени, портальная гипертензия и осложнения.
Серии связанных заболеваний все развиваются после фиброза печени. Фиброз печени вызывается накоплением в печени коллагена, фиброгенного вещества. Клетки печени состоят из гепатоцитов, синусоидальных эндотелиальных клеток (SEC), клеток Купфера и звездчатых клеток печени (HSC), и среди них 4 типа клеток; звездчатые клетки печени играют наиболее важную роль в фиброзе печени (American Journal of Physiology, Gastrointestinal & Liver Physiology, 279(1), G7, 2000). Звездчатые клетки печени составляют 15% всех клеток печени и в норме осуществляют функцию запасания ретиноида, который является предшественником витамина A. Однако после повреждения гепатоцитов клетки Купфера начинают поглощать поврежденные гепатоциты и секретировать цитокины (TGF-бета, PDGF, FGF, HGF, PAF и ET-I) для пролиферации звездчатых клеток печени. Звездчатые клетки печени дифференцируются в миофибробласты. Миофибробласты синтезируют коллаген, который накапливается во внеклеточном матриксе и приводит к фиброзу печени. Это означает, что активация звездчатых клеток печени играет существенную роль в развитии фиброза печени.
Более точно активация звездчатых клеток печени осуществляется в три следующие стадии: предвоспалительная стадия, воспалительная стадия и поствоспалительная стадия.
В предвоспалительной стадии повреждение гепатоцитов вызывает секрецию раневого гормона, стимулятора пролиферации звездчатых клеток печени, или пролиферацию звездчатых клеток печени посредством уменьшения аргиназы, ингибитора клеточной пролиферации. В большинстве случаев спирт вызывает образование ацетальдегида или пероксида липидов, приводя к стимуляции экспрессии генов матрикса.
На воспалительной стадии звездчатые клетки печени пролиферируют под воздействием цитокинов (TGF-бета, PDGF, FGF, HGF, PAF и ET-1), секретируемых активированными клетками Купфера и тромбоцитами, которые затем дифференцируются в миофибробласты, способные формироваться в фиброциты (Seminars in Liver Disease, 16(4), 357, 1996; Journal of Hepatology, 26(6), 1220, 1997).
На поствоспалительной стадии цитокины и факторы роста секретируются полностью дифференцированными миофибробластами для активации недифференцированных звездчатых клеток печени и для секреции внеклеточных матриксов. Миофибробласты, активированные и дифференцированные под воздействием звездчатых клеток печени, синтезируют коллаген, который затем накапливается во внеклеточном матриксе. Мономер коллагена очень нестабилен и легко распадается при температуре тела, и распавшиеся мономеры полимеризуются, вызывая фиброз печени (American Journal of Physiology, 264(4 Pt 1), G589, 1993).
Цирроз печени объясняют фиброзом печени, который развивается вследствие полимеризации непрерывно накапливающегося коллагена, превращающей накопленный коллаген в нерастворимые волокна. Цирроз печени может также вызываться продолжающимся воспалением в печени, сопровождающимся деструкцией гепатоцитов, регенерацией и рубцеванием, вызываемым продолжительным потреблением алкоголя, гепатитом, воздействием токсических веществ и т.д. В результате размер печени уменьшается, и поверхность печени становится бугристой. Тяжелый цирроз печени является серьезным заболеванием, вызывающим летальные осложнения, такие как портальная гипертензия, кровотечение (особенно пищеводное и желудочное), гепатома, интоксикация из-за накопления продуктов обмена, кома и т.д. (N. Engl. J. Med. 350:1646-1654).
Портальная гипертензия тесно связана с активацией звездчатых клеток печени, фиброзом печени и циррозом печени. Миофибробласты, дифференцированные вследствие активации звездчатых клеток печени, уменьшают эластичность гепатоцитов, и, таким образом, нарастает внутрипеченочное сопротивление, и развивается портальная гипертензия (Semin Liver Dis 2001; 21:337-349).
В отличие от других органов для ткани печени характерно обладание двойным путем тока крови, которая представляет собой артериальную кровь, богатую кислородом, текущую в ткань печени через печеночную артерию, и венозную кровь, содержащую питательные вещества, всосавшиеся из желудка или кишечника, текущую через воротную вену печени. Количество крови, протекающей через печеночную артерию, составляет приблизительно 400 мл в минуту, и количество крови, протекающей через воротную вену печени, составляет приблизительно 1200 мл в минуту, означая, что 1/4 всей крови, притекающей к печени, доставляется печеночной артерией, в то время как оставшиеся 3/4 доставляются воротной веной печени.
Давление в воротной вене, подобно другому венозному давлению, составляет только приблизительно 1/10 артериального давления, и оно может легко приводить к расстройствам кровообращения. Повторение повреждения и регенерации гепатоцитов продолжающимся воспалением приводит к накоплению волокнистых веществ и развитию узлов регенерации. Узлы регенерации оказывают давление на путь крови в ткани печени или сдавливают сам кровеносный сосуд, вызывая нарушение кровотока. В то время как ток крови через воротную вену не изменен, ток крови через ткань печени уменьшен вследствие расстройства кровообращения. В результате давление в воротной вене повышается, вызывая портальную гипертензию. Воротная вена представляет собой тип вены без клапана, препятствующего обратному току крови, так что обратный ток крови может возникать в любое время, когда давление в воротной вене повышается из-за расстройства циркуляции, и затем кровь ищет обходной путь в циркуляции. В результате развиваются коллатеральные сосуды в пищеварительном тракте (в частности, пищеводе и желудке), таким образом, вызывая гиперспленизм. Коллатеральные сосуды, как правило, развиваются в областях низкого давления, таких как подслизистая оболочка пищевода, переднебоковая брюшная стенка, прямая кишка и т.д., с последующими симптомами варикозного расширения вен пищевода, асцитической жидкости, геморроидальных узлов и увеличения селезенки.
Наиболее обычным осложнением портальной гипертензии являются варикозные расширения вен пищевода, для образования которых необходимо, по меньшей мере, 12 мм рт. ст. давления. Приблизительно одна треть пациентов с циррозом печени обладает варикозными расширениями вен пищевода и желудка, которые ответственны за приблизительно 30% случаев смертей (American Family Physician, 55(5), 1851, 1997). До настоящего времени факторы, принимающие участие в кровотечении из-за варикозных расширений вен пищевода и варикозных расширений вен желудка, полностью не изучены, но, как предполагают, размер варикозных расширений вен связан с тяжестью портальной гипертензии (Pharmacotherapy: a phathophysiologic approach, 1996).
Для лечения портальной гипертензии выполняли хирургические операции, такие как спленэктомия или портокавальный анастомоз, для уменьшения тока в воротном русле. Примерами лекарственных средств при портальной гипертензии служат вазопрессин, как правило, используемый при остром варикозном кровотечении, соматостатин, неспецифический бета-адренергический блокатор, альфа-адренергический блокатор и препараты нитратов. Эти лекарственные средства уменьшают давление в воротной вене за счет снижения артериального тока к печени. В результате суммарный портальный кровоток в печень, который уже сильно нарушен, нарушается еще сильнее. Таким образом, в течение многих лет существует потребность в разработке веществ, которые избирательно снижают давление в воротной вене.
Доказано, что ингибитор фосфодиэстеразы 5 типа (в дальнейшем обозначаемой как «PDE 5»), уже известный как активный ингредиент в лечении эректильной дисфункции, также эффективен в лечении портальной гипертензии и связанных с ней заболеваний.
Например, применение ингибиторов PDE 5 для профилактики и лечения портальной гипертензии описано в PCT/EP2004/006014. А именно ингибиторы PDE 5, силденафил и варденафил, обладают профилактическими и терапевтическими эффектами на портальную гипертензию и ее осложнения вследствие снижения давления в воротной вене через увеличение диаметра воротного кровеносного сосуда и воротного тока крови.
Однако релаксация воротной вены не означает автоматически усиления тока крови через печень и снижения давления в воротной вене, и фактически эффект конкретного ингибитора PDE 5 на ток крови через печень и давление в воротной вене непредсказуем.
Согласно более раннему сообщению, в котором исследовали эффект силденафила на системную и висцеральную гемодинамику в экспериментальных моделях цирроза, силденафил снижает среднее артериальное давление, вызывая системную гипотензию, и усиливает ток крови через брыжейки и давление в воротной вене в зависимости от дозы (Liver International, 24(1), 63, 2004; Digestive Disease Week, Abs Sl 553, 2003). Таким образом, исследователи, которые осуществили вышеописанные эксперименты сделали вывод, что необходимы дополнительные исследования для назначения силденафила пациенту с циррозом, так как увеличение давления в воротной вене из-за силденафила может вызывать осложнения в виде кровотечения.
В случае цирроза печени наблюдали релаксацию сосудов внутренностей вследствие местной сверхпродукции NO. Согласно сообщению силденафил усиливает эффект NO, вызывая снижение тонуса сосудов брыжейки и повышение воротного тока крови (Liver International, 24(1):63, 2004; Digestive Disease Week, Abs Sl 553, 2003).
Более или менее, метаболическая функция печени снижена у пациентов с заболеванием печени, таким как цирроз печени, портальная гипертензия и т.д., так что область под кривой концентрация-время (AUC) и время полужизни лекарственного средства возрастают (Alimentary Pharmacology Therapeutics, 20(1), 29, 2004; Methods and Findings in Experimental and Clinical Pharmacology, 25(8), 625, 2003).
Тем не менее, пациент с хроническим заболеванием печени нуждается в долговременном введении и множественных назначениях. Если пациенту назначено лекарственное средство, обладающее коротким временем полужизни, оно снижает степень комплаентности пациента и препятствует эффективному лечению.
Таким образом, предприняты исследования для получения лекарственного средства для лечения хронического заболевания печени, которое непрерывно сохраняет свой фармацевтический эффект и повышает степень комплаентности пациента. И сообщено, что при введении синтетического соматостатин-подобного октреотида один раз в сутки в виде препарата с замедленным высвобождением, эффект снижения давления в воротной вене оказался продолжительным (Hepatology Research, 19(2), 108, 2001). Более того, при введении замедленно высвобождающегося ланреотида один раз в сутки внутримышечной инъекцией мыши с портальной гипертензией, вызванной гепатопортальным склерозом, задерживались периферическая вазодилятация и избыточное кровообращение и предотвращались портальная гипертензия и застой крови во внутренних органах, в дополнение к портально-системному шунту (Journal of Hepatology, 31(3), 482, 1999).
Учитывая вышеописанные проблемы, существует потребность в разработке нового лекарственного средства, которое может повышать ток крови в печени без побочных эффектов, уменьшать давление в воротной вене и повышать комплаентность вследствие длительного времени полужизни.
Авторы настоящего изобретения синтезировали новое соединение, производное пиразолопиримидинона 5-[2-пропилокси-5-(1-метил-2-пироллидинилэтиламидосульфонил)фенил]-1-метил-пропил-1,6-дигидро-7H-пиразоло(4,3-d)пиримидин-7-он, и сообщили о его ингибиторном эффекте на PDE 5 в предыдущем исследовании (патент Кореи № 377782). Затем авторы настоящего изобретения продолжили исследование производного пиразолопиримидинона в качестве ингибитора PDE 5 и дополнили это изобретение подтверждением того, что производное пиразолопиримидинона обладает исключительным ингибиторным эффектом на синтез коллагена и может повышать лекарственную комплаентность пациентов с хроническим заболеванием печени, так как производное пиразолопиримидинона обладает большим временем полужизни и снижает давление в воротной вене.
ОПИСАНИЕ
Техническая проблема
Задачей настоящего изобретения является предоставление фармацевтической композиции для профилактики и лечения заболевания печени, содержащей производное пиразолопиримидинона в качестве активного ингредиента.
Другой задачей настоящего изобретения является предоставление ингибитора фиброза печени.
Следующей задачей настоящего изобретения является предоставление фармацевтической композиции для профилактики и лечения цирроза печени с помощью ингибирования фиброза печени.
Также задачей настоящего изобретения является предоставление ингибитора портальной гипертензии.
Другой задачей настоящего изобретения является предоставление фармацевтической композиции для профилактики и лечения осложнений, вызываемых развитием портальной гипертензии.
Техническое решение
Для решения вышеперечисленных задач настоящее изобретение предоставляет фармацевтическую композицию для профилактики и лечения фиброза печени, цирроза печени, портальной гипертензии и вызываемых ею осложнений, содержащую производное пиразолопиримидинона в качестве активного ингредиента.
Далее следует подробное описание настоящего изобретения.
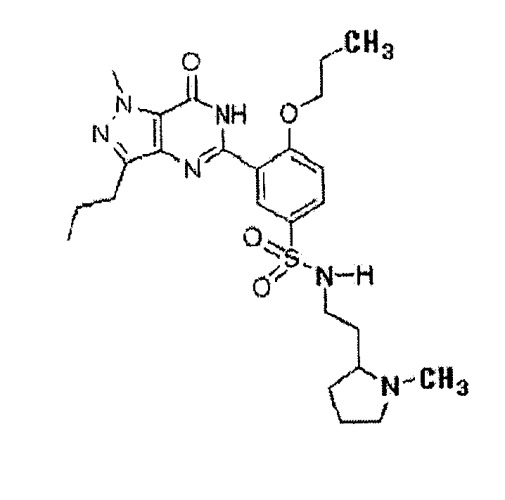
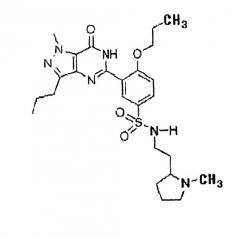
Настоящее изобретение относится к фармацевтической композиции для профилактики и лечения фиброза печени, цирроза печени, портальной гипертензии и вызываемых ею осложнений, содержащей производное пиразолопиримидинона (5-[2-пропилокси-5-(1-метил-2-пироллидинилэтиламидосульфонил)фенил]-1-метил-пропил-l,6-дигидро-7H-пиразоло(4,3-d)пиримидин-7-он), представленное следующей химической формулой 1, в виде активного ингредиента.
Производное пиразолопиримидинона является разновидностью ингибитора PDE 5. Оно обладает исключительной ингибиторной активностью в отношении PDE 5 и селективностью. Производное пиразолопиримидинона быстро всасывается благодаря повышенной растворимости и обладает высокой биодоступностью и очень большим биораспределением. Более того, оно характеризуется временем полужизни, превышающим время полужизни силденафила и варденафила, по меньшей мере, в три раза.
Физико-химические свойства производного пиразолопиримидинона являются следующими: оно нерастворимо в воде, но растворимо в уксусной кислоте, метаноле и хлороформе. Его температура плавления составляет приблизительно 158-161°C, и оно обладает значениями pKa1 и pKa2 6,5 и 12,5 соответственно. Оно представляет собой белый или бледно-желтый порошок, который не является или гидратом, или сольватом.
Производное пиразолопиримидинона можно синтезировать в следующие три стадии, как подробно описано ниже.
На стадии 1 получают 4-[2-пропилокси-5-(хлорсульфонил)бензамидо]-1-метил-3-пропил-5-карбамоилпиразол. А именно соответствующее количество 4-[2-пропилоксибензамидо]-1-метил-3-пропил-5-карбамоилпиразола добавляют к раствору соответствующего количества хлорсульфоновой кислоты, охлажденному при 0°C. Смесь перемешивают, фильтруют, промывают и высушивают, получая 4-[2-пропилокси-5-(хлорсульфонил)бензамидо]-1-метил-3-пропил-5-карбамоилпиразол.
На стадии 2 получают 4-[2-пропилокси-5-(1-метил-2-пирролидинилэтиламидосульфонил)бензамидо]-1-метил-3-пропил-5-карбамоилпиразол из соединения пиразола, полученного на вышеописанной стадии 1. А именно соответствующее количество 2-(2-аминоэтил)-1-метилпирролидина добавляют при 0°C к раствору дихлорметана, содержащего соответствующее количество 4-[2-пропилокси-5-(хлорсульфонил)бензамидо]-1-метил-3-пропил-5-карбамоилпиразола со стадии 1 с последующим перемешиванием. После окончания реакции реакционный раствор разводят дихлорметаном. Органический слой промывают, высушивают, концентрируют и фильтруют, получая 4-[2-пропилокси-5-(1-метил-2-пирролидинилэтиламидосульфонил)бензамидо]-1-метил-3-пропил-5-карбамоилпиразол.
На стадии 3 5-[2-пропилокси-5-(1-метил-2-пирролидинилэтиламидосульфонил)фенил]-1-метил-3-пропил-1,6-дигидро-7H-пиразоло(4,3-d)пиримидин-7-он, который является производным пиразолопиримидинона по настоящему изобретению, получают из соединения, полученного на стадии 2. А именно соответствующее количество соединения пиразола, синтезированного на стадии 2, растворяют в трет-бутаноле, к которому добавляют соответствующее количество калия трет-бутоксида с последующим кипячением с обратным холодильником в течение необходимого времени. После окончания реакции реакционный раствор охлаждают, разводят, промывают и высушивают. Затем осуществляют перегонку при пониженном давлении, удаление растворителя и хроматографию на колонке с силикагелем, получая новое производное пиразолопиримидинона по изобретению.
Настоящее изобретение относится к фармацевтической композиции для профилактики и лечения заболевания печени, и оно описано, как следует далее.
1. Настоящее изобретение относится к ингибитору фиброза печени.
2. Настоящее изобретение также относится к фармацевтической композиции для профилактики и лечения цирроза печени, ингибирующей фиброз печени.
3. Настоящее изобретение далее относится к ингибитору портальной гипертензии.
4. Настоящее изобретение также относится к фармацевтической композиции для профилактики и лечения осложнений, вызываемых портальной гипертензией.
С возрастанием отложения коллагена в печеночных звездчатых клетках в печени развивается фиброз печени. Затем клетки печени, остающиеся между волокнами, начинают пролиферировать для поддержания функций печени, посредством чего формируются узлы регенерации. Центральная вена печеночной дольки сдавливается таким фиброзом и узлами регенерации, что приводит к препятствию для тока крови по воротной вене в печень, вызывая портальную гипертензию.
Таким образом, давление в воротной вене можно снизить ингибированием фиброза печени. Ток крови через печень можно усилить снижением давления в воротной вене и увеличением воротного тока крови, что приводит к защите печени.
Как упомянуто выше, контролирование фиброза печени и давления в воротной вене тесно связано с защитой печени. Композиция по настоящему изобретению, содержащая производное пиразолопиримидинона в виде активного ингредиента, может предотвращать развитие фиброза печени с помощью ингибирования синтеза коллагена в звездчатых клетках печени, обладает защитным действием на печень, может снижать давление в воротной вене, действуя непосредственно на воротную вену, и усиливает ток крови по воротной вене; все это позволяет предположить, что настоящее изобретение обладает исключительным терапевтическим эффектом на хроническое заболевание печени, связанное с фиброзом печени и портальной гипертензией.
Производное пиразолопиримидинона по настоящему изобретению обладает в 10-16 раз большим ингибиторным эффектом на синтез коллагена, чем другие общепринятые ингибиторы PDE 5. Таким исключительным эффектом подтверждено, что производное пиразолопиримидинона по изобретению может ингибировать фиброз печени, вызываемый отложением коллагена в печеночных звездчатых клетках в печени, и защищает печень (см. таблицу 1). Кроме того, производное пиразолопиримидинона по изобретению снижает давление в воротной вене в зависимости от дозы, но увеличивает диаметр воротной вены и воротный ток крови. В отличие от силденафила, который, как сообщалось, скорее увеличивает давление в воротной вене, производное пиразолопиримидинона по изобретению можно эффективно применять для лечения портальной гипертензии и вызываемых ею различных осложнений (см. таблицу 2).
Хроническое заболевание печени включает различные осложнения, вызываемые циррозом печени, возникающем в результате фиброза печени и портальной гипертензии (Rubin Farber Pathology, 1999). Примерами таких осложнений являются варикозные расширения вен пищевода (American Family Physician, 55(5), 1851, 1997), увеличение селезенки и гиперспленизм, асцит, гепаторенальный синдром (Gastroenterology Vol.120, No.3), спонтанный бактериальный перитонит (Curr Opinion In Gastroenterology 2004, 20:254-263), гепатопульмональный синдром (Dig Dis Sci 2003, 48:556-560), печеночная энцефалопатия (Neuroreport 2003, 14:2379-2382) и т.д. Такие осложнения подробно описаны далее.
Варикозные расширения вен пищевода означают образование аномальных вен в пищеводе или желудке. С ухудшением состояния это ухудшается, эти вены разрываются и кровоточат. Высокое кровяное давление в воротной вене вызывает нарушение тока крови, увеличение размера клеток селезенки, из-за чего развивается увеличение селезенки - другая причина внутреннего кровотечения. Асцит указывает на отек брюшной полости. Высокое давление в воротной вене повышает гидростатическое давление плазмы крови и лимфы, приводя к лимфостазу, вызывающему выделение жидкости в брюшную полость. Асцит оказывает давление на легкие, вызывая затрудненное дыхание, и долговременное давление на легкие даже вызывает летальный сепсис. Идиопатический (аутогенный) бактериальный перитонит, также вызываемый высоким кровяным давлением в воротной вене, часто наблюдают у пациентов с асцитом, в отличие от другого перитонита (вторичный перитонит), который обладает ожидаемой причиной, такой как внутреннее прободение кишки и желудка или травма. Гепаторенальный синдром указывает на тяжелое опущение почки из-за цирроза печени, вызываемого нарушением равновесия жидкости в организме. Гепатопульмональный синдром является заболеванием вследствие гипоксии, наблюдаемой у пациентов с хроническим заболеванием печени, хотя у этих пациентов отсутствует специфическое заболевание сердца или легких. Подобно циррозу печени печеночная энцефалопатия является другим тяжелым осложнением, которое развивается из нарушенной функции превращения аммиака, внутреннего токсического вещества, в мочевину по мере того, как функции печени снижаются, таким образом, поражая нервную систему и даже приводя к летальной коме. Как объяснено выше, происходит нарушение кровяного давления в воротных венах и затем обратного тока крови в воротных венах, так что ток крови находит обходной путь, минуя прохождение через печень. В результате образуются коллатеральные сосуды, в частности, в областях низкого давления пищеварительного тракта, таких как под слизистой оболочкой пищевода, на переднебоковых стенках брюшной полости и в прямой кишке, и т.д. Таким образом, производное пиразолопиримидинона по настоящему изобретению можно эффективно применять в виде фармацевтической композиции для профилактики и лечения вышеупомянутых осложнений посредством существенного ослабления повышенного давления в воротной вене.
Фармацевтическую композицию для профилактики и лечения заболевания печени, содержащую производное пиразолопиримидинона в виде активного ингредиента по настоящему изобретению, можно вводить перорально или парентерально и применять в общепринятых формах фармацевтического состава. По настоящему изобретению предпочтительным является пероральное введение. Фармацевтическую композицию по настоящему изобретению можно получать для перорального или парентерального введения посредством смешивания с обычно используемыми наполнителями, добавками, связующими веществами, увлажняющими веществами, дезинтегрирующими средствами, разбавителями, такими как поверхностно-активное вещество или эксципиенты.
Твердые составы для перорального введения представляют собой таблетки, пилюли, присыпки, гранулы и капсулы. Эти твердые составы получают смешиванием одного или нескольких подходящих эксципиентов, таких как крахмал, карбонат кальция, сахароза, лактоза, желатин и т.д. Кроме простых эксципиентов можно использовать лубриканты, например стеарат магния, тальк и т.д.
Жидкие составы для пероральных введений представляют собой суспензии, растворы, эмульсии и сиропы, и вышеупомянутые составы могут содержать различные эксципиенты, такие как увлажняющие вещества, подсластители, ароматизаторы и консерванты в дополнение к обычно используемым простым разбавителям, таким как вода и жидкий парафин. Составы для парентерального введения представляют собой стерильные водные растворы, водонерастворимые эксципиенты, суспензии, эмульсии и суппозитории. Водонерастворимые эксципиенты и суспензии могут содержать в дополнение к активному соединению или соединениям пропиленгликоль, полиэтиленгликоль, растительное масло, такое как оливковое масло, сложный эфир для инъекций, такой как этилолеат и т.д. Суппозитории могут содержать в дополнение к активному соединению или соединениям витепсол, макрогол, твин-61, масло какао, лауриновое масло, глицерожелатин и т.д.
Эффективную дозировку композиции, содержащей производное пиразолопиримидинона в виде активного ингредиента по настоящему изобретению, можно определять исходя из массы, возраста, пола, состояния здоровья, питания, частоты введения, способа введения, выделения и тяжести заболевания. Предпочтительная дозировка и частота введения для взрослого составляют 50-200 мг в сутки и от одного до трех или четырех раз в сутки.
Краткое описание чертежей
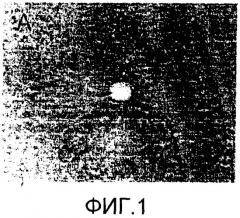
Фиг. 1-4 представляют собой набор микрофотографий, на которых представлены ингибиторные эффекты на синтез коллагена согласно примеру 2 изобретения, контроля дикого типа (фиг.1), контроля с растворителем (фиг.2), группы, обработанной силденафилом (фиг.3), и группы, обработанной производным пиразолопиримидинона (фиг.4).
Лучший способ осуществления изобретения
Практические и в настоящее время предпочтительные варианты осуществления настоящего изобретения являются иллюстративными, как показано в следующих примерах.
Однако будет принято во внимание, что специалисты в данной области, при рассмотрении этого описания, могут осуществить модификации и улучшения в пределах сущности и объема настоящего изобретения.
Пример 1. Исследование ингибиторного эффекта производного пиразолопиримидинона на синтез коллагена с использованием звездчатых клеток печени
Для исследования ингибиторного эффекта производного пиразолопиримидинона по настоящему изобретению на синтез коллагена осуществляли следующие эксперименты.
Звездчатые клетки печени выделяли из самцов белых крыс Sprague Dawley (массой приблизительно 300 г, n=10). Сначала инъецировали кетамин в брюшную полость для анестезии крыс. Брюшную полость вскрывали, и гепарин инъецировали в воротную вену. Затем буферный раствор Хэнкса, содержащий 0,02% проназы и 0,015% коллагеназы, перфузировали через печень в течение необходимого времени для получения препарированной печени. Выделенную печень измельчали в стерильной чашке Петри, затем помещали в буферный раствор, содержащий проназу и ДНКазу, и измельченную печень затем гомогенизировали в стерильной чашке Петри.
Полученный образец фильтровали через нейлоновое сито 100 мкм в 50 мл пробирку. Центрифугирование осуществляли при 50 г в течение 2 минут для отделения непаренхиматозных клеток в супернатанте. Центрифугирование осуществляли повторно при 450 г при 4°C в течение 10 минут. Преципитат плавал в буферном растворе, содержащем 25 мкг/мл ДНКазы, с последующим центрифугированием при 450 г при 4°C в течение 10 минут, которое повторяли два раза. Окончательный преципитат плавал в 21 мл буферного раствора, который затем смешивали с 17 мл 25% OptiPrep для получения конечного раствора 11,2% OptiPrep (1,058 г/см3). Раствор суспензии клеток, смешанный с OptiPrep, осторожно распределяли по четырем 15-мл пробиркам, содержащим 3 мл 17% OptiPrep, к которым добавляли 1 мл буферного раствора. Центрифугирование осуществляли при 1400 г при 4°C в течение 17 минут и в результате получали звездчатые клетки печени без примесей из непрозрачного слоя между буферным раствором и 11,8% OptiPrep.
Выделенные звездчатые клетки печени суспендировали в DMEM (среда Игла, модифицированная Дульбекко), с последующей промывкой. Клетки снова суспендировали в DMEM с добавлением 10% FBS (эмбриональная телячья сыворотка) и антибиотиков, затем инкубировали в культуральном сосуде, который культивировали в термостате с 5% CO2 при 37°C. Культуральную среду сначала сменили через 24 часа, и затем сменяли каждые 48 часов для субкультивирования.
Звездчатые клетки печени, субкультивированные 8 раз, объединяли из расчета 2×105, которые предварительно обрабатывали 25 нг/мл PDGF (тромбоцитарный фактор роста) 24 часа. В это время добавляли производное пиразолопиримидинона, силденафил и варденафил в разных концентрациях 0,3, 5 и 10 нг/мл для реакции. Экстрагировали общую РНК и осуществляли RT-PCR (полимеразная цепная реакция после обратной транскрипции) для коллагена.
На основе относительной концентрации бета-актина сравнивали исследуемое вещество с другими тестируемыми образцами. Для определения ингибиторного эффекта в исследуемом образце на синтез коллагена изучали ингибиторную концентрацию 50% (IC50), и результат представлен в таблице 1.
| Таблица 1Ингибиторный эффект ингибиторов PDE 5 на синтез коллагена | |||
| Производное пиразолопиримидинона | Силденафил | Варденафил | |
| IC50 (нМ) | 0,8±0,2а | 13,1±2,3 | 7,8±1,7 |
| аСреднее значение ± стандартное отклонение |
Как показано в таблице 1, IC50 производного пиразолопиримидинона составляла 0,8±0,2 нМ, что являлось в 16 раз и в 10 раз более высоким ингибиторным эффектом на синтез коллагена, чем эффекты силденафила и варденафила соответственно. Таким образом, подтверждено, что производное пиразолопиримидинона по настоящему изобретению обладает более сильным ингибиторным эффектом на синтез коллагена, чем другие ингибиторы PDE 5, силденафил и варденафил, и, соответственно, оно также обладает исключительным ингибиторным эффектом на фиброз печени, вызываемым избыточным отложением коллагена, и, таким образом, исключительным защитным действием на печень.
Пример 2. Исследование защитного действия на печень производного пиразолопиримидинона с использованием модели на животном с фиброзом печени
Для исследования in vivo ингибиторного эффекта на синтез коллагена производного пиразолопиримидинона по настоящему изобретению осуществляли следующие эксперименты.
Самок белых крыс Sprague Dawley (обладающих массой приблизительно 300 г) разделяли на 4 группы (5 крыс на группу) и индуцировали фиброз печени в экспериментальных группах за исключением контрольной группы дикого типа (Toxicology, 2001). DMN (диметилнитрозамин) инъецировали в брюшную полость в дозировке 10 мг/кг сериями в течение 2 недель с частотой дозировки три раза в неделю. Производное пиразолопиримидинона и силденафил в триазольном буфере (Merch) вводили перорально из расчета 10 мг/кг/сутки в течение 2 недель (период индукции посредством DMN). В контрольной группе с растворителем вводили только триазольный буфер. Две недели спустя печень выделяли, фиксировали в 10% нейтральном формалине, заключали в парафин и готовили срезы по 4 мкм. Каждый срез обрабатывали ксилолом для удаления парафина с последующей обработкой спиртом и 0,1% пероксидом водорода (H2O2). После обработки PBS срезы обрабатывали поликлональной антисывороткой (Chemicon) против коллагена I типа, разведенной 1:500, и поликлональной антисывороткой (BioGenesis) против коллагена III типа, разведенной 1:100, при 37°C в течение одного часа. После промывки образцы обрабатывали конъюгированными с биотином козьими IgG против кролика в разведении 1:200. Иммуногистологическое окрашивание осуществляли взаимодействием образцов с комплексом авидин-биотин (Vector Laboratories), затем комплекс антиген-антитело выявляли 3-амино-9-этилкарбазолом (AEC), изображение которого получали с помощью оптического микроскопа, в данной работе приведенное на фиг. 1-4. Контрольную группу обрабатывали неиммунизированной лошадиной сывороткой вместо первичных антител.
Как показано на фиг. 1-4, высокий уровень синтеза коллагена наблюдали в воротных венах печени и вокруг воротных вен в контрольной группе с растворителем по сравнению с животными дикого типа, указывая на то, что синтез коллагена заметно ингибируется производным пиразолопиримидинона и силденафилом. Ингибирование синтеза коллагена в группе, обработанной производным пиразолопиримидинона, оказалось выше, чем ингибирование в группе, обработанной силденафилом.
Пример 3. Исследование эффекта производного пиразолопиримидинона на моделях на животных с портальной гипертензией
Для исследования эффекта производного пиразолопиримидинона на портальную гипертензию осуществляли следующие эксперименты.
12 собак породы бигль с массой приблизительно 10 кг разделяли на четыре группы (3 собаки на группу отбирали случайным образом) и осуществляли у них лигирование желчного протока. В течение двух недель после операции перорально вводили производное пиразолопиримидинона, силденафил и варденафил в дозировке 10 мг/кг/сутки, и 3 из них вводили только растворитель. Животных лишали пищи 4 часа, затем внутривенно инъецировали пентобарбитал для их анестезии. Зонд вставляли через брыжеечную вену в воротную вену для измерения давления в воротной вене.
Доплеровскую ультрасонографию также осуществляли для измерения диаметра воротной вены. Ток крови через воротную вену измеряли с использованием следующей математической формулы 1, и результат представлен в таблице 2.
Математическая формула 1
| Таблица 2Эффект производного пиразолопиримидинона на портальную гипертензию | ||||
| Группа, обработанная растворителем | Группа, обработанная производным пиразоло-пиримидина | Группа, обработанная силденафилом | Группа, обработанная варденафилом | |
| Давление в воротной вене (кПа) | 3,13±0,31а | 2,50±0,20* | 2,93±0,25 | 2,87±0,25 |
| Диаметр воротной вены (мм) | 7,07±0,15 | 7,70±0,26 | 7,47±0,21 | 7,43±0,21 |
| Скорость тока крови (мл/мин) | 584,26±159,97 | 932,31±89,83* | 754,47±80,24 | 729,29±83,23 |
| аСреднее значение + стандартное отклонение; *Статистически значимый (р<0,05) |
Как представлено в таблице 2, давление в воротной вене снижалось на 21% в группе, обработанной производным пиразолопиримидинона, снижалось на 7% в группе, обработанной силденафилом, и снижалось на 9% в группе, обработанной варденафилом, по сравнению с давлением в контрольной группе, обработанной растворителем. Сравнением диаметра воротной вены подтверждено, что диаметры воротных вен для каждой из групп, об